Состав и функционирование микробного сообщества при разложении соломы злаковых культур в дерново- подзолистой почве
Автор: Орлова О.В., Андронов Е.Е., Воробьев Н.И., Колодяжный А.Ю., Москалевская Ю.П., Патыка Н.В., Свиридова О.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Солома, микробное сообщество почв, гумус, микроорганизмы
Статья в выпуске: 3 т.50, 2015 года.
Бесплатный доступ
Трансформация микроорганизмами свежего органического вещества в пахотных почвах определяет такие процессы, как глобальный круговорот углерода, производство продовольствия и парниковый эффект. Один из доступных способов повышения содержания органического вещества в почвах - рациональное использование пожнивных остатков, в частности соломы. Причиной слабого использования соломы называют то, что она долго разлагается, при этом создается дефицит минерального азота в почве, выделяются фитотоксичные соединения, накапливаются фитопатогены. Поэтому возрастает значение использования препаратов для ускорения трансформации соломы зерновых культур. В модельном лабораторном опыте мы изучали влияние обработки ржаной соломы биопрепаратами БАГС (на основе Bacillus ), баркон (целлюлозоллитическая ассоциация сложного состава) и омуг (биоудобрение из подстилочного помета) (Всероссийский НИИ сельскохозяйственной микробиологии) в зависимости от глубины заделки (поверхностно, в слой 0-3 см, в слой 9-12 см) соломы на состав и функционирование микробного сообщества почв. Известно, что наиболее легкодоступные органические соединения соломы разлагаются в первые 2 нед после внесения соломы, поэтому мы через 2 мес оценивали влияние препаратов и глубины заделки соломы на состав бактериального сообщества на поздних стадиях разложения, когда идет деструкция более труднодоступных соединений. В этот период разложение соломы ведут в основном k-стратеги. Существует мнение, что их сообщество более устойчиво к внешним воздействиям и будет не так сильно меняться, как у r-стратегов, ответственных за первый этап. Через 60 сут компостирования определяли численность физиологических групп микроорганизмов, размеры микробной биомассы, содержание подвижных соединений азота и углерода, дыхание. Подтвердилась слабая применимость традиционного микробиологического анализа физиологических групп микроорганизмов для целей сравнения структуры микробных сообществ. Четко прослеживалось только положительное влияние внесения соломы на численность амилолитических, олиготрофных и педотрофных микроорганизмов. В этой связи структуру микробного сообщества оценивали методом высокопроизводительного секвенирования библиотек гена 16S-рРНК. Солома положительно влияла на численность и активность микроорганизмов, микробную биомассу, подвижный органический углерод. Препараты усиливали разложение соломы, наибольшая деградация за исключением варианта с обработкой омугом, была в слое 0-3 см. Более 80 % бактериального сообщества почв составляли Proteo-bacteria и Actinobacteria, слабее были представлены (благодаря высокому плодородию почвы) Acidobacteria. Внесение соломы увеличило долю актинобактерий и бетапротеобактерий по сравнению с контролем. Актинобактерии принимают большее участие в разложении соломы заделанной на глубину 9-12 см, исключением стала обработка барконом. Показано, что варианты с обработкой соломы барконом и омугом характеризовались большим разнообразием: индекс Шеннона 1,29-1,27 против 1,0-1,16 для контроля и необработанной соломы
Солома, микробное сообщество почв, гумус, микроорганизмы
Короткий адрес: https://sciup.org/142134841
IDR: 142134841 | УДК: 631.872:631.427.22:574.472 | DOI: 10.15389/agrobiology.2015.3.305rus
Текст научной статьи Состав и функционирование микробного сообщества при разложении соломы злаковых культур в дерново- подзолистой почве
Трансформация микроорганизмами свежего органического вещества в пахотных почвах — ключевой фактор, определяющий такие процессы, как глобальный круговорот углерода, производство продовольствия и парниковый эффект (1). Один из доступных способов повышения содержания органического вещества в почвах заключается в рациональном использовании пожнивных остатков, в частности соломы, которой в Российской Федерации ежегодно производится 150 тыс. т (2). Причиной слабой распространенности такого подхода называют то, что солома долго разлагается, при этом создается дефицит минерального азота в почве, выделяются
Работа поддержана грантом Российского научного фонда ¹ 14-26-00094. Исследования выполнены с использованием оборудования ЦКП «Геномные технологии, протеомика и клеточная биология» Всероссийского НИИ сельскохозяйственной микробиологии.
фитотоксичные соединения, накапливаются фитопатогены. Поэтому возрастает значение использования препаратов для ускорения трансформации соломы зерновых культур (3, 4).
В последнее время все большее распространение для характеристики состава микробного сообщества почв находят молекулярные методы, но вопрос о связи биоразнообразия и функционировании микробного сообщества остается открытым (5, 6). Это обусловлено в том числе полифункциональностью микроорганизмов: изменение таксономического состава микробного сообщества не обязательно свидетельствует об изменении химических свойств разлагающегося субстрата (6, 7). Недостаточно изучена роль состава и структуры микробного сообщества, ведущего разложение, в определении направленности деструкционных цепей в сторону преобладания минерализации или гумификации (8, 9). В частности, не более 10 % почвенных микроорганизмов известны или могут культивироваться на элективных питательных средах, остальные представляют своей массой огромный ресурс для изучения.
Цель работы заключалась в оценке влияния соломы, биопрепарата и глубины заделки в почву на структуру и функционирование микробного сообщества почвенных микроорганизмов. Наиболее легкодоступные органические соединения соломы разлагаются в первые 2 нед после внесения соломы, поэтому мы оценивали влияние препаратов и глубины заделки соломы на состав бактериального сообщества через 2 мес — на поздних стадиях разложения, когда идет деструкция более труднодоступных соединений. В этот период разложение соломы ведут в основном k-стратеги. Существует мнение, что их сообщество более устойчиво к внешним воздействиям и будет не так сильно меняться, как у r-стратегов, ответственных за первый этап (10).
Методика . В модельном опыте с хорошо окультуренной дерновоподзолистой почвой (Сгум. 4,02 %, Nобщ. 0,316 %, рНсол. 5,63, подвижный Р2О5 — 37 мг/100 г, обменный К — 9,6 мг/100 г) в пластиковые сосуды на 1 кг почвы вносили по 3 г измельченной на кусочки размером 1-2 см солому ржи (зольность 3,4 %, N — 0,25±0,02, С/N — 195) тремя способами: поверхностно, заделка в слое 0-3 см, заделка в слое 9-12 см. Для ускорения разложения солому обрабатывали препаратами БАГС (на основе Bacillus ), баркон (целлюлозоллитическая ассоциация сложного состава) и омуг (биоудобрение из подстилочного помета) согласно рекомендациям разработчиков (ФГБНУ Всероссийский НИИ сельскохозяйственной микробиологии, г. Санкт-Петербург). Анализы выполняли на 60-е сут.
Агрохимические исследования почвы проводили общепринятыми методами (11) . Содержание углерода в вытяжках определяли на спектрофотометре Ultraspec («LKB», Швеция; λ = 340 нм) (12). Дыхание почвы измеряли на газовом хроматографе Цвет (Россия); детектор — катарометр, газ-носитель — гелий.
Активную микробную биомассу в почве учитывали методом суб-страт-индуцированного дыхания (13), определяя суммарную биомассу и грибную биомассу (обработка стрептомицином и рифампицином, 16 мг антибиотика на 1 г почвы). Азот микробной биомассы анализировали ре-гидратационным методом (14), содержание остаточной соломы в почве — методом флотации в 0,5 н. Na2SO4. Численности физиологических групп микрофлоры (аммонифицирующие, амилолитические, актинобактерии, целлюлозоразлагающие, педотрофы, олиготрофы, общее количества бактерий, микромицетов) учитывали при посеве почвенной суспензии на плотные питательные среды. Биоразнообразие микробных сообществ оце- нивали по индексу разнообразия Шеннона и коэффициенту сходства Се-ренсена-Чекановского.
Структуру бактериального сообщества почв для срока 60 сут определяли с применением высокопроизводительного секвенирования библиотек гена 16S-рРНК. Для этого выделяли из почвы ДНК с использованием наборов MoBio (CША), приготовление библиотек проводили с помощью ПЦР с универсальными праймерами на ген 16S-рРНК F515 и R806 (15). Секвенирование выполняли на приборе GS Junior («Roche», США), обработку результатов секвенирования — в программе QIIME (16).
Для дальнейшей статистической обработки использовали стандартные методы статистики, граф-анализа (17) и анализа главных компонент.
Результаты . Определение численности микроорганизмов по слоям почвы выявило, что микромицеты более чувствительны к внесению соломы по сравнению с бактериями (табл. 1). В большинстве вариантов численность грибов в слое с соломой повышалась в 1,5-2,0 раза. Внесение соломы увеличивало грибную биомассу. Таким образом, наши данные согласуются с известной из литературы ведущей ролью грибов на более глубоких стадиях разложения соломы (10). На численность грибов и бактерий больше влиял фактор глубины заделки соломы, а не вид примененного биопрепарата.
Подтвердилась слабая применимость традиционного микробиологического анализа физиологических групп микроорганизмов для целей сравнения структуры микробных сообществ. Четко прослеживалось только положительное влияние внесения соломы на численность амилолитических, олиготрофных и педотрофных микроорганизмов (см. табл. 1), тогда как различия между вариантами в большинстве случаев оказались несущественными. Возможная причина заключается в учете этим методом только быстрорастущих микроорганизмов, тогда как на исследуемой стадии разложения соломы преобладают медленно растущие k-стратеги.
Разложение соломы на 60-е сут опыта не превышало 10-40 %, что совпадает с данными ряда исследователей (1-3), но противоречит результатам, которые указывают на 50 % разложение за 1 мес (10). Применение биопрепаратов усилило минерализацию соломы, наилучшие результаты отмечали при обработке соломы барконом. Разложение соломы было выше при заделке в слой 0-3 см, за исключением варианта с омугом, где активнее всего деструкция соломы происходила в слое 9-12 см.
Влияние изучаемых факторов на фракции органического вещества, характеризующие количество наиболее доступных органических соединений (водо- и солерастворимый углерод), количество новообразованного (С лабильного гумуса) или подвижного (С NaOH- или пирофосфатной вытяжки) гумуса (см. табл. 1), отмечали только для легкодоступных фракций.
Рост микробиологической активности при внесении соломы и биопрепаратов ускорял разложение соломы, но не гумуса (см. табл. 1). Сохранению гумуса в почве из использованных препаратов способствовал омуг, что согласуется с результатами проведенных нами исследований по влиянию биоудобрений на процессы гумификации (18). Комплексный показатель гумификации (Кгум.) (19) в вариантах с омугом аналогично степени минерализации соломы повышался при ее внесении в слой 9-12 см.
Разная глубина заделки соломы и ее обработка препаратами изменили структуру бактериального сообщества почвы (табл. 2). Основную часть бактериального сообщества на уровне фил составляли Proteobacteria и Actinobacteria , благодаря высокому плодородию почвы были слабо представлены Acidobacteria . Наличие соломы на 60-е сут ожидаемо увеличило (по сравнению с контролем) долю актинобактерий и бетапротеобактерий,
-
1. Биологические и химические характеристики почвы в зависимости от глубины заделки соломы и ее обработки различными биопрепаратами (60-е сут, модельный опыт)
Показатель
К
Солома без обработки
Солома + БАГС
Солома + баркон
Солома + омуг
П 1
0-3 см
9-12 см
П
] 0-3 1
9-12
П
0-3
9-12
П
0-3 1
9-12
Бактерии в 0-4 см, ½106 КОЕ/г
4±0,7
2±0,6
5±0,7
Микроби 1 5±0,6
ологичес 6±0,4
кие свой 4±0,4
ства
4±0,4
7±0,7
6±0,2
3±0,4
4±0,6
4±0,3
2±0,2
Бактерии 8-12 см, ½106 КОЕ/г
Грибы в 0-4 см, ½103 КОЕ/г
2±0,2
2±0,2
2±0,4
6±0,6
2±0,3
5±0,4
6±0,9
5±0,6
3±0,4
6±0,4
4±0,4
3±0,4
7±0,6
31±2,8
28±1,4
30±3,7
7±0,8
22±2,9
41±2,1
15±1,4
25±2,1
43±3,7
12±1,0
21±2,8
11±1,6
6±0,8
Грибы в 8-12 см, ½103 КОЕ/г
20±1,6
21±3,7
21±2,8
24±1,6
12±2,1
21±2,8
38±4,2
15±2,4
18±1,6
25±1,7
12±1,4
12±2,1
15±1,4
Аммонификаторы, ½106 КОЕ/г
12±0,8
16±2,4
16±0,3
13±0,8
15±0,9
17±1,0
18±2,2
19±2,0
14±0,5
14±1,0
10±0,8
16±1,4
16±1,4
Амилолитические, ½106 КОЕ/г
9±0,6
13±1,3
14±1,4
14±1,1
13±1,2
11±1,4
14±1,3
16±0,2
13±1,5
14±1,6
10±0,3
14±1,7
13±0,6
Олиготрофы, ½106 КОЕ/г
6±0,6
9±1,1
7±1,0
10±0,7
5±0,4
6±0,8
6±0,2
9±0,8
9±1,0
9±0,9
6±0,6
9±1,3
7±0,8
Педотрофы, ½106 КОЕ/г
6±0,8
11±1,1
11±1,2
10±1,5
8±0,7
7±0,7
8±0,3
8±1,0
10±1,1
11±1,4
8±0,6
10±1,1
11±1,5
Целлюлозолитики, ½103 КОЕ/г
16±2,0
41±8,0
66±8,0
62±14,0
74±14,0
168±8,0
123±14,0
263±21,0
127±16,0
99±14,0
145±14,0
113±8,0
150±21,0
Актинобактерии, ½106 КОЕ/г
1,6±0,20
1,3±0,20
1,3±0,20
3,0±0,60
1,5±0,30
2,4±0,40
1,5±0,30
2,1±0,60
1,1±0,20
1,6±0,30
1,5±0,20
1,4±0,20
1,3±0,30
С СО2, мг/(кг•сут)
9±0,1
13±0,8
18±1,6
14±0,8
22±6,2
21±0,7
22±1,6
36±5,7
21±1,9
15±3,2
28±3,5
15±2,8
12±1,7
С ∑ активной биомассы, мг/кг
571±60
700±40
697±52
807±39
728±22
749±101,0
756±120,0
547±73
669±86
603±72
448±60
631±88
652±104,0
С грибной биомассы, мг/кг
81±7
122±15
112±20
111±10
143±12
223±41
87±14,0
77±35,0
106±32
102±16
109±11
114±16
83±17,0
N биомассы, мг/кг
44±0
47±3,0
53±4,2
53±4,9
50±2,9
43±2,7
46±3,0
39±2,5
46±2,7
42±5,6
35±0,1
41±2,7
49±0,5
С общей биомассы, мг/кг
834±123
963±43
1016±115
1017±63
1034±115
1039±73
847±63
749±54
961±76
947±47
850±54
901±70
988±82
N NH4 мг/кг
0,7±0,10
0,7±0,10
0,7±0,10
Агрохи 0,7±0,10
мически 0,7±0,10
е свойст 1,4±0,10
ва
2,1±0,10
1,4±0,10
2,1±0,10
2,2±0,10
2,1±0,10
2,1±0,10
2,2±0,10
N NO3, мг/кг
26±0,8
22±0,8
22±0,8
17±1,7
23±0,1
21±0,1
20±0,1
23±0,1
21±0,1
20±1,5
21±0,8
20±0,1
19±0,1
С водорастворимый, мг/кг
131±7
132±30
123±11
155±13
174±26
138±25
133±29
133±26
145±33
140±9
168±27
182±21
157±22
С солерастворимый, мг/кг
116±12
113±8
109±9
94±16,0
106±16
108±13
109±14
130±22
107±12
109±8
128±14
131±19
116±11
С лабильного гумуса, г/кг
0,8±0,10
0,8±0,05
0,8±0,01
0,8±0,05
0,8±0,02
0,7±0,10
0,9±0,10
0,9±0,01
0,9±0,10
0,7±0,01
0,9±0,10
0,9±0,10
0,9±0,10
С гумуса, %
3,78±0,050
3,95±0,080
3,83±0,040
3,81±0,140
3,89±0,050
3,85±0,070
3,85±0,040
3,89±0,040 3,84±0,030 3,89±0,080 3,82±0,040 3,93±0,050
4,01±0,050
Остаточная солома, мг/100 г
0
262±15
186±26
174±76
216±98
262±41
217±22
250±62
242±38
296±25
247±83
233±85
260±90
Р 2 О 5 , мг/100 г
58±9,5
53±6,7
48±3,6
48±6,2
61±12,1
51±12,0
46±4,2
51±6,1
45±7,0
69±7,6
56±16,0
56±3,5
85±2,8
К, мг/100 г
9±1,2
13±1,4
8±1,2
10±1,0
12±0,5
10±1,4
9±1,1
10±1,5
11±1,7
11±0,4
9±1,5
9±0,0
9±0,5
рН сол.
5,6±0,02
5,8±0,02
5,8±0,01
5,9±0,05
5,9±0,02
5,9±0,05
5,9±0,07
5,8±0,04
5,8±0,02
5,8±0,03
5,9±0,01
5,8±0,10
5,9±0,03
Остаточная соломаа, мг/100 г
0
193±72
156±18
155±36
161±40
108±31
126±34
145±45
81±45,0
95±53,0
193±48
178±20
94±56,0
К гум. б
3,50
3,67
2,87
2,34
3,24
2,90
3,11
3,22
3,21
3,66
2,53
3,04
3,36
П р и м еч ани е. К — контроль, П — поверхностное внесение; а
— данные для 90-х сут опыта, б — комплексный показатель
гумификации (Кгум.
). Описание препаратов и опре-
деления показателей см. в разделе «Методика» (также см. рис. 3). Приведены средние и доверительные интервалы при уровне значимости
P = 0,05.
-
2. Состав бактериального сообщества почвы (%) в зависимости от глубины заделки соломы и ее обработки различными биопрепаратами (60-е сут, модельный опыт)
|
Таксон |
К |
Без обработки |
БАГС |
Баркон |
Омуг |
||||||||
|
П 1 |
1 |
1 2 |
П |
1 1 1 |
2 |
П |
1 1 1 |
2 |
П |
1 1 |
2 |
||
|
Archaea |
0,7 |
0,9 |
0,9 |
0,7 |
0,9 |
0,3 |
0,9 |
1,8 |
0,9 |
0,7 |
0,6 |
1,6 |
1,0 |
|
Acidobacteria |
2,6 |
2,4 |
3,6 |
2,4 |
2,4 |
1,6 |
2,5 |
4,0 |
2,6 |
2,6 |
1,7 |
3,5 |
4,8 |
|
Actinobacteria |
15,6 |
19,3 |
17,5 |
21,9 |
17,9 |
14,8 |
19,3 |
26,7 |
18,4 |
18,8 |
14,3 |
22,0 |
27,2 |
|
Bacteroidetes |
0,2 |
0,2 |
0,4 |
0,5 |
2,0 |
0,6 |
0,4 |
0,4 |
5,7 |
0,4 |
0,1 |
0,5 |
0,7 |
|
Chloroflexi |
2,2 |
2,0 |
2,5 |
2,8 |
2,9 |
2,2 |
3,1 |
5,1 |
2,6 |
2,9 |
1,9 |
3,2 |
4,6 |
|
Firmicutes |
2,3 |
2,6 |
2,6 |
2,4 |
2,2 |
2,0 |
2,6 |
2,8 |
3,2 |
3,1 |
1,7 |
4,0 |
4,4 |
|
Gemmatimonadetes |
2,3 |
2,6 |
2,6 |
2,4 |
2,2 |
2,0 |
2,6 |
2,8 |
3,2 |
3,1 |
1,7 |
4,0 |
4,4 |
|
Planctomycetacia |
0,8 |
0,9 |
1,3 |
1,8 |
0,8 |
0,6 |
1,0 |
1,5 |
1,4 |
0,7 |
0,7 |
1,6 |
1,9 |
|
Alphaproteobacteria |
4,5 |
4,5 |
4,5 |
3,9 |
5,8 |
3,9 |
4,2 |
4,7 |
10,5 |
3,6 |
4,1 |
4,5 |
6,4 |
|
Betaproteobacteria |
2,7 |
2,8 |
3,0 |
2,6 |
3,7 |
8,2 |
3,4 |
4,3 |
3,3 |
1,7 |
2,1 |
4,6 |
4,3 |
|
Deltaproteobacteria |
2,2 |
2,4 |
2,6 |
2,2 |
2,5 |
1,7 |
2,4 |
4,6 |
2,2 |
2,3 |
1,4 |
3,8 |
4,4 |
|
Gammaproteobacteria |
62,3 |
56,8 |
56,7 |
53,5 |
52,4 |
59,1 |
52,0 |
36,4 |
44,2 |
59,3 |
68,1 |
45,9 |
34,0 |
|
Прочие |
1,6 |
2,6 |
1,8 |
2,9 |
4,3 |
3,0 |
5,6 |
4,9 |
1,8 |
0,8 |
1,6 |
0,8 |
1,9 |
П р и м еч ани е. К — контроль, П — поверхностное внесение; 1 и 2 — почвенный слой соответственно 0-3 и 9-12 см. Описание препаратов см. в разделе «Методика».
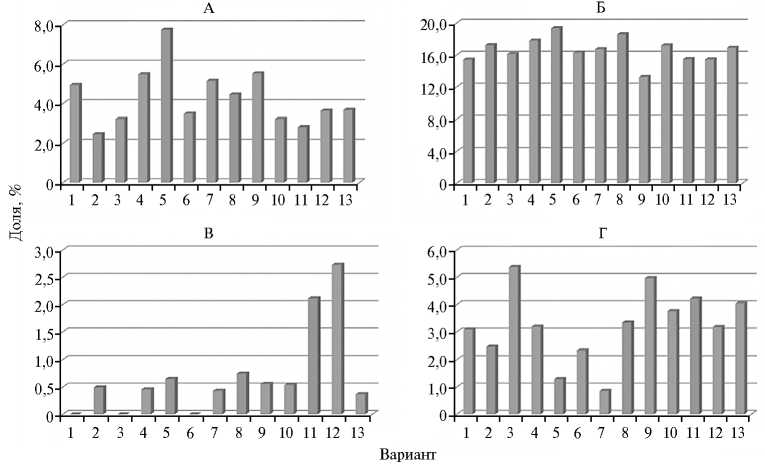
Рис. 1. Представленность семейств класса Actinobacteria в почве в зависимости от глубины заделки соломы и ее обработки различными биопрепаратами: А — Micrococcaceae , Б — Gaiellaceae , В — Nocardiaceae , Г — Pseudonocardiaceae ; 1 — контроль; 2, 3, 4 — без обработки (соответственно поверхностное внесение и заделка на глубину 0-3 и 9-12 см); 5, 6, 7 — обработка БАГС (поверхностное внесение и заделка на глубину 0-3 и 9-12 см); 8, 9, 10 — обработка барконом (поверхностное внесение и заделка на глубину 0-3 и 9-12 см); 11, 12, 13 — обработка омугом (поверхностное внесение и заделка на глубину 0-3 и 9-12 см) (60-е сут, модельный опыт). Описание препаратов см. в разделе «Методика».
относящихся к k-стратегам. Поверхностное внесение соломы не влияло на соотношение семейств альфапротеобактерий, среди которых много симбионтов растений, изменения были только при обработке барконом. Заделка соломы в почву существенно сказалась на структуре этого таксона, но выявить закономерности в зависимости наблюдаемого эффекта от глубины заделки или препарата не удалось, возможно, изменения в отмеченном случае произошли под воздействием косвенных причин (конкуренция, антагонизм и т.п.).
Обработка соломы омугом и барконом увеличила долю актинобактерий, играющих большую роль в деструкции трудноразлагаемых субстратов, по сравнению с вариантом без обработки. Участие актинобактерий в разложении усиливалось при заделке соломы в слой 9-12 см, за исключением вариантов с барконом (аналогично данным о доминировании бактериальных сообществ при разложении заделанных растительных остатков) (20). Внесение соломы и препарат слабо влияли на такие семейства актинобактерий, как Solirubrobacteraceae и Gaiellaceae, тогда как Micrococcaceae, Nocardioidacea и Pseudonocardiaceae оказались более чувствительны к изучаемым факторам (рис. 1), что позволяет выявить влияние как препаратов, так и глубины заделки соломы. Наибольшие различия по структуре класса актинобактерий отмечали между вариантами с препаратами БАГС и омуг, а влияние глубины заделки соломы по фону баркона и омуга часто было противоположным.
Важную роль в разложении свежего органического вещества играют Firmicutes. При использовании БАГС доля Firmicutes была выше практически в 2 раза , что, казалась бы, объяснимо, так как препарат создан на основе Bacillus . Однако резко возрастала численность Lactobacillaceae (повышение составляло до 40 % по сравнению с 5-8 % для необработанной соломы и варианта с омугом и 19 % — для баркона), а число представителей семейства Bacillaceae было низким.
Наибольшим биоразнообразием характеризовались образцы при обработке соломы барконом и омугом: индекс Шеннона составил 1,291,27 против 1,0-1,16 для контроля и необработанной соломы. Возрастание таксономического разнообразия микробиома отражается в увеличении его метаболической активности и усложнении трофических связей между разными физиологическими группами микроорганизмов, что согласуется с усилением гумификационных процессов (повышение содержания гумуса, водорастворимого углерода и лабильного гумуса).
Анализ сходства бактериальных сообществ методом главных компонент при группировке по обработке соломы препаратами для компонента 1 и 2 не выявил четких различий между вариантами (вклейка, рис. 2, А), при анализе по компонентам 1 и 3 можно отметить различия для БАГС и омуга. Если сгруппировать для анализа данные по глубине заделки соломы (см. рис. 2, Б), то различия не будут существенными, хотя на численность и активность микроорганизмов сильно влиял именно этот фактор. Вероятно, причина в достаточно поздней стадии разложения, когда различия между сообществами k-стратегов не столь заметны (7, 10), а также в более полном составе сообщества, учитываемого молекулярными методами.
Значения коэффициентов сходства Серенсена-Чекановского бактериальных сообществ для слоя 0-3 см (наибольшее разложение соломы) оказались самыми высокими (0,72-0,78). То есть наиболее эффективно разлагающие солому микробные сообщества имели близкий состав, влияние препаратов было слабым. БАГС часто отличался от других препаратов по влиянию на структуру сообщества, формировал наименее схожие мик-робоценозы, особенно при поверхностном внесении (коэффициенты колебались от 0,58 до 0,63).
Следует отметить, что многие показатели, характеризующие микробиологические (дыхание почвы, содержание С и N в микробной биомассе) и агрохимические (например, содержание подвижного органического углерода и минерального азота) свойства почв изменяются при внесении соломы (см. табл. 1), но обнаружить в этом четкие закономерности и оценить эффект от препарата или глубины заделки без применения математических методов анализа практически невозможно.
Использование метода граф-анализа (15) для оценки функционирования микробоценоза позволяет выявить общие черты и различия в зави- симости от глубины заделки соломы (рис. 3). Общее заключается в отрица-
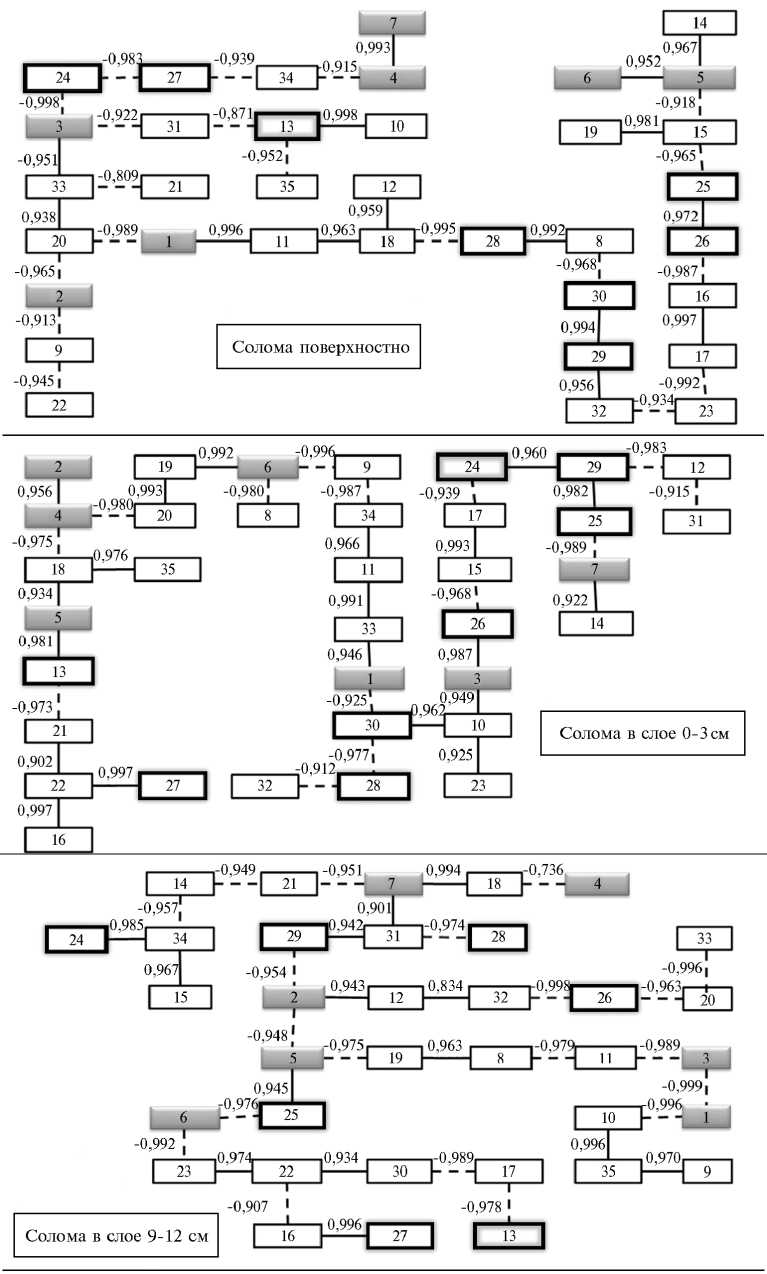
Рис. 3. Графы максимальных корреляционных связей для показателей состояния почвы и
почвенного микробного сообщества в зависимости от глубины заделки соломы и ее обработки различными биопрепаратами (серые квадраты — численность микроорганизмов, квадраты, обведенные жирной рамкой, — пулы С): 1 — численность аммонификаторов, 2 — численность амилолитических микроорганизмов, 3 — численность олиготрофов, 4 — численность педотрофов, 5 — численность целлюлозолитиков, 6 — численность актиномицетов, 7 — численность микромицетов; 8 — коэффициент минерализации, 9 — коэффициент педотроф-ности, 10 — коэффициент олиготрофности, 11 — коэффициент трансформации органического вещества; 12 — влажность; 13 — остаточное содержание соломы; 14 — дыхание почвы; 15 — С микробной биомассы (регидратационный метод); 16 — N микробной биомассы; 17 — С активной биомассы (сумма «бактерии + грибы»); 18 — доля активной биомассы от общей, %; 19 — активная грибная биомасса; 20 — доля активной грибной биомассы от суммарной, %; 21 — общий азот в почве, 22 — нитратный азот, 23 — аммонийный азот; 24 — С в водной вытяжке, 25 — С в вытяжке К2SО4, 26 — С лабильного гумуса (нейтральная пирофосфатная вытяжка), 27 — С щелочной пирофосфатной вытяжки, 28 — С в вытяжке 0.1 н. NaOH, 29 — С гумуса; 30 — комплексный показатель гумификации; 31 — подвижный фосфор, 32 — подвижный калий; 33 — рН; 34 — урожай растений (получен во второй срок, данные не приводятся); 35 — вынос азота растениями (см. пункт 34).
тельной зависимости между количеством остаточной соломы и содержанием азота в почве. Количество иммобилизованного в микробной биомассе азота для вариантов с заделкой соломы в почву тесно связано с содержанием нитратов. Новообразование гумуса (С лабильного гумуса) связано с микробной биомассой, что объясняет рост содержания гумуса при поверхностном внесении соломы, когда органические вещества поступают в почву в растворенном состоянии. Комплексный показатель гумификации (Кгум) связан с микробиологическими свойствами почв, в частности с коэффициентами минерализации и олиготрофности, отражающими структуру микробного сообщества.
При поверхностном внесении солома на 60-е сут служит основным источником многих пулов подвижного органического вещества, но так как она медленнее разлагается, то с ней связаны олиготрофные микроорганизмы. Наиболее активное разложение соломы идет в верхнем слое (03 см), о чем свидетельствует ее связь с целлюлозолитическими микроорганизмами и роль для азотного цикла. В зависимости от глубины заделки соломы основной вклад в минерализационные процессы (выделение СО2) вносят разные группы микроорганизмов.
Таким образом, анализ воздействия обработки соломы ржи биопрепаратами БАГС, баркон и омуг на состав и функционирование микробного сообщества почвы показал, что эффект биопрепарата сравним по силе с влиянием глубины заделки соломы. Однако в отношении функционирования микробиома, а следовательно, и свойств почвы, это не всегда четко проявляется. Здесь подтверждается тот факт, что таксономический состав микробиома может быть разным, а результаты благодаря полифункциональности микроорганизмов окажутся одинаковыми. При использовании препаратов за 90 сут разлагается 60-70 % соломы против 30-50 % в вариантах без обработки. Наиболее эффективно солома разлагалась в слое 0-3 см, за исключением обработки омугом (лучше — в слое 9-12 см), слабее всего — при поверхностном внесении. Выявлено, что биопрепараты БАГС и баркон эффективнее омуга разлагают солому, но действие последнего более благоприятно на почвенный гумус: повышается содержание новообразованного и общего гумуса. Внесение соломы увеличило долю актинобактерий и бетапротеобактерий по сравнению с контролем. Актинобактерии принимают большее участие в разложении соломы, заделанной на глубину 9-12 см (исключением стала обработка барконом). Варианты с обработкой соломы барконом и омугом характеризовались боль- шим разнообразием (индекс Шеннона 1,29-1,27 против 1,00-1,16 для контроля и необработанной соломы).
Список литературы Состав и функционирование микробного сообщества при разложении соломы злаковых культур в дерново- подзолистой почве
- Baldock J.A. Composition and cycling of organic carbon in soil. In: Nutrient сycling in terrestrial ecosystems/P. Marschner, Z. Rengel (eds.). Springer Berlin Heidelberg, 2007 ( ) DOI: 10.1007/978-3-540-68027-7_1
- Верзилин В.В., Коржов С.И., Придворев Н.И. Биология почв среднерусского Черноземья (диагностика и пути решения): монография. Воронеж, 2005.
- Шершнева О. М., Тарасов С. А. Использование микробиологических препаратов для ускорения деструкции соломы. Вестник Курской государственной сельскохозяйственной академии, 2014, 6: 41-45.
- Щербаков А. В., Русакова И.В., Орлова О.В., Воробьев Н.И., Свиридова О.В., Щербакова Е.Н., Чеботарь В.К. Аэробное целлюлозолитическое сообщество ассоциантов сфагнового мха Sphagnum fallax как основа в процессах деструкции пожнивных остатков. Сельскохозяйственная биология, 2014, 1: 54-62 ( ) DOI: 10.15389/agrobiology.2014.1.54eng
- Nannipieri P., Ascher J., Ceccherini M.T., Landi L., Pietramellara G., Renella G. Microbial diversity and soil functions. European Journal of Soil Science, 2003, 54(4): 655-670 ( ) DOI: 10.1046/j.1351-0754.2003.0556.x
- Marschner P., Kandeler E., Marchner B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biol. Biochem., 2003, 35(3): 453-461 ( ) DOI: 10.1016/S0038-0717(02)00297-3
- Baumann K., Marschner P., Smernik R.J., Baldok J.A. Residue chemistry and microbial community structure during decomposition of eucalypt, wheat and vetch residues. Soil Biol. Biochem., 2009, 41(9): 1966-1975 ( ) DOI: 10.1016/j.soilbio.2009.06.022
- Bending G.D., Turner M.K., Jones J.E. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities. Soil Biol. Biochem., 2002, 34(8): 1073-1082 ( ) DOI: 10.1016/S0038-0717(02)00040-8
- Coppens F., Garnier P., De Gryze S., Merckx R., Recous S. Soil moisture, carbon and nitrogen dynamics following incorporation and surface application of labelled crop residues in soil columns. European Journal of Soil Science, 2006, 57(6): 894-905 ( ) DOI: 10.1111/j.1365-2389.2006.00783.x
- Nicolardot B., Bouziri L., Bastian F., Ranjard L. A microcosm experiment to evaluate the influence of location and quality of plant residues on residue decomposition and genetic structure of soil microbial communities. Soil Biol. Biochem., 2007, 39(7): 1631-1644 () DOI: 10.1016/j.soilbio.2007.01.012
- Агрохимические методы исследования почв/Под ред. А.В. Соколова. М., 1975.
- Паников Н.С., Горбенко А.Ю., Светлов С.В. Способ определения суммарного содержания водорастворимых органических веществ в почве. А.с. № 3949440/30-15. Опубл. 1987. Бюл. № 23.
- West A.W., Sparling G.P. Modification to the substrate-induced respiration method to permit measurement of microbial biomass in soils of different water contents. J. Microbiol. Meth., 1986, 5: 177-189 ( ) DOI: 10.1016/0167-7012(86)90012-6
- Благодатский С.А., Благодатская Е.В., Горбенко А.Ю., Паников Н.С. Регидратационный метод определения биомассы микроорганизмов в почве. Почвоведение, 1987, 4: 64-72.
- Bates S.T., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil. ISME J., 2010, 5: 908-917 ( ) DOI: 10.1038/ismej.2010.171
- Caporaso J.G., Bittinger K., Bushman F.D., DeSantis T.Z., Andersen G.L., Knight R. PyNAST: a flexible tool for aligning sequences to a template alignment. Bioinformatics, 2010, 26(2): 266-267 ( ) DOI: 10.1093/bioinformatics/btp636
- Воробьев Н.И., Свиридова О.В., Кутузова Р.С. Методические рекомендации по использованию граф-анализа в исследовании биосистем. СПб, 2005.
- Орлова О.В., Архипченко И.А. Роль повышения биологической активности почв при внесении биоудобрений для урожая растений и воспроизводства гумуса. В кн.: Высокоэффективные системы использования органических удобрений и возобновляемых биологических ресурсов. Владимир, 2012: 99-106.
- Бакина Л.Г. Роль фракций гумусовых веществ в почвенно-экологических процессах. Автореф. докт. дис. СПб, 2012.
- Six J., Frey S.D., Thiet R.K., Batten K.M. Bacterial and fungal contributions to carbon sequestration in agroecosystems. Soil Science Society of America Journal, 2006, 70(2): 555-569 () DOI: 10.2136/sssaj2004.0347


