Состав и содержание фенольных соединений в побегах Casuarina equisetifolia L
Автор: Кроль Т.А., Балеев Д.Н., Осипов В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Метаболиты, метаболомные профили
Статья в выпуске: 1 т.59, 2024 года.
Бесплатный доступ
Вид Casuarina equisetifolia L. широко используется в лесоводстве во многих странах с тропическим климатом. Известно, что экстракты из побегов C. еquisetifolia характеризуются высоким содержанием фенольных соединений, которые играют важную роль в процессах роста и развития растений, а также в адаптации к абиотическим и биотическим факторам окружающей среды. Кроме того, они обладают противовирусной, антибактериальной, противовоспалительной, противоопухолевой, нейропротекторной и другими видами активности. В настоящей работе в побегах C. еquisetifolia впервые подробно исследован состав фенольных соединений, которые были представлены в основном мономерными эллаготаннинами. Нашей целью было изучение состава и содержания фенольных соединений в побегах Casuarina equisetifolia методом ультра-эффективной жидкостной хроматографии в комбинации с фотодиодным и масс-спектрометрическим детекторами (УЭЖХ-ДД-МС). Объектом исследования были зеленые однолетние фотосинтезирующие побеги дерева C. еquisetifolia , которое произрастает в оранжерее Ботанического сада Всероссийского института лекарственных и ароматических растений (ФГБНУ ВИЛАР, г. Москва) в условиях защищенного грунта. Сбор образцов проводили в I декаде июля в 2019 году. Побеги замораживали, лиофильно высушивали и измельчали. Образец массой 15 мг экстрагировали 1 мл 80 % ацетона в течение 60 мин при комнатной температуре и постоянном перемешивании. Экстракт центрифугировали в течение 20 мин при 14000 об/мин и упаривали досуха при 45 °С. Экстракцию образца повторяли еще 2 раза. Полученный сухой экстракт растворяли в 1 мл деионизированной воды в течение 60 мин, центрифугировали в течение 20 мин при 14000 об/мин, разбавляли в 5 раз деионизированной водой и фильтровали. Для анализа фенольных соединений использовали ультра-эффективную жидкостную хроматографическую систему (УЭЖХ, Acquity UPLC® 2.9.0, «Waters Corporation», США), которая включала фотодиодный детектор (190-500 нм) и тройной квадрупольный масс-спектрометр (Xevo TQ, «Waters Corporation», США). Разделение проводили на колонке Acquity UPLC® BEH Phenyl (2,1½100 мм, 1,7 мкм, «Waters Corporation», Ирландия). Полученные данные анализировали с использованием программы DataAnalysis 4.0. При идентификации фенольных соединений использовали данные масс-спектрометрии, определяя m/z значение иона [M-H]- и его фрагментов. Содержание различных классов фенольных соединений - галлоил-глюкоз, эллаготаннинов, конденсированных таннинов, флавоноидов (производных кверцетина и кемпферола) определяли методом мониторинга множественных реакций. В результате проведенных исследований в экстракте обнаружили 16 фенольных соединений, среди которых 14 относились к классу гидролизуемых таннинов, 2 - к классу флаван-3-олов. Установлено, что побеги C. еquisetifolia накапливают мономерные эллаготаннины с молекулярной массой от 784 до 1068 Да, имеющие в молекуле в качестве полиола циклическую или линейную форму глюкозы. Среди эллаготаннинов C. еquisetifolia впервые идентифицированы казуариин, два изомера педункулагина, страхиурин, чебулаговая кислота, казуаринин и казуариктин. Два соединения с молекулярной массой 1068 Да были предварительно идентифицированы как изомеры птерокаринина А. В побегах также были идентифицированы эллаговая кислота и ее производные: арабинозид эллаговой кислоты и рамнозид эллаговой кислоты. Общее содержание фенольных соединений составило 55 мг/г сухой массы. При этом основными фенольными соединениями были эллаготаннины, содержание которых достигало 42 мг/г, или 76 % от общего количества всех фенольных соединений. На долю галлоил-глюкоз и конденсированных таннинов приходилось по 10 % от общего количества всех фенольных соединений. Полученные данные свидетельствуют о возможном использовании побегов C. еquisetifolia в качестве исходного сырья для получения индивидуальных эллаготаннинов и изучения их противовирусной, противовоспалительной и противоопухолевой активности.
Casuarina equisetifolia l, ультраэффективная жидкостная хроматография, масс-спектрометрия, фенольные соединения, гидролизуемые таннины, эллаготаннины
Короткий адрес: https://sciup.org/142241608
IDR: 142241608 | УДК: 615.322:582.621:581.192 | DOI: 10.15389/agrobiology.2024.1.106rus
Текст научной статьи Состав и содержание фенольных соединений в побегах Casuarina equisetifolia L
Casuarina equisetifolia L. — это быстрорастущее вечнозеленое древесное растение семейства Casuarinaceae (1) с сильно редуцированными чешуевидными листьями в мутовках на длинных тонких побегах, напоминающими хвою растений Pinaceae (2). В отличии от других видов рода, C. eq-uisetifolia имеет наибольший естественный ареал распространения (3). Во многих странах с тропическим климатом растение используется для восстановления деградированных экосистем, предотвращения эрозии и закрепления песков, при посадке прибрежных ветрозащитных полос, в лесоводстве в засушливых районах (4, 5).
Ранее была показана способность C. equisetifolia накапливать большие количества фенольных соединений. Например, в экстракте коры их общее содержание варьировало от 43 до 76 мг/г (6, 7), а в побегах достигало 100 мг/г (9). Среди фенольных соединений C. equisetifolia обнаружены флавоноиды, конденсированные и гидролизуемые таннины (9). Основными флавоноидами были рутин, гесперетин, а также агликоны кверцетин, наренги-нин и кемпферол (10).
Конденсированные таннины представлены полимерами проциани-дина, продельфинидина и пропеларгонидина со степенью полимеризации до 30 (11). Кроме того, идентифицированы мономерные предшественники конденсированных таннинов — эпикатехин и катехин (10). Состав гидролизуемых таннинов у C. equisetifolia детально не исследован, но изучение близкого вида C. stricta показало, что эллаготаннины служат основными фенольными соединениями (12). Выделены и идентифицированы педункула-гин, казуаринин, стахиурин, теллимаграндин I, стриктинин, казуариин, ка-зуариктин, 2,3-гексагидроксидифеноил-глюкоза и 4,6-гексагидроксидифе-ноил-глюкоза (12).
Фенольные соединения в растениях выполняют разнообразные физиологические и экологические функции. Они играют важную роль в процессах роста и развития, а также в адаптации к абиотическим и биотическим факторам окружающей среды, таким как УФ-радиация, низкие температуры, фитопатогены, насекомые-фитофаги (13, 14). В настоящее время механизм устойчивости C. equisetifolia к засолению и засухе активно изучается на уровне транскриптома и метаболома (15, 16). Показано, что засухоустойчивость C. equisetifolia связана с изменениями в биосинтезе фенилпро-паноидов и увеличением содержания конденсированных таннинов (15, 17). Кроме того, многие фенольные соединения обладают фармакологической активностью — антиоксидантной, противомикробной, противовоспалительной, противоопухолевой, другими полезными свойствами (18-21). Следовательно, C. equisetifolia представляет значительный интерес как объект для эффективного выделения индивидуальных фенольных соединений и изучения их фармакологической активности.
В настоящей работе в побегах C. еquisetifolia впервые подробно исследован состав фенольных соединений, которые были представлены в основном мономерными эллаготаннинами.
Нашей целью было изучение состава и содержания фенольных соединений в побегах Casuarina equisetifolia методом ультра-эффективной жидкостной хроматографии в комбинации с фотодиодным и масс-спектрометрическим детекторами (УЭЖХ-ДД-МС).
Методика. Объектом исследования были зеленые однолетние фотосинтезирующие побеги дерева C. еquisetifolia , которое произрастает в оранжерее Ботанического сада Всероссийского института лекарственных и ароматических растений (ФГБНУ ВИЛАР, г. Москва) в условиях защищенного грунта. Побеги членистые, толщиной около 1 мм, с редуцированными сросшимися чешуевидными листьями, собранными по 6-8 в мутовки. Сбор образцов проводили в I декаде июля в 2019 году.
Побеги замораживали, лиофильно высушивали (FreeZone 2.5 L, «Labconco Corporation», США) и измельчали (MM 400, «Retsch GmbH», Германия). Образец сухого измельченного побега массой 15 мг (CPA 225D, «Sartorius AG», Германия) экстрагировали 1 мл 80 % ацетона (для хроматографии, «Компонент-Реактив», Россия) в течение 60 мин при комнатной температуре и постоянном перемешивании (VORTEX Genie 2, «Scientific Industries, Inc.», США). Экстракт центрифугировали в течение 20 мин при 14000 об/мин (5430R, «Eppendorf AG», Германия) и упаривали досуха при 45 °С (концентратор CentriVap, «Labconco Corporation», США). Экстракцию образца повторяли еще 2 раза. Полученный сухой экстракт растворяли в 1 мл деионизированной воды (Direct-Q3, «Merck KGaA», Германия) в течение 60 мин, центрифугировали в течение 20 мин при 14000 об/мин, разбавляли в 5 раз деионизированной водой и фильтровали (PTFE filter Clean 2, 0,45 мкм, «Thermo Fisher Scientific, Inc.», США).
Для анализа фенольных соединений использовали ультра-эффективную жидкостную хроматографическую систему (УЭЖХ, Acquity UPLC® 2.9.0, «Waters Corporation», США), которая включала фотодиодный детектор (190-500 нм) и тройной квадрупольный масс-спектрометр (Xevo TQ, «Waters Corporation», США). Разделение проводили на колонке Acquity UPLC® BEH Phenyl (2,1½100 мм, 1,7 мкм, «Waters Corporation», Ирландия) в градиенте 0,1 % муравьиной кислоты (А) и ацетонитрила (Б) по программе: 00,5 мин, 0,1 % Б в А; 0,5-5,0 мин, 0,1-30,0 % Б в А (линейный градиент); 5,0-6,0 мин, 30-35 % Б в А (линейный градиент). Скорость потока элюента — 0,5 мл/мин, объем введенного образца — 5 мкл (22). Для регистрации фенольных соединений масс-спектрометр функционировал в режиме отрицательной ионизации. Полученные данные анализировали с использованием программы DataAnalysis 4.0.
При идентификации фенольных соединений использовали данные масс-спектрометрии, определяя m/z значение иона [M-H] - и его фрагментов, а также сравнивая полученные результаты с опубликованными в литературе (12, 23) и в базе масс-спектрометрических данных The Human Metabolome Database (HMDB) (24).
Содержание различных классов фенольных соединений — галлоил-глюкоз, эллаготаннинов, конденсированных таннинов, флавоноидов (производных кверцетина и кемпферола) — определяли методом мониторинга множественных реакций (22) и выражали в мг/г сухой массы побега. Использовали калибровочные графики, полученные для стандартов фенольных соединений: 1,2,3,4,6-пентагаллоилглюкозы, эллаговой кислоты, галловой кислоты, (+)-катехина, кверцетина и кемпферола («Sigma-Aldrich», США). Общее содержание определяли как сумму всех классов фенольных соединений.
Результаты. УЭЖХ-ДД-МС анализ показал присутствие в экстракте побегов C. еquisetifolia 16 фенольных соединений. По данным УФ-спектров, 14 фенольных соединений были классифицированы как гидролизуемые таннины или их предшественники и производные, а 2 соединения — как флаван-3-олы (рис. 1).
Соединение 1 со временем удерживания 1,26 мин показало УФ-спектр с двумя максимумами поглощения в области 218 и 274 нм, что характерно для галлоил-глюкоз (рис. 2). В масс-спектре определили депрото-нированный ион m/z 331 [M-H] - , а также его фрагмент m/z 169 [галловая кислота-Н] - (табл.). На основании этого соединение 1 было идентифицировано как моногаллоил-глюкоза, служащая предшественником гидролизуемых таннинов.
Соединения 2, 3, 4 со временем удерживания 2,14; 2,55 и 2,86 мин имели УФ-спектр с максимумом поглощения при 228-229 нм и небольшое плечо в области 260-280 нм, что характерно для эллаготаннинов, в структуре которых отсутствуют галлоильные группы (см. рис. 2). Эти соединения имели депротонированный ион m/z 783 [M-H] - и его фрагмент m/z 301
[эллаговая кислота-H] - (см. табл.). В результате соединение 2 было идентифицировано как казуариин, а соединения 3 и 4 — как изомеры педункула-гина (см. табл.). Все три эллаготаннина имеют одинаковую массу, но отличаются структурно. В молекуле казуариина глюкоза имеет линейную форму, тогда как в педункулагине — циклическую форму (12). По этой причине время удерживания казуариина при ВЭЖХ анализе на колонках с обращенной фазой меньше, чем у педункулагина (25).
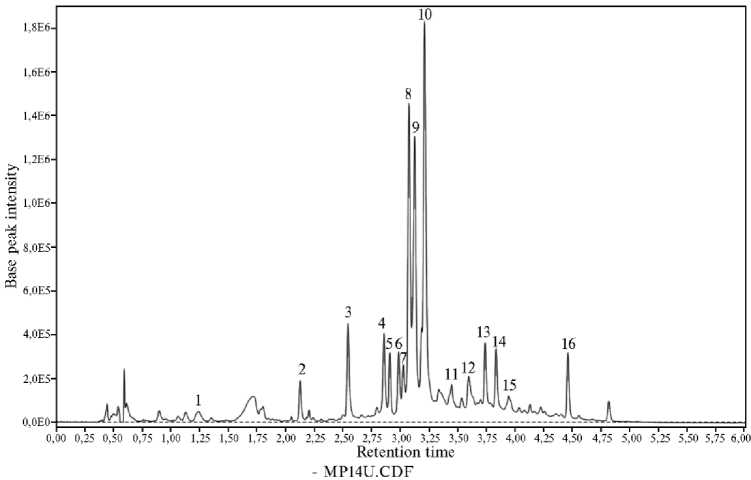
Рис. 1. Профиль фенольных соединений экстракта из побегов Casuarina equisetifolia L., полученный с помощью ультраэффективной жидкостной хроматографии с фотодиодным детектором (280 нм): 1 — моногаллоил-глюкоза, 2 — казуариин, 3 — педункулагин (изомер 1), 4 — пе-дункулагин (изомер 2), 5 — катехин, 6 — птерокаринин А (изомер 1), 7 — птерокаринин А (изомер 2), 8 — стахиурин, 9 — чебулаговая кислота, 10 — казуаринин, 11 — производное катехина, 12 — эллаготаннин, 13 — арабинозид эллаговой кислоты, 14 — казуариктин, 15 — эллаговая кислота, 16 — рамнозид эллаговой кислоты.
Соединение 5 было идентифицировано как (+)-катехин на основании характерного для флаван-3-олов УФ-спектра с двумя максимумами поглощения в области 226 и 278 нм (см. рис. 2), а также депротонированного иона m/z 289 [M-H] - , фрагмента m/z 245 [М-Н-CO 2 ] - и иона m/z 579 [2MH] - (см. табл.).
Соединения 6 и 7 имели УФ-спектр с двумя максимумами поглощения в области 224 и 271-273 нм (см. рис. 2), что характерно для эллаготан-нинов, содержащих галлоильные и гексагидроксидифеноильные группы. Изучение масс-спектра этих соединений показало присутствие депротони-рованного иона m/z 1067 [M-H] - и характерные фрагменты m/z 169 [галловая кислота-Н] - , 275 [монолактон декарбоксилированной гексагидроксиди-феновой кислоты-H] - и 533 [М-2Н]2 - (см. табл.). В результате соединения 6 и 7 были предварительно идентифицированы как изомеры птерокаринина А — мономерные эллаготаннины с С-гликозидной связью (26). Для более точной идентификации необходимы дополнительные исследования.
Соединения 8, 10 и 14 также имели УФ-спектр, характерный для эллаготаннинов. В масс-спектре присутствовали депротонированный ион m/z 935 [M-H]-, ион m/z 467 [М-2Н]2- и характерный фрагмент m/z 301 [эллаговая кислота-H]- (см. табл.). Эти соединения были идентифициро- ваны соответственно как стахиурин, казуаринин и казуариктин. Стахиурин и казуаринин относятся к эллаготаннинам с С-гликозидной связью, в которых глюкоза с открытой цепью образует сложноэфирные связи с двумя гексагидроксидифеноильными группами, а казуариктин относится к простым мономерным эллаготаннинам (12).
Результаты идентификации фенольных соединений побегов Casuarina equiseti-folia L., полученные с использованием ультра-эффективной жидкостной хроматографии в комбинации с фотодиодным и масс-спектрометрическим детекторами
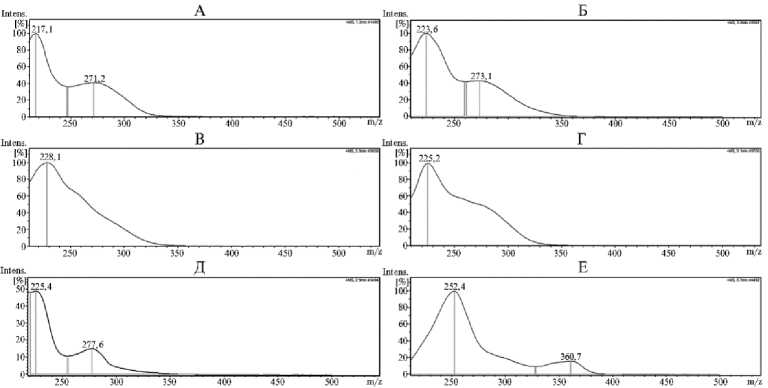
Рис. 2. Примеры УФ-спектров различных фенольных соединений, идентифицированных методом ультраэффективной жидкостной хроматографии в экстракте из побегов Casuarina equisetifolia L.: А — моногаллоил-глюкоза, Б — птерокаринин А (изомер 1), В — педункулагин (изомер 1), Г — казуаринин, Д — катехин, Е — арабинозид эллаговой кислоты.
Соединение 9 было идентифицировано как чебулаговая кислота или ее изомер по присутствию в масс-спектре депротонированного иона со значением m/z 953 [M-H] - и характерных фрагментов со значениями m/z 169 [галловая кислота-Н] - , m/z 275 [монолактон декарбоксилированной гекса-гидроксидифеновой кислоты-H] - , m/z 301 [эллаговая кислота-H] - , m/z 476 [М-2Н]2 - и m/z 633 [корилагин-H] - (см. табл.).
Соединение 11 имело УФ-спектр с максимумами поглощения в области 226 и 275 нм, а также в нем было зафиксировано присутствие ионов с m/z значениями 458 и 917, которые соответствовали ионам [M-H]- и [2MH]-, и фрагмент исходного иона со значением m/z 289 [катехин-Н]-. Соединение 11 не удалось точно идентифицировать, но на основании полученных данных можно предположить, что это производное катехина.
Для соединения 12 со временем удерживания 3,60 мин не удалось определить в масс-спектре депротонированный ион и произвести его идентификацию. Однако УФ-спектр, характерный для эллаготаннинов, и присутствие в масс-спектре ионов с m/z 169, 275, 633, 785, 917 свидетельствуют, что это соединение относится к классу эллаготаннинов.
Соединения 13, 15 и 16 имели УФ-спектры, характерные для эллаговой кислоты (см. рис. 2). Анализ масс-спектров показал наличие фрагмента со значением m/z 301 [эллаговая кислота-Н] - . В масс-спектре соединения 13 наблюдали ионы с m/z значениями 433 и 867, которые соответствуют [M-H] - и [2M-H] - (см. табл.). В результате соединение 13 было идентифицировано как арабинозид эллаговой кислоты, а соединение 15 — как эллаговая кислота. Соединение 16 показало присутствие ионов с m/z значениями 447 [M-H] - и 895 [2M-H] - и было идентифицировано как рамнозид эллаговой кислоты. Несмотря на то, что ранее проведенные исследования указывают на присутствие гидролизуемых таннинов в C. equisetifolia , подробно их состав не изучался.
Педункулагин, казуаринин и казуариктин были ранее выделены из растений другого вида семейства Casuarinaceae — C. stricta (12). Чебулаговая кислота обнаружена в C. glauca (27). Птерокаринин А выявлен у представителей семейства Juglandaceae, которое относится к тому же порядку, что
Casuarinaceae (23). О наличии катехина и эллаговой кислоты в C. equisetifolia также сообщалось ранее (28).
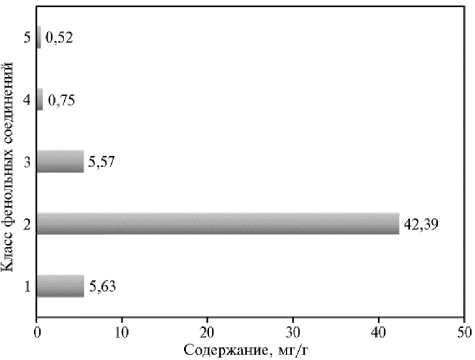
Рис. 3. Содержание различных классов фенольных соединений в побегах Casuarina equisetifolia L.: 1 — галлоил-глю-козы, 2 — эллаготаннины, 3 — конденсированные тан-нины, 4 — производные кемпферола, 5 — производные кверцетина.
Общее содержание фенольных соединений в побегах C. equisetifolia составило 55 мг/г сухой массы (рис. 3). При этом общее содержание эллаготаннинов достигало 42 мг/г сухой массы побега, или 76 % от суммы всех классов фенольных соединений, что в основном соответствует данным других исследований (6-8).
При изучении состава эллаготаннинов были обнаружены казуариин, два изомера педункулагина, два изомера птерокаринина А, стахиурин, чебулаговая кислота, казуаринин, неиден-тифицированный эллаго- таннин и казуариктин (см. табл.). В количественном отношении преобладали стахиурин, чебулаговая кислота и казуаринин (см. рис. 1).
Эллаготаннины играют важную роль в физиологии растений (29), участвуя в процессах роста, развития и размножения (30), защите от насекомых-фитофагов и патогенов (31, 32). Синтез этих соединений происходит в клетках растений по шикиматному пути (33). Состав и содержание гидролизуемых таннинов, в том числе эллаготаннинов, зависит как от вида растения, так и от фазы его развития (34). Например, в начале вегетации наблюдается преобладание галлоил-глюкоз, которые впоследствии окисляются до эллаготаннинов (35).
Обнаруженные в побегах C. equisetifolia эллаготаннины обладают разнообразной фармакологической активностью. Например, чебулаговая кислота, педункулагин и казуаринин отличаются высокой антиоксидантной (36) и противовирусной (37, 38) активностью. Кроме того, педункулагин проявляет противоопухолевые свойства в отношении культур раковых клеток (39), а казуаринин способен вызывать их апоптоз (40). Установлены противовоспалительное и антикоагулянтное действие казуаринина (41, 42). Антибактериальной активностью обладают казуариктин, стахиурин и казу-аринин (43).
Таким образом, методом ультра-эффективной жидкостной хроматографии в комбинации с фотодиодным и масс-спектрометрическим детекторами изучен состав и содержание фенольных соединений в побегах растения Casuarina equisetifolia , произрастающего в условиях защищенного грунта в оранжерейном комплексе ФГБНУ ВИЛАР. Показано, что основные фенольные соединения в его побегах — эллаготаннины. Идентифицированы казуариин, два изомера педункулагина, два изомера птерокаринина А, стра-хиурин, чебулаговая кислота, казуаринин и казуариктин. Общее содержание эллаготаннинов составило 42 мг/г, или 76 % от суммы всех фенольных соединений. Полученные результаты свидетельствуют о важной роли эллаго-таннинов в жизнедеятельности C. equisetifolia , а также о возможном использовании его побегов для препаративного выделения индивидуальных элла-готаннинов (стахиурина, чебулаговой кислоты и казуаринина) с целью изучения их фармакологической активности.
Список литературы Состав и содержание фенольных соединений в побегах Casuarina equisetifolia L
- Diouf D., Sy M.O., Gherbi H., Bogusz D., Franche C. Casuarinaceae. In: Compendium of Transgenic Crop Plants /C. Kole, T.C. Hall (eds.). Blackwell Publishing Ltd, 2009: 279-292 (doi: 10.1002/9781405181099.k0910).
- Dörken V.M., Parsons R.F. Morpho-anatomical studies on the leaf reduction in Casuarina: the ecology of xeromorphy. Trees, 2017, 31: 1165-1177 (doi: 10.1007/s00468-017-1535-5).
- Li H.-B., Li N., Yang S.-Z., Peng H.-Z., Wang L.-L., Wang Y., Zhang X.-M., Gao Z.-H. Transcriptomic analysis of Casuarina equisetifolia L. in responses to cold stress. Tree Genetics & Genomes, 2017, 13: 7 (doi: 10.1007/s11295-016-1090-z).
- Wang Y., Zhang Y., Fan C., Wei Y., Meng J., Li Z., Zhong C. Genome-wide analysis of MYB transcription factors and their responses to salt stress in Casuarina equisetifolia. BMC Plant Biology, 2021, 21: 328 (doi: 10.1186/s12870-021-03083-6).
- Zhong C., Zhang Y., Wei Y., Meng J., Chen Y., Bush D., Bogusz D., Franche C. The role of Frankia inoculation in Casuarina plantations in China. Antonie van Leeuwenhoek, 2019, 112: 47-56 (doi: 10.1007/s10482-018-1205-7).
- Saranya K., Gowrie U. Phytochemical analysis and in vitro studies on antibacterial, antioxidant and anti-inflammatory activities using Casuarina equisetifolia bark extracts. International Journal of Pharmacy and Pharmaceutical Sciences, 2018, 10(1): 118-125 (doi: 10.22159/ijpps.2018v10i1.22188).
- Pawar A.R., Rao P.S., Vikhe D.N. Pharmacognostic, phytochemical, physico-chemical standardization of Casuarina equisetifolia stem-inner bark. Research Journal of Science and Technology, 2021, 13(3): 193-199 (doi: 10.52711/2349-2988.2021.00029).
- Zhang L., Zhang S., Ye G., Qin X. Seasonal variation and ecological importance of tannin and nutrient concentrations in Casuarina equisetifolia branchlets and fine roots. Journal of Forestry Research, 2020, 31(5): 1499-1508 (doi: 10.1007/s11676-019-00991-0).
- Muhammad H.L., Garba R., Abdullah A.S., Adefolalu F.S., Busari M.B., Hamzah R.U., Makun H.A. Hypoglycemic and hypolipidemic properties of Casuarina equisetifolia leaf extracts in alloxan induced diabetic rats. Pharmacological Research-Modern Chinese Medicine, 2022, 2: 100034 (doi: 10.1016/j.prmcm.2021.100034).
- Muthuraj S., Muthusamy P., Radha R., Ilango K. Pharmacognostical, phytochemical studies and in vitro antidiabetic evaluation of seed extracts of Casuarina equisetifolia Linn. The Journal of Phytopharmacology, 2020, 9(6): 410-418 (doi: 10.31254/phyto.2020.9605).
- Zhang S.-J., Lin Y.-M., Zhou H.-C., Wei S.D., Lin G.-H., Ye G.-F. Antioxidant tannins from stem bark and fine root of Casuarina equisetifolia. Molecules, 2010, 15(8): 5658-5670 (doi: 10.3390/molecules15085658).
- Okuda T., Yoshida T., Ashida M., Yazaki K. Tannis of Casuarina and Stachyurus species. Part 1. Structures of pendunculagin, casuarictin, strictinin, casuarinin, casuariin, and stachyurin. Journal of the Chemical Society, Perkin Transactions 1, 1983: 1765-1772 (doi: 10.1039/P19830001765).
- Pratyusha S. Phenolic compounds in the plant development and defense: an overview. In: Plant stress physiology — perspective in agriculture /M. Hasanuzzaman, K. Nahar (eds.). Intechopen, 2022: 125-140 (doi: 10.5772/intechopen.102873).
- Kumar S., Abedin M.M., Singh A.K., Das S. Role of phenolic compounds in plant-defensive mechanisms. In: Plant phenolics in sustainable agriculture /R. Lone, R. Shuab, A. Kamili (eds.). Springer, Singapore, 2020: 517-532 (doi: 10.1007/978-981-15-4890-1_22).
- Zhang S., He C., Wei L. Jian S., Liu N. Transcriptome and metabolome analysis reveals key genes and secondary metabolites of Casuarina equisetifolia ssp. incana in response to drought stress. BMC Plant Biology, 2023, 23: 200 (doi: 10.1186/s12870-023-04206-x).
- Ai D., Wang Y., Wei Y., Zhang J., Meng J., Zhang Y. Comprehensive identification and expression analyses of the SnRK gene family in Casuarina equisetifolia in response to salt stress. BMC Plant Biology, 2022, 22: 572 (doi: 10.1186/s12870-022-03961-7).
- Zhang L.H., Shao H.B., Ye G.F., Lin Y. M. Effects of fertilization and drought stress on tannin biosynthesis of Casuarina equisetifolia seedlings branchlets. Acta Physiologiae Plantarum, 2012, 34: 1639-1649 (doi: 10.1007/s11738-012-0958-2).
- Kiss A.K., Piwowarski J.P. Ellagitannins, gallotannins and their metabolites-the contribution to the anti-inflammatory effect of food products and medicinal plant. Current Medicinal Chemistry, 2018, 25(37): 4946-4967 (doi: 10.2174/0929867323666160919111559).
- Olchowik-Grabarek E., Sękowski S., Kwiatek A., Płaczkiewicz J., Abdulladjanova N., Shlyonsky V., Swiecicka I, Zamaraeva M. The structural changes in the membranes of Staphylococcus aureus caused by hydrolysable tannins witness their antibacterial activity. Membranes, 2022, 12(11): 1124 (doi: 10.3390/membranes12111124).
- Kaneshima T., Myoda T., Nakata M., Fujimori T., Toeda K., Nishizawa M. Antioxidant activity of C-Glycosidic ellagitannins from the seeds and peel of camu-camu (Myrciaria dubia). LWTFood Science and Technology, 2016, 69: 76-81 (doi: 10.1016/j.lwt.2016.01.024).
- Senobari Z., Karimi G., Jamialahmadi K. Ellagitannins, promising pharmacological agents for the treatment of cancer stem cells. Phytotherapy Research, 2022, 36(1): 231-242 (doi: 10.1002/ptr.7307).
- Engstrom M.T., Palijarvi M., Salminen J.P. Rapid fingerprint analysis of plant extracts for ellagitannins, gallic acid, and quinic acid derivatives and quercetin-, kaempferol-and myricetin-based flavonol glycosides by UPLC-QqQ-MS/MS. Journal of Agricultural and Food Chemistry, 2015, 63(16): 4068-4079 (doi: 10.1021/acs.jafc.5b00595).
- Xu M., Liu P., Jia X., Zhai M., Zhou S., Wu B., Guo Z. Metabolic profiling revealed the organspecific distribution differences of tannins and flavonols in pecan. Food Science & Nutrition, 2020, 8(9): 4987-5006 (doi: 10.1002/fsn3.1797).
- Wishart D.S., Feunang Y.D., Marcu A., Guo A.C., Liang K., Vázquez-Fresno R., Sajed T., Johnson D., Li C., Karu N., Sayeeda Z., Lo E., Assempour N., Berjanskii M., Singhal S., Arndt D., Liang Y., Badran H., Grant J., Serra-Cayuela A., Liu Y., Mandal R., Neveu V., Pon A., Knox C., Wilson M., Manach C., Scalbert A. HMDB 4.0: the human metabolome database for 2018. Nucleic Acids Research, 2018, 46(D1): D608-D617 (doi: 10.1093/nar/gkx1089).
- Plaza M., Batista A.G., Cazarin C.B.B., Sandahl M., Turner C., Östman E., Júnior M.R.M. Characterization of antioxidant polyphenols from Myrciaria jaboticaba peel and their effects on glucose metabolism and antioxidant status: A pilot clinical study. Food Chemistry, 2016, 211: 185-197 (doi: 10.1016/j.foodchem.2016.04.142).
- Nonaka G., Ishimaru K., Azuma R., Ishimatsu M., Nishioka I. Tannins and related compounds. LXXXV: Structures of novel C-glycosidic ellagitannins, grandinin and pterocarinins A and B. Chemical and Pharmaceutical Bulletin, 1989, 37(8): 2071-2077 (doi: 10.1248/cpb.37.2071).
- Jorge T.F., Tohge T., Wendenburg R., Ramalho J.C., Lidon F.C., Ribeiro-Barros A.I., Fernie A.R., Antonio C. Salt-stress secondary metabolite signatures involved in the ability of Casuarina glauca to mitigate oxidative stress. Environmental and Experimental Botany, 2019, 166: 103808 (doi: 10.1016/j.envexpbot.2019.103808).
- Aher A.K., Pal S., Yadav S., Patil U., Bhattacharya S. Evaluation of antimicrobial activity of Casuarina equisetifolia frost (Casuarinaceae). Research Journal of Pharmacognosy and Phytochemistry, 2009, 1(1): 64-68.
- Yoshida T., Amakura Y., Yoshimura M. Structural features and biological properties of ellagitannins in some plant families of the order Myrtales. International Journal of Molecular Sciences, 2010, 11(1): 79-106 (doi: 10.3390/ijms11010079).
- Karlińska E., Masny A., Cieślak M., Macierzyński J., Pecio Ł., Stochmal A., Kosmala M. Ellagitannins in roots, leaves, and fruits of strawberry (Fragaria ½ ananassa Duch.) vary with developmental stage and cultivar. Scientia Horticulturae, 2021, 275: 109665 (doi: 10.1016/j.scienta. 2020.109665).
- Anstett D.N., Cheval I., D’Souza C., Salminen J.-P., Johnson M.T. Ellagitannins from the Onagraceae decrease the performance of generalist and specialist herbivores. Journal of Chemical Ecology, 2019, 45: 86-94 (doi: 10.1007/s10886-018-1038-x).
- Grellet-Bournonville C.F., Di Peto P.A., Cervino Dowling A.M., Castagnaro A.P., Schmeda- Hirschmann G., Diaz Ricci J.C., Mamaní A.I., Filippone M.P. Seasonal variation of plant defense inductor ellagitannins in strawberry leaves under field conditions for phytosanitary technological applications. Journal of Agricultural and Food Chemistry, 2021, 69(42): 12424-12432 (doi: 10.1021/acs.jafc.1c03810).
- Ossipov V., Salminen J.-P., Ossipova S., Haukioja E., Pihlaja K. Gallic acid and hydrolysable tannins are formed in birch leaves from an intermediate compound of the shikimate pathway. Biochemical Systematics and Ecology, 2003, 31(1): 3-16 (doi: 10.1016/S0305-1978(02)00081-9).
- Salminen J.-P. The chemistry and chemical ecology of ellagitannins in plant–insect interactions: from underestimated molecules to bioactive plant constituents. In: Recent advances in polyphenol research /A. Romani, V. Lattanzio, S. Quideau (eds.). Wiley, Hoboken, 2014: 83-113 (doi: 10.1002/9781118329634.ch4).
- Hatano T., Kira R., Yoshizaki M., Okuda T. Seasonal changes in the tannins of Liquidambar formosana reflecting their biogenesis. Phytochemistry, 1986, 25(12): 2787-2789 (doi: 10.1016/S0031-9422(00)83742-5).
- Yin T.-P., Cai L., Chen Y., Li Y., Wang Y.-R., Liu C.-S., Ding Z.-T. Tannins and antioxidant activities of the walnut (Juglans regia) pellicle. Natural Product Communications, 2015, 10(12): 1934578X1501001232 (doi: 10.1177/1934578X1501001232).
- Khalifa I., Zhu W., Nafie M.S., Dutta K., Li C. Anti-COVID-19 effects of ten structurally different hydrolysable tannins through binding with the catalytic-closed sites of COVID-19 main protease: an in-silico approach. Preprints, 2020: 2020030277 (doi: 10.20944/preprints202003.0277.v1).
- Du R., Cooper L., Chen Z., Lee H., Rong L., Cui Q. Discovery of chebulagic acid and punicalagin as novel allosteric inhibitors of SARS-CoV-2 3CLpro. Antiviral Research, 2021, 190: 105075 (doi: 10.1016/j.antiviral.2021.105075).
- Kuo P.-L., Hsu Y.-L., Lin T.-C., Lin L.-T., Chang J.-K., Lin C.-C. Casuarinin from the bark of Terminalia arjuna induces apoptosis and cell cycle arrest in human breast adenocarcinoma MCF-7 cells. Planta Medica, 2005, 71(3): 237-243 (doi: 10.1055/s-2005-837823).
- Yang L.-L., Lee C.-Y., Yen K.-Y. Induction of apoptosis by hydrolyzable tannins from Eugenia jambos L. on human leukemia cells. Cancer Letters, 2000, 157(1): 65-75 (doi: 10.1016/S0304-3835(00)00477-8).
- Kim M., Yin J., Hwang I.H., Park D., Lee, E., Kim M., Lee M. Anti-Acne vulgaris effects of pedunculagin from the leaves of Quercus mongolica by anti-inflammatory activity and 5-reductase inhibition. Molecules, 2020, 25(9): 2154 (doi: 10.3390/molecules25092154).
- Kwon D.-J., Bae Y.-S., Ju S.M., Goh A.R., Choi S.Y., Park J. Casuarinin suppresses TNF-- induced ICAM-1 expression via blockade of NF-κB activation in HaCaT cells. Biochemical and Biophysical Research Communications, 2011, 409(4): 780-785 (doi: 10.1016/j.bbrc.2011.05.088).
- Puljula E., Walton G., Woodward M.J., Karonen M. Antimicrobial activities of ellagitannins against Clostridiales perfringens, Escherichia coli, Lactobacillus plantarum and Staphylococcus aureus. Molecules, 2020, 25(16): 3714 (doi: 10.3390/molecules25163714).


