Состояние гранулоцитопоэза в условиях противоопухолевого лекарственного лечения немелкоклеточного рака легкого
Автор: Хричкова Т.Ю., Гольдберг В.Е., Жданов В.В., Попова Н.О., Болдышев Д.А., Шаталова В.А., Бурштейн Е.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 (38), 2010 года.
Бесплатный доступ
Изучали изменения гранулоцитарного ростка кроветворения у больных немелкоклеточным раком легкого III-IV стадии при цитостатическом лечении по схеме доцетаксел/цисплатин в сравнении с комбинацией циклофосфамид/винкристин/ карбоплатин. Показано, что в условиях использования режима доцетаксел/цисплатин гранулоцитарный росток гемопоэза обладает более широкими возможностями компенсации повреждений, вызванных цитостатическими препаратами, что выявляется на уровне коммитированных предшественников, морфологически дифференцируемых элементов костного мозга и периферической крови.
Немелкоклеточный рак легкого, химиотерапия, гранулоцитопоэз
Короткий адрес: https://sciup.org/14055606
IDR: 14055606 | УДК: 616.24-006.6:615.28:616.155.34-007.1
Текст научной статьи Состояние гранулоцитопоэза в условиях противоопухолевого лекарственного лечения немелкоклеточного рака легкого
На сегодняшний день производные платины (цисплатин и карбоплатин) – общепризнанная основа для создания высокоэффективных программ лечения немелкоклеточного рака легкого (НМРЛ) [9], включение данных препаратов в состав лекарственных комбинаций является самостоятельным прогностическим фактором, определяющим увеличение выживаемости при химиотерапии опухолей указанной локализации [5]. Использование новых противоопухолевых препаратов, в первую очередь таксанов, вино-релбина, гемцитабина в сочетании с платиноидами, позволило достичь более высокого уровня выживаемости больных с распространенным НМРЛ [5]. Эффективность комбинации таксотера с цисплатином составляет от 30 до 52 % с медианой выживаемости 10 мес [6, 7].
Однако известно, что основной дозолимитирующей токсичностью таксотера является ней- тропения, которая развивается у 76 % больных, получающих препараты из группы таксанов [6]. Вполне естественно, что предпочтение при выборе химиотерапевтических схем отдается комбинациям препаратов, которые позволяют достичь желаемого клинического эффекта при наименее выраженных побочных реакциях. В связи с этим представляется актуальным изучение механизмов, лежащих в основе гематотокси-ческих влияний как давно существующих, так и современных режимов химиотерапии.
Целью настоящего исследования явилось сравнительное изучение токсического влияния на гранулоцитарный росток кроветворения химиотерапевтических схем доцетаксел/циспла-тин и циклофосфамид/винкристин/карбоплатин, применяемых при лечении больных раком легкого, и вскрытие механизмов, лежащих в основе различия их гематологических эффектов.
Материал и методы
В ходе работы было обследовано 78 больных немелкоклеточным раком легкого III–IV стадий, из которых 33 человека получали противоопухолевую химиотерапию по схеме CVC, включающую внутривенное введение винкристина (Гедеон Рихтер А/О, Венгрия) 1,4 мг/м2, цикло-фосфана (ЛЭНС-Фарм, Одинцово) 600 мг/м2 в первый день и введение карбоплатина (Ebewe, Австрия) 300 мг/м2 во второй день. Другая группа, включающая 45 пациентов, получала специальную терапию по однодневной схеме ТР с использованием внутривенного введения 75 мг/м2 таксотера (Авентис Фарма, С.A., Франция) и затем 75 мг/м2 цисплатина (Бристол-Майерс Сквибб, Италия). Интервалы между курсами лечения по обеим схемам составляли 3 нед, показатели системы крови оценивали на протяжении 3 курсов химиотерапии.
Материал для исследования (капиллярную и венозную кровь) забирали до и после каждого цикла цитостатического лечения. Проведение преднизолоновых проб и стернальных пункций было запланировано до начала специального лечения, а также перед II и III курсами химиотерапии.
Определение показателей периферической крови (лейкоциты, лейкоцитарная формула) и дифференциальный подсчет миелограмм в стернальных пунктатах производили стандартными гематологическими методами. Колониеобразующую способность костного мозга и периферической крови определяли путем клонирования клеток – предшественников грануломоноци-топоэза (КОЕ-ГМ) в полувязкой питательной среде на основе метилцеллюлозы [3].
Для оценки костномозгового резерва нейтрофильных гранулоцитов использовали преднизолоновую пробу. Преднизолон (Гедеон Рихтер, Венгрия) вводили внутривенно в дозе 60 мг. Общее количество лейкоцитов (ОКЛ) и содержание сегментоядерных форм нейтрофилов определяли до, а также через 2, 3, 4, 5 и 6 ч после введения препарата. Результат пробы оценивали по величине выброса нейтрофильных гранулоцитов в процентах от исходного уровня, отмечали величину максимального выброса нейтрофилов в процентах и абсолютных числах.
Статистическую обработку полученных данных проводили методом вариационной статистики с использованием t-критерия Стьюдента.
Результаты и обсуждение
Показано, что общее количество лейкоцитов при использовании схемы CVC достоверно снижалось на протяжении второго курса лечения и в начале третьего, с минимальным уровнем, составившим 60 % от исходного. В то же время применение режима ТР у больных РЛ приводило к прогрессирующему уменьшению ОКЛ после каждого курса химиотерапии с восстановлением к началу следующего. При этом максимальное падение отмечалось в конце периода наблюдения, ОКЛ составило 48 % от уровня до начала лечения (рис. 1).
Уменьшение числа лейкоцитов под воздействием цитостатических препаратов обеих исследуемых схем было обусловлено снижением содержания лимфоцитов, моноцитов и сегментоядерных нейтрофилов (рис. 1). В нашем исследовании указанные изменения были выражены несколько значительнее при использовании схемы ТР. В то же время число палочкоядерных нейтрофилов на фоне режима таксотер/цисплатин существенно превосходило уровень такового при лечении больных РЛ препаратами схемы CVC (рис. 1). Описанное явление возможно, видимо, вследствие значительного накопления зрелых нейтрофильных гранулоцитов в костном мозге на протяжении всего периода исследования как по сравнению с исходным уровнем (на 18,4 %), так и с данными, полученными при использовании схемы CVC (рис. 2). Число же незрелых нейтрофильных гранулоцитов при лечении препаратами обеих изучаемых схем не изменялось. Преобладание молодых форм (промиелоциты, миелоциты, метамиелоциты) с одновременным уменьшением количества зрелых нейтрофилов в костном мозге, что имело место перед третьим курсом лечения по схеме CVC (рис. 2), свидетельствует о дифференцировке большего по сравнению с нормой количества гемопоэтических стволовых клеток в направлении гранулоцитопоэза и усилении пролиферативной активности гранулоцитарных элементов, что, в конечном итоге,
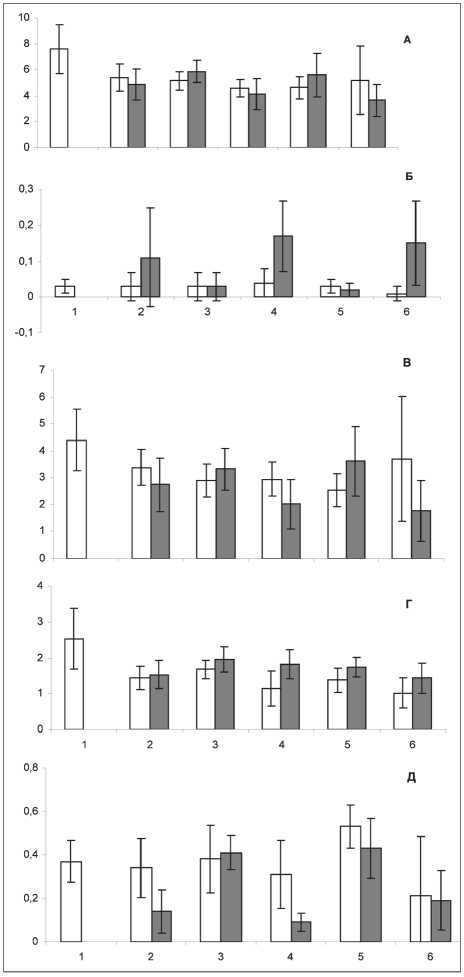
Рис. 1. Изменение общего количества лейкоцитов (А), содержания палочкоядерных (Б), сегментоядерных нейтрофилов (В), лимфоцитов (Г) и моноцитов (Д) в периферической крови больных раком легкого III–IV стадии в динамике противоопухолевой химиотерапии по схеме CVC (белые столбики) либо ТР (серые столбики).
По оси абсцисс – сроки исследования (1 – до лечения, 2 – после первого курса, 3 – перед вторым курсом, 4 – после второго курса, 5 – перед третьим курсом, 6 – после третьего курса), по оси ординат – содержание клеток в периферической крови (Г/л); доверительные интервалы при р<0,05
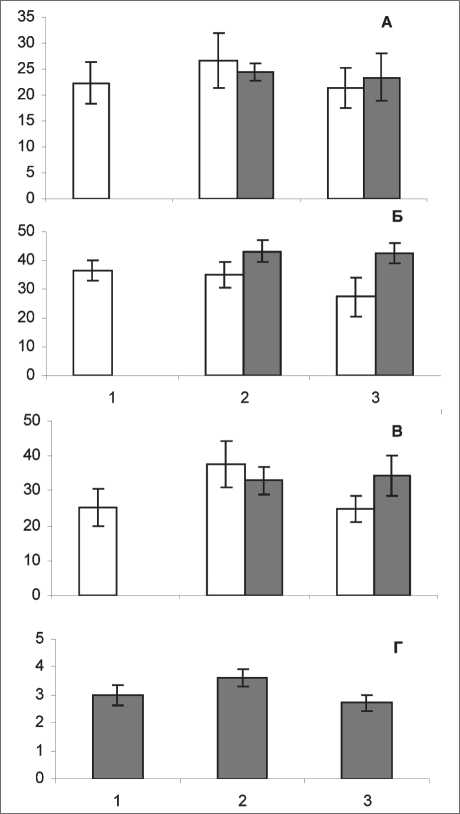
Рис. 2. Изменение содержания незрелых (А, %), зрелых (Б, %) нейтрофильных гранулоцитов, количество КОЕ-ГМ (В, на 105 неприлипающих мононуклеаров) и интенсивность созревания КОЕ-ГМ (Г, индекс созревания) в костном мозге больных раком легкого III–IV стадии в динамике противоопухолевой химиотерапии по схеме CVC (белые столбики) либо ТР (серые столбики). По оси абсцисс – сроки исследования (1 – до лечения, 2 – после первого курса, 3 – после второго курса), по оси ординат – значения показателя; доверительные интервалы при р<0,05
Таблица
Прирост содержания нейтрофилов (Г/л) и их максимальный выброс в периферическую кровь в ответ на введение преднизолона в процессе лечения больных раком легкого III – IV стадии по схеме CVC (А) либо ТР (Б)
|
Показатели |
Cроки исследования |
||||
|
До лечения |
Перед 2 курсом |
Перед 3 курсом |
|||
|
Динамика реакции (ч) |
До введения |
3,10 ±0,30 |
А |
2,84 ± 0,10 |
3,11 ± 1,10 |
|
Б |
4,09 ± 0,56# |
3,74 ± 0,57 |
|||
|
2-й |
4,90 ± 0,62 |
А |
4,98 ± 1,56 |
4,31 ± 1,71 |
|
|
Б |
7,38 ± 1,34 |
7,17 ± 1,35 |
|||
|
3-й |
4,87 ± 0,56 |
А |
5,73 ± 1,88 |
5,20 ± 2,45 |
|
|
Б |
7,78 ± 1,26* |
6,65 ± 1,14 |
|||
|
4-й |
5,55 ± 0,56 |
А |
5,94 ± 1,58 |
4,33 ± 1,71 |
|
|
Б |
7,87 ± 1,13 |
6,97 ± 0,97 |
|||
|
5-й |
5,36 ± 0,71 |
А |
5,30 ± 1,23 |
4,37 ± 1,58 |
|
|
Б |
7,91 ± 0,97* |
5,95 ± 0,81 |
|||
|
6-й |
4,75 ± 0,41 |
А |
4,39 ± 1,36 |
3,49 ± 1,22 |
|
|
Б |
7,19 ± 0,98* |
5,65 ± 0,77 |
|||
|
Максимальный выброс |
Г/л |
2,84 ± 0,44 |
А |
4,80 ± 0,85 |
2,83 ± 0,83 |
|
Б |
4,89 ± 0,71* |
3,74 ± 0,67 |
|||
|
% |
59,50 ± 0,52 |
А |
66,80 ± 1,69 |
54,00 ± 2,26 |
|
|
Б |
121,81 ± 9,86*# |
99,56 ± 8,33*# |
|||
Примечание: * – отличия от значения показателя до лечения достоверны (р<0,05); # – отличия между группами достоверны (р<0,05).
позволяет организму не впасть в состояние фебрильной нейтропении.
При использовании в лечении НМРЛ схемы ТР в ускоренную дифференцировку вовлечены все отделы гранулоцитарного ростка. При этом, вероятно, наряду с усилением пролиферации гранулоцитарных предшественников происходит форсированное созревание менее дифференцированных прекурсоров, благодаря чему нижележащие отделы пополняются довольно быстро, и мы фиксируем достоверный рост числа зрелых нейтрофильных гранулоцитов на все сроки наблюдения.
В настоящее время доказано, что основным звеном системы крови, обеспечивающим восполнение отдела морфологически распознаваемых гемопоэтических клеток в экстремальных ситуациях, являются не полипотентные стволовые кроветворные клетки, а элементы «буферного» отдела кроветворной ткани – коммитированные прекурсоры [2].
Уже перед началом второго курса химиотерапии с использованием обеих изучаемых схем наблюдалось существенное увеличение содержания в кроветворной ткани клеток-предшественников грануломоноцитопоэза (рис. 2). Перед третьим курсом специального лечения данный показатель оставался достоверно повышен лишь в случае применения режима ТР как по сравнению с исходным уровнем, так и с аналогичной величиной в группе больных, леченных по схеме CVC.
Увеличение колониеобразующей способности кроветворной ткани развивается за счет активации нейроэндокринных механизмов, действующих как непосредственно на гемопоэтические клетки, так и через элементы ГИМ, что вызывает повышение интенсивности процессов пролиферации и дифференцировки КОЕ [2, 4]. Подтверждением вышесказанному служит зафиксированное нами усиление скорости созревания гемопоэтических предшественников перед вторым курсом химиотерапии по схеме ТР (рис. 2). Кроме того, усиление апоптоза гемопоэтических элементов под действием цитостатиков ведет к образованию большого количества продуктов деструкции, которые, в свою очередь, посредством повышения активности целого ряда акцессорных клеток – компонентов ГИМ – также стимулируют функционирование кроветворных предшественников [8].
Известно, что одной из наиболее важных особенностей нейтрофилов костномозгового пула является их свойство выходить в большом количестве в циркуляцию в ответ на введение глюкокортикоидов. При введении преднизолона больным раком легкого нами было выявлено преходящее повышение числа нейтрофилов в периферической крови у пациентов, леченных по обеим схемам, что свидетельствует о наличии типичной реакции костномозговых нейтрофилов на гормональный препарат. Развивающийся лейкоцитоз был более выражен у больных, получавших лечение по схеме ТР как перед вторым, так и перед третьим курсами цитостатического лечения. Так, прирост числа нейтрофилов в ответ на глюкокортикоид в периферической крови пациентов, получавших схему ТР, в среднем в полтора раза превышал таковой при лечении по схеме CVC на протяжении всего срока изучения (таблица). Достоверно выше перед вторым и третьим курсами химиотерапии по схеме ТР оказалась и относительная величина максимального выброса нейтрофилов в ответ на фармакологическую стимуляцию по сравнению с аналогичным показателем у больных, леченных по протоколу CVC, – на 55 % и 46 % соответственно (таблица).
Снижение величин показателей преднизолоновых проб в случае применения схемы CVC может быть связано с уменьшением числа нейтрофилов в результате более агрессивного воздействия цитостатиков, вызывающих угнетение продукции лейкоцитов и деструкцию циркулирующих клеток. Ослабление реакции на преднизолон может быть обусловлено повреждением эндотелия синусоидов костного мозга цитостатическими препаратами (циклофосфамид). Полноценность ответа на преднизолон зависит, кроме того, от объема костномозгового пула нейтрофильных гранулоцитов. Именно при применении режима ТР имело место значительное накопление зрелых нейтрофильных гранулоцитов, которые и составляют костномозговой резерв нейтрофилов (рис. 2). Полученные результаты свидетельствуют о том, что механизмы, обеспечивающие восполнение и мобилизацию костномозгового резерва нейтрофилов, в меньшей степени страдают именно на фоне схемы ТР.
Подводя итог изучению системы крови у больных РЛ, леченных по двум исследуемым схемам, можно заключить, что при использовании режима ТР по сравнению со схемой CVC реактивность системы крови страдает в меньшей степени. Благодаря этому наблюдается более значительная активация центральных звеньев гранулоцитарного ростка гемопоэза, что приводит к накоплению незрелых и зрелых миелокариоцитов в костном мозге, увеличению костномозгового пула зрелых нейтрофилов, а также к возрастанию числа костномозговых клеток-предшественников гемопоэза в условиях ускорения их созревания. Полученные результаты приобретают еще большую значимость, если учесть, что изучение доцетаксела продолжается в различных комбинациях цитостатических препаратов для лечения НМРЛ, и, по предварительным данным, схемы с включением доцетаксела лучше переносятся и чаще приводят к улучшению качества жизни [1].


