Состояние эритроцитарных мембран при нитритной гипоксии и ультрафиолетовом облучении
Автор: Черкесова Д.У., Рабаданова А.И.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: фауна
Статья в выпуске: 1-5 т.13, 2011 года.
Бесплатный доступ
Изучена кислотная резистентность эритроцитов крыс при нитритной гипоксии и УФ-облучении. Показано, что нитритная гипоксия сопровождается левым сдвигом эритрограммы и повышением доли низкостойких эритроцитов, что свидетельствует о деструктивных изменениях в популяции эритроцитов. УФ облучение сопровождается компенсаторными изменениями в популяции эритроцитов, связанными с правым сдвигом эритрограммы и увеличением доли высокостойких эритроцитов.
Нитриты, гипоксия, эритроциты, крысы, ультрафиолетовое облучение
Короткий адрес: https://sciup.org/148199822
IDR: 148199822 | УДК: 591.3.615
Текст научной статьи Состояние эритроцитарных мембран при нитритной гипоксии и ультрафиолетовом облучении
(УФ-облучение), которое используется в защитных целях при воздействии различных стрессовых факторов, однако сведения об использовании этого вида излучения в целях защиты при нитритной интоксикации практически отсутствуют.
Цель работы: изучение кислотной резистентности эритроцитов и активности каталазы в сыворотке крови при нитритной и УФ-облучении.
Материалы и методы. Опыты проводили на белых крысах весом 180-200 г, содержащихся в условиях вивария на обычном рационе в весенний период года. Животные были разделены на группы: 1 группа – интактные животные; 2 группа – крысы, которым внутрибрюшинно вводили нитрит натрия в дозе 5 мг/100 г., эта доза вызывает нитритную гипоксию средней тяжести; 3 группа – животные, подвергавшиеся УФ-облучению в режиме возрастающих биологических доз (максимальная доза 63 эр/м2) в течение 7 дней; 4 группа – животные, которым вводили нитрит натрия после УФ-облучения. В каждой группе использовали по 10 животных. В нужный момент у животных забирали кровь. В плазме крови определяли кислотную резистентность эритроцитов [10] и активность каталазы [8]. Полученные результаты подвергали статистической обработке по методу малой выборки [9].
Результаты и их обсуждение. Результаты исследования представлены на рис. 1 и табл. 1, 2. Как следует из наших данных кислотная эритрограмма интактных животных отличается от эритрограмм животных опытных групп.
Начальные участки эритрограммы отражают предгемолизные изменения эритроцитов с переходом в сферическую форму, что приводит к изменению оптической плотности. Учитывая, что при патологии возможно появление группы низкостойких эритроцитов, гемолиз которых может повлиять на величину оптической плотности, связанной с предгемолизными изменениями, мы сочли возможным не исключать начального участка из расчета. Продолжительность эритрограммы интактных животных составляет 5,5 мин, она имеет одну вершину и указывает на однородность эритроцитарной популяции, соответствующей нормобластическому типу кроветворения. Вершина пика эритрограммы располагается на четвертой минуте. В этой точке гемолизирует 39,4% эритроцитов. Доля эритроцитов с минимальной стойкостью в интервале 0,5-3 мин составляет 6,3%, эритроциты со средней стойкостью в интервале 3,5-4,5 мин составляет 76,0% и максимальной стойкостью в интервале от 5,0-19,4%.
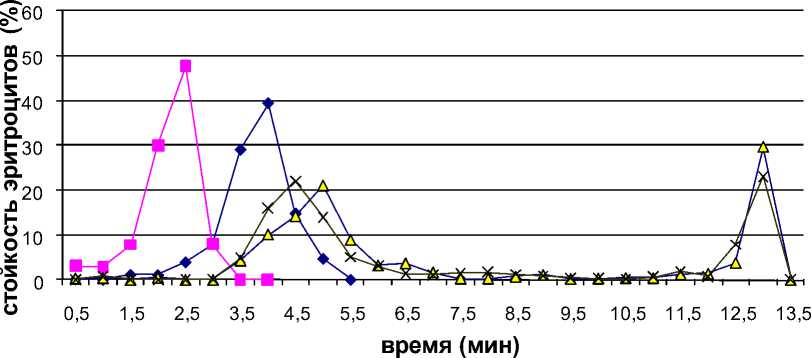
Рис. 1. Кислотные эритрограммы: 1 - интактные животные, 2 - на следующий день после введения нитрита натрия (5 мг/100г); 3 - многократное УФ-облучение;
4 - на следующий день после введения нитрита натрия УФ-облученным животным.
Таблица 1. Показатели кислотной резистентности эритроцитов крыс при нитритной итоксикации и УФ-облучении (M±m, n =10)
|
Группы показателей |
Контроль |
Нитрит натрия |
УФ-облучение |
УФ-облучение + нитрит натрия |
|
время начала гемолиза (мин) |
1,5±0,0003 |
0,5±0,02 * |
3,5±0,4 |
3,5±0,1 |
|
время окончания гемолиза (мин) |
5,0±0,1 |
3,0±0,09 * |
13,0±0,2 * |
13,0±0,5 |
|
пик кислотной эритрограммы |
4,0±0,8 |
2,5±0,03 * |
5,0±0,06 * |
4,5±0,6 |
|
низкостойкие эритроциты (%) |
6,3±0,5 |
91,5±3,8 * |
1,2±0,4 * |
0,8±0,06 |
|
среднестойкие эритроциты (%) |
76,0±1,2 |
8,0±1,7 * |
28,6±1,9 * |
42,8±1,2 |
|
высокостойкие эритроциты (%) |
19,4±0,9 |
- |
67,2±1,3 * |
64,7±2,1 |
Дестабилизация эритроцитарных мембран при воздействии различных экстремальных факторов сопровождается выходом эритроцитарных ферментов в плазму крови. В наших опытах показано, что через час после введения нитрита натрия в дозе 5 мг/100 г. массы тела активность каталазы в сыворотке крови возрастает на 66,2%. Повышение активности эритроцитарного фермента в сыворотке крови свидетельствует о развитии гемолитических процессов в эритроцитах и согласуется с данными [13] подавления активности каталазы в эритроцитах при введении нитрита натрия и развитии гемической гипоксии. Высокий уровень активности каталазы в сыворотке крови сохраняется и на следующий день после перенесенного нитритного стресса (табл. 2).
Таблица 2. Активность каталазы (мкмоль/мг/мин) в сыворотке крови при нитритной интоксикации и УФ облучении (n=10)
|
Варианты опытов |
Активность каталазы в сыворотке крови |
|
интактные животные |
0,74±0,03 |
|
через час после введения нитрита натрия |
1,23±0,03* |
|
на следующий день после воздействия нитрита натрия |
1,13±0,04 * |
|
после семидневного УФ облучения |
1,16±0,02 * |
|
на следующий день после воздействия нитрита натрия, животным, подвергшимся УФ облучению |
1,34±0,01 ** |
Примечание: * - достоверные различия по отношению к контролю; ** - достоверные различия по отношению к УФ облученным животным
Эритрограмма следующего дня характеризуется левым сдвигом и сокращением времени гемолиза эритроцитов. Вершина пика эритрограммы животных этой группы располагается на 2,5 минуте. К этому времени гемолизирует 47,7% эритроцитов. Доля эритроцитов с низкой стойкостью составляет 91,5%, доля среднестойких - 8,0%. Точка минимальной резистентности эритроцитов составляет 1,5 мин, максимальной резистентности - 3,5 мин. Различие интервалов стойкости эритроцитов контрольной и опытной группы животных составляет 2 минуты. Это свидетельствует о том, что наиболее многочисленная группа эритроцитов в крови контрольных животных имеет большую стойкость, чем основная группа эритроцитов животных, подвергшихся воздействию нитрита натрия.
Снижение стойкости эритроцитов при нитритной гипоксии возникает в общем комплексе реакций организма на тканевую гипоксию, вследствие активации перекисного окисления липидов [4]. Гипоксия сопровождается изменением пластических свойств мембраны эритроцитов, снижение ее ригидности. Эритроциты могут принимать форму эхиноцитов, стоматоцитов, нарушается К+ \а' градиент, активность фермента [2]. Снижение кислотной резистентности эритроцитов, смещение основного пика влево и сокращение длительности гемолиза в результате физико-химической модификации эритроцитарных мембран и их дестабилизации обнаружено при воздействии различных токсикантов [3]. Учитывая защитные возможности УФ-облучения в следующей серии опытов нами исследовались кислотная резистентность и активность каталазы в сыворотке крови после облучения в режиме возрастающих биологических доз.
Под влиянием УФ-облучения в клетках крови усиливается экспрессия и активность целого ряда мембранных рецепторов, антигенов, активности ферментов, изменяются многие свойства самой мембраны - ее деформируемость, проницаемость для ионов, газов, метаболитов [12], улучшаются реологические свойства крови и микроциркуляция, усиливается оксигенация крови. Вместе с тем одним из эффектов УФ излучения на молекулярном уровне является повышение интенсивности перекисного окисления липидов (ПОЛ), которое может происходить как непосредственно из-за увеличения оксигенации крови, так и благодаря усилению образования фотоиндуци-рованных свободных радикалов. Однако активация процессов ПОЛ при действии физиологических доз УФ-облучения, сопровождается адекватным или несколько большим усилением активности ферментов антиоксидантной защиты, что является проявлением адаптоген-ного и стимулирующего действия облучения [7].
Нами показано, что под воздействием УФ-облучения происходит значительное повышение активности каталазы в сыворотке крови (в 2,2 раза). Очевидно, увеличение активности фермента в сыворотке крови происходит в результате активации биосинтеза и повышения его уровня в эритроцитах. Кислотная эритрограмма крыс после УФ-облучения обнаруживает сдвиг вправо и появление второго пика, связанного с выбросом в кровеносное русло высокостойких эритроцитов, хотя эритроцитарная популяция в целом неоднородна. Точка минимальной резистентности приходится на 3,5 мин, точка максимальной резистентности - на 13,5 мин. Максимум вершины первого пика эритрограммы приходится на 5 минуту, при котором гемолизируют 21% эритроцитов, максимум второго пика - на 13 минуту, к этому времени гемолизирует 30% эритроцитов. Таким образом, наиболее многочисленная группа эритроцитов в крови облученных животных имеет большую стойкость, по сравнению с необлученными животными. Появление дополнительного максимума справа от основного, смещение точки минимальной резистентности эритроцитов до 3,5 минуты, растяжение левого крыла эритрограммы первой вершины свидетельствуют о повышении устойчивости эритроцитарных мембран при УФ-облучении. Особенности эритрограммы УФ- облученных животных очевидно являются следствием стимулирующего воздействия УФ лучей на процессы гемопоэза.
Эритрограмма животных, которым вводили нитрит натрия после многократного УФ-облучения незначительно изменяется. Эритрограмма имеет также две вершины, однако максимум первой вершины смещен влево к 4,5 минуте, очевидно в результате гемолиза старых эритроцитов. Точка минимальной резистентности сохраняется на 3,5 мин, несколько увеличивается количество эритроцитов со стойкостью 4 минуты. Точка максимальной резистентности составляет также 13,5 мин, при этом максимум второй вершины несколько ниже и число эритроцитов, подвергшихся гемолизу к 13 мин составляет 23%. Увеличение активности каталазы в сыворотке крови происходит в меньшей степени, чем при нитритной интоксикации у необлученных животных.
Выводы: УФ-облучение благотворно влияет при нитритной интоксикации. Вместе с тем неоднородность эритроцитарной популяции при использованной схеме облучения свидетельствует лишь о начальных этапах адаптивных изменений в системе крови. Эти изменения еще не приводят к появлению однородной популяции эритроцитов и дают основание для дальнейших исследований.
Список литературы Состояние эритроцитарных мембран при нитритной гипоксии и ультрафиолетовом облучении
- Ажипа, Я.И. Экологические аспекты загрязнения окружающей среды нитритами и нитратами/Я.И. Ажипа, В.П. Реутова, П.П. Каюшин//Физиология человека. 1990. Т.16. № 3. С. 131-145.
- Вельтищев, Ю.Е. Биологически активные метаболиты мембранных глицерофосфолипидов в норме и при патологии/Ю.Е. Вельтищев, Э.А. Юрьева, Е.С. Воздвиженская//Вопросы мед. химии. 1987. № 2. С. 2-8.
- Голенда, И.Л. Способ определения функционального состояния организма по степени резистентности крови к кислотному гемолизу/И.Л. Голенда, А.И. Голенда, В.И. Иванов и др.//Патент на изобретение РФ № 2179315 от 10.02., 2002.
- Владимиров, Ю.А. Биологические мембраны и незапрограммированная смерть клеток//Соросов. образоват. журн. Биология. 2000. №9. С. 2-9.
- Владимиров, Ю.А. Перекисное окисление липидов в биологических мембранах/Ю.А. Владимиров, А.И. Арчаков. -М.: Наука, 1972. С. 248.
- Воложин, А.И. Адаптация и компенсация -универсальный биологический механизм приспособлений/А.И. Воложин, Ю.К. Субботин. -М.: Медицина. 1987. 176 с.
- Карандашев, В.И. Ультрафиолетовое облучение крови/В.И. Карандашев, Е.Б. Петухов. -М.: Медицина, 1997. 224 с.
- Королюк, М.А. Метод определения активности каталазы/М.А. Королюк, Л.К. Иванова, И.Г. Майорова, В.А. Токарева//Лаб. Дело. 1988. № 4. С. 44-47.
- Лакин, Т.Б. Биометрия. -М.: Высшая школа, 1990. 352 с.
- Леонова, В.Г. Анализ эритроцитарных популяций в онтогенезе человека. -Новосибирск: Наука, 1987. С. 241.
- Нагнибеда, Н.М. Изменение активности симпато-адреналовой системы в условиях острой гемической гипоксии//Физиол. журнал, 1987. Т. 33. №4. С. 124-145.
- Самойлов, Г.А. Фотобиологические процессы в клетках и плазме крови и их роль в лечебно-оздоровительном действии УФ-излучения/Г.А. Самойлов, И.Г. Дуткевич//В кн. Механизмы влияния облученной УФ-лучами крови на организм. -М.: Наука, 1986. С. 155-178.
- Шугалей, В.С. Влияние интоксикации нитритом натрия на активность ферментов антиоксидантной защиты в эритроцитах//Укр. биох. ж., 1992. Т. 64. №2. С. 111-114.
- Newberne, P.M. Significance of environmental nitrates, nitrites and nitrosamines/P.M. Newberne, K.M. Nauss//Trace Subst.Environ. Health -XIV. Proc. 14th Ann/Conf., Columbia, Miss. 1980. P. 3-15.


