Состояние окислительных процессов в образцах тестикулярной ткани после ионизирующего излучения
Автор: Аль Меселмани М.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 6 т.14, 2024 года.
Бесплатный доступ
Цель исследования: изучение окислительных процессов в тестикулярных тканях после γ-облучения. Материал и методы. С помощью полярографического метода исследована скорость поглощения кислорода на эндогенных и экзогенных субстратах (Vэнд, Vяк, Vглу, Vднф) и при специфических ингибиторах тканевого дыхания амитала и малоната натрия (Vам, Vмал) в тестикулярных тканях в разные сроки (3-и, 10-е, 40-е сутки) после тотального однократного γ-облучения (1,0 Гр).
Семенники, митохондрии, окисление, малые дозы γ-излучения, сперматозоид, крыса
Короткий адрес: https://sciup.org/143184009
IDR: 143184009 | УДК: 612.617:636.028 | DOI: 10.20340/vmi-rvz.2024.6.MORPH.3
Текст научной статьи Состояние окислительных процессов в образцах тестикулярной ткани после ионизирующего излучения
Радиация является одним из наиболее опасных факторов окружающей среды, влияющих на здоровье человека. В последнее время радиационный риск повышается из-за широкого применения в самых разных областях человеческой деятельности, особенно в медицине, технике и промышленности. Поэтому проблема нежелательных влияний радиации на организм человека и, особенно, на его репродуктивную систему, всё ещё остаётся актуальной для биологии и медицины. Важно почеркнуть, что в литературных данных имеются раздельные сведения об отрицательных воздействиях различных доз радиации, внешнего и внутреннего типа облучения на морфологическое и функциональное состояние мужской репродуктивной системы [1, 2, 3] . Мамина и др. показали структурно-функциональное повреждение семенников при условии повышенного радиационного фона, в том числе однократного внешнего облучения [4, 5] .
Литературные данные подтверждают, что вредные эффекты наблюдаются при применении радиации в диагностических и лечебных целях разных заболеваний. Так, было отмечено снижение активности клеток мужской репродуктивной системы, вырабатывающихся мужским половым гормоном – тестостероном, а также изменение концентрации мужских половых гормонов, поэтому для проведения диагностики и лечения разных заболеваний необходимо обратить внимание на то, чтобы дозировки облучения были с минимальным воздействием на здоровые органы обследуемых [6, 7, 8].
Одним из важных негативных воздействий ионизирующего излучения является создание окислительного стресса, который вызывает крупномасштабное разрушение или повреждение различных биомолекул.
Учитывается, что семенники имеют первостепенное значение для размножения и эволюции вида, а также выполняют две основные функции: выработка половых клеток (сперматозоидов) и синтез/ секреция гормонов (в первую очередь тестостерона). Поэтому они являются тканями с высокой потребностью энергии, выполняющими энергозатратные процессы [9] .
Однако применение кислорода во многих важных метаболических процессах живыми системами обошлось в эволюционную цену, поскольку метаболизм кислорода может привести к образованию активных форм кислорода (АФК). В научных работах показано, что увеличение выработки АФК, как из-за внутренних, так и из-за внешних факторов, может вызвать окислительный стресс, влекущий изменения в структуре и функции фосфолипидов и белков. В ядре АФК атакуют ДНК, вызывая её фрагментацию и активацию апоптоза, тем самым изменяя экспрессию генов и белков. Накопленные данные также свидетельствуют о том, что эндогенно продуцируемые АФК могут выступать в качестве вторичных посредников в регуляции клеточных сигнальных путей и в передаче сигналов, которые отвечают за регулирование самообновления и пролиферации спер-матогоний [10, 11, 12].
Ранее Аль Меселмани М.А. показал, что на эндогенных и экзогенных субстратах окислительные процессы воздействуют с поступлением разных количеств цезия 137СS [2] .
Целью настоящего исследования является изучение воздействия эндогенных и экзогенных субстратов в кусочках ткани мужской репродуктивной системы в условиях внешнего радиационного облучения.
Методы и материалы
В исследовании были использованы беспородные белые крысы-самцы линии Wistar массой 220–240 г (n = 36). Крыс разделили на четыре группы, из которых одна группа – контрольная, а три остальные – подопытные. Количество крыс контрольной группы (9) облучению не подвергались. Крыс подопытных групп облучали дозой 1,0 Гр (мощности 0,92 Гр/мин) с помощью γ -установки «ИГУР-1» (Москва).
Для проведения анализа крыс трёх подгрупп выводили из эксперимента по истечении с момента облучения 3-х (группа 3сут), 10-ти (группа 10сут) и 40 (группа 40сут) суток соответственно.
Выделение семенников крыс проводили в среде Хенкса при t = 25 °C. Ткань измельчали, фильтровали, полученную суспензию центрифугировали в течение 5 мин при 1000 об/мин. Для расчёта количества клеток использовали камеру Горяева. Измерение содержания белка в пробах проводили биуретовым методом. После пермеабилизации клеточных мембран 0,005-процентным раствором дигитонина, для облегчения свободного поступления глутамата в клетки, для оценки параметров поглощения кислорода использовали полярографическую ячейку с закрытым платиновым электродом Кларка [13] .
Значения регистрировали в нмоль О 2 /мин на 1 мг белка исследуемой ткани или нмоль О 2 за 1 мин на 107 клеток. Чувствительность метода позволяет определять концентрацию кислорода до 1 нМ/л. Измерения проводили в трёх повторах на каждую экспериментальную крысу.
Скорость дыхания ткани семенников оценивали на эндогенных субстратах (V энд ), а также и при добавлении в полярографическую ячейку 10 мМ глутамата натрия (V глу ). Рассчитывали коэффициент стимулирующего действия (СД) глутаминовой кислоты: СД глу = V глу /V энд .
Также определяли скорость потребления кислорода на экзогенных субстратах (10 ммоль сукцината,
V як ; 100 мкмоль 2,4-динитрофенола, V днф ). Рассчитывали величины стимулирующего действия янтарной кислоты (СД як = V як /V энд ; СД глу = V глу /V энд ) и 2,4-динитрофенола (СД днф = V днф /V глу ) [2, 14] .
Используя метод ингибиторного анализа, путём добавления в инкубационную среду (2,5 ммоль ами-тала натрия, V ам и 10 ммоль малоната натрия, V мал ), рассчитывали показатели амиталрезистентного дыхания – АРД = V ам /V энд и малонатрезистентного дыхания – МРД = V мал /V ам [2, 14] . Показатели АРД и МРД характеризовали интенсивность окисления флаво-протеидзависимых субстратов, позволяя оценить энергетический вклад жирных кислот (ЖК) [15] .
Статистическую обработку результатов выполнили с помощью программы «Statistica» 6.0 и Microsoft Excel 2021. Данные проверяли на нор- мальность распределения с использованием критерия хи-квадрата Пирсона. Различия считали статистически значимыми при p < 0,05.
Результаты
В ходе серии исследований установлено, что кусочки ткани мужской репродуктивной системы животных характеризуются высоким уровнем потребления кислорода (табл. 1, рис. 1).
Полученные данные о высоком потреблении кислорода в препаратах мужской репродуктивной системы подтверждаются литературными данными, о чём свидетельствуют уникальные характеристики метаболизма и биоэнергетики клеток семенников для поддержки своих функций, выработки сперматозоидов и секреции мужских гормонов [9] .
Таблица 1. Показатели поглощения кислорода в семенниках крыс после γ-облучения в дозе 1,0 Гр на 3-и, 10-е и 40-е сутки эксперимента Table 1. Oxygen uptake indicators in rat testes after γ -irradiation at a dose of 1.0 Gy on days 3, 10, and 40 of the experiment
Скорость поглощения кислорода
|
Параметр |
Контрольная группа |
Группа 3 сут, n = 9 |
% |
Группа 10сут, (n = 9) |
% |
Группа 40сут, (n = 9) |
% |
|
V энд |
3,19 ± 0,02 |
2,72 ± 0,07* |
85,3 |
6,64 ± 0,12* |
208,2 |
7,04 ± 2,76* |
220,7 |
|
V як |
5,32 ± 0,31 |
4,33 ± 0,26* |
81,4 |
7,72 ± 0,24* |
145,1 |
11,96 ± 6,68* |
224,8 |
|
V глу |
4,79 ± 0,29 |
4,27 ± 0,38 |
89,1 |
10,17 ± 0,28* |
212,3 |
9,44 ± 2,24* |
197,1 |
|
V днф |
6,31 ± 0,16 |
5,01 ± 0,44* |
79,4 |
11,81 ± 0,38* |
187,2 |
12,43 ± 2,59* |
150,6 |
|
CД як |
1,66 ± 0,10 |
1,59 ± 0,16 |
95,8 |
1,23 ± 0,03* |
74,1 |
1,47 ± 0,37* |
88,5 |
|
СД глу |
1,46 ± 0,09 |
1,39 ± 0,07 |
95,2 |
1,53 ± 0,08 |
104,8 |
1,21 ± 0,05*** |
82,9 |
|
СД днф |
1,33 ± 0,08 |
1,29 ± 0,06 |
97,0 |
1,16 ± 0,01* |
87,2 |
1,09 ± 0,04*** |
98,5 |
Примечание: достоверность различий по отношению к контрольной группе: * – p < 0,05; ** – p < 0,01; *** – p < 0,001.
Из данных, приведённых в таблице 1, видно, что ткань мужской репродуктивной системы крыс отличалась высоким уровнем потребления кислорода и повышенной чувствительностью к воздействию γ -излучения в дозе 1.0 Гр.
По прошествии 3-х суток (группа 3сут) с момента облучения в дозе 1,0 Гр (мощность дозы 0,92 Гр/мин)
отмечалось достоверное снижение интенсивности потребления кислорода препаратами ткани мужской репродуктивной системы животных на эндогенных субстратах (Vэнд) c 3,19 ± 0,02 нмоль О2/мин/мг в контроле до 2,72 ± 0,07 (–14,7 %) (p < 0,05), в то время как на 10-е сутки, напротив, наблюдалось увеличение скорости дыхания до 6,64 ± 0,12 нмоль О2/мин/мг (108,2 %) (p < 0,05). На 3-и сутки также наблюдалось достоверное снижение скорости поглощения кислорода в присутствии субстрата сукцината (Vяк) с 5,32 ± 0,31 в контроле до 4,33 ± 0,26 нмоль О2/мин/мг, т.е. на 18,6 % (p < 0,05), которая на 10-е сутки превышала исходное значение на 45,1 % (p < 0,05), достигнув величины 7,72 ± 0,24 нмоль О2/мин/мг. Примерно такая же динамика скорости окисления прослеживалась в присутствии другого экзогенного субстрата – глутамата. Так, отмечалось снижение скорости потребления кислорода при использовании глутамата с 4,79 ± 0,29 в контроле до 4,27 ± 0,38 нмоль О2/мин/ мг белка, т.е. на 10,9 % (p < 0,05), к 3-м суткам наблюдения. А по истечении 10-х суток наблюдения ско- рость поглощения кислорода в присутствии глутамата составила 10,17 ± 0,28 (112 %) (p < 0,05) (табл. 1, рис. 1).
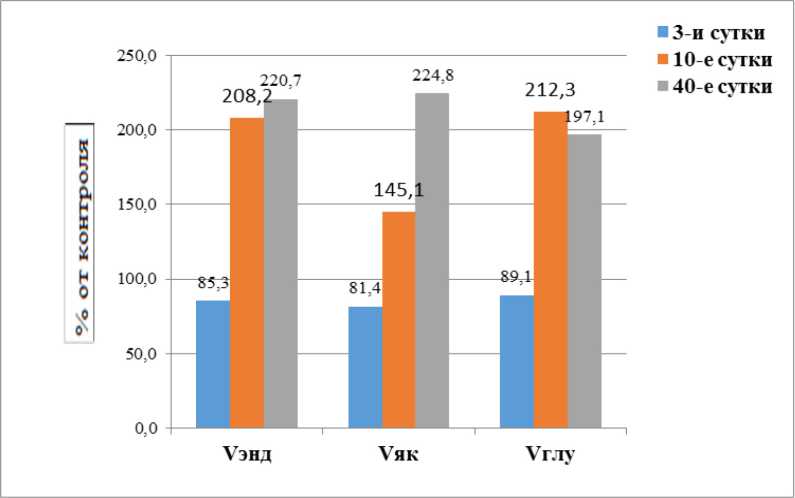
Рисунок 1. Показатели поглощения кислорода в ткани семенников в % по отношению к контролю после однократного γ -облучения (1,0 Гр). Примечание: достоверность различий по отношению к контрольной группе: * – p < 0,05; ** – p < 0,01; *** – p < 0,001
Figure 1. Oxygen uptake indicators in testicular tissue as a percentage relative to the control after a single γ -irradiation (1.0 Gy). Note: Statistical significance compared to the control group: * – p < 0.05; ** – p < 0.01; *** – p < 0.001
В процессе оценки показателей стимулирующего действия сукцината (СД як ) и глутамата (СД глу ) было отмечено уменьшение СД як по прошествии 10-х суток после облучения. Так, уменьшение СД як на этот момент составило 1,23 ± 0,03 по сравнению с контрольным 1,66 ± 0,10 (–25,9 %) (p < 0,05). Не было обнаружено достоверных изменений показателя СД глу (табл. 1, рис. 2).
Следует отметить, что, с одной стороны, снижение СД як является свидетельством повышения содержания сукцината в митохондриях, но, с другой стороны, демонстрирует уменьшение доли участия сукцината в транспорте энергии к митохондриям ткани семенников [9 , 15] .
Анализы влияния специфических ингибиторов тканевого дыхания амитала натрия (V ам ) и малоната натрия (V мал ) на окислительные процессы в семенниках крыс представлен в таблице 2. Так, через 3-е суток после облучения скорости поглощения кислорода при V ам и V мал соответственно уменьшалась с 2,53 ± 0,34 и 2,15 ± 0,31 нмоль O 2 /мин/мг белка в контроле до 1,94 ± 0,03 и 1,15 ± 0,12 нмоль O 2 /мин/мг белка в опыте. Однако через 10 суток V ам и V мал достоверно возрастали до 6,37 ± 0,04 и 5,84 ± 0,23 нмоль O 2 /мин/мг белка, т.е. на 151 % (p < 0,05) и 171 % (p < 0,05) соответственно (табл. 2, рис. 3).
Таблица 2. Показатели поглощения кислорода при использовании амитала натрия и малоната натрия в семенниках крыс после γ-облучения в дозе 1,0 Гр на 3-и, 10-е и 40-е суткиэксперимента
Table 2. Oxygen uptake indicators with the use of sodium amytal and sodium malonate in rat testes after γ -irradiation at a dose of 1.0 Gy on days 3, 10, and 40 of the experiment
|
Параметр |
Скорость поглощения кислорода |
|||
|
Контрольная группа |
Группа 3 сут, n = 9 |
Группа 10сут, (n = 9) |
Группа 40сут, (n = 9) |
|
|
Vэнд |
3,34 ± 0,43 |
2,73 ± 0,19 |
7,21 ± 0,11** |
6,86 ± 0,02* |
|
Vам |
2,53 ± 0,34 |
1,94 ± 0,03 |
6,37 ± 0,04* |
4,52 ± 0,16* |
|
Vмал |
2,15 ± 0,31 |
1,15 ± 0,12* |
5,84 ± 0,23* |
3,15 ± 0,22* |
|
АРД |
0,77 ± 0,02 |
0,70 ± 0,03 |
0,88 ± 0,02* |
0,68 ± 0,02* |
|
МРД |
0,85 ± 0,02 |
0,60 ± 0,04* |
0,93 ± 0,02* |
0,59 ± 0,07* |
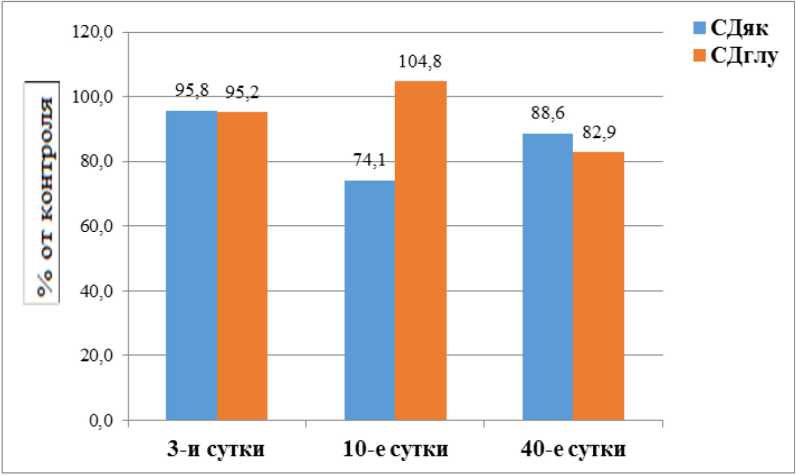
Рисунок 2. Величины стимулирующего действия янтарной кислоты и глутамата, а в ткани семенников в % по отношению к контролю после однократного γ -облучения (1,0 Гр)
Figure 2. The magnitude of the stimulatory effect of succinic acid and glutamate in testicular tissue as a percentage relative to the control after a single γ -irradiation (1.0 Gy)
Для описанной метаболической ситуации (рис. 4) нет оснований говорить об активации на 3-и сутки после облучения системы β -окисления жирных кислот, поскольку коэффициент малонатрезистентного дыхания (МРД) в подопытной группе животных к этому моменту достоверно снижался до 0,60 ± 0,04 по сравнению с 0,85 ± 0,02 в контроле.
Вместе с тем, спустя десять суток после облучения крыс в дозе 1,0 Гр показатель, характеризую-
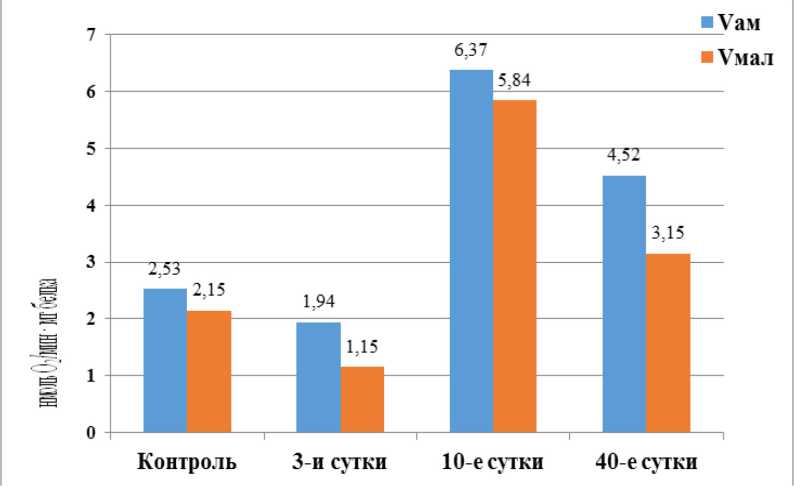
Рисунок 3. Показатели поглощения кислорода в ткани семенников при влиянии ингибиторов после однократного γ -облучения (1,0 Гр)
Figure 3. Oxygen uptake indicators in testicular tissue under the influence of inhibitors after a single γ -irradiation (1.0 Gy)
щий МРД, демонстрировал тенденцию к росту до 0,93 ± 0,02 против 0,85 ± 0,02 в контроле (табл. 2, рис. 4). Последнее может быть истолковано в пользу увеличения чувствительности дыхательной цепи к действию высокоспецифического ингибитора СДГ малоната натрия.
Опыты, выполненные с добавлением разобщителя процессов окислительного фосфорилирования, подтвердили разнонаправленную динамику изменения функциональной активности потребления кислорода в образцах семенников крыс на 3-и и 10-е сутки. В частности, Vднф у крыс на 3-и сутки достоверно снижалась на 20,6 % (p < 0,05), а на 10-е – достоверно возросла на 87,2 % (p < 0,05) (табл. 1, рис. 5). Исходя из величины расчётного коэффициента СДднф после облучения в дозе 1,0 Гр на протяжении 3-х суток наблюдения не происходило разобщения дыхания и фосфоримерования в митохондриях семенников (табл. 1). Снижение СДднф с 1,33 ± 0,08 в контроле до 1,16 ± 0,01 (p < 0,05) в подопытной группе животных на 10-е сутки свидетельствовала о возможной лабилизации системы окислительного фосфорилирования митохондрий семенников.
В ходе опытов на 40-е сутки наблюдалось сохранение статистически значимо усиленного потребления кислорода в ткани семенников на эндогенных субстратах и возврат показателей скорости окисле- ния экзогенных субстратов (сукцината и глутамата) к исходным значениям. В частности, усиление поглощения кислорода в присутствии сукцината на 40-е сутки наблюдения составило 11,96 ± 6,68 нмоль O2/мин/мг белка против 5,32 ± 0,31 нмоль O2/мин/мг белка в контроле. В присутствии экзогенного субстрата глутамата скорость потребления кислорода возрастала с 4,79 ± 0,29 нмоль O2/мин/мг белка в контроле до 9,44 ± 2,24 нмоль O2/мин/мг белка (на 152 %) (p < 0,05) в подопытной группе. Эндогенное дыхание составило 7,04 ± 2,76 против 3,19 ± 0,02 нмоль O2/мин/мг белка в контроле (табл. 1, рис. 1). При оценке коэффициентов СДяк и СДглу отмечено их достоверное снижение. Так, величина СДглу на 40-е сутки составляла 1,21 ± 0,05 (p < 0,001) против 1,46 ± 0,09 в контроле, а величина CДяк составляла 1,47 ± 0,37(p < 0.05) против 1,66 ± 0,10 в контроле (табл. 1, рис. 2).
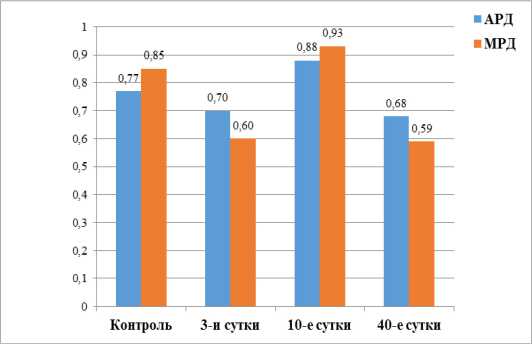
Рисунок 4. Показатели амиталрезистентного и малонатрезистент-ного дыхания в ткани семенников крыс после однократного γ -облучения (1,0 Гр)
Figure 4. Amytal-resistant and malonate-resistant respiration indicators in rat testicular tissue after a single γ -irradiation (1.0 Gy)
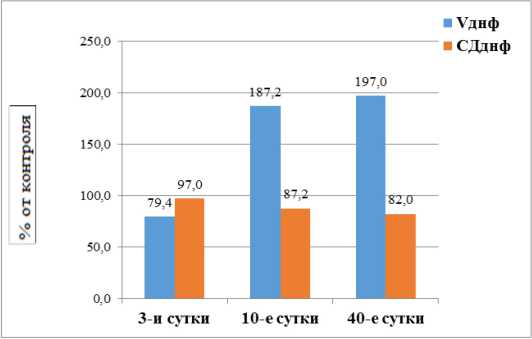
Рисунок 5. Влияние 2,4-ДНФ на поглощение кислорода в семенниках крыс в % по отношению к контролю после однократного γ -облучения (1,0 Гр)
Figure 5. The effect of 2,4-DNP on oxygen uptake in rat testes as a percentage relative to the control after a single γ -irradiation (1.0 Gy)
Данные о результатах ингибиторного анализа, выполненного через 40 суток после облучения животных, приведённые в таблице 2, с одной стороны, позволили обнаружить достоверное увеличение интенсивности процессов тканевого дыхания в семенниках после однократного γ -облучения (увеличение V ам и V мал ), что подтвердило феномен стимулирующего влияния радиации на работу митохондрий. С другой стороны, было отмечено снижение резервов жирных кислот в изученных препаратах, что проявлялось в достоверном уменьшении коэффициентов АРД и МРД соответственно с 0,77 ± 0,02 и 0,85 ± 0,02 в контроле до 0,68 ± 0,02 и 0,59 ± 0,07 в подопытной группе (p < 0,05) (рис. 4).
В соответствии с полученными данными, спустя 40 суток после облучения, происходило снижение показателя СД днф с 1,33 ± 0,08 (контроль) до
1,09 ± 0,02 (на11,5 %) (p < 0,001), что всё ещё позволяло констатировать присутствие разобщения в системе окисления и фосфорилирования (рис. 5).
Однако через 10 суток коэффициент CД як уменьшался на 25,9 % (p < 0,05) и, забегая вперёд, оставался достоверно сниженным вплоть до завершения эксперимента, т.е. до 40-х суток наблюдения. Интересно отметить, что CД глу после облучения животных в дозе 1,0 Гр практически не изменялся ни через 3, ни через 10 суток наблюдения (рис. 2).
Обсуждение
Как известно, процесс поглощения кислорода в митохондриях сперматозоидов разъясняет метаболическую картину и функциональное состояние мужской репродуктивной системы. Так, уменьшение или повышение потребления кислорода в тестику- лярных тканях приводит к нарушению энергетического баланса мужской половой системы и, соответственно, к изменению морфофункциональной характеристики семенников.
Окислительный стресс играет важную роль в развитии и прогрессировании метаболизма сперматозоидов. Митохондрии являются наиболее важными источниками активных форм кислорода в сперматозоидах [10, 11, 15]. Нарушения метаболизма субстратов в мужской репродуктивной системе вызывают адаптацию и дисфункцию митохондрий, проявляющихся в несоответствии между окислением жирных кислот в митохондриях и активностью цепи переноса электронов (ЭТЦ), что способствует выработке АФК в компонентах ЭТЦ. Кроме того, другие источники митохондриальных АФК, полученные как продукты метаболических путей, таких как β-окисление жирных кислот, также могут продуцировать значительное количество АФК с вовлечением их в метаболизм сперматозоида [12, 14, 15]. Повышенная выработка АФК сперматозоидами может вызывать различные эффекты, включая сбой программирования метаболизма энергетических субстратов в мужской репродуктивной системе, модуляцию метаболического воспаления, окислительно-восстановительную модификацию ионных каналов и транспортёров, а также апоптоз сперма- тозоидов, что, в конечном итоге, приводит к структурным и функциональным изменениям семенников [3, 12]. Основываясь на вышеуказанных механистических взглядах, в настоящем обзоре обобщено современное понимание механизмов, лежащих в основе метаболизма сперматозоидов с акцентом на роль окислительного стресса [10, 11, 12].
Заключение
Окислительные процессы в сперматозоидах чувствительны к внешнему γ -облучению при дозе 1,0 Гр. Воздействие однократного γ -облучения на показатели поглощения кислорода выражается в ингибирующем влиянии на 3-и сутки, которое сменяется стимулирующим действием на 10-е и 40-е сутки.
Выявлен эффект снижения потребления кислорода при окислении сукцината и глутамат натрия, а также в присутствии малоновой кислоты и 2,4-динитрофенола через 3-е суток после облучения крыс.
На 10-е сутки потребление кислорода увеличилось сперматозоидами в 2 раза в результате окисления эндогенных субстратов, сукцината натрия, глутамата натрия с сохранением этого эффекта в присутствии ингибиторов дыхания и 2,4-динитрофенола на протяжении 40-суточного наблюдения.
Список литературы Состояние окислительных процессов в образцах тестикулярной ткани после ионизирующего излучения
- Аль Меселмани М.А., Шабанов, П.Д. Морфофункциональное состояние семенников в условиях радиационного воздействия. Экологический Вестник. 2014;27 (1):45-50. Al meselmany, M.A, Shabanov, P.D. Morfofunkcional'noe sostojanie semennikov v uslovijah radiacion-nogo vozdejstvija [Morphofunctional condition of testis in conditions of radiation exposure]. Ecological Bulletin.2014; 27 (1): 45-50. (In Russ).
- Аль Меселмани М.А. Показатели поглощения кислорода в тканях семенников под воздействием инкорпорации 137СS. Прикладные ин-формационные аспекты медицины: научно-практический журнал. 2023;26 (2): 92–100. Al Meselmani M.A. Pokazateli pogloshhenija kisloroda v tkanjah semennikov pod vozdejstviem inkorporacii 137 cs [Indicators of oxygen absorption in testicular tissues under the influence of incorporation 137cs]. Applied Information Aspects of Medicine. 2023;26(2):92–100. (In Russ). https://doi.org/10.18499/2070-9277-2023-26-2-92-100
- Lixin Qi, Jiaxuan Li, Wei Le, Jinfu Zhang. Low-dose ionizing irradiation triggers apoptosis of undifferentiated spermatogonia in vivo and in vitro. Transl Androl Urol. 2019;8(6): 591–600. https://doi.org/10.21037/tau.2019.10.16
- Мамина В.П. Радиопротекторный эффект эраконда на сперматогенез при воздействии однократного внешнего острого γ-облучения. Радиационная биология. 2022;67(5):18-23. Mamina V.P. Radioprotektornyj jeffekt jerakonda na spermatogenez pri vozdejst-vii odnokratnogo vneshnego ostrogo γ-obluchenija [Radioprotective Effect of the Eracond on Spermatogenesis Under the Influence of a Sin-gle External Acute γ-Irradiation]. Radiation biology. 2022;67(5):18-23. (In Russ). https://doi.org/10.33266/1024-6177-2022-67-5-18-23
- Shin E, Lee S, Kang H, Kim J, Kim K, Youn H, Jin YW, Seo S and Youn B (2020) Organ-Specific Effects of Low Dose Radiation Exposure: A Comprehensive Review. Front. Genet. 11:566244. https://doi.org/10.3389/fgene.2020.566244
- Mortezaee K., Motallebzadeh E., Milajerdi A., Farhood B., Najafi M., Sahebkar A. The Effect of Prostate Cancer Radiotherapy on Testos-terone Level: A Systematic Review and Meta-analysis Meta-Analysis. Anticancer Agents Med Chem. 2020;20(6):636-642. https://doi.org/10.2174/1871520620666200128112558
- Hoa Thi Kim Nguyen, Michael A Terao, Daniel M Green, Ching-Hon Pui, Hiroto Inaba. Testicular involvement of acute lymphoblastic leukemia in children and adolescents: Diagnosis, biology, and management. Cancer. 2021;1;127(17):3067-3081. https://doi.org/10.1002/cncr.33609
- Delessard M, Saulnier J, Rives A, Dumont L, Rondanino C, Rives N. Exposure to Chemotherapy During Childhood or Adulthood and Conse-quences on Spermatogenesis and Male Fertility. Int J Mol Sci. 2020 ;21(4):1454. https://doi.org/10.3390/ijms21041454
- Ricardo Silva, David F. Carrageta, Marco G. Alves, Pedro F. Oliveira. Testicular Glycogen Metabolism: An Overlooked Source of Energy for Spermatogenesis?. BioChem. 2022;2(3):198-214. https://doi.org/10.3390/biochem2030014
- Baskaran S., Finelli R., Agarwal A., Henkel R. Reactive oxygen species in male reproduction: A boon or a bane? Andrologia. 2020;53(1):e13577. https://doi.org/10.1111/and.13577
- Lizbeth J-R, Fahiel C,Alma L, Miguel B, M M O, Socorro R-M. Physiological role of reactive oxygen species in testis and epididymal spermato-zoa. Andrologia. 2022;54(4):e14367. https://doi.org/10.1111/and.14367
- Barati E., Nikzad H., Karimian M. Oxidative stress and male infertility: Current knowledge of pathophysiology and role of antioxidant therapy in disease management. Cellular and Molecular Life Sciences. 2020;77(1):93-113. https://doi.org/10.1007/s00018-019-03253-8
- Франк Г.М., Кондрашова М.Н., Ананенко А.А. Руководство по изучению биологического окисления полярографическим методом. 1973;106-119. Frank G.M., Kondrashova M.N., Ananenko A.A. Rukovodstvo po izucheniyu biologicheskogo okisleniya polyarograficheskim me-todom. 1973;106-119. (In Russ).
- Грицук, Н.А, Конопля, Е.Ф, Грицук, А.И. Влияние инкорпорации 137Cs на показатели митохондриального окисления миокарда и ди-намику электрокардиографических параметров у крыс. Весці Нацыянальнай Акадэміі навук Беларусі. Серыя медыцынскiх навук. 2008;2:105–110. Gritsuk, N.A, Konoplya, E.F, Gritsuk, A.I. Vliyanie inkorporatsii 137Cs na pokazateli mitokhondrial'nogo okisleniya miokarda i dinamiku elektrokardiograficheskikh parametrov u krys. Vestsі Natsyyanal'nay Akademіі navuk Belarusі. Seryya medytsynskikh navuk. 2008;2:105–110. (In Russ).
- Casey L Quinlan, Irina V Perevoshchikova, Martin Hey-Mogensen, Adam L Orr, Martin D Brand. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biol. 2013;1(1):304-12. https://doi.org/10.1016/j.redox.2013.04.005


