Состояние сосудов печени при экспериментальном стенозе легочного ствола с разным уровнем компенсации кровообращения
Автор: Куликов Сергей Владимирович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.5, 2009 года.
Бесплатный доступ
Изменения печени изучены у 25 щенков с моделью компенсированного стеноза и 8 животных с декомпенсированным стенозом легочного ствола. В качестве контроля использовали печень от 10 собак соответствующего возраста. Материал подвергали гистологическому, стереометрическому и морфометрическому исследованию. Цифровые данные подвергали статистической обработке с использованием t-критерия с поправкой для множественных сравнений. Установлено, что после сужения легочного ствола и нарушения оттока венозной крови от печени рефлекторно повышается тонус артерий и возрастает сопротивление кровотоку. Кроме вено-артериальной реакции, в приносящих сосудах образуются пучки косопродольной интимальной мускулатуры, мышечно-эластические сфинктеры и полиповидные подушки, а в выносящих наблюдается гипертрофия мышечных валиков собирательных вен. При декомпенсированном стенозе, на фоне гипоксии, происходит расслабление и атрофия стенок приносящих и выносящих сосудов, численность артерий с адаптационными структурами снижается, а мышечные валики печеночных вен атрофируются.
Стеноз легочного ствола, сосуды печени, компенсация, декомпенсация, морфология
Короткий адрес: https://sciup.org/14916872
IDR: 14916872
Текст научной статьи Состояние сосудов печени при экспериментальном стенозе легочного ствола с разным уровнем компенсации кровообращения
рока, а также определение роли этих изменений в компенсации гемодинамики.
Материалы и методы исследования. Для достижения поставленной цели в эксперименте на 25 щенках, по ранее разработанной методике [8,9], создавали стеноз легочного ствола. Животных наблюдали от 6 до 24 месяцев. На протяжении этого срока у 8 из них появились признаки декомпенсации сердца с развитием водянки полостей, анасарки и застойного полнокровия внутренних органов. В качестве контроля использовали материал от 10 собак соответствующего возраста. Всех животных выводили из эксперимента кровопусканием из бедренной артерии под эфирным наркозом, в соответствии с Хельсинской декларацией и «Правилами проведения работ с использованием экспериментальных животных». Из различных отделов их печени вырезали кусочки в трех плоскостях, фиксировали в 10% нейтральном формалине и заливали в парафин. Гистологические срезы окрашивали гематоксилин-эозином, по Масcону, Харту и импрегнировали серебром по Футу. Морфометрию всех попавших в поперечный срез артерий, воротных и печеночных вен выполняли с помощью винтового окуляр-микрометра типа МОВ-1–15х, измеряя наружный диаметр и толщину их средней оболочки. Для определения уровня их ветвления использовали ранее разработанную нами методику комплексного изучения сосудов печени [9]. В соответствии с этим все артерии были разделены на 4 группы: крупные (диаметром 125 мкм и более), средние (124–51 мкм), мелкие (50–21 мкм) и артериолы (20 мкм и менее). Интрамуральные ветви воротной вены, в зависимости от калибра сопровождаемых ими артерий, также разбивали на вены уровня крупных артерий (190 мкм и более), средних артерий (189–110 мкм), мелких артерий (109–51 мкм) и артериол (50 мкм и менее). На 4 группы (крупные, средние, мелкие, венулы) были разбиты и печеночные вены: за основу был принят диаметр соответствующих воротных вен. В русле оттока крови от печени, на уровне собирательных печеночных вен, имеющих у собак особые мышечные валики, измеряли толщину последних. Цифровой материал обрабатывали с помощью программы STATISTICA (версия 6) с использованием t-критерия Стьюдента с поправкой
Бонферони для множественных сравнений. Результаты считали достоверными, если ошибка средней не превышала 5% (р<0,05).
Результаты. Проведенные исследования показали, что при компенсированном стенозе легочного ствола артерии печени, приносящие кровь к этому органу, находились в состоянии гипертонуса. Внутренняя эластическая мембрана данных сосудов приобретала складчатый, гофрированный вид (рис., а). Наряду с отмеченым выше, в печени увеличивалось количество артерий, обладающих ин-тимальной мускулатурой, мышечно-эластическими сфинктерами и полиповидными подушками. Инти-мальная мускулатура была представлена отдельными леоймиоцитами, формировала пучки или имела вид сплошного, располагающегося по всему периметру сосуда, косопродольного слоя. В месте обнаружения пучков из гладких миоцитов внутренняя
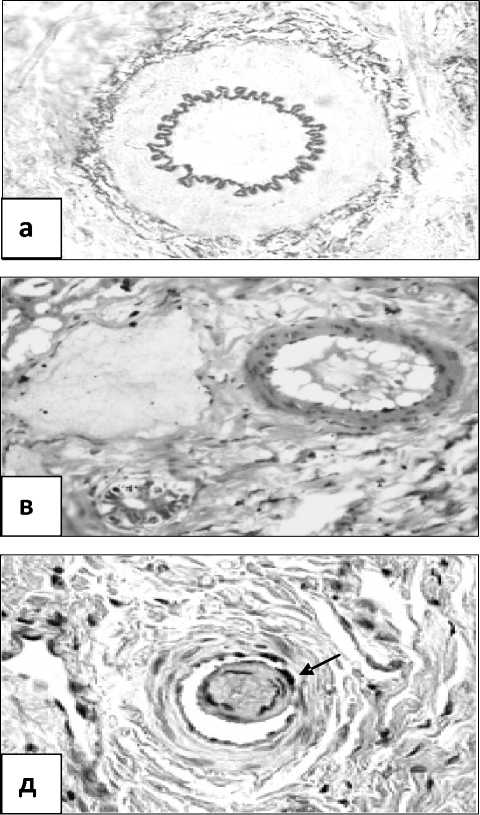
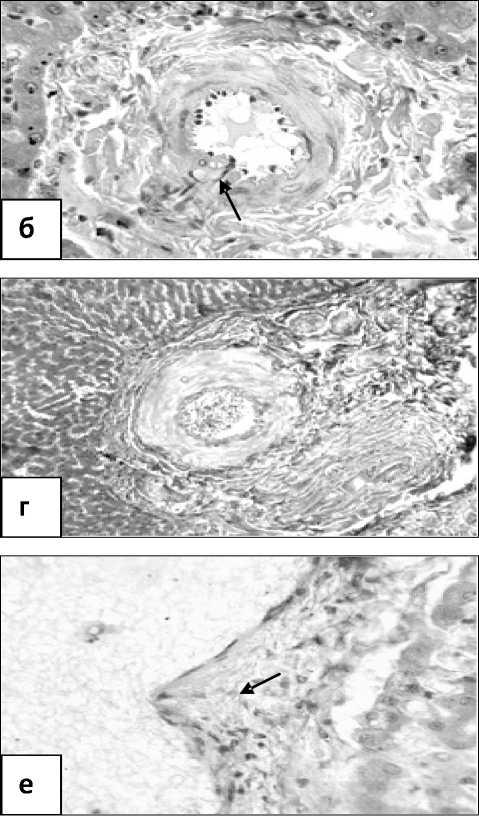
Состояние сосудов печени при компенсированном (а,б) и декомпенсированном (в,г,д,е) стенозе легочного ствола: а – утолщение стенки и повышение складчатости внутренней эластической мембраны средней артерии печени; б – мышечно-эластический сфинктер второго типа в устье средней артерии печени (пока-зан стрелкой); в – расширение просвета и истончение стенки мелкой артерии печени;
г – гиалиноз стенки средней артерии печени;
д – гиалиноз полиповидной подушки Конти средней артерии печени (показана стрелкой); е – атрофия и склероз мышечного валика мелкой печеночной вены (показана стрелкой);
Окраска: а – по Харту, б,в,е – гематоксилином и эозином, г – по Масону, д – по ван Гизо-ну.
Увеличение: а,б,в,д,е – 200, г – 100
эластическая мембрана расщеплялась на наружную и внутреннюю пластинки, образуя дубликатуру. От этих пластинок отходили тонкие эластические волоконца, окутывающие каждую клетку. Мышечноэластические сфинктеры располагались устьях боковых артериальных ветвей, в одних случаях напоминали валик, который наполовину охватывал устье боковых сосудистых ветвей и на продольном срезе образовывал только один лепесток, в других — в поперечном срезе устья боковой ветви имели вид замкнутого кольца, а в продольном — состояли из двух лепестков, расположенных под углом друг к другу (рис., б). Изучение их структуры показало, что в области расположения данных образований эластическая мембрана сосуда расщеплялась на два листка, между которыми находились гладкомышечные клетки, оплетенные эластическими и ретикулиновыми фибриллами. Полиповидные подушки имели несколько иное строение. Оно заключалось в том, что в артериях крупного калибра сама подушка имела круглую или овальную форму, а ножка была представлена тонким шнуром, соединяющей его со стенкой сосуда. В таких случаях по внешнему виду данное образование в полной мере соответствовало своему названию «полиповидная». Если срез проходил через центральную часть подушки, то можно было видеть, что она часто почти полностью закрывала просвет сосуда. В тех случаях, когда срез шел по касательной, она была значительно меньше внутреннего диаметра артерии и напоминала небольшой фрагмент интимы. В ветвях воротной вены, относимых, как и артерии, к руслу притока крови к печени, определялся миоэластоз стенок, с разрастанием в них гладкой мускулатуры, ретикулиновых и эластических волокон. В сосудах русла оттока крови от печени, т.е. в печеночных венах, отмечалось полнокровие с расширением просвета. При этом крупные вены в продольном срезе имели зубчатообразные контуры просвета в связи с глубоким выбуханием в него гипертрофированных мышечных валиков. Гладкие миоциты последних были оплетены густой сетью эластических и ретикулиновых волокон. Морфометрия показала, что толщина медии крупных артерий увеличивалась в 1,7 раза, средних и мелких артерий — 1,2 раза, а артериол — в 1,1 раза (см. таблицу). В воротных венах, сопровождающих крупные артерии, толщина стенки увеличивалась в 2,3 раза, средние артерии — в 1,4 раза, а мелкие артерии — в 1,2 раза; в венах уровня артериол стенки утолщались в 1,5 раза. В печеночных венах, выносящих кровь из печени, происходили более значимые изменения. Так, толщина медии крупных вен возрастала в 5 раз, средних — в 2,1 раза, мелких — в 1,6 раза, а в венулах — в 1,7 раза. Средняя толщина мышечных валиков крупных печеночных вен возрастала с 36±3,5 мкм до 50±3,4 мкм (p<0,001).
При декомпенсированном стенозе легочного ствола наблюдались значительно более выраженные структурные изменения сосудов печени. Печеночные артерии характеризовались нормотонией или гипотонией, при этом просвет их представлялся широким, а стенка истонченной (рис., в). В части из этих сосудов отмечались признаки склероза, а иногда и гиалиноза
(рис., г). В то же время артерии с интимальной мускулатурой, мышечно-эластическими сфинктерами и полиповидными подушками встречались значительно реже, чем при компенсированном стенозе. В некоторых из этих структур выявлялись склеротические изменения, что особенно было заметно в полиповидных подушках Конти (рис., д). Воротные, а особенно печеночные вены разного калибра были резко полнокровными. В печеночных венах, наряду с расширением просвета, выявлялся склероз мышечных валиков с разрастанием в них соединительной ткани (рис.1,е). Морфометрия позволила установить, что средняя оболочка артерий печени истончалась. Так, в крупных артериях и артериолах она уменьшалась в 1,7 раза (р<0,001), а в средних и мелких артериях соответственно — в 1,3 и 1,5 раза (р<0,001) (см. таблицу). Медия воротных вен уровня крупных артерий была такой же, как в контроле, вен уровня средних и мелких артерий уменьшалась в 1,3 раза, а уровня артериол — в 1,2 раза. Толщина стенки крупных печеночных вен и венул истончалась в 1,4 раза, средних артерий — в 1,7 раза, а мелких артерий — в 1,2 раза, по сравнению с контролем. Средняя толщина мышечных валиков печеночных вен уменьшалась с 36±3,5 мкм до 31±2,8 (р<0,05).
Обсуждение. Таким образом, как установлено в наших исследованиях, моделирование стеноза легочного ствола приводит к нарушению оттока крови от печени с расширением ветвей печеночных вен, утолщением их стенки и выраженной гипертрофией мышечных валиков, играющих важную роль в компенсации нарушенной печеночной гемоциркуляции. Указанные структуры в норме обеспечивают депонирование крови в печени, а при создаваемом нами стенозе легочного ствола, способствуют сдерживанию венозного застоя. Кроме того, в порядке адаптации к новой гемодинамической ситуации происходит рефлекторное сокращение гладкой мускулатуры печеночных артерий, что сопровождается повышением их тонуса и возрастанием сопротивления току крови. Сущность данного рефлекса или вено-артериальной реакции [8,12] заключается в том, что в условиях развития венозного застоя происходит повышение тонуса артерий и кровь поступает в систему микроциркуляции печени с меньшим давлением [6,8]. Гипертонус гладкой мускулатуры артерий печени сопровождается гипертрофией ее клеток и утолщением стенки сосудов. Наряду с этим, как установлено нами, сокращению подвергаются и стенки воротных вен (вено-венозная реакция). Следовательно, в приносящих сосудах нарастает сопротивление кровотоку, а в выносящих, за счет гипертрофии мышечных валиков, создаются возможности для ограничения венозного возврата. Это позволяет уменьшить переполнение кровью синусо-идов печени и сохранить гомеостаз ее капиллярного кровообращения [9]. Наши исследования показали, что в условиях нарушения местной гемодинамики включается еще целый комплекс универсальных механизмов. К ним относится появление специализированных структур в виде пучков косопродольной интимальной мускулатуры, мышечно-эластических сфинктеров и полиповидных подушек Конти, получивших свое название по фамилии автора впервые
Толщина средней оболочки сосудов печени (М±m) в контроле, при компенсированном и декомпенсированном стенозе легочного ствола (в мкм)
|
Cерия |
Русло притока крови к печени |
|||||||
|
Артерии |
Воротные вены уровня |
|||||||
|
крупные |
средние |
мелкие |
артериолы |
крупных артерий |
средних артерий |
мелких артерий |
артериол |
|
|
К |
24,0±1,1 |
13,2±0,8 |
6,5±0,1 |
3,7±0,1 |
6,0±0,2 |
5,1±0,3 |
4,1±0,2 |
2,8±0,1 |
|
СК |
42,7±2,8 |
16,0±0,8 |
8,1±0,2 |
3,9±0,1 |
13,9±1,2 |
6,9±0,4 |
5,0±0,2 |
4,2±0,2 |
|
рк |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
|
СД |
25,1±3,6 |
12,6±0,7 |
5,5±0,3 |
2,2±0,1 |
5,9±0,6 |
4,0±0,2 |
3,0±0,2 |
2,4±0,3 |
|
рк |
>0,05 |
>0,05 |
<0,05 |
<0,001 |
>0,05 |
<0,001 |
<0,001 |
>0,05 |
|
рк стк |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
<0,05 |
|
Русло оттока крови от печени |
||||||||
|
Серия |
Печеночные вены |
|||||||
|
крупные |
средние |
мелкие |
венулы |
|||||
|
К |
6,2±0,3 |
4,4±0,1 |
3,2±0,1 |
2,7±0,1 |
||||
|
СК |
31,1±4,1 |
9,5±1,1 |
5,3±0,3 |
4,7±0,3 |
||||
|
рк |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||||
|
СД |
4,5 ±0,9 |
2,6±0,1 |
2,7±0,1 |
1,9±0,1 |
||||
|
р к |
>0,05 |
<0,001 |
<0,05 |
<0,001 |
||||
|
рк стк |
<0,001 |
<0,001 |
<0,001 |
<0,001 |
||||
П р и м еч а н и е : К – контроль, СТК – стеноз компенсированный, СТД — стеноз декомпенсированный. рк — сравнение с контролем, рстк — сравнение с компенсированным стенозом описавшего их [8,10,11]. Источником их развития являются миоциты медии, мигрирующие в интиму через окна во внутренней эластической мембране [8,11]. С помощью данных структур происходит регулирование потоков крови по артериальной системе печени [9].
В ходе естественного течения порока, в направлении от компенсации к декомпенсации, на фоне нарастающей правожелудочковой недостаточности усиливается гипоксия, что, как показано в ряде исследований [8], сопровождается понижением тонуса гладкой мускулатуры. Она оказывается не в состоянии поддерживать адекватный тонус сосудов. Последнее приводит к расширению приносящих и выносящих сосудов печеночного бассейна. Снижается и миграционная активность миоцитов [8], при этом численность артерий с адаптационными структурами падает. Гипоксический фактор играет роль и в расслаблении мышечных валиков печеночных вен с развитием их атрофии. С течением времени в средней оболочке всех сосудов печени развиваются грубые склеротические изменения. Они касаются, как показано нами, и регуляторных структур русла притока и оттока крови от этого органа. Последнее приводит к их неспособности обеспечивать регуляцию нарушенной органной гемодинамики. Более того, фиброзированные гладкомышечные образования, выступая в просвет сосудов, становятся препятствием для движения крови, усугубляя развитие гипоксии, и формируя порочный круг. Все это ведет к срыву адаптации, что проявляется расстройством движения крови на уровне системы микроциркуляции печени. Следовательно, степень выраженности морфологических изменений печени при стенозе легочного ствола зависит не только от состояния сердца и уровня его компенсации, но и от адаптационных пластических возможностей сосудистой системы этого органа.
Выводы:
-
1. Создание в эксперименте стеноза легочного ствола сопровождается расстройством кровообра-
- щения в печени, выражающимся в нарушении оттока крови от этого органа с последующим развитием комплекса приспособительных и патологических изменений сосудов печени.
-
2. Приспособительные изменения в сосудах русла притока и оттока крови от печени в стадии компенсации порока заключаются в возникновении вено-артериальной и вено-венозной реакций, а также усилении развития комплекса адаптационных структур, регулирующих движение крови в системе микроциркуляции.
-
3. Переход моделируемого порока от состояния компенсации к декомпенсации сопровождается ослаблением приспособительных артериальных и венозных реакций, а также снижения уровня развития адаптационных структур.
-
4. В условиях декомпенсации порока, наряду с атрофией гладкой мускулатуры печеночных сосудов наблюдаются выраженные склеротические изменения, которые касаются не только стенок артерий и вен, но и их адаптационных образований, что превращает последние в малосократимые структуры, препятствующие движению крови.
Список литературы Состояние сосудов печени при экспериментальном стенозе легочного ствола с разным уровнем компенсации кровообращения
- Амиркулов, Б.Д. Тетрада Фалло у взрослых/Б.Д. Амиркулов//Грудная и сердечно-сосудистая хирургия. -2004. -№ 3. -С.69-72.
- Белоконь, Н.А. Врожденные пороки сердца/Н.А. Белоконь, В.П. Подзолков. -М.: Медицина, 1991.
- Есипова И.К. Морфологические проявления сосудистой компенсации нарушенного кровообращения/И.К. Есипова//Тр. 1-го съезда Российского общества патологоанатомов. -М.: Медицина, 1996. -С. 69-70.
- Изменения сосудов легких при сложных врожденных пороках сердца с легочной гипертензией/С.Г. Мальцев, А.И. Горчакова, А.А. Шмальц, Ш.И. Марасулов//Архив патологии. -2006. -Т. 68. -№ 6. -С. 35-38.
- Хирургическое лечение врожденных пороков сердца у взрослых/В.Н. Медведев, Ш.М. Курмаев, Г.И. Харитонов и др.//Казанский медицинский журнал. -2001. -Т. 82. -№ 3. -С. 161-164.
- Гемодинамика и локальные натрийуретические системы почек при начальных стадиях сердечной недостаточности/М.Ю. Ситникова, О.Д. Беляева, Ю.А. Сычева и др.//Кардиология. -2000. -Т. 40. -№ 9. -С. 64-68.
- Шарыкин, А.С. Врожденные пороки сердца/А.С. Шарыкин. -М..: Медицина, 2005.
- Шорманов, И.С. Сосудистая система почек при стенозе легочного ствола с различным уровнем компенсации гемодинамики/И.С. Шорманов//Бюллетень экспериментальной биологии и медицины. -2004. -Т. 137. -№ 3. -С. 332-375.
- Шорманов, С.В. Структурные изменения интраорганных артерий печени при коарктации аорты в эксперименте/С.В. Шорманов, С.В. Куликов//Морфология. -2001. -Т. 122. -№ 4. -С. 25-29.
- Шорманов, С.В. Состояние артериальной системы почек при экспериментальной коарктации аорты и после ее устранения/С.В. Шорманов, А.В. Яльцев//Архив патологии. -1996. -Т. 58. -№ 1. -С. 37-41.
- Яльцев, А.В. Структурная перестройка артерий головного мозга и почек при коарктации аорты в эксперименте/А.В. Яльцев, С.В. Шорманов//Морфология. -2000. -Т. 117. -№ 1. -С. 29-33.
- Imig, J.D. Small artery resistance increases during the development of renal hypertension/J.D. Imig, G.L. Anderson//Hypertension. -1991. -V. 17. -№ 2. -P. 317-322.
- Kreuser, W. Hepatic hemodinamics in experimental coarctation of the aorta/W. Kreuser, B. Sykes, W.G. Schenk//Vasa. -1973. -V. 2. -№ 1. -P. 51-57.
- Samanek, M. Children with congenital heart disease/M. Samanek//Pediatric Cardiology. -1992. -V. 13. -№ 3. -P. 152-158.


