Состояние внутриклеточного метаболизма лейкоцитов периферической крови при артериальной гипертензии (экспериментально исследование)
Автор: Романова Т.П., Бугаева И.О., Уварова И.А., Перевозникова Т.В., Шаповал О.Г.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Патологическая физиология
Статья в выпуске: 4 т.19, 2023 года.
Бесплатный доступ
Цель: провести сравнительный анализ особенностей внутриклеточного метаболизма полиморфноядерных лейкоцитов (ПЯЛ) в периферической крови крыс с наследственной индуцированной стрессом артериальной гипертензией (линия НИСАГ) и нормотензивных животных (НТК). Материал и методы. В лейкоцитах крови крыс (линия НИСАГ- 15 особей и НТК - 20) гистохимическими методами определяли показатели углеводно-липидного обмена, активность ряда ключевых ферментов, отражающих состояние окислительно-восстановительных процессов, уровень функциональной активности ПЯЛ.
Артериальная гипертензия, внутриклеточный метаболизм, полиморфноядерные лейкоциты
Короткий адрес: https://sciup.org/149144844
IDR: 149144844 | УДК: 616.12-008.331.1612014 | DOI: 10.15275/ssmj1904404
Текст научной статьи Состояние внутриклеточного метаболизма лейкоцитов периферической крови при артериальной гипертензии (экспериментально исследование)
EDN: CQWHJE
заболеваний (ССЗ) умирают приблизительно 17 млн человек, причем приблизительно 9,4 млн из них — от осложнений АГ в виде ишемической болезни сердца и острых нарушений коронарного и мозгового кровообращения [2]. Несмотря на наметившуюся за последние годы положительную динамику, смертность от ССЗ в России остается одной из самых высоких в мире, а по распространенности АГ наша страна занимает одно из первых мест (37,8%). Примерно 45% случаев смерти от болезней сердца и 51 % — от инсульта вызваны повышенным артериальным давлением (АД). Было подтверждено, что АГ увеличивает риск смерти от всех причин в 2,2 раза, от ССЗ — в 3,4 раза, а основной причиной смерти у лиц с высоким АД являются ССЗ [3].
В настоящее время активно обсуждаются актуальные вопросы о наследственной предрасположенности более тонких триггерных механизмов развития АГ и ее осложнений. Известно, что регуляторные функции организма при АГ могут реализовываться гуморальным путем, посредством которого при действии различных неблагоприятных факторов запускаются не только компенсаторные реакции, но и формируются дополнительные патологические процессы. Существует точка зрения, согласно которой некоторые гуморальные механизмы формирования АГ могут быть связаны с форменными элементами крови, цитохимические изменения в которых выявляются раньше, чем их структурные модификации. В реализации гуморальных факторов развития АГ определенная роль принадлежит лейкоцитам, среди которых значительную долю составляют наиболее активные клетки крови — полиморфноядерные лейкоциты (ПЯЛ). Одним из актуальных аспектов, на наш взгляд, является изучение взаимосвязи развивающейся при АГ эндотелиальной дисфункции и изменением метаболического профиля ПЯЛ. Однако в литературе данные об изменении характера метаболических процессов и функциональной активности ПЯЛ при АГ и ее осложнениях крайне немногочисленны [4, 5], поэтому в данном исследовании основное внимание было акцентировано на одном из малоизученных направлений гипертензиологии: поиску возможной взаимосвязи АГ с нарушениями метаболизма в лейкоцитах крови.
Анализ имеющихся сведений о роли ПЯЛ в формировании АГ показал, что они секретируют большое количество гранулярных ферментных и неферментных белков, обладающих антибактериальными, иммуномодулирующими и регуляторными свойствами, а также цитокинов, хемокинов, факторов роста, кис-лородзависимых и кислороднезависимых биоцидных факторов. На поверхностную мембрану ПЯЛ экспрессируют сотни различных молекул-рецепторов, обеспечивающих их связь с микроокружением и другими клетками иммунной системы. Изменение функционального состояния, в частности показателей углеводно-липидного обмена и энзиматической активности основных ферментов ПЯЛ, может являться маркером повреждений тканей при АГ. Большая роль принадлежит ПЯЛ при формировании лейкоцитарно-эндотелиальных взаимодействий. Известны эффекты миграции, пролиферации, агрегации и адгезии ПЯЛ к эндотелиальной стенке сосудов в органах-мишенях при АГ [6]. Активированные ПЯЛ проявляют не только биоцидную активность, но и участвуют в окислительном стрессе, воспалении и формировании механизмов эндотелиальной дисфункции, а именно они могут повреждать окружающие ткани путем выделения активных форм кислорода, а также могут разрушать оксид азота, который является эндотелиальным фактором релаксации сосудов. Так, нейтрофильный фермент миелопероксидаза (МПО), обладая антимикробным действием, повышается в крови в результате развития воспаления в стенке сосудов разного типа. Продукты катализа МПО способны взаимодействовать с остатками глюкозы в составе внутриклеточных полисахаридов и липидами, что вызывает разрушение атеросклеротических отложений в стенке сосудов и последующий тромбоз. Поэтому уровень МПО является достаточно точным диагностическим маркером риска развития осложнений при АГ. ПЯЛ, так же как и мощный индуктор окислительного стресса в сосудах — ангиотензин II, индуцируют рост гладких миоцитов, что может приводить к гипертрофии и стенозу сосудов.
Таким образом, степень повреждения стенки сосудов при АГ может иметь связь с динамикой окислительно-метаболических процессов в нейтрофилах. В связи с этим одним из актуальных перспективных направлений, на наш взгляд, становится исследование возможных изменений углеводно-липидного обмена и энзиматической активности основных ферментов полинуклеаров крови при АГ.
На основе обобщения имеющихся данных об участии лейкоцитов в формировании гуморальных механизмов развития гипертонической болезни была выдвинута цель — провести сравнительный анализ особенностей внутриклеточного метаболизма полиморфноядерных лейкоцитов в периферической крови у крыс с наследственной индуцированной стрессом артериальной гипертензией (линия НИСАГ) и у нормотензивных крыс (НТК).
Материал и методы . В качестве модели АГ были использованы 15 интактных половозрелых крыс-самцов массой 250–300 г с наследственной, индуцированной стрессом АГ (линия НИСАГ). Для этих животных характерно стабильно высокий уровень АД и повышенная чувствительность к стрессу. Группа сравнения состояла из 20 нелинейных НТК. Животных содержали в стандартных условиях вивария согласно требованиям Международных рекомендаций по проведению медико-биологических исследований с использованием животных, принятых в 1985 г. Советом международных медицинских научных организаций. Измерение АД и числа сердечных сокращений (ЧСС) проводили в хвостовой артерии у неанастезированных животных автоматическим плетизмографическим методом с помощью электросфигмоманометра Natsum КН-209 (Япония). При исследовании срезов сердца применяли морфометрический анализ после окрашивания гематоксилином и эозином, железным гематоксилином по Гейденгайну. Определяли средний диаметр кардиомиоцитов, индекс Керногана (отношение толщины средней оболочки сосудистой стенки к ширине просвета сосуда), среднее количество функционирующих капилляров на единицу площади среза сердца.
После декапитации у животных забирали кровь в пробирки с гепарином (по сравнению с другими антикоагулянтами гепарин вызывает наименьшие морфологические изменения лейкоцитов). Затем готовили мазки и, после соответствующей фиксации, гистохимическими методами выявляли в лейкоцитах содержание липидов и гликогена, а также активность ряда ферментов [7]. Изменение функциональной активности лейкоцитов регистрировали с помощью НСТ-теста (по способности нейтрофилов генерировать активные формы кислорода). Количество гликогена определяли с помощью ШИК-реакции по McManus. Другой вид энергетических субстратов — липиды, присутствующие в нейтрофилах в виде капель нейтральных жиров, окрашивали суданом черным-Б по методу Sheehan и Storey. Определение лизосомальных катионных белков (ЛКБ) проводили с использованием метода Пигаревского. Активность АТФ-азы выявляли по Wachstein — Meisel. Проявление активности сукцинатдегидрогеназы (СДГ) определяли по методу Nahlas в модификации Р. П. Нарциссова. Важным и специфическим ферментом окислительно-восстановительных процессов в клетке является МПО, активность которой определяли по методу Graham — Knoll.
В каждом мазке крови подсчитывали процент положительно реагирующих клеток, а также средний цитохимический коэффициент — СЦК. Показатели СЦК высчитывали по Astaldi и Verga. Результаты всех цитохимических реакций оценивали путем исследования 100 гранулоцитов под большим увеличением микроскопа. В каждой клетке определяли степень интенсивности окраски. Отсутствие окраски цитоплазмы при любой реакции принимали за нулевую степень. Морфометрический анализ проводили на имидж-анализаторе Bioscan.
Количественные данные были обработаны в программе MS Excel. Для подтверждения нормальности распределения использовался критерий Шапиро — Уилка. При описании результатов статистической обработки данных использовали среднее значение величины и его стандартное отклонение. Значимость отличий между двумя независимыми группами определяли с помощью t -критерия Стьюдента при принятом уровне значимости 0,05.
Результаты. Перед проведением гематологических исследований выполнен сравнительный анализ некоторых показателей состояния сердечно-сосудистой системы у гипертензивных (ГТК) и НТК с целью подтверждения характерных для АГ морфофункциональных изменений. Установлено, что разница показателей уровня АД у крыс линии НИСАГ и НТК составляла 43%. Так, у НТК высота АД составляла 113,4±7,3 мм рт. ст., а у крыс линии НИСАГ — 162,2±8,6 мм рт. ст. ( р <0,001). ЧСС, равное у крыс линии НИСАГ 488,0±l2,0 уд/мин, было на 27% больше по сравнению с НТК ( р <0,001). При этом у ГТК выявлено статистически значимое увеличение сердечного индекса и диаметра кардиомиоцитов (18,5±0,9 мкм против 12,6±0,7 мкм у НТК, р <0,001). О гипертрофии стенки интрамуральных артериол свидетельствовало увеличение на 46% ( р <0,001) по сравнению с этим показателем у НТК индекса Керногана. При подсчете количества функционирующих капилляров на единицу площади среза миокарда НТК и гипертензвных животных было установлено уменьшение плотности самых мелких сосудов микроциркуляторного русла у последних на 22%. Так, при АГ число функционирующих капилляров в миокарде равнялось 9,3±0,3, у животных с нормальным давлением оно составляло 11,8±0,7 ( р <0,001). В эндотелиальной выстилке мелких сосудов также наблюдались признаки дистрофических изменений. Полученные данные подтверждают тот факт, что у взрослых особей крыс линии НИСАГ наряду с повышенным уровнем АД и ЧСС имеются признаки гипертрофии миокарда, дистрофии отдельных кардиомиоцитов, а также формируются изменения стенки мелких артерий сердца, то есть имеют место морфофункциональные нарушения, сопутствующие АГ. Следовательно, у исследуемых ГТК нарушено соответствие важнейших морфофункциональных показателей сердца в виде увеличения объема сократительных кардиомиоцитов и одновременного разрежения капиллярного русла миокарда, что, в свою очередь, может приводить к хронической гипоксии этого органа.
В связи с обнаружением выраженных гистологических и функциональных признаков АГ у крыс линии НИСАГ в ходе данного экспериментального исследования более пристальное внимание было уделено анализу метаболического профиля лейкоцитов. Исходя из того, что гликоген является одним из самых доступных и лабильных продуктов клетки, играющих важную роль в ее энергетическом метаболизме, определяли его содержание в цитоплазме ПЯЛ гипертензивных животных. Было выявлено снижение количества гликогена на 23% по сравнению с контролем (2,02±0,05 у НТК и 1,56±0,07 — у НИСАГ, p<0,001). Однако достоверного снижения числа клеток, содержащих гликоген, не обнаружено.
Сравнительный анализ СЦК липидов в нейтрофилах показал, что у ГТК нет значимых различий по сравнению с показателями НТК (1,83±0,07 у НТК и 1,86±0,09 — у НИСАГ, р >0,05). Между тем число лейкоцитов, в которых выявлялись липиды, у ГТК оказалось несколько сниженным. В целях получения более полной информации о состоянии (интенсивности) обменных процессов в нейтрофилах при АГ было проведено изучение активности важнейших ферментов. Как показали цитохимические исследования, в нейтрофилах периферической крови на фоне АГ при неизменном количестве положительно окрашивающихся клеток, активность внутриклеточной АТФ-азы в них была снижена на 22% по сравнению с нормой (1,53±0,08 и 1,96±0,04 у НТК, р <0,001). В такой же степени в нейтрофилах крыс линии НИ-САГ была угнетена и активность МПО (1,60±0,03 и 2,05±0,05 у НТК, р <0,001). Наряду с уменьшением ферментативной активности АТФ-азы и МПО, в нейтрофилах выявлено незначительное повышение активности одного из окислительно-восстановительных ферментов — СДГ (1,36±0,04 против 1,20±0,02 в норме, то есть на 13%, р <0,001).
Наличие у животных подтвержденной АГ не отражалось на количественном содержании ЛКБ в цитоплазме ПЯЛ, судя по СЦК (1,26±0,09, в контроле — 1,22±0,02, р >0,05). Вместе с тем у них обнаружено увеличение числа клеток, содержащих лизосомальные катионные белки (87,8±2,8; в норме — 77,0±0,8, р <0,001). Аналогичная тенденция выявлена и при реализации НСТ-теста, отражающего степень активации функции гексозомонофосфатного шунта и наработку свободных радикалов в ПЯЛ. Количество клеток, дающих положительную реакцию на НСТ-тест, у крыс линии НИСАГ было на 35% больше по сравнению с этим показателем у НТК (59,7±1,5 и 44,2±1,0 соответственно, p <0,001). Однако по степени их насыщенности зернами диформазана (по СЦК), достоверных различий не найдено (НТК — 0,83±0,02, у крыс НИСАГ — 0,85±0,04, р >0,05). Обобщенные результаты, отражающие состояние метаболизма лейкоцитов крыс с наследственной АГ при использовании СЦК, представлены на рисунке.
Обсуждение. В проведенных ранее экспериментальных исследованиях нами установлено, что под воздействием патологического стресса (модель Т. П. Романовой) у крыс линии НИСАГ по сравнению с НТК развиваются более выраженные кар-дио- и цереброваскулярные нарушения в виде крупноочаговых геморрагических очагов в головном мозге и сердце, нарушений проницаемости стенки сосудов с признаками дисфункции эндотелия [8–11]. Учитывая ранее полученные результаты, в данном исследовании пристальное внимание было уделено изменениям метаболизма лейкоцитов при АГ. Мы основывались на том, что, во-первых, форменные элементы крови и эндотелиальные клетки относятся к двум системам гистогенетически и функционально тесно взаимосвязанным. Во-вторых, и лейкоциты, и эндотелиоциты продуцируют и выделяют ряд соединений, обладающих как сосудосуживающим, так и сосудорасширяющим эффектом. В-третьих, эндотелиальные клетки и ПЯЛ способны оказывать взаимное модулирующее влияние. Например, влияние сосудистой стенки на функциональное состояние
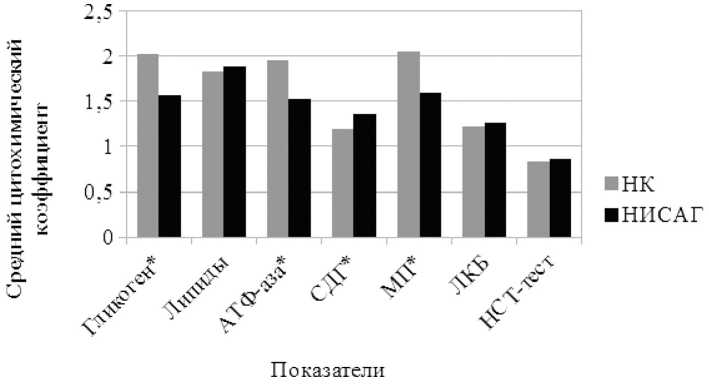
Показатели состояния метаболизма полиморфноядерных лейкоцитов у нормо- и гипертензивных крыс с использованием среднего цитохимического коэффициента:
* — значимость различий между группами нормотензивных крыс и животных линии НИСАГ ( р <0,001)
нейтрофилов может осуществляться через продукты метаболизма арахидоновой кислоты, выделяющиеся эндотелиальными клетками. В свою очередь, активированные под действием патогенных факторов лейкоциты при дегрануляции могут выделять вещества, повреждающие эндотелий и приводящие к повышению проницаемости и пропитыванию плазмой сосудистой стенки, что может провоцировать формирование геморрагических очагов. Важно подчеркнуть, что и при нормальном физиологическом состоянии, и при развитии патологических процессов в организме постоянно происходят сложные взаимодействия циркулирующих клеточных элементов крови и сосудистого эндотелия. Так, развитию эндотелиальной дисфункции может способствовать обнаруженное у ГТК уменьшение активности МПО по сути являющейся антиоксидантом. Известно, что низкие концентрации образованного при катализе МПО гипохлорита вызывают активацию эндотелиоцитов, сопровождающуюся увеличением экспрессии Р-селектина и тканевого фактора, что приводит к повышению тромбогенности эндотелиальной поверхности. Высокие концентрации гипохлорита приводят к апоптозу эндотелиоцитов. Кроме того, МПО может переводить липопротеины низкой плотности в «атерогенную», легко захватываемую макрофагами форму, а липопротеины высокой плотности — в дисфункциональную форму, нарушая тем самым клеточный транспорт холестерина. Предполагают, что таким образом МРО как в низких, так и высоких концентрациях может способствовать возникновению и преобразованию атеросклеротических бляшек.
Выявленные повышенные показатели НСТ-теста могут указывать на признаки «метаболического взрыва», при котором увеличивается количество выделяющихся активных формы кислорода лейкоцитов, следствием которого может быть формирование эндотелиальной дисфункции у крыс линии НИСАГ [12]. Активные формы кислорода, с одной стороны, обладают биоцидной активностью, но, с другой стороны, могут оказывать альтерирующий эффект на миокард путем свободно-радикального перекисного окисления внутриклеточных структур собственных клеток и тканей. Лизосомные катионные белки также являются медиаторами биохимической фазы альтерации. Увеличение у крыс линии НИСАГ числа клеток, содержащих ЛКБ, может быть связано с тем, что содержащиеся в них вещества в ассоциации с макрофагами участвуют в формировании местной защитной функции, вызывая миграцию лейкоцитов в миокард [13].
Об изменении баланса энергообеспечивающих метаболитов свидетельствует и отмеченное нами увеличение активности СДГ, катализирующей окисление янтарной кислоты, которая представляет собой важнейший источник энергии, восполняющий недостаточность энергоёмких молекул при поражениях миокарда [14]. Одновременно в лейкоцитах было обнаружено снижение активности внутриклеточной АТФ-азы, которая катализирует гидролиз АТФ с выделением энергии, что обеспечивает пусковую роль в сокращении кардиомиоцитов. Таким образом, у крыс линии НИСАГ сдвиги ферментативных процессов в ПЯЛ (снижение активности ионтранспор-тирующих ферментов сердца — АТФ-азы и МПО, незначительное повышение активности СДГ), вероятно, являются маркерами напряженности энергообеспечивающих метаболических процессов, что может представлять собой патогенетический фактор развития гипертрофических нарушений в миокарде с одновременным уменьшением количества функционирующих в нем сосудов.
Обратило на себя внимание достоверное снижение содержания в ПЯЛ ГТК наиболее лабильного и доступного полисахарида — гликогена, что также указывает на напряжение энергообеспечивающих процессов в миокарде. Вероятно, что усиление функциональной активности ПЯЛ происходит на фоне увеличения содержания в них гликогена, а снижение количества цитоплазматического гликогена в ходе гликогенолиза свидетельствует об интенсификации энергозависимых метаболических процессов в лейкоцитах с последующим угнетением их функционально-метаболической активности. Некоторое снижение количества ПЯЛ, в которых выявлялись липиды, при отсутствии изменений их среднего цитохимического коэффициента (СЦК), косвенно может указывать на дислипидемию и вовлеченность липидов лейкоцитов в патогенез генетически детерминированной, индуцированной стрессом АГ [15].
Полученные результаты указывают не только на существование взаимосвязи между патологическими процессами, формирующимися при АГ в миокарде и в лейкоцитах. Обнаруженные нарушения сердечно-сосудистой системы и внутриклеточного метаболизма ПЯЛ периферической крови у крыс представляют собой комплекс индуцированных гипертензией изменений гомеостаза, которые еще раз подтверждают полигенность АГ и множественное фенотипическое и функциональное проявление болезни. Возможно, формирующийся отклик метаболических реакций лейкоцитов приводит к более глубоким поражениям миокарда [11]. Таким образом, можно полагать, что генетически обусловленная метаболическая дисфункция ПЯЛ периферической крови может способствовать снижению адаптационных механизмов организма и служить одним из факторов риска дебюта АГ и развития ее осложнений.
В ходе данного экспериментального исследования было также показано, что благодаря широкому спектру генетически детерминированных фенотипических и функциональных проявлений АГ, в том числе со стороны гранулоцитов и миокарда, крысы линии НИСАГ представляют собой результативную модель для изучения этиологии и патогенеза АГ. Полученные в ходе данного исследования результаты могут иметь диагностическое и прогностическое значение при учете наследственной предрасположенности к АГ и для профилактики ее осложнений [16]. Для клинической практики полученные результаты также имеют определенное значение, так как могут актуализировать необходимость проведения полноценной диагностики и анализа не только количественных, но и функциональных нарушений ПЯЛ, являющихся зеркалом гомеостаза при АГ. Это важно для совершенствования терапии гипертонической болезни, в том числе сосудисто-метаболической терапии и иммунотерапии. Последнее утверждение уже используется в ведении больных с АГ, но требует расширения фактической доказательной базы [17], что подтверждает актуальность дальнейшего изучения представленной проблемы.
Заключение. Оценивая результаты сравнительного анализа в целом, можно заключить, что АГ у крыс линии НИСАГ сопровождается разнонаправленными генетически обусловленными изменениями состояния обменных процессов в ПЯЛ периферической крови, что, в свою очередь, может инициировать или усугублять развитие эндотелиальной дисфункции в сосудах. Таким образом, выявленные изменения метаболического профиля в лейкоцитах крови при АГ могут быть сопутствующими факторами в развитии гипер- и дистрофических нарушений в миокарде, что в итоге способствует снижению адаптационных возможностей организма и может служить одним из триггерных механизмов развития более глубокой патологии при гипертонической болезни. Высокая скорость обменных процессов в лейкоцитах крови придает цитохимическим исследованиям особую информативность, позволяя прицельно наблюдать за динамикой патологического процесса и прогнозировать его исходы.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Состояние внутриклеточного метаболизма лейкоцитов периферической крови при артериальной гипертензии (экспериментально исследование)
- Zhou В, Carrillo-Larco RM, Danaei G, et al. Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: A pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021; 398 (10304): 957-80. DOI:10.1016/S0140-6736 (21) 01330-1
- Сабиров И. С, Муркамилов И.Т., Фомин В. В. и др. Артериальная гипертензия в молодом возрасте: современное состояние проблемы. The Scientific Heritage. 2021; (72-2): 15-23.
- Косова В.Ю., Медведев И.Н. Современный взгляд на эпидемиологию, патогенез и классификацию артериальной гипертонии. Вестник науки и образования. 2019; 9-1 (63): 87-90.
- Шабалин А. В., Ходыкина E.H., Сентякова Т.Н. Окислительный метаболизм полиморфноядерных лейкоцитов при артериальной гипертензии у пациентов разных возрастов. Сибирский научный медицинский журнал. 2007; (6): 78-83.
- Васькина E.A. Артериальная гипертензия: окислительный стресс и эндотелиальная дисфункция: автореф. дис. ... докт мед. наук. Новосибирск, 2004; 36 с.
- Tong S, Neboori HJ, Tran ED, Schmid-Schonbein GW. Constitutive expression and enzymatic cleavage of ICAM-1 in the spontaneously hypertensive rat. J Vase Res. 2011; 48 (5): 386-96. DOI:10.1159/000323474
- Нестерова И. В., Чудилова Г.А., Ковалева СВ. и др. Методы комплексной оценки функциональной активности гранулоцитов в норме и патологии. Методические рекомендации для иммунологов-аллергологов, врачей и биологов клинической лабораторной диагностики. Краснодар, 2017; 51 с.
- Романова Т. П. Способ моделирования внутримозговых гематом при артериальной гипертензии. Патологическая физиология и экспериментальная терапия. 1989; (3): 80-81.
- Романова Т. П., Архангельский А. В. Ранние морфо-функциональные изменения крови и миокарда при стрессе на фоне артериальной гипертензии: сб. науч. работ к 100-летию Л. С. Шварца. Москва, 2003: с. 122-7.
- Романова Т.П., Уварова И.A. Kapдио- и цереброваскулярные изменения под влиянием разных видов стресса при артериальной гипертензии. Бюллетень медицинских интернет-конференций. 2014; 4 (6): 946.
- Романова Т.П., Уварова И.А. Морфофункциональные изменения сосудов микроциркуляторного русла миокарда гипертензивных крыс при стрессе. Известия Саратовского университета. Новая серия. Сер.: Химия. Биология. Экология. 2017; 17 (2): 208-11. DOI: 10.18500/1816-9775-2017-17-2-208-211
- Аттаева М.Ж., Гурижева M.B., Василенко B.M. Стимулированная тетразолиевая активность нейтрофилов у больных хроническим пиелонефритом, осложненным артериальной гипертонией. Современные проблемы науки и образования. 2017; (5): 38.
- Болтаев Д.Э., Мадаминов А. С. Сравнительное изучение показателей лизосомальных катионных белков у больных с мочекаменной болезнью. Вестник экстренной медицины. 2011; (2): 29-31.
- Магомедова K.M., Арсланова P.M., Османова П.М., Гаджиева А. К. Современные представления о структуре и механизмах функционирования сукцинатгидрогеназы. Международный студенческий научный вестник. 2020; (3): 146.
- Ковшик ГГ., Храпова M.B., Душкин М.И. Особенности липидного и глюкозного обмена гипертензивной линии крыс НИСАГ Сибирский научный медицинский журнал. 2013; (4): 5-11.
- Петрухин И. С, Лунина Е. Ю. Актуальные проблемы профилактики сердечно-сосудистых заболеваний в России. Верхневолжский медицинский журнал. 2012; 10 (1): 3-8.
- Костин И. В., Шангина О. А., Шелихов В. Г. Метаболическая терапия в кардиологии с позиций доказательной медицины. Фундаментальная и клиническая медицина. 2021; 6 (1): 60-8. DOI:10.23946/2500-0764-2021 -6-1 -60-68


