Сосудистые нарушения при ожирении: факторы риска и клинические особенности
Автор: Лындина М.Л., Шишкин А.Н.
Журнал: Juvenis scientia @jscientia
Рубрика: Медицинские науки
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
В статье представлены данные о сосудистых нарушениях и развитии эндотелиальной дисфункции у пациентов с ожирением и развитием метаболического синдрома. Рассмотрены различные факторы риска при ожирении, в частности липидные нарушения, курение. Обследовано 108 пациентов (90 женщин и 18 мужчин) в возрасте от 43 до 65 лет (средний возраст 54,62 ± 0,43) с ожирением и развитием метаболического синдрома. Сосудодвигательная функция эндотелия оценивалась по методике Celermajer и соавт. Проанализированы результаты клинических исследований, направленных на изучение ранних маркеров эндотелиальной дисфункции (уровень МАУ, гомоцистеин, состояние внутрипочечной гемодинамики (индекс пульсации и индекс резистивности) на уровне междолевых и сегментарных артерий, данные пробы с реактивной гиперемией). Выполнена обработка полученных данных с помощью стандартных статистических методов. Обсуждается влияние ожирения, как независимого фактора, на развитие дисфункции эндотелия.
Факторы риска ссз, ожирение, метаболический синдром, эндотелиальная дисфункция, микроальбуминурия
Короткий адрес: https://sciup.org/14110480
IDR: 14110480 | УДК: 616-056.527
Текст научной статьи Сосудистые нарушения при ожирении: факторы риска и клинические особенности
Введение. В развитых странах сердечно-сосудистые заболевания (ССЗ) являются ведущей причиной смертности и одной из основных причин инвалидности среди взрослого населения. В России болезнями системы кровообращения страдают 21,6 млн. человек. Сердечно-сосудистые болезни обусловливают почти половину (48,3%) случаев инвалидизации по всем причинам. В структуре общей смертности населения на долю болезней системы кровообращения приходится 56,7%. Рост смертности, главным образом, растет за счет потерь в трудоспособном возрасте. [1].
Сегодня мы выделяем как не модифицируемые факторы риска (генетические, демографические – пол, возраст), так и модифицируемые факторы (употребление большого количества жирной пищи; питание, обогащенное жирами и легкоусвояемыми углеводами; дефицит пищевых антиоксидантов; гиподинамия-гипокинезия; стрессы; алкоголь; курение).
Большинство ССЗ, как у мужчин, так и у женщин наблюдается в возрасте старше 65 лет. В этом возрастном периоде они обусловливают почти 85% смертей. Риск развития ССЗ у мужчин значительно выше, чем у женщин (49% – мужчины, 32% – женщины в возрасте 40 лет). У мужчин в 2-5 раз выше риск развития ИБС, а риск инсульта в 1,25 раз выше, чем у женщин. Это различие наиболее отчетливо наблюда- ется в возрасте до 65 лет и значительно изменяется после менопаузы, когда риск развития ССЗ у женщин становится в 2-3 раза выше риска женщин того же возраста, но в пре-менопаузальном периоде [2]. Снижение уровня эстрогенов приводит к нарушению эндотелий зависимой вазодилатации вследствие снижения продукции оксида азота.
Наследственность является независимым фактором риска ССЗ. Риск преждевременного развития ССЗ (мужчины моложе 55 лет, женщины моложе 65 лет) повышается более чем в три раза при наличии ближайшего родственника с патологией сердечно-сосудистой системы, в шесть раз с развитием ССЗ в возрасте до 45 лет, либо – двух ближайших родственников с наличием ССЗ [2].
Курение является одним из основных факторов риска ССЗ. В России с этой вредной привычкой связаны 40% случаев смерти от ИБС среди мужчин и 10% случаев смерти от инсульта среди женщин. В табачном дыме содержится более 4000 вредных веществ, многие из которых токсичны для сердечно-сосудистой системы: монооксид углерода, нитрозамины, полициклические ароматические углеводороды и др. Курение вызывает эндотелиальную дисфункцию вследствие повреждения эндотелия токсинами и свободными радикалами табачного дыма. Кроме того, компоненты дыма активируют тромбоциты и нейтрофилы, что в свою очередь усиливает продукцию свободных радикалов, усиливается адгезия моноцитов к эндотелиоцитам, что является ранним проявлением атеросклероза [3]. Курение сочетается с повышением маркеров воспаления: концентрация в сыворотке крови СРБ, уровней интерлейкина-8, фактора некроза опухолей-α и межклеточных молекул адгезии [4]. У курильщиков чаще выявляется гипергомоцистеинемия, выраженность которой прямо коррелирует с интенсивностью курения.
Кроме того значимо повышает риск развития ССЗ наличие дислипидемии и сахарного диабета. Многочисленные международные исследования (4S, CARE, Framingham, PROCAM) убедительно доказали, что гиперхолестеринемия напрямую связана со смертностью от ССЗ. В частности, повышенное содержание в плазме липопротеидов низкой плотности (ЛПНП) отчетливо связано с развитием коронарного, каротидного и периферического атеросклероза. Причем атерогенными свойствами обладают модифицированные ЛПНП – результат перекисного окисления [5]. Окисленные ЛПНП также индуцируют пролиферацию гладкомышечных клеток сосудов [6].
Сахарный диабет также значимо повышает риск развития ССЗ и смертность от них. Нарушение метаболизма глюкозы ведет к гликозилированию белков и образованию конечных продуктов гликозилирования, которые вызывают активацию свободнорадикальных процессов в эндотелиальных и гладкомышечных клетках сосудов, нейронах, макрофагах и других клетках. Усиление свободнорадикальных процессов является одним из триггерных факторов, ведущих к развитию и прогрессированию атеросклероза [7].
В многочисленных исследованиях показано, что ожирение является самостоятельным, независимым фактором риска сердечно-сосудистых заболеваний, характеризующихся высокой смертностью. Степень кардиоваскулярного риска при ожирении зависит от распределения жировой ткани в организме и значительно выше при так называемом центральном, или андроидном, типе, т. е. при преимущественном отложении жира в области туловища по сравнению с бедрами и ягодицами. У пациентов с ожирением увеличен сердечный выброс для восполнения возросших метаболических потребностей, который достигается не за счет увеличения частоты сердечных сокращений (ЧСС), а за счет увеличения ударного объема. Высокий сердечный выброс ведет к развитию эксцентрической гипертрофии левого желудочка и диастолической дисфункции.
Ожирение часто сопровождается инсулинорезистент-ностью, что повышает риск ССЗ [4]. Ожирение сопровождается повышением уровня ренина в плазме, тем самым активируя ренин-ангиотензиновую систему, что способствует дисфункции эндотелия [6].
Ожирение также может способствовать развитию хронической болезни почек (ХБП) путем увеличения гломерулярного обьема за счет гиперпродукции мезангиального матрикса и гипертрофии подоцитов [8]. Кроме того, триглицериды и свободные жирные кислоты могут быть сами по себе нефротоксичными, содействуя продуцкии провоспа-лительных цитокинов [9].
Нарушение функции эндотелия является одним из универсальных механизмов патогенеза многих заболеваний, в том числе и таких, как атеросклероз, гипертоническая болезнь, сахарный диабет, гломерулонефрит. Эндотелиальная дисфункция характеризуется сдвигом в работе эндотелия в сторону уменьшения вазодилатации, провоспалительного состояния и протромботических свойств[10].
В настоящее время известно, что эндотелий контролирует сосудистый тонус, местные процессы гемостаза, пролиферации, миграции клеток крови в сосудистую стенку, рост гладкомышечных клеток, тромбообразование, фибринолиз и многие другие процессы.
Поскольку дисфункция эндотелия связана с дисбалансом между продукцией вазодилататоров и вазоконстрикторов, тромбогенных и атромбогенных факторов, ангиогенных факторов и их ингибиторов, выделяют вазомоторную, тромбофилическую, адгезивную и ангиогенную формы эндотелиальной дисфункции [11].
Тромбофилическая форма ДЭ, обусловлена нарушением нормального соотношения веществ, образующихся в эндотелии и участвующих в гемостазе или влияющих на этот процесс.
Нарушение соотношения между атромбогенными и тромбогенными веществами, образующимися в эндотелии, может привести к развитию сосудистой тромбофилии и тромбообразованию. Значительное снижение тромборе-зистентности сосудов имеет место при атеросклерозе, артериальной гипертензии, сахарном диабете и опухолевых заболеваниях [12, 13].
Адгезивная форма ДЭ обусловлена нарушением взаимодействия лейкоцитов и эндотелия, постоянно протекающего физиологического процесса, осуществляющегося при участии специальных адгезивных молекул. При участии Р- и Е-селектинов осуществляется задержка и неполная остановка лейкоцитов (роллинг), а ICAM-1 и VCAM-2, взаимодействуя соответствующими лигандами лейкоцитов, обеспечивают их полную остановку (адгезию) [14].
Ангиогенная форма ДЭ связана с нарушением неоангиогенеза, процесса, в котором выделяют следующие стадии: увеличение проницаемости эндотелия и разрушение базальной мембраны, миграция эндотелиальных клеток, пролиферация и созревание эндотелиальных клеток, ремоделирование сосудов [11].
Вазомоторная форма ДЭ обусловлена нарушением соотношения между эндотелиальными вазоконстрикторами и вазодилататорами и имеет значение в механизмах, как системного повышения артериального давления (АД), так и локального ангиоспазма [12, 15].
Результирующий эффект (сосудосуживающий или сосудорасширяющий) вазоактивных веществ находится в зависимости от их концентрации, а также типа и локализации сосудов, что объясняется неравномерным распределением рецепторов в артериях, артериолах, венулах и даже в однотипных сосудах разных регионов [16].
Эндотелиальная дисфункция (ЭД) и её роль в повреждении сосудов представляется важным звеном в сердечно-сосудистом континууме. Современные данные убедительно демонстрируют, что микроальбуминурия является не только маркером вовлечения в патологический процесс почек, но и точно отражает, как степень генерализованного поражения микрососудов, так и степень суммарного риска развитий осложнений и неблагоприятных исходов. В различных исследованиях было показано, что микроальбуминурия является независимым фактором риска ишемической болезни почек, ССЗ и других причин смертности при сахарном диабете, артериальной гипертензии [17, 18].
Пациенты и методы. Нами было обследовано 108 пациентов (90 женщин и 18 мужчин) в возрасте от 43 до 65 лет (средний возраст 54,62±0,43) с МС. В исследование включали пациентов, соответствующих критериям IDF и AHA/NHLBI 2009 года [19]. Критериями исключения были сахарный диабет 1 типа, онкологическое заболевание, ХБП 3 стадии, выраженной анемии (уровень гемоглобина менее 70 г/л), дыхательной недостаточности 2 степени, острое нарушение мозгового кровообращения или острый инфаркт миокарда в анамнезе. Контрольную группу составили 28 больных без признаков МС, средний возраст которых составил 54,82±0,27, ИМТ – 25,68±042. Среди них количество женщин составляло 67,86 %, мужчин – 32,14%. В основной группе количество женщин составляло 83,3%, мужчин – 16,7%. По полу и возрасту группы не различались.
На этапе скрининга проводился сбор данных анамнеза, объективный осмотр, антропометрия. При проведении антропометрического исследования нами оценивался в первую очередь такой показатель как окружность талии (ОТ, см), окружность бедер (ОБ, см) и рассчитывалось соотношение ОТ/ОБ, позволяющее дифференцировать фенотипический вариант ожирения. Ожирение расценивалось как абдоминальное при ОТ/ОБ у женщин более 0,80, у мужчин – более 0,94. Степень ожирения оценивали по ИМТ=масса тела (кг)/рост (м²).
Массу тела считали нормальной при ИМТ в пределах 2025 кг/м2, избыточной – при ИМТ 25-30 кг/м2, ИМТ более 30 кг/м2 расценивали, как ожирение. Методом анкетирования подробно изучали жалобы больных, анамнез заболевания, наследственный анамнез. Уделялось внимание образу жизни пациентов – особенностям питания, физической активности, наличию вредных привычек, в частности курению. Во время проведения обследования пациенты не получали медикаментозную терапию. Получаемая до обследования терапия была отменена за 3 месяца до начала данного исследования. Всем пациентам проводили клинико-лабораторное обследование с помощью стандартных лабораторных методик, которое включало определение показателей липидограммы, концентрации инсулина крови, С-пептида, мочевой кислоты, гомоцистеина плазмы. Уровень МАУ напрямую, без перерасчета, определяли турбодиметриче-ским методом на иммунохемилюминисцентном анализаторе «IMMULITE» (США) у всех пациентов в утренней порции мочи, считая референтной величину показателя не выше 20 мг/л [20]. Исследование внутрипочечного кровотока проводилось методом цветовой доплерографии с импульсной доплерометрией на приборе Aloka SSD-5500 (Япония). Исследовались магистральные и интраренальные почечные артерии (сегментарные и междолевые) в проекции трех сегментов обеих почек. Скоростные показатели интраре-нальных почечных артерий измерялись с коррекцией угла локации, не превышающем 20 градусов, а показатели магистральных почечных артерий измерялись при коррекции угла локации не более 60 градусов. Определяли резистивные характеристики артериального кровотока (RI и PI). RI – индекс резистивности или индекс периферического сопротивления – отражает состояние сопротивления кровотоку дистальнее места измерения и определяется по формуле. PI – индекс пульсации – отражает упруго-эластические свойства сосудов.
Нормальными показателями считаются данные значения: PI=0,85-1,3, RI=0,54-0,7 [21].
Кроме того, у всех пациентов исследовали сосудодвигательную функцию эндотелия с помощью ультразвукового аппарата ALOKA SSD-5500 линейным электронным муль-тичастотным датчиком 5-13 МГц по методике Celermajer и соавт. [22].
Исходно измерение диаметра плечевой артерии осуществляли в покое с помощью линейного датчика 7 МГц. Нормальной реакцией плечевой артерии принято считать 10% и более от исходного диаметра при пробе с реактивной гиперемией. Изменение диаметра сосудов выражали в процентах по отношению к исходной величине (%).
Статистическую обработку полученных результатов проводили с помощью программы StatSoft Statistica v.6.0. Коэффициенты корреляции рассчитывались по стандартным формулам. Результаты представлены в виде средних арифметических значений и стандартных отклонений.
Полученные результаты. Все обследованные пациенты были разделены на группы. Группа 1 – 1 степень ожирения (ИМТ=30,0-34,9); Группа 2 – 2 степень ожирения (ИМТ=35,0-34,9); Группа 3 – 3 степень ожирения (ИМТ > 40,0) и контрольная группа – пациенты без ожирения ( ИМТ 18,524,99).
Мы распределили пациентов по половому признаку в группах с различной степенью ожирения. Было выявлено, что среди мужчин отмечалась тенденция к наличию меньшей степени ожирения по сравнению с женщинами.
Таблица 1
Показатели встречаемости лиц мужского и женского пола среди больных с МС с различной степенью ожирения
|
Показатель |
Группа 1 (n = 41) |
Группа 2 (n = 33) |
Группа 3 (n = 34) |
|
Мужчины |
33,33 % |
9,09 % |
14, 81 % |
|
Женщины |
66,67 % |
90,91 % |
85,19 % |
Возраст всех обследованных пациентов в среднем составлял 54,62±0,43 лет, однако в группах с различной степенью ожирения этот показатель несколько различался.
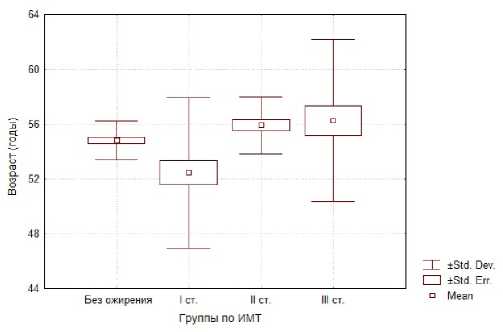
Рисунок 1. Возрастной показатель у пациентов с метаболическим синдромом с различной степенью ожирения
Как видно на данном рисунке среди всех обследуемых, пациенты с 1 степенью ожирения были достоверно моложе (средний возраст оставлял 52,44±0,92 лет), в остальных группах не было достоверных различий.
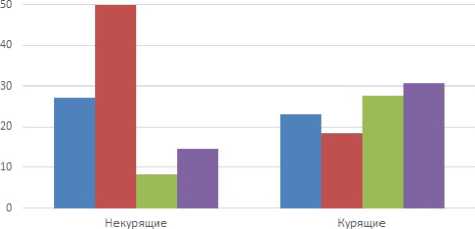
Другим качественным показателем в обследуемых группах для нас представил интерес такой показатель, как курение, что выявлялось при сборе анамнеза (рисунок 2).
Как видно на данном рисунке, среди некурящих пациентов преобладают пациенты с 1 степенью ожирения – 50 % обследованных, со 2 степенью ожирения – 8,33 %,
в Нет ожирения Bl ст. В II ст. в III ст.
Рисунок 2. Показатели наличия различных степеней ожирения у курящих и некурящих пациентов среди всех обследованных групп с 3 степенью ожирения – 14,58 %. Некурящие пациенты контрольной группы составляют 27,08 %.
Среди курящих чаще всего выявляется ожирение 3 степени – в 30,77 % случаев и ожирение 2 степени – 27,69 % пациентов. С 1 степенью ожирения курящие пациенты составляют 18, 46 % и без ожирения – 23, 08 % обследованных. При анализе этих данных можно предположить, что среди курящих пациентов ожирение распространено чаще, чем среди некурящих.
У всех пациентов были выявлены нарушения липидного обмена. При исследовании показателей липидного спектра были получены следующие результаты – прежде всего, с нарастанием степени ожирения отмечалось увеличение такого показателя, как триглицериды (1 ст ожирения – 1,83 ± 0,11 ммоль/л, 2 ст ожирения – 2,06 ± 0,16 ммоль/л, 3 ст ожирения – 2,10 ± 0,14 ммоль/л, (р<0,001), однако при попарном сравнении групп не было выявлено достоверного различия между пациентами со 2 и 3 степенями ожирения по данному показателю.
Еще одним методом косвенной оценки состояния эндотелия является исследование содержания в крови факторов, повреждающих эндотелий, уровень которых коррелирует с эндотелиальной дисфункцией. К таким факторам относятся гипергомоцистеинемия и уровень микроальбуминурии. Полученные данные представлены в таблице 2.
этот показатель превышает нормальные значения в 5 раз.
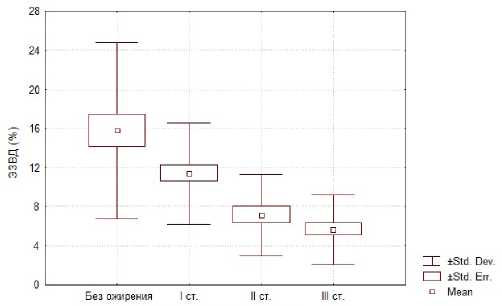
При исследовании эндотелий зависимой вазодилатации всем пациентам измерялся исходный диаметр плечевой артерии и диаметр артерии через 4,5 минуты с последующим измерением через 30, 60 и 90 секунд после декомпрессии. Кроме того, оценивалась исходная скорость кровотока и скорость кровотока сразу после декомпрессии. По формуле производился подсчет % прироста диаметра сосуда: ЭЗВД = ((ДПА после РГ – ДПА исх)/ ДПА исх) х х100%.
Группы по степени ожирения
Рисунок 3. Показатели эндотелий зависимой вазодилатации у пациентов с разными степенями ожирения
При подсчете % прироста диаметра сосуда, вызванного потоком крови было выявлено достоверное снижение этого показателя вместе с нарастанием степени ожирения (р < 0,001) : 1 группа – 1 степень ожирения – дилатация, вызванная потоком крови – 11,37±0,86 %; 2 группа – 2 степень ожирения – дилатация, вызванная потоком крови – 7,13±0,88 %; 3 группа – 3 степень ожирения – дилатация, вызванная потоком крови – 5,66±0,69 %; контрольная группа – без ожирения – дилатация, вызванная потоком крови – 15,79±1,70 %. Из чего следует, что при 1 степени ожирения значение эндотелий зависимой вазодилатации остается в пределах нормальных значений, при 2 и 3 степенях ожирения этот показатель достоверно ниже нормальных значений, что подразумевает под собой нарушение функции эндотелия в данных группах.
Таблица 2
Показатели уровня гомоцистеина и микроальбуминурии у пациентов с различной степенью ожирения
|
Показатель |
Группа 1 (n = 41) |
Группа 2 (n = 33) |
Группа 3 (n = 34) |
Контрольная группа (n = 28) |
|
Гомоцистеин, мкмоль/л |
14,31±1,38 |
14,60±0,22 |
18,43±0,57 |
6,95±0,29 |
|
Микроальбумин мочи, мкг/л |
14,28±1,38 |
20,44±0,46 |
53,09±7,87 |
10,74±0,77 |
Как видно из представленных данных уровень микроальбуминурии закономерно повышается вместе с нарастанием степени ожирения, однако достоверное изменение этого показателя выше нормальных значений отмечается лишь во 2 (р<0,05) и 3 группах (р<0,001): 2 группа – 2 степень ожирения – МАУ – 20,44±0,46 мкг/л ; 3 группа – 3 степень ожирения – МАУ – 53,09±7,87 мкг/л, причем в 3 группе
Таблица 3
Показатели индексов RI и PI на уровне междолевых и сегментарных артерий почек у пациентов с различной степенью ожирения
|
Показатель |
Группа 1 (n = 41) |
Группа 2 (n = 33) |
Группа 3 (n = 34) |
Контрольная группа (n = 28) |
|
RI (сегментарные) |
0,64±0,01 |
0,71±0,01 |
0,70±0,01 |
0,60±0,02 |
|
RI (междолевые) |
0,63±0,01 |
0,70±0,01 |
0,68±0,01 |
0,60±0,02 |
|
PI (сегментарные) |
0,99±0,02 |
1,24±0,03 |
1,33±0,04 |
0,94±0,06 |
|
PI (междолевые) |
0,99±0,02 |
1,24±0,03 |
1,31±0,04 |
0,93±0,07 |
Как видно из представленных данных при исследовании внутрипочечного кровотока в исследуемых группах индекс резистентности и пульсационный индекс превышают нормальные значения, что можно рассматривать как признак повышения внутрисосудистого почечного сопротивления.
Выводы. Полученные данные свидетельствуют о том, что у больных уже при ожирении I степени возникают нарушения внутрисосудистой и внутрипочечной гемодинамики и повышение уровня МАУ. Наличие взаимосвязи между этими показателями следует учитывать при обследовании пациентов с начальными степенями ожирения и метаболическими нарушениями. Ожирение может являться независимым фактором, способствующим нарушению микроциркуляции и прогрессированию эндотелиальной дисфункции. Выявление признаков дисфункции эндотелия позволит индивидуализировать профилактику и лечение ССЗ и начальных стадий ХБП у пациентов с МС.
Список литературы Сосудистые нарушения при ожирении: факторы риска и клинические особенности
- Воробьева Е.Н., Воробьев Р.И., Шарлаева Е.А., Фомичева М.Л., Соколова Г.Г., Казызаева А.С., Батанина И.А. Дисфункция эндотелия при сердечно-сосудистых заболеваниях: факторы риска, методы диагностики и коррекции//Acta Biologica Sibirica, 2016. 2 (1), с.22.
- Jousilahti P, Vartiainen E, Tuomilehto J, Puska P. Sex, age, cardiovascular risk factors and coronary heart disease: a prospective follow-up study of 14786 middle-aged men and women in Finland//Circulation. 1999. 99. 1465-1472.
- Вихирева О.В. Курение как фактор риска сердечно-сосудистых заболеваний: актуальность проблемы и возможности ее контроля путем лечения никотиновой зависимости (обзор литературы)//Профилактика заболеваний и укрепеление здоровья. 2003. №4. С. 21-27.
- Oliviera G.H. Novel serologic markers of cardiovascular risk//Current Atherosclerosis Reports. 2005. Vol. 7. P. 148-154.
- Davignon J., Ganz P. Role of endothelial dyfuction in atherosclerosis//Circulation. 2004. Vol. 109. P.27-32.
- Fornoni A., Raij L. Metabolic syndrome and endothelial dysfunction//Current Hypertension Reports. 2005. 7, p. 88-95.
- Schulze P.C., Lee R.T. Oxidative stress and atherosclerosis//Current Atherosclerosis Reports. 2005. Vol. 7. P. 242-248.
- Serra A, Romero R, Lopez D, Navarro M et al. Renal injury in the extremely obese patients with normal renal function. Kidney Int. 2008 Apr; 73 (8): 947-55.
- Лындина М.Л., Шишкин А.Н., Воловникова В.А. Особенности внутрипочечной гемодинамики у пациентов с метаболическим синдромом//Нефрология. 2015. Т. 19. № 4. С. 82-88.
- Лындина М.Л., Шишкин А.Н., Тесля О.В. Особенности ранней диагностики эндотелиальной дисфункции у больных с метаболическим синдромом//Вестник СПбГУ. Серия 11, Медицина. 2014. №3. С. 56-64.
- Панина И.Ю., Румянцев А.Ш., Меншутина М.А., Ачкасова В.В., Дегтерева О.А., Тугушева Ф.А., Зубина И.М. Особенности функции эндотелия при хронической болезни почек. Обзор литературы и собственные данные//Нефрология, 2007. Том 11. №4. С. 28-42.
- Петрищев Н.Н, Власов Т.Д. Физиология и патофизиология эндотелия. В: Петрищев Н.Н., ред. Дисфункция эндотелия. Причины, механизмы, фармакологическая коррекция. Изд-во СПбГМУ, СПб., 2003; С.4-38.
- Петрищев Н.Н. Современные аспекты эндотелиопротекции в клинической практике. Ангиопротекция в практике терапевта: Материалы III Конгресса терапевтов Санкт-Петербурга и Северо-Западного Федерального округа России. СПб., 2004; 3-6.
- Шишкин А.Н., Кирилюк Д.В. Дисфункция эндотелия у пациентов с прогрессирующими заболеваниями почек//Нефрология. 2005; 9(2): 16-22.
- Дедов И.И., Шестакова М.В., Кочемасова Т.В. и др. Дисфункция эндотелия в развитии сосудистых осложнений сахарного диабета//Рос физиол журн им И.М.Сеченова 2001; 87(8): 1073-1084.
- Marie I, Beny JL. Endothelial dysfunction in murine model of systemic sclerosis//J Invest Dermatol 2002; 119 (6): 1379-1385.
- Ali Ozyol, Oguzhan Yucel et al. Microalbuminuria is associated with the severity of coronary artery disease independently of other cardiovascular risk factors//Angiology, Aug 2012. Vol. 63, no. 6. 457-460.
- Slarma S., Chalaut Vs. et al. Microalbuminuria and C-reactive protein as a predictor of coronary artery disease in patient of acute chest pain//J Cardiovascular Disease Research 2013 Mar; 4(1); 37-9, doi 10.1016.
- Alberti KG, Eckel RH, Grundy SM, et al, International Diabetes Federation Task Force on Epidemiology and Prevention, National Heart, Lung, and Blood Institute, American Heart Association, World Heart Federation, International Atherosclerosis Society, International Association for the study of Obesity//Circulation. 2009 Oct 20; 120 (16): 1640-5.
- Литвин А. Микроальбуминурия: клиническое значение.//Врач. 2011; 9. С. 7-13.
- Клиническое руководство по ультразвуковой диагностике (в 2-х томах под ред. В.В.Митькова). 1 том -М.: Видар, 1996.-336 с.
- Celermajer D.S. Testing endothelial function using ultrasound//J. Cardiovasc. Pharmacol. 1998. 32 (Suppl.) 3:S29-32


