Совершенствование методов одноэтапной реконструктивно-восстановительной хирургии при рубцовых дефектах век
Автор: Банщиков П.А., Егоров В.В., Смолякова Г.П.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель: выполнить анализ процессов послеоперационного приживления различных вариантов сложносоставного лоскута при одноэтапной реконструктивной блефаропластике сквозных рубцовых дефектов век. Материал и методы. Объектом исследования явились 40 пациентов (40 глаз), которым выполнена одноэтапная пластическая реконструкция рубцовых дефектов век, разделенные на две группы в зависимости от варианта сложносоставного лоскута: в основной группе (20 пациентов: 20 глаз) - трехслойный лоскут, в контрольной группе (20 пациентов: 20 глаз) - двухслойный. Критериями оценки результатов явились: характер приживления сложносоставного лоскута, цитологический анализ раневого отделяемого, клинические характеристики рубца, размеры глазной щели, показатели микроциркуляции. Результаты. Через 3 месяца после операции репаративный процесс у 18 пациентов (90%) основной группы у и 15 пациентов (75%) контрольной группы завершился нормотрофическим рубцеванием; у 2 пациентов (10%) основной группы имелось патологическое рубцевание, отклонение размеров глазной щели составило -9%; у 5 пациентов (25%) контрольной группы наблюдали образование осложненного рубца, отклонение размеров глазной щели -22%. Заключение. Основным преимуществом трехсоставной реконструктивной блефаропластики является сокращение частоты осложненного рубцевания в 3 раза. Разработанный нами математический алгоритм объективирует и индивидуализирует выбор наиболее рациональной хирургической технологии.
Блефаропластика, обширные рубцовые деформации век, показатель микроциркуляции, сложносоставной тканевый комплекс
Короткий адрес: https://sciup.org/149135571
IDR: 149135571 | УДК: 617.77-089.844
Текст научной статьи Совершенствование методов одноэтапной реконструктивно-восстановительной хирургии при рубцовых дефектах век
-
1Введение. Реконструктивная блефаропластика обширных сквозных рубцовых дефектов век является одной из актуальных проблем современной офтальмохирургии. Сквозные дефекты век, занимающие более ½ его площади, оказывают негативное воздействие на зрительные функции и могут создавать реальную угрозу для гибели глаза, а их замещение требует сложных пластических реконструкций [1, 2].
Реконструктивная блефаропластика за последнее десятилетие претерпела значительные позитивные изменения: предложены разнообразные технологии устранения тканевых дефектов век и новые искусственные и биологические пластические материалы, лишенные антигенных свойств [3–7]. Стратегические же задачи пластической реконструкции рубцовых дефектов век: улучшение анатомо-функциональных результатов, оптимизация сроков реабилитации при минимизации затратной эффективности — остаются пока нерешенными.
В последнее время для улучшения функционально-эстетических результатов и сокращения много-этапности реконструктивной хирургии при тяжелых рубцовых сквозных дефектах век многие офтальмохирурги стали отдавать предпочтение операциям с применением комбинированных тканевых лоскутов различной морфологической структуры, которые од-ноэтапно позволяют восстановить структурную организацию века и его функциональную активность [2, 3, 5, 7–9].
По единодушному мнению офтальмохирургов, процессы приживления пересаживаемых тканей при пластической реконструкции сквозных рубцовых дефектов век неразрывно связаны с формированием оптимального васкуляризированного ложа в ре-ципиентной зоне из-за высокого риска возникновения
сосудисто-трофических расстройств и тканевых некрозов в зоне проведенной реконструктивной блефа-ропластики [5, 10].
Традиционно для решения данной задачи в пластической реконструктивной хирургии рубцовых дефектов век обычно используют кожные лоскуты на питающей сосудистой ножке путем их перемещения с донорских зон лица (лба, виска, щеки, носогубного треугольника) [4, 6]. Однако их возможности для замещения дефекта и создания трофического ложа в реципиентной зоне век из-за хаотичного типа кровоснабжения и других анатомических особенностей сосудистой архитектоники довольно часто ограничены в связи с высоким риском возникновения сосудистых расстройств и вторичного рубцевания [5, 9, 11].
В современной реконструктивно-пластической хирургии головы многие авторы демонстрируют результаты успешного применения височной мышцы для создания васкуляризированного ложа, в связи с тем что она хорошо кровоснабжается, а осевой ход кровеносных сосудов исключает нарушение трофики и возникновение тканевых некрозов при ее перемещении в зону дефекта.
Данное обстоятельство послужило поводом для сравнительного анализа эффективности применения в одноэтапной реконструктивной блефаропла-стике сквозных рубцовых дефектов век различных вариантов сложносоставных лоскутов, включающих, с одной стороны, хорошо известные и широко применяемые в пластической хирургии век васкуляризированные кожные лоскуты на сосудистой ножке, а с другой — малоизученные лоскуты височной мышцы на сосудистом питающем основании.
Цель: выполнить анализ процессов послеоперационного приживления различных вариантов сложносоставного лоскута при одноэтапной реконструктивной блефаропластике сквозных рубцовых дефектов век.
Материал и методы. Объектом исследования явились 40 пациентов (40 глаз) в возрасте от 37 до 65 лет (в среднем 54±6 лет), из них мужчин 17, женщин 23.
Причинами рубцовых дефектов век являлись: механическая (автодорожная) травма (13 чел.); взрывная травма (6 чел.); укусы животных (5 чел.); хирургия опухолей, удаление которых ранее проведено в медицинских учреждениях Дальневосточного федерального округа (16 чел.).
-
У 11 пациентов сложные рубцовые дефекты имелись на верхнем веке, у 29 на нижнем.
Площадь дефекта век варьировалась от 196 до 275 мм2 (в среднем 225,4±9,0 мм2).
В зависимости от вариантов сложносоставной реконструктивной блефаропластики все пациенты были разделены на две группы, сопоставимые по полу, возрасту, причинам возникновения и площади дефекта век.
В 1-ю (основную) группу вошли 20 пациентов (20 глаз), пластическая реконструкция рубцовых дефектов век которым проводилась разработанным нами методом с помощью трехслойного сложносоставного лоскута [9].
Этапы реконструктивной хирургии у пациентов основной группы включали в себя хирургическую коррекцию дефекта путем рассечения и иссечения рубцов и послойное восстановление тканевого дефекта века согласно разработанной нами технологии: формирование заднего слоя век мукопериостальным свободным трансплантатом из твердого неба с фиксацией к надкостнице орбитального края и остаткам связочного аппарата век и конъюнктивы; среднего слоя — путем ротирования мышечно-фасциального лоскута височной мышцы на питающем основании в область дефекта и его укладывания на мукопериостальный трансплантат с фиксацией к остаткам круговой мышцы реципиентной зоны; переднего слоя — свободным кожным трансплантатом, взятым с задней поверхности ушной раковины с фиксацией к краям раневой зоны.
На завершающем этапе операции применяли шовное соединение трех тканевых лоскутов по свободному краю в единый комплекс и его фиксацию П-образными швами к ресничному краю неповрежденного века с сохранением отверстия во внутреннем углу глазной щели для оттока раневого секрета из конъюнктивальной полости. Продолжительность выполнения хирургической операции по данной технологии варьировалась от 1,5 до 2,4 часа (в среднем 1,9±0,2 часа).
Во 2-ю (контрольную) группу включены 20 пациентов (20 глаз), реконструкция рубцовых дефектов век которым проводилась одноэтапно с помощью двухслойного сложносоставного лоскута.
Этапы реконструктивной двусоставной блефа-ропластики у пациентов контрольной группы после хирургической подготовки реципиентной зоны содержали: восстановление внутреннего слоя век мукопериостальным лоскутом с твердого неба и формирование наружного слоя век стандартным способом с помощью кожного лоскута на питающей ножке. Адаптацию лоскута проводили наложением кожных швов и блефарорафии. Продолжительность операции составляла от 1,1 до 1,5 часа (в среднем 1,2±0,2 часа).
В послеоперационном периоде в течение первого месяца после операции характер приживления сложносоставных лоскутов контролировали с помощью клинических критериев: наличие отека, изменения цвета кожного лоскута, состояние швов и характер раневого отделяемого.
Для верификации продолжительности фаз раневого процесса и темпов эпителизации поверхности раны в зоне адаптации кожного лоскута использовали цитологический метод исследования раневого отделяемого как объективного показателя процессов заживления [12].
Для цитологических исследований материал получали на перевязках путем соскоба, взятого с поверхности раны на границе кожного лоскута и здоровой кожи. Полученный материал наносили на обезжиренное предметное стекло и равномерно распределяли по его поверхности, далее окрашивали по методу Романовкого — Гимзы. Под иммерсионным микроскопом Leica DM LS2 (Германия) в 10 полях зрения подсчитывали клеточный состав мазков (нейтрофильные лейкоциты (НЛ), макрофаги (МФ), лимфоциты (ЛФ), фибробласты (ФБ), эпителиоциты (ЭЦ)) и выражали в процентах. В соответствии с фазами раневого процесса цитограммы анализировали на 2–3, 5–7 и 10–14-е сутки после операции [12, 13].
В позднем послеоперационном периоде (спустя 3, 6 и 12 месяцев после операции) изучали клинические характеристики рубца, с помощью измерительной линейки определяли вертикальный размер глазной щели, сравнивая его с размером глазной щели на здоровой стороне, анализировали также частоту деформирующих рубцовых последствий, требующих повторных корригирующих операций [14].
Статистическая обработка результатов исследования проводилась с помощью стандартной программы IBM SPSS Statistics 20. Распределение соответствовало нормальному. Данные представлены в виде М±σ, где М — среднее значение, σ — стандартное отклонение. Для выявления различий меду двумя группами применяли параметрический t-критерий Стьюдента. Статистически значимыми считались различия при p<0,05.
Для выявления прогностических параметров, влияющих на исход процессов приживления аутотрансплантата, использовались логистическая регрессия и анализ ROC-кривых.
Результаты. При первой перевязке, после снятия давящей повязки на 2–3-и сутки после операции, у пациентов обеих групп отсутствовали признаки инфицирования и гематома век. Наблюдался соизмеримый умеренный отек сложносоставных лоскутов и окружающих операционную зону тканей по границам. В обеих группах наблюдения регистрировалась полная адаптация краев раны без прорезывания швов и краевого некролиза пересаженных тканевых трансплантатов. Из конъюнктивальной полости через отверстие во внутреннем углу глазной щели выделялось небольшое количество скудного раневого секрета.
К 10-м суткам после операции у всех пациентов основной группы визуально завершился процесс эпителизации раны по границам трансплантата, кожный лоскут по всей своей поверхности приобрел розовый оттенок. В контрольной группе на 10-е сутки после операции розовый оттенок кожного лоскута зарегистрирован только со стороны питающей ножки и в прилежащих к ней отделах трансплантата. Остальная часть кожного лоскута сохраняла бледный оттенок. У 5 пациентов контрольной группы наблюдали также по границам кожного лоскута локальные участки эпидермального некроза, из них у 3 пациентов в зоне некроза имелось частичное расхождение краев раны.
Таблица 1
Динамика клеточного состава мазков-соскобов раневой зоны в раннем послеоперационном периоде в сравниваемых группах, M±m (%)
|
Цитограмма |
Срок наблюдения |
|||||
|
2–3-е сутки |
5–7-е сутки |
10–14-е сутки |
||||
|
Основ. группа |
Контр. группа |
Основ. группа |
Контр. группа |
Основ. группа |
Контр. группа |
|
|
Нейтрофилы |
37,0±0,5 |
46,3±0,6* |
8,6±0,2 |
12,1±0,5* |
00,0±0,0 |
2,2±0,2 |
|
Макрофаги |
35,4±0,6 |
39,4±0,4* |
9,4±0,5 |
16,6±0,6* |
00,0±0,0 |
3,6±0,4 |
|
Лимфоциты |
22,6±0,2 |
12,3±0,4* |
6,3±0,2 |
11,2±0,4* |
1,2±0,1 |
2,2±0,1* |
|
Фибробласты |
4,0±0,4 |
1,0±0,2* |
12,6±0,4 |
18,1±0,3* |
4,2±0,2 |
6,1±0,2* |
|
Эпителиоциты |
1,0±0,2 |
0,0±0,0 |
63,1±0,4 |
42,0±0,3* |
94,6±0,3 |
85,9±0,4* |
П р и м еч а н и е : * — статистическая значимость межгрупповых различий (р<0,05).
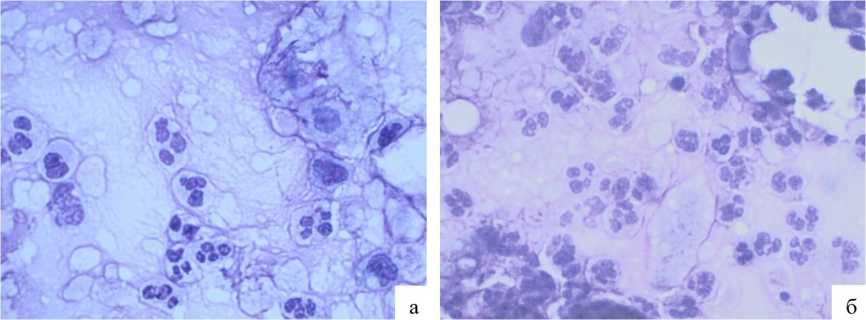
Рис. 1. Цитологический мазок-соскоб с раневого края оперированной зоны на 2–3-е послеоперационные сутки: а — основная группа; б — контрольная группа
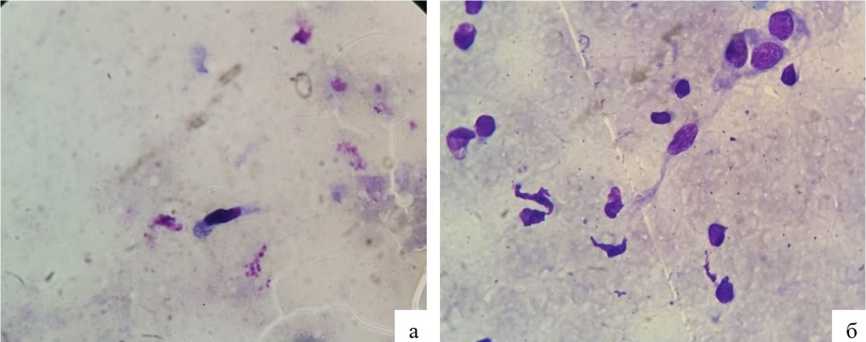
Рис. 2. Цитологический мазок-соскоб с раневого края оперированной зоны на 5–7-е послеоперационные сутки: а — основная группа; б — контрольная группа
Сравнительная цитологическая картина раневого секрета в раннем послеоперационном периоде при различных вариантах реконструктивной блефа-ропластики представлена в табл. 1.
В цитограммах мазков-соскобов, выполненных на 2–3-и сутки после операции (фаза воспаления), у пациентов обеих групп в клеточном составе преобладали НЛ, МФ и ЛФ, отражающие интенсивность проявления экссудативной реакции воспаления (см. табл. 1). При этом относительное содержание воспалительных клеток в цитограмме достоверно превалировало у пациентов контрольной группы по сравнению с основной, p<0,05 (рис. 1).
К 5–7-м суткам после операции (фаза регенерации-репарации) результаты цитологического исследования в обеих группах иллюстрировали смену альтеративно-экссудативных реакций в ране на репаративные процессы. При этом у всех пациентов среднее количество НЛ, МФ, ЛФ имело тенденцию к снижению, однако в большей степени позитивные изменения касались цитограмм, полученных в основной группе, p<0,05. В этот период послеоперационного наблюдения зарегистрировано также появление на цитограммах молодых эпителиальных клеток и ФБ. Количество ФБ в контрольной группе оказалось в среднем на 5,5% больше, ЭЦ — на 21,1% меньше, чем в основной группе, p<0,05. Данная цитологическая картина у пациентов основной группы свидетельствовала о более быстром стихании местного воспаления и начале регенераторного процесса, по сравнению с контрольной, p<0,05 (рис. 2).
Таблица 2
Прогнозируемый характер послеоперационного рубцевания для обоих вариантов реконструктивновосстановительной блефаропластики в зависимости от показателя микроциркуляции
|
Показатель микроциркуляции пораженного века до операции, перф. ед. |
Прогнозируемый тип рубцевания для двухслойного лоскута |
Прогнозируемый тип рубцевания для трехслойного лоскута |
|
Менее 3,5 |
– Осложненный |
– Осложненный |
|
От 3,5 до 7,0 |
– Осложненный |
+ Неосложненный |
|
Более 7,0 |
+ Неосложненный |
+ Неосложненный |
К 10–14-м суткам послеоперационного периода в цитологических препаратах у пациентов обеих групп преобладали ЭЦ на фоне полного отсутствия воспалительных клеток в основной группе и их сохранения у 5 пациентов в контрольной.
Такие показатели свидетельствуют о том, что применение трехслойного сложносоставного лоскута для закрытия рубцовых дефектов век, по сравнению с двухслойным, позволяет снизить выраженность местных воспалительных реакций, оптимизировать течение регенераторного процесса.
Принимая во внимание тот факт, что позитивные изменения цитограмм в большей степени регистрируют у пациентов основной группы по сравнению с контрольной, сочли целесообразным в соответствии с общепринятой клинической классификацией рубцевания оценить клинико-эстетическую эффективность разных вариантов реконструктивной бле-фаропластики.
Так, через 3 месяца после операции репаративный процесс у 18 (90%) пациентов основной группы завершился формированием нежного тонкого нормотрофического рубца шириной 1,8–2,5 мм (в среднем 2,2±0,3 мм). Цвет рубца и кожного лоскута не отличался от окружающих тканей, поверхность его была ровной и пальпаторно веки стали мягкими, появилась их подвижность. Вертикальный размер глазной щели варьировался от 9 до 12 мм (в среднем 10,6±0,4 мм). У 2 пациентов (10%) имелось патологическое рубцевание с образованием слегка проминирующего рубца с неровной поверхностью и признаками гиперемии. У данных пациентов отклонение размеров от глазной щели по сравнению со здоровым глазом составило -9%.
В этот период послеоперационного наблюдения только у 15 пациентов (75%) в контрольной группе репаративный процесс завершился нормотрофическим рубцеванием. У остальных 5 пациентов (25%) данной группы наблюдали образование осложненного рубца, выходящего за пределы операционной зоны, ширина рубца оказалась почти в 2 раза больше, чем в основной группе, и составила 3,4–4,5 мм. Подвижность века у данных пациентов была ограничена, имелось отклонение размеров глазной щели по сравнению со здоровым глазом -22%.
При оценке окончательных результатов реконструктивной блефаропластики в отдаленном послеоперационном периоде от 6 до 12 месяцев у 18 пациентов основной группы наблюдения отмечалось правильное положение век с отсутствием разницы в размере глазной щели по сравнению со здоровым глазом, веки смыкались полностью, сохранен активный мигательный рефлекс, отсутствовало слезотечение. У 2 пациентов было небольшое увеличение размеров глазной щели до +10% за счет частичного рубцового выворота ниж- него века, хирургически исправленного через 12 месяцев после первой операции.
В контрольной группе при сроках наблюдения от 6 до 12 месяцев у 5 пациентов образование патологического рубца привело к вывороту нижнего века (4 чел.), ретракции верхнего (1 чел.) и увеличению размеров глазной щели до +17%.
На основании результатов проведенного исследования, с учетом возможности эффективного применения в разных клинических ситуациях при обширных рубцовых дефектах век одноэтапной двух- либо трехслойной сложносоставной блефаропластики, различающейся по объему оперативного вмешательства и медицинским затратам, становится очевидной необходимость дифференцированного выбора методики операции с целью получения наиболее позитивных исходов реабилитации. В связи с этим нами разработан и реализован в клинической практике метод математического прогнозирования выбора наиболее рациональной хирургической тактики (решение о выдаче патента РФ на изобретение от 20.03.2020 г. по заявке 2019126314 от 21.08.2019 г.). Предварительно для выявления прогностически значимых параметров, влияющих на исход приживления аутотрансплантата, использовали метод логистических регрессий и анализ ROC-кривых. Проведенный регрессивный анализ различных факторов (возраст пациента, площадь утраченных тканей, показатель микроциркуляции (ПМ, перф. ед.), индекс эффективности микроциркуляции) показал высокую прогностическую значимость ПМ в тканях пораженного века, что свидетельствует о возможности использования данного показателя для прогнозирования результатов реконструктивной блефаропластики.
На основании изучения ПМ в области реципи-ентной зоны пораженного века нами разработаны два математических уравнения, представленных в табл. 2, позволяющих до операции прогнозировать характер течения приживления аутотрансплантата (осложненное и неосложненное) при обоих вариантах одноэтапной сложносоставной блефаропластики и осуществлять выбор оптимальной хирургической тактики.
Так, при ПМ<3,5 перф. ед. для обоих типов хирургической реконструкции прогнозируется осложненный тип послеоперационного рубцевания (см. табл. 2). В данной клинической ситуации проведение одноэтапной пластической реконструкции рубцовых дефектов век можно считать неэффективным.
При ПМ пораженного века от 3,5 до 7,0 перф. ед. включительно неосложненный характер послеоперационного рубцевания прогнозируется только для одноэтапной блефаропластики с применением трехслойного сложносоставного лоскута (см. табл. 2).
При ПМ пораженного века более 7,0 перф. ед. образование неосложненных рубцов в послеоперационном периоде прогнозируется для обоих типов одноэтапной блефаропластики. Однако в связи с уменьшением медицинских затрат, упрощением хирургической технологии, а также сокращением длительности наркоза и операции предпочтение можно отдать реконструктивной блефаропластике с использованием двухслойного лоскута (см. табл. 2).
Обсуждение. Проблема реконструктивно-восстановительной блефаропластики обширных рубцовых дефектов век остается пока полностью нерешенной и до сих пор требует к себе пристального внимания. По данным литературы, у 15-50% оперированных пациентов по поводу рубцовых дефектов век вследствие вторичного грубого рубцевания возникает необходимость в проведении повторных пластических реконструкций [5, 11]. В представленном исследовании продемонстрированы в сравнительном аспекте процесс приживления и исходы стандартной двусоставной блефаропластики и разработанного нами трехсоставного метода. Установлено, что трехсоставная реконструктивная блефа-ропластика по сравнению с двусоставной на 15% уменьшает частоту вторичного рубцевания, требующего повторных операций, но уступает последней по затратной эффективности, включающей продолжительность операции и анестезиологического пособия, а также медицинские расходы. Разработанный нами математический алгоритм позволяет осуществлять дифференцированный подход к выбору метода сложносоставной реконструктивной блефаропластики в каждой конкретной ситуации.
Выводы:
-
1. В сравнительном исследовании представлены преимущества и недостатки использования для одноэтапной реконструктивной блефаропласти-ки обширных дефектов век трехсоставного лоскута, включающего два свободных тканевых трансплантата (кожного и мукопериостального) и васкуляризированную височную мышцу на сосудистом основании, по сравнению со стандартным двусоставным, состоящим из кожного лоскута на сосудистой ножке и свободного мукопериостального.
-
2. Основным преимуществом трехсоставной реконструктивной блефаропластики по сравнению с двусоставной является сокращение в 3 раза частоты осложненного рубцевания, требующего повторной хирургической коррекции.
-
3. Разработанный нами на основании регрессивного ROC-анализа математический алгоритм изначально объективирует и индивидуализирует выбор наиболее рациональной хирургической технологии при рубцовых дефектах век, обеспечивающей высокий уровень медицинской, социальной и психологической реабилитации пациентов.
Список литературы Совершенствование методов одноэтапной реконструктивно-восстановительной хирургии при рубцовых дефектах век
- Gundorova RA, Malaev AA, Yuzhakov AM. Eye injuries. Moscow, 1986; 386 p. Russian (Гундорова Р. А., Малаев А. А., Южаков А. М. Травмы глаза. М., 1986; 386 с.).
- Grishchenko SV. Comprehensive rehabilitation of patients with congenital and acquired deformities, defects of eyelids and soft tissues of periorbital area: DSc abstract. Moscow,
- 2012; 44 p. Russian (Грищенко С. В. Комплексная реабилитация пациентов с врожденными и приобретенными деформациями, дефектами век и мягких тканей периорбитальной области: автореф. дис.... д-ра мед. наук. М., 2012; 44 с.).
- Bastrikov NI. Method of restoration of missing eyelids. Bulletin of Ophthalmology 2004; 120 (2): 36-9. Russian (Бастри-ков Н. И. Способ восстановления отсутствующих век. Вестник офтальмологии 2004; 120 (2): 36-9).
- Bondar VS. With the plasticity of end-to-end defects of the eyelids. Grekov's Bulletin of Surgery 1989; 143: 93-6. Russian (Бондарь В. С. Пластика сквозных дефектов век. Вестник хирургии им. И. И. Грекова 1989; 143: 93-6).
- Gushchina MB. Development of reconstructive-reconstructive operations with deformations of eyelids and surrounding areas of the face with the use of compression plates: PhD abstract. Moscow, 2007; 24 p. Russian (Гущина М. Б. Разработка реконструктивно-восстановительных операций при деформациях век и окружающих зон лица с использованием компрессионных пластин: автореф. дис. ... канд. мед. наук. М., 2007; 24 с.).
- Krasnov ML, Belyaev VS. Guidelines for eye surgery. Moscow: Meditsina, 1988; 624 p. Russian (Краснов М. Л., Беляев В. С. Руководство по глазной хирургии. М.: Медицина, 1988; 624 с.).
- Copcu E, Sivrioglu N. The new reconstruction technique in the treatment of the skin cancers located on the eyelid: Posterior temporalis fascia composite graft. International Seminars in Surgical Oncology 2004; 1: 5. DOI: 10.1186/1477-7800-1-5.
- Lee WW, Erickson BP, Ko MJ, Liao SD, Neff A. Advanced single-stage eyelid reconstruction: anatomy and techniques. Dermatologic Surgery 2014; 40 (9S): 103-12. DOI: 10.1097/DSS. 0000000000000117.
- A method for blepharoplasty of extensive full-layer defects of the eyelids using a complex autograft: Patent of Russian Federation No. 2611940, 01.03.2017/Banshchikov PA, Egorov VV, Smoliakova GP. Bulletin No. 7. Russian (Банщиков П. А., Егоров В. В., Смолякова Г. П. Способ блефаропластики обширных полнослойных дефектов век с помощью сложносоставного аутотрансплантата: патент РФ № 2611940, 01.03.2017. Бюл. № 7).
- Makarov PV, Katayev MG, Gundorova RA, et al. Rehabilitation of patients with burn injury to the eye. Bulletin of Ophthalmology 2009; 125 (5): 52-6. Russian (Макаров П. В., Катаев М. Г., Гундорова Р. А. и др. О реабилитации пациентов с ожоговой травмой глаз. Вестник офтальмологии 2009; 125 (5): 52-6).
- Banshchikov PA, Egorov VV, Smoliakova GP. Optimization of a reconstructive plastic surgery of extensive cicatrical blepharon defects with multipartite tissue complex. Fyodorov Journal of Ophthalmic Surgery 2017; (4): 60-6. Russian (Банщиков П. А., Егоров В. В., Смолякова Г. П. Оптимизация реконструктивно-восстановительной хирургии обширных рубцовых дефектов век сложносоставным тканевым комплексом. Офтальмохирургия 2017; (4): 60-6. DOI: 10.2527 6/0235-4160-2017-4-60-66.
- Smotrin SM. Cytolizing methods of investigating the first stage of the wounding process. Journal of State Medical University of Grodno 2003; 3 (3): 6-9. Russian (Смотрин С. М. Цитологические методы изучения первой фазы раневого процесса. Журнал Гродненского государственного медицинского университета 2003; 3 (3): 6-9).
- Belyanin VL. Morphodynamics of the inflammatory process. In: Pathomorphological criteria for the limitation of mechanical injury and some pathological processes. St. Petersburg, 1996; p. 9-10. Russian (Белянин В. Л. Морфоди-намика воспалительного процесса. В кн.: Патоморфологиче-ские критерии давности механической травмы и некоторых патологических процессов. СПб., 1996; c. 9-10).
- Kovalyova LM. Clinical and morphological parallels in patients with skin scar disorders. Dermatovenerology. Cosmetology. Sexopathology 2016; 1-4: 108-17. Russian (Ковалева Л. Н. Клинико-морфологические параллели у пациентов с рубцовой патологией кожи. Дерматовенерология. Косметология. Сексопатология 2016; 1-4: 108-17).


