Современная терапия рака молочной железы: от тамоксифена до Т-клеточной инженерии
Автор: Шевченко Ю.А., Кузнецова М.С., Христин А.А., Сидоров С.В., Сенников С.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - провести систематический анализ имеющихся в литературе новейших данных о современных, в том числе высокотехнологичных, препаратах и технологиях для эффективной терапии рака молочной железы. Материал и методы. Для выбора информационных источников был проведен глобальный поиск с использованием баз данных Web of Science, Scopus, PubMed, РИНЦ. Первый этап поиска включал анализ метаданных источников по ключевым словам, релевантные источники были использованы для полнотекстового поиска. В обзоре использовано 55 источников (2001-2021), большинство из которых по теме обзора представлены статьями, опубликованными в течение последних 7 лет, более ранние источники относятся именно к начальным этапам применения методов или препаратов. Результаты. Литературные данные, представленные в обзоре, показывают, что многолетние исследования, основанные на патогенетических, гистологических и иммунологических особенностях развития опухоли, очень важны для улучшения показателей выживаемости при раке молочной железы. Клинические протоколы лечения, которые были основаны преимущественно на анатомических характеристиках заболевания, теперь переключаются на биологические механизмы, лежащие в основе онкогенеза. Препараты, направленные на рецепторы эстрогенов, играют важную роль в системной терапии и дают возможность коррекции механизмов, ответственных за эндокринную резистентность. Таргетная терапия, нацеленная на рецептор HER2, особенно в комбинации конъюгат антитело-лекарство, связала цитотоксическую терапию с антителами к HER2. Современные методы биологической терапии и клеточной инженерии позволяют разработать методы лечения тройного негативного рака молочной железы, основанные на регуляции микроокружения, механизмов репарации, иммуносупрессии, создания мишени из большего репертуара как поверхностных, так и внутриклеточных антигенов. Заключение. Перспективные стратегии, основанные на использовании сигнальных, метаболических путей, молекул клеточной поверхности, методов клеточной инженерии, приводят к повышению эффективности комплексного лечения, увеличению длительности безрецидивного периода и улучшению общей выживаемости при раке молочной железы.
Опухоль, рецепторы, гормонотерапия, таргетная терапия, иммунотерапия, клеточная терапия, химерные антигенные рецепторы
Короткий адрес: https://sciup.org/140296669
IDR: 140296669 | УДК: 618.19-006.6-08:615.28 | DOI: 10.21294/1814-4861-2022-21-5-109-122
Текст научной статьи Современная терапия рака молочной железы: от тамоксифена до Т-клеточной инженерии
Иммунологические и клинические особенности рака молочной железы
Иммунная система играет важную роль в контроле, развитии и прогрессировании рака молочной железы (РМЖ). На ранних этапах онкогенеза острое воспаление активирует врожденный иммунитет, что приводит к гибели опухолевых клеток и созреванию дендритных клеток, которые запускают опухолеспецифический Т-клеточный ответ. В этот момент происходит либо иммуноопосредованное отторжение зарождающейся опухоли, либо отбор тех вариантов опухолевых клеток, которые смогут избежать иммунного ответа. В конечном итоге происходит переход от острого к хроническому воспалению, создается сложное микроокружение опухоли, состоящее из супрессивных иммунных клеток (Т-регуляторных клеток, миелоидных супрессорных клеток и В-клеток), стромальных клеток (фибробластов) и эндотелиальных клеток, которые способствуют явному ускользанию от иммунного надзора и прогрессированию опухоли. Во время этого сдвига ответ CD4 Т-лимфоцитов смещен с Т-хелперов 1-го типа на Т-хелперы 2-го типа, молекулы иммунных контрольных точек активируются на опухолевых и иммунных клетках в ответ на раннюю иммунную активацию, а иммуносупрессивные метаболические процессы усиливаются [1, 2].
Инвазивный РМЖ условно подразделяется на три терапевтических клинических подтипа: HR-положительный (наличие рецепторов к эстрогену и/или прогестерону), HER2-положительный и тройной негативный (с отсутствием рецепторов эстрогена, прогестерона и экспрессии HER2). Ни один из этих подтипов не является отдельным заболеванием, но каждый из них неоднороден. Такое разделение имеет значение из-за существенных различий с точки зрения прогноза и применяемых терапевтических методов [3]. Основная задача терапии состоит в возможности успешно воздействовать на раковые клетки, используя свойства, приобретаемые ими в результате неконтролируемого роста и пролиферации.
Эндокринная терапия гормон-зависимых опухолей РМЖ
У женщин в пременопаузе свыше 60 % случаев РМЖ представлено гормон-позитивными форма- ми. За последние десятилетия прогресс, достигнутый в эндокринной терапии, кардинально улучшил исход таких опухолей. У женщин в пременопаузе основной источник циркулирующих эстрогенов – это ароматизация экзогенных и эндогенных андрогенов в яичниках, тогда как в постменопаузе – периферическое производство эстрогенов. Ориентация на эстрогеновый путь позволила разработать нескольких успешных вариантов лечения [4]. Эстроген-позитивные опухоли обычно считаются менее чувствительными к химиотерапии по сравнению с другими подтипами РМЖ. Используют три основных класса препаратов: селективные модуляторы рецепторов эстрогена, ингибиторы ароматазы и селективные деструкторы рецепторов эстрогена [5] (рис. 1).
Тамоксифен является селективным модулятором рецепторов эстрогена, который конкурентно ингибирует связывание эстрогена с рецептором и является эффективным в пре- и постменопаузе. Препарат оказывает антиэстрогенное действие на слизистую молочной железы и влагалища за счет частичного ингибирования димеризации эстрогеновых рецепторов. Однако тамоксифен также оказывает и эстрогенное действие на эндометрий (способствуя гиперплазии), систему свертывания (способствуя тромбоэмболическим явлениям), костную ткань (предотвращая остеопороз), липидный обмен (предотвращая гиперлипидемию) и печень (способствуя гепатотоксичности) [6].
Ингибиторы ароматазы (анастрозол, экземестан и летрозол) снижают циркулирующий уровень эстрогена за счет ингибирования превращения андрогенов в эстроген и эффективны только у женщин в постменопаузе (в т.ч. из-за медикаментозного подавления функции яичников или овариэктомии). Анастрозол и летрозол имеют нестероидную природу с обратимым ингибированием ароматазы, тогда как экземестан является стероидом с необратимым ингибированием фермента, требующим выработки новой ароматазы для преодоления ингибирования [6].
Деструкторы эстрогеновых рецепторов – фулве-странт и аналоги. Фулвестрант – высокоспецифический агент, необратимо подавляющий эстрогеновые рецепторы в молочной железе посредством ингибирования и деградации. Он не оказывает систематического агонистического действия на эстроген, поэтому его профиль побочных эффектов кажется более благоприятным по сравнению с ингибиторами ароматазы и тамоксифеном [5]. При связывании с цитоплазматическим рецептором фулвестрант ингибирует транслокацию эстрогенового рецептора в ядро. В ядре фулвестрант блокирует конформационные изменения, необходимые для связывания рецептора эстрогена с коактиваторами, такими как AF1 и AF2, и связывания ДНК. Этот механизм отличается от тамоксифена, где гомодимер рецептор-тамоксифен постоянно связан с AF1Б что и объясняет частичную агонистическую активность
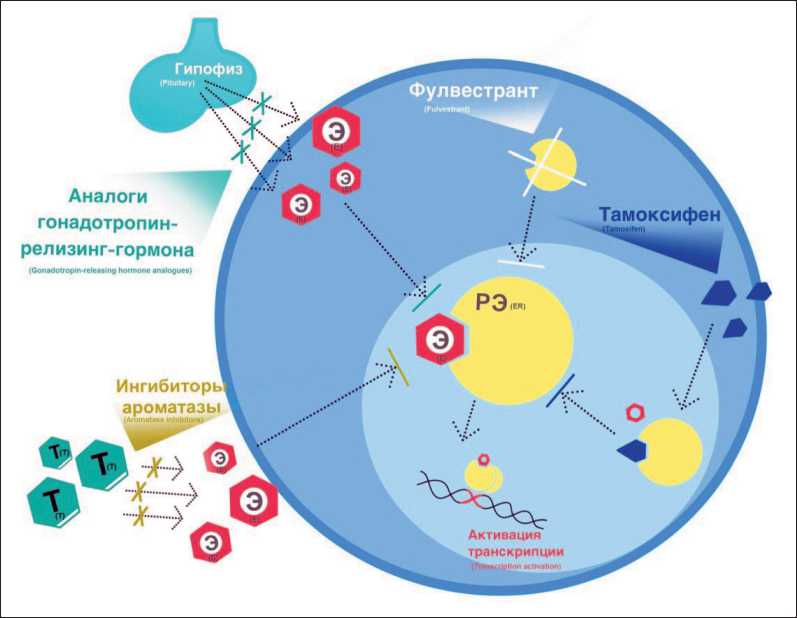
Рис. 1. Механизмы действия антиэстрогеновых препаратов
Fig. 1. Mechanisms of action of antiestrogen drugs
тамоксифена. Комплекс же фулвестрант-рецептор нестабилен, что приводит к ускоренной деградации эстрогенового рецептора [7].
Медикаментозная, лучевая или оперативная кастрация все еще сохраняет свою актуальность в клинической практике. Двусторонняя овариэкто-мия всегда обеспечивает окончательное снижение выработки эстрогена. Аналоги гонадотропин-рилизинг-гормона – гозерелин, трипторелин, лейпрорелин, бусерелин – блокируют секрецию гонадотропинов: фолликулостимулирующего гормона [ФСГ] и лютеинизирующего гормона [ЛГ] и половых стероидов за счет подавления рецепторов гонадотропин-рилизинг-гормона и разъединения механизма передачи сигнала [4]. Постоянное применение агонистов гонадотропин-рилизинг-гормона сначала стимулирует повышение уровня ФСГ и ЛГ («обострение»), а затем вызывает последовательное падение гонадотропинов и половых стероидов до значений, примерно соответствующих уровню хирургической кастрации. В отличие от агонистов, антагонисты гонадотропин-рилизинг-гормона (цетрореликс, ганиреликс, абареликс, дегареликс) не вызывают «обострения». Агонисты и антагонисты оказывают обратимое подавление гипофизарно-гонадной стимуляции, но не влияют на уровень андростендиона, кортизола и пролактина в плазме крови, часто позволяет избежать или снизить физическое и психологическое воздействие хирургической кастрации [4].
За последние 5 лет в терапии прогрессирования эстроген-положительного, HER2-отрицательного рака молочной железы появились и активно используются два новых препарата гормоно-таргетной терапии: ингибитор mTOR – эверолимус и ингибитор CDK4/6 – палбоциклиб [8]. Эвероли-мус был одобрен на основе исследования фазы III BOLERO-2, в котором использовали комбинацию эверолимуса и экземестана у пациенток с прогрессированием на нестероидных ингибиторах ароматазы [9].
Основным механизмом резистентности к эндокринной терапии при гормон-позитивном раке молочной железы является аберрантная передача сигналов через фосфатидилинозитол-3-киназу (PI3K) – Akt – мишень у млекопитающих для сигнального пути рапамицина (mTOR) [10, 11]. Путь PI3K/AKT/mTORC1 аномально активирован примерно в 70 % случаев РМЖ в результате повышенной внеклеточной концентрации факторов роста, активации мутации генов, кодирующих рецепторные тирозинкиназы, онкогены, потери функции или снижения уровней белков-супрессоров опухолей [12]. mTOR является нижестоящим эффектором пути PI3K/AKT и состоит из двух отдельных мультибелковых комплексов: комплекса mTOR 1 и комплекса mTOR 2. Эверолимус, аналог рапамицина, связывает внутриклеточный FK506- связывающий белок 12 кДа (FKBP-12). Комплекс эверолимус–FKBP-12 связывается с комплексом 1 mTOR и ингибирует активность протеинкина-зы mTOR. Поскольку путь PI3K/mTOR является необходимым для роста и выживания клеток, ингибирование комплекса mTOR1 с эверолиму-сом ограничивает рост клеток [13]. В моделях гормон-позитивного рака in vitro ингибиторы PI3K и mTORC1 проявляют синергетическую противораковую активность в комбинации с антиэстрогена-ми – опухолевые клетки накапливаются в G1 фазе клеточного цикла, где подвергаются ингибированию пролиферации и апоптозу [12].
Палбоциклиб (ингибитор CDK4/6) получил одобрение в качестве препарата первой линии для лечения женщин в постменопаузе с эстроген-позитивным HER2-отрицательным метастатическим РМЖ, на основании результатов исследования фазы II PALOMA-1 [14]. Циклинза-висимые киназы-4 и 6 (CDK4/6) играют ключевую роль в пролиферации клеток. Циклины класса D (D1, D2 и D3) являются регуляторами киназ CDK4 и CDK6 и вместе образуют активные комплексы. Сверхэкспрессия циклина D1 (CCND1), который представляет собой транскрипционную мишень рецептора эстрогена, присутствует примерно в половине случаев РМЖ. Он активирует прогрессирование клеточного цикла через переход G1/S путем инактивации белка-супрессора опухоли ретинобластомы (Rb). Эндокринная терапия подавляет активацию этого пути, в то время как селективные ингибиторы CDK4/6 запускают арест клеточного цикла в Rb-(белок ретинобластомы)-компетентных клетках [15].
Таргетная терапия рака молочной железы
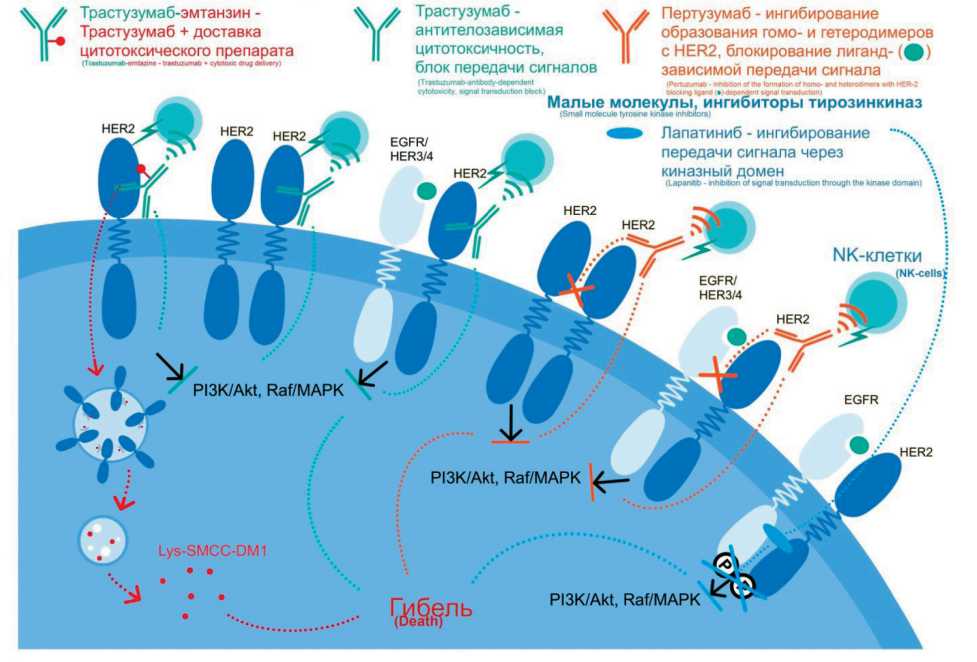
Таргетная терапия РМЖ нацелена на блокирование функции конкретных молекул-мишеней, ответственных за пролиферацию и выживаемость опухолевых клеток. В качестве агентов часто используются гуманизированные антитела, которые естественным образом связываются с мишенью [16]. Сверхэкспрессия рецептора эпидермального фактора роста-2 (белок HER-2, кодируемый геном ErbB-2) наблюдается в 10–12 % случаев и связана с худшей общей выживаемостью, особенно при регионарном метастазировании. На данный момент одобрено 4 препарата для лечения HER-2-положительного рака молочной железы: трастузумаб, лапатиниб, пертузумаб, TDM1 (рис. 2).
Рекомбинантное антитело трастузумаб (Герцептин), нацеленное на HER2, является первым, одобренным еще в 1998 г., препаратом для лечения HER2-положительного РМЖ [17]. Трастузумаб с высоким сродством связывается с внеклеточным доменом HER2. Предполагается, что существует 3 основных механизма действия трастузумаба: ингибирование лиганд-независимой HER-2–HER-3 гетеродимеризации, происходящей в условиях
Антитела: моно- и совместная терапия
Коньюгаты антител и химиопрепаратов
Трастузумаб
Малые молекулы, ингибиторы тирозинкиназ
HER2.
PI3K/Akt, Raf/MAPK
PI3K/Akt, Raf/MAPK
Lys-SMCC-DM1
PI3K/Akt, Raf/MAPK
!ЛЬ
Лапатиниб- ингибирование передачи сигнала через киназный домен цитотоксичность, блок передачи сигналов
Пертузумаб - ингибирование образования гомо- и гетеродимеров с HER2, блокирование лиганд- (ф) зависимой передачи сигнала
NK-клетки ;
(NK-cellsi
-К А Трастузумаб-эмтанзин -Трастузумаб + доставка цитотоксического препарата
Рис. 2. Механизмы действия анти-HER-2 таргетных препаратов
Fig. 2. Mechanisms of action of anti-HER-2 targeted drugs
сверхэкспрессии HER-2; предотвращение протеолитического расщепления внеклеточного домена HER2 и формирования активного фрагмента p95HER2; стимуляция антителозависимой клеточной цитотоксичности по отношению к HER-2-положительным опухолям посредством взаимодействия с Fc-рецепторами на эффекторных иммунных клетках. В результате этих действий происходит подавление сигнальных путей, в которых участвуют фосфатидилинозитол 3-киназа (PI3K)/ протеинкиназа B (Akt) и митоген-активированная протеинкиназа (MAPK), что приводит к увеличению ядерного импорта, стабилизации ингибитор циклинзависимой киназы (CDK) p27, снижению секреции ангиогенных факторов и нарушению реакции на повреждение ДНК [18]. Иммунологический механизм антителозависимой клеточной цитотоксичности считается ключевым фактором эффективности терапии на основе трастузумаба.
При добавлении к стандартной химиотерапии трастузумаб значимо увеличивает выживаемость при метастатическом раке и достоверно снижает риск рецидива. Анти-HER2 терапию в среднем продолжают от полугода до года в адъювантном режиме, а при прогрессировании часто комбинируют с цитостатическими агентами. Непрерывная блокада передачи сигналов HER2 является одним из ключевых элементов улучшения результатов выживаемости при метастатическом HER-позитивном РМЖ [1].
Пертузумаб (Перьета) представляет собой гуманизированное моноклональное антитело, которое имеет механизмы действия, комплементарные механизмам действия трастузумаба, связываясь с другими доменами HER-2. Трастузумаб связывается близко к трансмембранному домену, ингибируя димеризацию HER-2, тогда как пертузумаб связывает димеризующий домен, ингибирующий гетеродимеризацию HER-2 с другими рецепторами семейства HER. Оба антитела вызывают антителозависимую клеточно-опосредованную цитотоксичность. У пациенток с HER2-положительным метастатическим РМЖ пертузумаб при добавлении к трастузумабу и доцетакселу значительно продлевает как выживаемость без прогрессирования, так и общую выживаемость. Двойная блокада HER2 пертузумабом и трастузумабом уже является стандартным подходом в качестве терапии первой линии для пациенток с запущенной HER2-позитивной формой РМЖ [19].
Конъюгаты антитело-лекарственный препарат являются способом доставки цитотоксических препаратов специально для опухолевых клеток. Доставка с последующей интернализацией комплекса приводит к внутриклеточному высвобождению свободных высокоактивных цитотоксических агентов, способствующих в конечном итоге гибели клеток. Компоненты эффективного комплекса антитело-лекарственное средство обычно состоят из гуманизированного или человеческого моноклонального антитела, которое избирательно и специфично доставляет цитотоксический агент к опухолевым клеткам, вызывая рецептор-опосредованный эндоцитоз цитотоксического агента, который убивает клетку; и линкера, связывающего цитотоксический агент с антителом
-
[20]. Трастузумаб-эмтанзин (T-DM1, торговое наименование Кадсила) представляет собой конъюгат, включающий HER2-таргетные противоопухолевые свойства трастузумаба с цитотоксической активностью ингибитора микротрубочек DM1 (производное майтанзина). T-DM1 несет в среднем 3,5 молекулы DM1 на одну молекулу трастузумаба. Каждая молекула DM1 конъюгирована с трастузумабом через невосстанавливаемый тиоэфирный линкер (N-сукцинимидил-4- (N-малеимидометил) циклогексан-1-карбоксилат). После связывания с HER2 комплекс T-DM1 проникает в клетку с помощью рецептор-опосредованного эндоцитоза. Поскольку линкер стабилен в кровообращении и в опухолевом микроокружении, то активное высвобождение DM1 происходит только в результате протеолитической деградации в лизосоме. После высвобождения из лизосомы DM1-содержащие метаболиты ингибируют сборку микротрубочек, остановку в фазе G2-M и апоптотическую гибель клеток [20].
Другой группой соединений против HER-2 являются низкомолекулярные ингибиторы тиро-зинкиназы. В отличие от трастузумаба и перту-зумаба, которые связываются с внеклеточными доменами HER-2, ингибиторы тирозинкиназы конкурируют с АТФ в цитоплазматическом каталитическом киназном домене, тем самым блокируя фосфорилирование тирозина и передачу сигналов ниже связывания лиганда. Кроме того, в отличие от моноклональных антител, ингибиторы тиро-зинкиназы подавляют как конститутивную, так и индуцированную лигандами передачу сигналов ErbB. За последнее десятилетие HER-2 ингибиторы тирозинкиназы продемонстрировали клиническую активность при HER2-положительном раке молочной железы как при запущенном заболевании, так и в условиях неоадъювантной терапии. По сравнению с моноклональными антителами ингибиторы тирозинкиназы HER-2 характеризуются значительно более низкой молекулярной массой, что позволяет им более эффективно проникать через гематоэнцефалический барьер и применять их для лечения метастазов в мозг [21]. Моногидрат дитозилата лапатиниба (Тайверб, Тайкерб) представляет собой производное 4-анилинохиназолина для перорального приема, которое обратимо ингибирует тирозинкиназу HER1, HER2/ErbB2 и EGFR (двойной ингибитор тирозинкиназы). Лапатиниб конкурирует с аденозинтрифосфатом за сайт связывания в тирозинкиназном домене и связывает неактивную форму EGFR, что приводит к низкой скорости диссоциации и к большей продолжительности действия на целевой сайт. Одновременное ингибирование EGFR и HER2 может преодолеть избыточность клеточных сигнальных путей, приводящих к устойчивости, наблюдаемую при ингибировании одиночной тирозинкиназы, при которой происходит усиление регуляции других членов подсемейства HER. Синергическое ингибирование роста раковых клеток с одновременным нацеливанием на EGFR и HER2 приводит к более сильному ингибированию роста клеток по сравнению с нацеливанием только на EGFR или HER2 [22].
Кровеносные сосуды имеют важное значение для поддержки роста опухоли сверх размера, допускаемого только диффузией кислорода для обеспечения питательными веществами, кислородом и удаления продуктов метаболизма. Васкуляризации способствует ангиогенез, то есть образование новых кровеносных сосудов за счет прорастания существующих. Среди секретируемых опухолью проангиогенных факторов сосудистые эндотелиальные факторы роста (VEGF), в частности VEGF-A, идентифицированы как ключевые факторы, вызывающие ангиогенез опухоли. VEGF активируют передачу сигналов VEGF в эндотелиальных клетках путем связывания с рецепторными тирозинкиназами VEGF (VEGFR1-3) [23]. Принимая во внимание его роль в обеспечении иммунной толерантности к раку, нацеливание на VEGF/ VEGFR было признано подходом к усилению противоопухолевого иммунитета у больных раком, особенно в комбинации с иммунотерапией рака, в результате чего был представлен препарат беваци-зумаб (Hoffmann La-Roche AG, Швейцария) в виде гуманизированного моноклонального антитела, которое связывается со всеми циркулирующими растворимыми изоформами VEGF-A и предотвращает взаимодействие VEGF-A с VEGFR и, таким образом, ингибирует активацию сигнальных путей VEGF, которые способствуют неоваскуляризации. Повышая общую выживаемость и/или выживаемость без прогрессирования для пациентов, у которых не было других вариантов лечения помимо химиотерапии, бевацизумаб дополнил комбинации схем лечения и стал одной из стандартных опций лечения запущенных форм рака. Вместо прямого воздействия на раковые клетки бевацизумаб нацелен на опухолевое микроокружение, характеризующееся сложными взаимодействиями между опухолевыми клетками, нормальными клетками и внеклеточным матриксом [24].
Другой эффективный подход к таргетной терапии основан на концепции синтетического летального исхода между несколькими генами, потеря одного из которых по отдельности не влияет на жизнеспособность клеток, в то время как их совокупная потеря индуцирует летальный фенотип. Сила синтетической летальности в терапии рака отражается в чувствительности BRCA1/2-положительных мутантных опухолей к ингибиторам PARP (поли (АДФ-рибоза) полимераза). Поскольку BRCA1/2 участвуют в репарации двухцепочечных разрывов ДНК гомологичными рекомбинациями, то их инактивация приводит к нарушению гомологичной рекомбинации и увеличивает потребность в альтернативных механизмах репарации повреждений ДНК, таких как негомологичное соединение концов и базовая эксцизионная репарация (BER), для которых требуется PARP1, следовательно, ингибирование PARP1 в этих клетках вызывает гибель. Повышенная активность PARP также является одним из механизмов, с помощью которого опухолевые клетки избегают апоптоза, вызванного химиотерапевтическими агентами, повреждающими ДНК [25]. Предполагается, что 15 % пациенток с тройным негативным РМЖ имеют значимую, гетерозиготную BRCA1-мутацию. В настоящее время ингибиторы PARP одобрены для лечения рака яичников и рака молочной железы с мутациями в системе гена BRCA. Олапариб применяется в терапии тройных негативных, платиночувствительных форм РМЖ с мутациями BRCA [26, 27].
Залогом успешной терапии РМЖ является ранняя и полная диагностика. Основное препятствие оказывает стоимость новых методов исследований, но не менее значимы чувствительность и адекватная интерпретация полученных результатов. Большой потенциал молекулярных инструментов для улучшения исходов РМЖ на основе ранней диагностики стимулировал поиск диагностических биомаркеров, таких как различные белки, аутоантитела к опухоль-ассоциированным антигенам, циркулирующие опухолевые клетки, микроРНК, циркулирующая опухолевая ДНК и экзосомы. Идентификация и техническая возможность использования в клинике новых опухолевых маркеров, способных вызывать иммунный ответ на ранних стадиях развития опухоли, обеспечивают эффективный подход не только к ранней диагностике РМЖ, но и к развитию иммунотерапевтических методов.
Иммунотерапевтические подходы в лечении рака молочной железы
По сравнению с меланомой РМЖ не считается высокоиммуногенной опухолью, но использование иммунных механизмов успешно тестируется в клинических исследованиях. Иммунотерапия рака подразделяется на три основных формы: модуляция иммунных контрольных точек, адаптивный перенос иммунных клеток для уничтожения опухолевых клеток активными иммунными клетками и использование терапевтических вакцин для иммунного ответа против опухоль-ассоциированных или опухолеспецифических антигенов [28].
Применение ингибиторов контрольных точек
В нормальных физиологических условиях в иммунной системе существуют подавляющие специфический ответ пути, способствующие защите нормальных клеток. Опухолевые клоны используют эти же пути для ухода от иммунного надзора [29]. В контексте клинической имму- нотерапии рака наиболее изучены 2 рецептора иммунных контрольных точек – цитотоксический Т-лимфоцит-ассоциированный антиген 4 (CTLA-4) и белок запрограммированной клеточной смерти 1 (PD-1). Данные препараты также способствуют подавлению иммуносупрессии, что позволяет иммунной системе эффективно бороться с опухолевым процессом.
CTLA-4 экспрессируется на Т-клетках, где он регулирует амплитуду ранних стадий активации Т-клеток путем подавления активности эффекторных Т-клеток и усиления иммуносупрессивных Т-регуляторных клеток. PD-1 также экспрессируется на Т-клетках, и сигналы через путь PD-1 ограничивают активацию Т-клеток и ответы эффекторных Т-клеток и иммунные ответы в микроокружении опухоли. PD-L1 является наиболее охарактеризованным из двух известных лигандов PD-1, который экспрессируется опухолевыми клетками, Т- и В-клетками, макрофагами и дендритными клетками.
Ингибиторы модулируют взаимодействие между опухолевыми клетками и цитотоксическими Т-лимфоцитами, функции которых истощены. Нацеливание на CTLA-4 или PD-1/PD-L1 обращает вспять истощение цитотоксических Т-лимфоцитов, приводящее к элиминации опухолевых клеток за счет повторной индукции «естественной» функции популяции Т-клеток. Нацеливание на PD-L1 может приводить к иным биологическим эффектам, чем на PD-1. Помимо связывания PD-1, PD-L1 передает отрицательные сигналы на Т-клетки посредством взаимодействия с молекулами семейства B7. Антитела к PD-L1 предотвращают это взаимодействие. Кроме того, антитела к PD-L1 не препятствуют взаимодействию PD-1 с PD-L2 [30].
Ингибирование иммунных контрольных точек CTLA-4 и PD-1/PD-L1 дополнили схемы лечения многих видов рака [31]. Клиническое одобрение получили 6 ингибиторов контрольных точек: Nivolumab, Pembrolizumab, Atezolizumab, Avelumab, Durvalumab для блокады PD-1/PD-L1 и Ipilimumab для блокады CTLA-4 [31]. Ингибиторы иммунных контрольных точек (ICI) рассматриваются как перспективные препараты для лечения тройного негативного РМЖ как опухоли с высокой мутационной нагрузкой [32].
Адоптивная клеточная терапия
Адоптивная клеточная терапия направлена на введение аутологичных или даже аллогенных иммунных эффекторов (в основном Т-лимфоцитов) с активированной естественной или искусственно созданной противоопухолевой активностью с целью подавления роста опухоли за счет антиген-специфических иммунных клеток Основными направлениями для адоптивного переноса клеток являются использование опухоль-инфильтрирующих лимфоцитов, генетически мо-
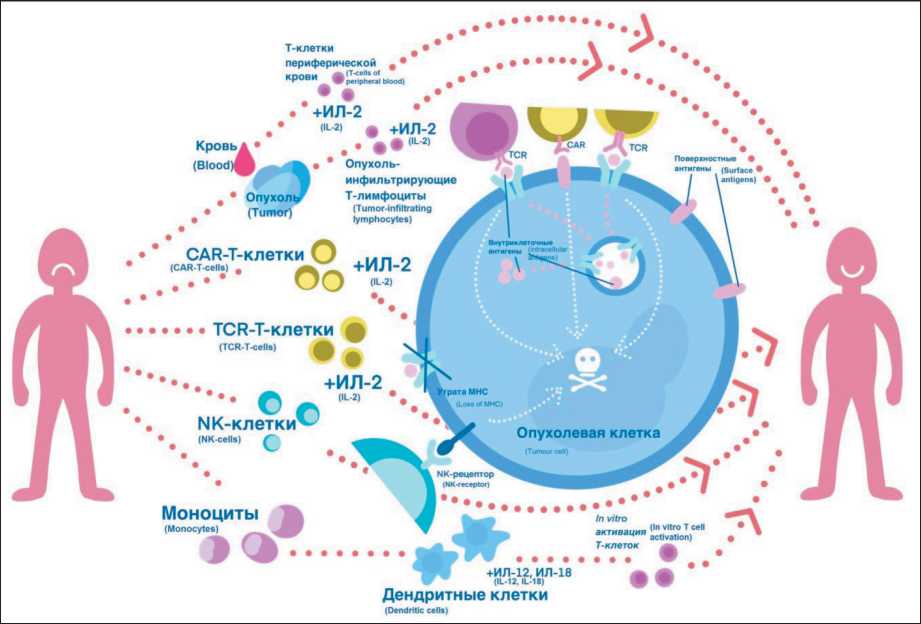
Рис. 3. Основные направления адоптивной клеточной терапии
Fig. 3. The main directions of adoptive cell therapy
дифицированных T-клеток (TCR и CAR T-клетки), а также терапия с использованием дендритных клеток и натуральных киллеров [33] (рис. 3).
Адоптивный перенос лимфоцитов для лечения РМЖ предпринимался неоднократно. Такая терапия требует выделения Т-клеток из свежих биоптатов пациентов и постепенного отбора опухолеспецифических Т-клеток ex vivo с использованием высоких уровней IL-2 и различных подходов к культивированию клеток [34]. Трансплантация аллогенных стволовых клеток в дополнение к высокодозной химиотерапии приводила к успешным долгосрочным результатам, но вызывала серьезные опасения по поводу безопасности, тогда как терапия аутологичными циркулирующими лимфоцитами, кондиционированными in vitro , показала меньшую эффективность, но и не вызывала столько опасений [35, 36].
Адоптивный перенос аутологичных опухоль-инфильтрирующих лимфоцитов был впервые описан как метод лечения, разработанный Розенбергом и соавт. еще в 1987 г., но существенные объективные отклики наблюдались лишь у пациентов с опухолями с высокой частотой мутаций, такими как меланома, рак легких или мочевого пузыря. Однако, за некоторыми исключениями, инфузия невыделенных гетерогенных опухоль-инфильтрирующих лимфоцитов оказывается менее эффективной при эпителиальных опухолях. Для увеличения эффективности распознавания и уничтожения опухоли такая терапия требует идентификации клеток путем секвенирования всего экзома и секвенирования РНК для выделе- ния несинонимичных соматических мутаций. На ClinicalTrials.gov зарегистрировано четыре клинических исследования, и только два из них включают предварительное кондиционирование с режимами немиелоаблативной химиотерапии [33].
Стратегии на основе переноса генов были разработаны для преодоления основных проблем терапии опухоль-инфильтрирующими лимфоцитами, включая низкий выход экспансии лимфоцитов, низкое сродство человеческих TCR к опухоль-ассоциированным антигенам и иммунную толерантность, вызванную подавлением MHC молекул. Перенос как TCR, так и химерного антигена (CAR) наделяет поликлональные Т-клетки реактивностью, которая не присутствует в природе против выбранных ОАА и таким образом предоставляет очень тонкий инструмент для персонализированной терапии [33].
Первым шагом к разработке эффективных CAR-терапевтических средств является выбор подходящих антигенов клеточной поверхности. Идеальными мишенями для создания CAR-терапии являются опухолеспецифические антигены, характеризующиеся стабильной экспрессией, высоким охватом и высокой специфичностью [37]. Однако опухолеспецифические антигены ограничены, а опухоль-ассоциированные антигены, которые представляют собой цели для химерного рецептора, также экспрессируются и в здоровых тканях. Т-клетки, нацеленные на эти химерные антигены, могут вызывать и распознавание «вне опухоли», называемое токсичностью «на мишени, вне опухоли», и вызвать тяжелое повреждение органа. Другой тип мишеней представлен антигенами, высоко экспрессируемыми в сосудистой сети опухоли или связанными с опухолью фибробластами, образующими поддерживающую нишу для опухолевых клеток, но не экспрессируемых на клетках опухоли. Нацеливание на них с помощью CAR Т-клеток может нарушить туморогенез путем ингибирования ангиогенеза или образования стромы [38].
CAR Т-клетки первого поколения содержат CAR, состоящий из CD3z-цепи Т-клеточного рецептора, которая способствует внутриклеточной сигнализации, CAR второго и третьего поколения включают один или два внутриклеточных кости-мулирующих домена, соответственно, для усиления эффекторной функции Т-клеток. Включение костимулирующих доменов CD27, CD28, 4–1BB, OX40 и/или ICOS в конструкции CAR увеличивает экспансию и персистирование Т-клеток. Введение конструкций CAR в аутологичные или аллогенные Т-клетки может быть проведено с помощью вирусных векторов (лентивирус, ретровирус, аденовирус), невирусных векторов (синтетическая ДНК, транспозоны мРНК, CRISPR-Cas9) или плазмид. CAR функционируют, перенаправляя Т-клетки к специфическим антигенам на поверхности опухолевых клеток и предоставляя критические сигналы для активации Т-клеток и цитолитической противоопухолевой активности. Распознавание целевого антигена CAR не зависит от MHC, что особенно выгодно при раке, когда опухолевые клетки часто подавляют экспрессию MHC как механизм устойчивости к иммунотерапии [39].
Количество и качество исследований иммунотерапии тройного негативного РМЖ как одной из агрессивных форм, практически не имеющих возможностей для таргетной терапии в клеточном пространстве CAR-T, экспоненциально увеличилось за последние годы [40]. Хотя многие антигенные мишени для CAR-T-клеток являются белками с высоким уровнем экспрессии на поверхности опухолевых клеток, антигены-мишени для CAR-T клеток также могут включать посттрансляционные модификации, такие как паттерны аберрантного гликозилирования или изменения белков клеточной поверхности [39]. Проводится несколько клинических исследований CAR-T-клеток: ROR1 + CAR-T-клетки (NCT02706392), анти-MUC1 CAR-T-клетки (NCT04020575, NCT02587689) и NKG2D CAR-T клетки (NCT04107142). Более чем 95 % клеток при тройном негативном раке сверх-экспрессируют аномально гликозилированную опухолевую форму MUC1 (tMUC1), которая отсутствует в нормальном эпителии. Действительно, tMUC1-CAR-T-клетки второго поколения недавно продемонстрировали сильную цитолитическую активность против опухоли, продукцию цитокинов Th1 и хемокинов in vitro , подавление роста опухолевых клеток на мышиной модели ксенотрансплантата. Другая аберрантная гликоформа
MUC1 (TnMUC1) также обильно экспрессируется при тройном негативном РМЖ. Клинические испытания для оценки CAR-T-клеток, нацеленных на эти гликоформы, продолжаются (NCT04020575 и NCT04025216) [41, 42].
CAR T-клетки, направленные на мезотелин, с нокаутом по PD-1, показали превосходную эффекторную функцию в ортотопической модели тройного негативного рака на мышах с ксенотрансплантатом из-за подавления этого ингибирующего рецептора [43]. Эта работа демонстрирует возможность использования блокады иммунных контрольных точек в комбинации с терапией мезотелин-CAR-Т-клетками для лечения тройного негативного РМЖ. Клинические испытания мезотелин-CAR-T-клеток продолжаются у пациентов с HER2-отрицательным раком молочной железы, включая тройной негативный рак (NCT02792114, NCT02580747).
Сверхэкспрессия рецепторной тирозинкиназы c-Met встречается более чем у 50 % пациенток с тройным негативным РМЖ и коррелирует с плохим прогнозом. Хотя низкий уровень экспрессии c-Met наблюдается в нормальных эпителиальных тканях, таких как гепатоциты, c-Met считается многообещающей мишенью для терапии CAR-Т-клетками. Чтобы избежать потенциальной токсичности «на мишени вне опухоли» из-за экспрессии c-Met на здоровой ткани, использовалась электропорация мРНК для индукции временной экспрессии c-Met-CAR в аутологичных Т-клетках. По сравнению со стабильно трансдуцированными CAR-T-клетками терапия CAR-T-клетками на основе мРНК обеспечивает более безопасный подход из-за временной экспрессии и ограниченной персистенции клеток. Показано, что клетки c-Met-CAR-T сохранялись в течение 4 дней, что было достаточно для цитолитической активности против мишени, а затем исчезали к 7-му дню после электропорации мРНК, что и ограничивало токсичность вне мишени. Безопасность внутриопухолевых инъекций мРНК c-Met-CAR-T клеток у пациенток с тройным негативным РМЖ наблюдалась в клинических условиях (NCT01837602) [44].
В то время как CAR нацелены на поверхностные опухолевые антигены с помощью антителоподобного фрагмента, TCR-T-клетки могут распознавать внутриклеточные антигены в контексте MHC, поэтому TCR-T-клеточная терапия имеет более широкий круг целей. Существует два типа антигенов, на которые нацелены TCR-Т-клетки: антигены, которые возникают в результате мутаций, которые отличаются от антигенов дикого типа (которые не распознаются иммунной системой через механизмы самотолерантности), известные как неоантигены, и те, что являются результатом сверхэкспрессии или аберрантно экспрессируемые гены, известных как опухоль-ассоциированные антигены (ТАА) [45]. TCR используют гетеродимеры, состоящие из альфа- и бета-пептидных цепей для распознавания полипептидных фрагментов, представленных молекулами MHC. Основная цель технологии TCR-T-клеток – непосредственно модифицировать связывание TCR с опухолевыми антигенами. Сродство человеческих TCR к этим антигенам относительно низкое, что делает невозможным эффективно распознавать и уничтожать опухоль. Искусственно созданный высокоаффинный TCR кодируется в Т-клетках с помощью генно-инженерной технологии, которая улучшает как распознавание специфичности, так и сродство при распознавании опухолевых клеток Т-клетками. Большинство мишеней для терапии TCR-T-клетками ограничено классом MHC. Кроме того, существует риск гибридизации между экзогенными и эндогенными цепями, которые могут вызывать опасное распознавание аутоантигенов, приводящее к реакции «трансплантат против хозяина». Повышенное сродство TCR создает риск ложного таргетинга, поэтому терапию TCR-T-клетками следует применять осторожно. В связи с относительной физиологической изолированностью и уникальным иммуносупрессивным микроокружением иммунотерапия менее эффективна для солидных опухолей, чем для гематологических [46]. Накопление клинических данных по нескольким типам опухолей наряду с доклиническими данными по РМЖ подчеркивают обоснованность использования TCR-Т-клеток для пациенток с РМЖ. Показано заметное усиление противоопухолевой цитотоксичности CD8+ Т-клетками, трансдуцированными комплексом MHC-A2-рестриктированными плацентоспецифическим 1 (PLAC1) и TCR для ксенотрансплантатов как гормонозависимых, так и независимых клеточных линий РМЖ. Однако клинические результаты использования Т-клеток, созданных с помощью TCR против опухоль-ассоциированных антигенов, таких как HER2, NYESO-1 и MAGE-A3, еще находятся в процессе тестирования (NCT03159585, NCT02457650, NCT02111850 NCT01967823).
Дендритные клетки (ДК) – профессиональные антиген-представляющие клетки, которые обладают высокой способностью захватывать, презентировать и представлять антигены Т-лимфоцитам и играют критическую роль в защитном иммунитете. ДК экспрессируют молекулы HLA класса I и класса II, ко-стимулирующие молекулы, такие как CD80 и CD86, продуцируют цитокины, которые необходимы для активации Т-клеток. Стратегия адоптивного переноса на основе ДК включает нагрузку опухолевыми антигенами ex vivo с последующим переносом пациенту [47]. Дендритные клетки хорошо подходят для иммунотерапии РМЖ благодаря способности сенсибилизировать CD8+ и CD4+ Т-клетки, генерировать Т-клетки памяти и усиливать противоопухолевую цитотоксичность [48].
Аутологичные ДК могут быть слиты с опухолевыми клетками, нагружены лизатами опухолей или опухоль-ассоциированными антигенами для активации Т-клеток против опухолей, поэтому возможно использовать один конкретный неоантиген или весь репертуар опухолевых антигенов, включая те, которые еще предстоит определить. ДК могут быть получены в больших количествах из предшественников костного мозга или из моноцитов периферической крови. Другие многообещающие подходы заключаются в добавлении цитокиновых адъювантов, таких как IL-2, или цитокин-индуцированных клеток-киллеров [33]. Исследована эффективность терапии, включающей дендритные клетки, нагруженные лизатом опухолевой ткани в качестве антигена, и активированные лимфоциты in vitro с повышенной цитотоксической активностью после поляризации Th1 с использованием IL-12 и IL-18 у пациенток с РМЖ IV стадии в рамках адъювантной или неоадъювантной терапии [49]. Было показано, что клеточная иммунотерапия РМЖ безопасна, снижает риск рецидива и метастазирования, а также способствует противоопухолевому иммунитету и снижает количество регуляторных Т-клеток. На данный момент зарегистрировано более 20 клинических исследований, направленных на тестирование терапии с использованием ДК у больных РМЖ на всех стадиях патологии с использованием различных опухоль-ассоциированных антигенов. Роль ДК как стимуляторов Т-клеточного ответа и долгосрочной иммунологической памяти, а также их безопасность и простота изготовления способствуют развитию метода как для самостоятельного лечения, так и в комбинации с другими видами терапии.
Врожденная способность устранять раковые клетки в MHC-независимой и не ограниченной по опухолевым антигенам манере характерна для NK-клеток. «Утрата своего», опосредованная подавлением молекул MHC, как механизм избегания опухолью иммунного ответа препятствует распознаванию раковых клеток CD8+ Т-клетками, но стимулирует активность NK-клеток, которая регулируется взаимодействием активирующих и ингибирующих рецепторов, таких как KIR и группа естественных киллеров 2D (NKG2D) [33]. Активированные NK-клетки могут производиться в больших количествах, например, ex vivo из первичных NK-клеток, гемопоэтических стволовых клеток и клеточных линий, одна из которых, NK-92, одобрена FDA США для использования в клинических испытаниях. Адоптивный перенос аутологичных NK-клеток, размноженных ex vivo для лечения пациентов с лимфомой, раком толстой кишки, РМЖ и раком легких, был протестирован в ряде клинических испытаний, но наблюдался только очень ограниченный противоопухолевый эффект, связанный с тем, что ингибирующие рецепторы на аутологичных NK-клетках соответствовали собственному классу MHC I, представленных на опухолевых клетках, и это распознавание «своих»
сигналов впоследствии ингибировало активацию NK-клеток. Кроме того, аутологичные NK-клетки, полученные от больных раком, находились в иммуносупрессивном состоянии с нарушением функций, что снижало противоопухолевую активность этих клеток [50]. Описан частичный ответ у пациентки с прогрессирующим метастатическим поражением HER2+ РМЖ, которая прошла лечение NK-клетками, обработанными трастузумабом. Применение аллогенных NK у пациенток с РМЖ опубликовано только в одном исследовании фазы II, где показана стабилизация заболевания через 4–6 нед после инфузии и после предварительного кондиционирования с лимфодеплецией, химиотерапией и облучением всего тела [33].
Генетическая модификация иммунных клеток химерными антигенными рецепторами (CAR) для непосредственного нацеливания на опухолевые клетки возможна и для NK-клеток. По сравнению с CAR-T-клетками, CAR-NK-клетки теоретически менее эффективны из-за отсутствия клональной экспансии, относительно короткой продолжительности жизни и меньшего количества цитотоксических цитокинов, но для них минимизирован риск синдрома цитокинового шторма и синдрома лизиса опухоли, что повышает общую безопасность лечения, а учитывая возможность получения NK-клеток из различных источников, ожидается, что CAR-NK терапия будет намного доступнее [51]. Недавно был описан тканевой фактор (TF) как новая и распространенная, но селективная молекула для тройного негативного рака. Использование TF-CAR NK-клеток привело к увеличению цитотоксичности в отношении клеточных линий тройного негативного рака и было эффективно и безопасно для лечения рака на ортотопической модели мышей [52].
Терапевтические вакцины против опухолевых антигенов
Многообещающие результаты дает развитие технологий получения терапевтических вакцин в терапии РМЖ. Этот иммунотерапевтический подход использует высокую специфичность адаптивного иммунного ответа и иммунологической памяти. Клинический потенциал вакцин против РМЖ заключается в ее способности уничтожить опухолевые клетки с минимальной токсичностью. Противораковые вакцины создавались из различных иммуногенных источников, представленных целыми лизатами опухоли, антигенными пептидами опухоли, ДНК, РНК и вирусами. Они могут сочетаться с иммуноадъювантами, которые способствуют иммунной стимуляции. Обнадеживающие результаты получены при использовании самых доступных вакцин против РМЖ: NeuVax, AVX901 и INO-1400 [53].
NeuVax – наиболее изученная вакцина для лечения HER2-позитивного рака. В ее состав входит иммуногенный MHC I-рестриктированный эпитоп HER2 E75 (нелипепимут-S) в сочетании с иммуно-адъювантным колониестимулирующим фактором гранулоцитов и макрофагов (GM-CSF). NeuVax стимулирует и активирует CD8+ цитотоксические и CD8+ клетки памяти против E75. В исследовании фазы I для оптимизации дозы и способа введения у пациенток с метастатическим РМЖ и разной степенью экспрессии HER2 было показано, что введение E75 плюс GM-CSF достаточно безопасно и стимулирует эффективное размножение E75-специфических цитотоксических лимфоцитов. NeuVax – единственная вакцина против РМЖ, которая прошла клиническое испытание фазы III (PRESENT, ClinicalTrials. gov: NCT01479244). Помимо PRESENT, биофарма-цевтическая компания Galena Biopharma провела два других исследования с NeuVax в комбинации с трастузумабом (ClinicalTrials.gov: NCT01570036) и у пациентов высокого риска (ClinicalTrials.gov: NCT02297698) [54].
Исследовательская антиген-специфическая противораковая вакцина против РМЖ AVX901 представлена вирусоподобной частицей реплико-на (VRP) -HER2. Он разработан из ослабленного штамма вируса венесуэльского конского энцефалита и демонстрирует потенциальную антинеопластиче-скую активность. В этой векторной вакцине гены, кодирующие структурные белки вируса, заменены внеклеточным доменом и участками трансмембранного домена гена HER2, создавая дефектную для размножения самореплицирующуюся РНК (репли-кон), высокоэкспрессирующую HER2. В нескольких доклинических исследованиях оценивалась способность вакцин VRP-HER2 активировать клеточные и гуморальные иммунные ответы против HER-2, что приводило к снижению роста опухоли в ортотопических ксенотрансплантатах на моделях мышей и на человеческих HER2-трансгенных мышах. После иммунизации AVX901 репликон эксспрессирует большое количество белка HER-2, направляя активированные CD8+ цитотоксические и клетки памяти против HER-2-экспрессирующих раковых клеток. Кроме того, AVX901 блокирует передачу сигналов HER-2 дикого типа, тем самым ограничивая поддержание роста опухоли. В клиническом исследовании фазы I (NCT01526473) AVX90 протестирован на 22 пациентках со сверхэкспрессией HER2 при прогрессирующем или метастатическом РМЖ, отдельно или в сочетании с другими таргетными анти-HER2-препаратами. В первых клинических данных не сообщается о дозозависимой токсичности, подтверждая безопасность VRP-HER2, но дальнейшие испытания будут выполняться для контроля скорости ответа опухоли [53].
Фермент теломераза гиперэкспрессируется более чем в 85 % случаев рака у человека, включая РМЖ, и его аберрантное выражение связано с долгосрочной выживаемостью и неограниченным размножением злокачественных клеток. Синтети- ческая ДНК-вакцина hTERT INO-1400 появилась как новый подход к антиген-специфической иммунотерапии при РМЖ. Он состоит из плазмиды, кодирующей каталитическую субъединицу теломеразы, с двумя иммуногенными мутациями, вызывая широкий цитотоксический ответ против опухолевых клеток. Показан эффективный противоопухолевый иммунитет, вызванный ДНК-вакциной hTERT у мышей и обезьян в доклинической модели. В частности, его введение мышам вызвало сильный клеточный иммунный ответ с увеличенным количества клеток, продуцирующих CD107a, IFN-γ и TNF-α, а у обезьян значительно замедлился рост опухоли и увеличилась общая выживаемость. В продолжающемся клиническом исследовании фазы I (NCT02960594) INO-1400 вводился подкожно самостоятельно или в сочетании с активатором IL-12 (INO-9012) у больных раком молочной железы, поджелудочной железы или легких с высоким риском рецидива после операции и адъювантной терапии [53]. Вакцина на основе пептида hTERT показала после вакцинации увеличение с 4 до 13 % CD8+ цитотоксических опухоль-инфильтрирующих лимфоцитов, специфичных против пептида hTERT, которые отсутствовали до вакцинации. В этом исследовании также показаны повышенная продукция IFN-γ после вакцинациии и увеличение средней общей выживаемости [55].
Таким образом, современное развитие медицинских, биологических и фармацевтических наук
Список литературы Современная терапия рака молочной железы: от тамоксифена до Т-клеточной инженерии
- Emens L.A. Breast Cancer Immunotherapy: Facts and Hopes. Clin Cancer Res. 2018; 24(3): 511-20. https://doi.org/10.1158/1078-0432.CCR-16-3001.
- Tashireva L.A., Gerashchenko T.S., Denisov E.V., Savel'eva O.E., Buzenkova A.V., Zav'yalova M.V., Cherdyntseva N.V., Perel'muter V.M. Kharakteristika sposobnosti opukholevykh kletok razlichnykh morfologicheskikh struktur invazivnoi kartsinomy molochnoi zhelezy modulirovat' immuno-vospalitel'nye reaktsii. Voprosy onkologii. 2020; 66(3): 270-6. https://doi.org/10.37469/0507-3758-2020-66-3-270-276.
- Gu G., Dustin D., Fuqua S.A. Targeted therapy for breast cancer and molecular mechanisms of resistance to treatment. Curr Opin Pharmacol. 2016; 31: 97-103. https://doi.org/10.1016/j.coph.2016.11.005.
- Rossi L., Pagani O. The Role of Gonadotropin-Releasing-Hormone Analogues in the Treatment of Breast Cancer. J Womens Health (Larchmt). 2018; 27(4): 466-75. https://doi.org/10.1089/jwh.2017.6355.
- Blackburn S.A., Parks R.M., Cheung K.L. Fulvestrant for the treatment of advanced breast cancer. Expert Rev Anticancer Ther. 2018; 18(7): 619-28. https://doi.org/10.1080/14737140.2018.1473038.
- Reinbolt R.E., Mangini N., Hill J.L., Levine L.B., Dempsey J.L., Singaravelu J., Koehler K.A., Talley A., Lustberg M.B. Endocrine therapy in breast cancer: the neoadjuvant, adjuvant, and metastatic approach. Semin Oncol Nurs. 2015; 31(2): 146-55. https://doi.org/10.1016/j.soncn.2015.02.002.
- Soleja M., Raj G.V., Unni N. An evaluation of fulvestrant for the treatment of metastatic breast cancer. Expert Opin Pharmacother. 2019; 20(15): 1819-29. https://doi.org/10.1080/14656566.2019.1651293.
- Gradishar W.J., Anderson B.O., Balassanian R., Blair S.L., Burstein H.J., Cyr A., Elias A.D., Farrar W.B., Forero A., Giordano S.H., Goetz M., Goldstein L.J., Hudis C.A., Isakoff S.J., Marcom P.K., Mayer I.A., McCormick B., Moran M., Patel S.A., Pierce L.J., Reed E.C., Salerno K.E., Schwartzberg L.S., Smith K.L., Smith M.L., Soliman H., Somlo G., Telli M., Ward J.H., Shead D.A., Kumar R. NCCN Guidelines Insights Breast Cancer, Version 1.2016. J Natl Compr Canc Netw. 2015; 13(12): 1475-85. https://doi.org/10.6004/jnccn.2015.0176.
- Yardley D.A., Noguchi S., Pritchard K.I., Burris H.A., Baselga J., Gnant M., Hortobagyi G.N., Campone M., Pistilli B., Piccart M., Melichar B., Petrakova K., Arena F.P., Erdkamp F., Harb W.A., Feng W., Cahana A., Taran T., Lebwohl D., Rugo H.S. Everolimus plus exemestane in postmenopausal patients with HR(+) breast cancer: BOLERO-2 final progression-free survival analysis. Adv Ther. 2013; 30(10): 870-84. https://doi.org/10.1007/s12325-013-0060-1. Erratum in: Adv Ther. 2014; 31(9): 1008-9.
- Baselga J., Campone M., Piccart M., Burris H.A., Rugo H.S., Sahmoud T., Noguchi S., Gnant M., Pritchard K.I., Lebrun F., Beck J.T., Ito Y., Yardley D., Deleu I., Perez A., Bachelot T., Vittori L., Xu Z., Mukhopadhyay P., Lebwohl D., Hortobagyi G.N. Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med. 2012; 366(6): 520-9. https://doi.org/10.1056/NEJMoa1109653.
- Dronova T.A., Babyshkina N.N., Matvienko N.V., Slonimskaya E.M., Cherdyntseva N.V. PI3K/AKT/MTOR: vklad v formirovanie fenotipa opukholi, chuvstvitel'nogo k tamoksifenu. Rossiiskii bioterapevticheskii zhurnal. 2021; 20(1): 16-23. https://doi.org/10.17650/1726-9784-2021-20-1-16-23.
- Vernieri C., Corti F., Nichetti F., Ligorio F., Manglaviti S., Zattarin E., Rea C.G., Capri G., Bianchi G.V., de Braud F. Everolimus versus alpelisib in advanced hormone receptor-positive HER2-negative breast cancer: targeting different nodes of the PI3K/AKT/mTORC1 pathway with different clinical implications. Breast Cancer Res. 2020; 22(1): 33. https://doi.org/10.1186/s13058-020-01271-0.
- O’Shaughnessy J., Thaddeus Beck J., Royce M. Everolimus-based combination therapies for HR+, HER2- metastatic breast cancer. Cancer Treat Rev. 2018; 69: 204-14. https://doi.org/10.1016/j.ctrv.2018.07.013.
- Finn R.S., Crown J.P., Lang I., Boer K., Bondarenko I.M., Kulyk S.O., Ettl J., Patel R., Pinter T., Schmidt M., Shparyk Y., Thummala A.R., Voytko N.L., Fowst C., Huang X., Kim S.T., Randolph S., Slamon D.J. The cyclin-dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first-line treatment of oestrogen receptor-positive, HER2-negative, advanced breast cancer (PALOMA-1/TRIO-18): a randomised phase 2 study. Lancet Oncol. 2015; 16(1): 25-35. https://doi.org/10.1016/S1470-2045(14)71159-3.
- Kwapisz D. Cyclin-dependent kinase 4/6 inhibitors in breast cancer: palbociclib, ribociclib, and abemaciclib. Breast Cancer Res Treat. 2017; 166(1): 41-54. https://doi.org/10.1007/s10549-017-4385-3.
- Masoud V., Pagès G. Targeted therapies in breast cancer: New challenges to fight against resistance. World J Clin Oncol. 2017; 8(2): 120-34. https://doi.org/10.5306/wjco.v8.i2.120.
- Slamon D.J., Leyland-Jones B., Shak S., Fuchs H., Paton V., Bajamonde A., Fleming T., Eiermann W., Wolter J., Pegram M., Baselga J., Norton L. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med. 2001; 344(11): 783-92. https://doi.org/10.1056/NEJM200103153441101.
- De P., Hasmann M., Leyland-Jones B. Molecular determinants of trastuzumab efficacy: What is their clinical relevance? Cancer Treat Rev. 2013; 39(8): 925-34. https://doi.org/10.1016/j.ctrv.2013.02.006.
- von Minckwitz G., Procter M., de Azambuja E., Zardavas D., Benyunes M., Viale G., Suter T., Arahmani A., Rouchet N., Clark E., Knott A., Lang I., Levy C., Yardley D.A., Bines J., Gelber R.D., Piccart M., Baselga J.; APHINITY Steering Committee and Investigators. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. N Engl J Med. 2017; 377(2): 122-131. https://doi.org/10.1056/NEJMoa1703643. Erratum in: N Engl J Med. 2017; 377(7): 702. Erratum in: N Engl J Med. 2018; 379(16): 1585.
- Barok M., Joensuu H., Isola J. Trastuzumab emtansine: mechanisms of action and drug resistance. Breast Cancer Res. 2014; 16(2): 209. https://doi.org/10.1186/bcr3621.
- Duchnowska R., Loibl S., Jassem J. Tyrosine kinase inhibitors for brain metastases in HER2-positive breast cancer. Cancer Treat Rev. 2018; 67: 71-7. https://doi.org/10.1016/j.ctrv.2018.05.004.
- Bilancia D., Rosati G., Dinota A., Germano D., Romano R., Manzione L. Lapatinib in breast cancer. Ann Oncol. 2007; 18(6): 26-30. https://doi.org/10.1093/annonc/mdm220.
- Ferrara N., Gerber H.P., LeCouter J. The biology of VEGF and its receptors. Nat Med. 2003; 9(6): 669-76. https://doi.org/10.1038/nm0603-669.
- Garcia J., Hurwitz H.I., Sandler A.B., Miles D., Coleman R.L., Deurloo R., Chinot O.L. Bevacizumab (Avastin®) in cancer treatment: A review of 15 years of clinical experience and future outlook. Cancer Treat Rev. 2020; 86. https://doi.org/10.1016/j.ctrv.2020.102017.
- Turk A.A., Wisinski K.B. PARP inhibitors in breast cancer: Bringing synthetic lethality to the bedside. Cancer. 2018; 124(12): 2498-2506. https://doi.org/10.1002/cncr.31307.
- Fang B. Development of synthetic lethality anticancer therapeutics. J Med Chem. 2014; 57(19): 7859-73. https://doi.org/10.1021/jm500415t.
- Tsyganov M.M., Ibragimova M.K., Deryusheva I.V., Garbukov E.Yu., Kazantseva P.V., Pevzner A.M., Slonimskaya E.M., Litvyakov N.V. Prognosticheskaya znachimost' ekspressii gena BRCA1 u bol'nykh rakom molochnoi zhelezy. Voprosy onkologii. 2019; 65(3): 368-73.
- Bu X., Yao Y., Li X. Immune Checkpoint Blockade in Breast Cancer Therapy. Adv Exp Med Biol. 2017; 1026: 383-402. https://doi.org/10.1007/978-981-10-6020-5_18.
- Pardoll D.M. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12(4): 252-64. https://doi.org/10.1038/nrc3239.
- Polk A., Svane I.M., Andersson M., Nielsen D. Checkpoint inhibitors in breast cancer - Current status. Cancer Treat Rev. 2018; 63: 122-34. https://doi.org/10.1016/j.ctrv.2017.12.008.
- Lyons T.G. Targeted Therapies for Triple-Negative Breast Cancer. Curr Treat Options Oncol. 2019; 20(11): 82. https://doi.org/10.1007/s11864-019-0682-x.
- Mediratta K., El-Sahli S., D’Costa V., Wang L. Current Progresses and Challenges of Immunotherapy in Triple-Negative Breast Cancer. Cancers (Basel). 2020; 12(12): 3529. https://doi.org/10.3390/cancers12123529.
- Fuentes-Antrás J., Guevara-Hoyer K., Baliu-Piqué M., GarcíaSáenz J.Á., Pérez-Segura P., Pandiella A., Ocaña A.Adoptive Cell Therapy in Breast Cancer: A Current Perspective of Next-Generation Medicine. Front Oncol. 2020; 10. https://doi.org/10.3389/fonc.2020.605633.
- June C.H. Adoptive T cell therapy for cancer in the clinic. J Clin Invest. 2007; 117(6): 1466-76. https://doi.org/10.1172/JCI32446.
- Wright S.E. Immunotherapy of breast cancer. Expert Opin Biol Ther. 2012; 12(4): 479-90. https://doi.org/10.1517/14712598.2012.665445.
- Ueno N.T., Rizzo J.D., Demirer T., Cheng Y.C., Hegenbart U., Zhang M.J., Bregni M., Carella A., Blaise D., Bashey A., Bitran J.D., Bolwell B.J., Elfenbein G.J., Fields K.K., Freytes C.O., Gale R.P., Lazarus H.M., Champlin R.E., Stiff P.J., Niederwieser D.Allogeneic hematopoietic cell transplantation for metastatic breast cancer. Bone Marrow Transplant. 2008; 41(6): 537-45. https://doi.org/10.1038/sj.bmt.1705940.
- Wei J., Han X., Bo J., Han W. Target selection for CAR-T therapy. J Hematol Oncol. 2019; 12(1): 62. https://doi.org/10.1186/s13045-019-0758-x.
- Xie Y., Hu Y., Zhou N., Yao C., Wu L., Liu L., Chen F. CAR T-cell therapy for triple-negative breast cancer: Where we are. Cancer Lett. 2020; 491: 121-31. https://doi.org/10.1016/j.canlet.2020.07.044.
- Dees S., Ganesan R., Singh S., Grewal I.S. Emerging CAR-T Cell Therapy for the Treatment of Triple-Negative Breast Cancer. Mol Cancer Ther. 2020; 19(12): 2409-21. https://doi.org/10.1158/1535-7163.MCT-20-0385.
- Li Z., Qiu Y., Lu W., Jiang Y., Wang J. Immunotherapeutic interventions of Triple Negative Breast Cancer. J Transl Med. 2018; 16(1): 147. https://doi.org/10.1186/s12967-018-1514-7.
- Zhou R., Yazdanifar M., Roy L.D., Whilding L.M., Gavrill A., Maher J., Mukherjee P. CAR T Cells Targeting the Tumor MUC1 Glycoprotein Reduce Triple-Negative Breast Cancer Growth. Front Immunol. 2019; 10: 1149. https://doi.org/10.3389/fimmu.2019.01149. Erratum in: Front Immunol. 2020; 11.
- Posey A.D. Jr, Schwab R.D., Boesteanu A.C., Steentoft C., Mandel U., Engels B., Stone J.D., Madsen T.D., Schreiber K., Haines K.M., Cogdill A.P., Chen T.J., Song D., Scholler J., Kranz D.M., Feldman M.D., Young R., Keith B., Schreiber H., Clausen H., Johnson L.A., June C.H. Engineered CAR T Cells Targeting the Cancer-Associated Tn-Glycoform of the Membrane Mucin MUC1 Control Adenocarcinoma. Immunity. 2016; 44(6): 1444-54. https://doi.org/10.1016/j.immuni.2016.05.014.
- Hu W., Zi Z., Jin Y., Li G., Shao K., Cai Q., Ma X., Wei F. CRISPR/Cas9-mediated PD-1 disruption enhances human mesothelin-targeted CAR T cell effector functions. Cancer Immunol Immunother. 2019; 68(3): 365-77. https://doi.org/10.1007/s00262-018-2281-2.
- Zhao X., Qu J., Hui Y., Zhang H., Sun Y., Liu X., Zhao X., Zhao Z., Yang Q., Wang F., Zhang S. Clinicopathological and prognostic significance of c-Met overexpression in breast cancer. Oncotarget. 2017; 8(34): 56758-67. https://doi.org/10.18632/oncotarget.18142.
- Crowther M.D., Svane I.M., Met Ö. T-Cell Gene Therapy in Cancer Immunotherapy: Why It Is No Longer Just CARs on The Road. Cells. 2020; 9(7): 1588. https://doi.org/10.3390/cells9071588.
- Zhao L., Cao Y.J. Engineered T Cell Therapy for Cancer in the Clinic. Front Immunol. 2019; 10: 2250. https://doi.org/10.3389/fimmu.2019.02250.
- Li X., Bu X. Progress in Vaccine Therapies for Breast Cancer. Adv Exp Med Biol. 2017; 1026: 315-30. https://doi.org/10.1007/978-981-10-6020-5_15.
- Kuznetsova M., Lopatnikova J., Shevchenko J., Silkov A., Maksyutov A., Sennikov S. Cytotoxic Activity and Memory T Cell Subset Distribution of in vitro-Stimulated CD8+ T Cells Specific for HER2/neu Epitopes. Front Immunol. 2019; 10: 1017. https://doi.org/10.3389/fimmu.2019.01017.
- Shevchenko J.A., Khristin A.A., Kurilin V.V., Kuznetsova M.S., Blinova D.D., Starostina N.M., Sidorov S.V., Sennikov S.V.Autologous dendritic cells and activated cytotoxic T-cells as combination therapy for breast cancer. Oncol Rep. 2020; 43(2): 671-80. https://doi.org/10.3892/or.2019.7435.
- Hu W., Wang G., Huang D., Sui M., Xu Y. Cancer Immunotherapy Based on Natural Killer Cells: Current Progress and New Opportunities. Front Immunol. 2019; 10: 1205. https://doi.org/10.3389/fimmu.2019.01205.
- Wu S.Y., Fu T., Jiang Y.Z., Shao Z.M. Natural killer cells in cancer biology and therapy. Mol Cancer. 2020; 19(1): 120. https://doi.org/10.1186/s12943-020-01238-x.
- Hu Z. Tissue factor as a new target for CAR-NK cell immunotherapy of triple-negative breast cancer. Sci Rep. 2020; 10(1): 2815. https://doi.org/10.1038/s41598-020-59736-3.
- Benedetti R., Dell’Aversana C., Giorgio C., Astorri R., Altucci L. Breast Cancer Vaccines: New Insights. Front Endocrinol (Lausanne). 2017; 8: 270. https://doi.org/10.3389/fendo.2017.00270.
- Clifton G.T., Gall V., Peoples G.E., Mittendorf E.A. Clinical Development of the E75 Vaccine in Breast Cancer. Breast Care (Basel). 2016; 11(2): 116-21. https://doi.org/10.1159/000446097.
- Burke E.E., Kodumudi K., Ramamoorthi G., Czerniecki B.J. Vaccine Therapies for Breast Cancer. Surg Oncol Clin N Am. 2019; 28(3): 353-67. https://doi.org/10.1016/j.soc.2019.02.004.


