Современное состояние проблемы лечения резистентного к радиоактивному йоду дифференицированного рака щитовидной железы и клинический случай длительного успешного лечения сорафенибом
Автор: Муфазалов Фагим Фанисович, Шарипова Наиля Саматовна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Оригинальные статьи
Статья в выпуске: 3 (14), 2015 года.
Бесплатный доступ
Рак щитовидной железы (РЩЖ) является наиболее распространенным эндокринным злокачественным новообразованием. За последнее десятилетие заболеваемость РЩЖ в мире и в Российской Федерации (РФ) неуклонно растет [1, 2]. Так, в Соединенных Штатах Америки отмечается ежегодный прирост выявленных случаев РЩЖ на 6,4%, с частотой прироста смертности в среднем на 0,9% [3]. В РФ в период с 2003-2013 гг. численность контингента больных РЩЖ возрастает из года в год в среднем на 5,4%. В 2013 г. в РФ выявлено 9624 новых случаев РЩЖ, численность контингента больных на 100 000 населения составила 93,2 [1]. Дифференцированный рак щитовидной железы (ДРЩЖ) составляет более 90% всех типов РЩЖ [4].
Дифференцированный рак щитовидной железы, резистентный к радиоактивному йоду, сорафениб, ленватиниб
Короткий адрес: https://sciup.org/140223360
IDR: 140223360 | DOI: 10.18027/2224-5057-2015-3-24-32
Текст научной статьи Современное состояние проблемы лечения резистентного к радиоактивному йоду дифференицированного рака щитовидной железы и клинический случай длительного успешного лечения сорафенибом
Mufazalov Fagim Fanisovich – GBUZ “Republican clinical oncological health center (RCOHC)” Bashkortostan
Republic Ministry of Healthcare, doctor of medical
Современное лечение ДРЩЖ включает в себя тотальное или субтотальное удаление щитовидной железы с последующим подавлением тиреотропного гормона (ТТГ) с помощью левотироксина [5]. Применение радиойодтерапии (РЙТ) показано в группах среднего и высокого риска для аблации остатков ткани и микрометастазов, также и для лечения регионарных и отдаленных метастазов.
При метастазах РЩЖ в кости и головной мозг может применяться дистанционная лучевая терапия (ДЛТ) [6].
При адекватном лечении, ДРЩЖ остается прогностически благоприятным заболеванием с 5-летней относительной выживаемостью до 83–98% в зависимости от возраста пациента и гистологического подтипа опухоли [7].
Несмотря на управляемость дифференцированных форм РЩЖ радиойодтерапией, все же от 5 до 15% пациентов становятся радиойодрезистент-ными [8–11]. Резистентность может быть как изначальной, так и возникнуть в процессе лечения в результате дедифференциации опухолевых клеток в сторону анаплазии. Пятилетняя выживаемость в таких случаях достигает 66%, тогда как 10-летняя общая выживаемость составляет только 10% [12, 13]. По данным некоторых исследований, выживаемость пациентов ДРЩЖ, резистентного к радиой-одтерапии и с отдаленными метастазами, составляет 2,5–3,5 года [13, 14].
До недавнего времени вариантов лечения пациентов с резистентным к радиойодтерапии ДРЩЖ было крайне мало. Стандартная химиотерапия дала неутешительные результаты [15–17], хотя появились работы с новыми эффективными схемами химиотерапии, которые требуют дальнейших рандомизированных исследований [18]. С введением таргетных препаратов прогноз для этих пациентов все же улучшился. Молекулярные препараты продемонстрировали доказанное увеличение безреци-дивной выживаемости почти в два раза (сорафениб), улучшение безрецидивной и объективного ответа опухоли (ленватиниб). С появлением этих новых вариантов лечения, врачи сталкиваются с проблемой в определении пациентов – кандидатов для системного лечения и оптимальных сроков ее начала.
В данной статье приведен обзор литературы по современному состоянию проблемы лечения резистентного к радиоактивному йоду ДРЩЖ, а также клинический случай длительного успешного лечения сорафенибом.
СИСТЕМНАЯ ТЕРАПИЯ РЕЗИСТЕНТНОГО К РАДИАКТИВНОМУ ЙОДУ ДРЩЖ
В целом системная терапия представляет собой важный компонент в лечении неоперабельного ра-диойодрезистентного РЩЖ.
На сегодняшний день, химиотерапия считается неэффективным терапевтическим подходом в лечении ДРЩЖ. Это заявление основано на неутешительных результатах исследований старых схем химиотерапии на основе доксорубицина, где отмечался низкий ответ на лечение (до 25%) и значительная токсичность [19]. Тем не менее имеются данные, которые могут привести к пересмотру роли химиотерапии в этой области. В небольшом ретроспективном исследовании [18] 14 больных с прогрессирующим радиойодрезистентным ДРЩЖ продемонстрированы результаты лечения в режиме GEMOX (гемцитабин и оксалиплатин) с объективным опухолевым ответом у 57,2% пациентов, со стабилизацией заболевания у 28,6%. Кроме того, отмечалась хорошая переносимость данной схемы с отсутствием токсичности 4 степени. Несмотря на ретроспективный характер исследования, небольшой размер выборки эти данные продемонстрировали сопоставимую с результатами исследований ингибиторов тирозинкиназ противоопухолевую активность и профиль безопасности. Таким образом, для схемы GEMOX и других химиопрепаратов в лечении радиойодрезистентного ДРЩЖ требуются дальнейшие проспективные и более крупные исследования.
Таргетная терапия при радиойодрезистентном ДРЩЖ осуществляется в основном при помощи двух механизмов действия: ингибирование ангиогенеза и пролиферации опухолевых клеток.
Наиболее тщательно изученными и одобренными Управлением по контролю за качеством пищевых продуктов и лекарственных средств США (FDA) молекулярными препаратами при лечении местно-распространенного, метастатического рефрактерного к препаратам радиоактивного йода ДРЩЖ является сорафениб и ленватиниб [20, 21].
Сорафениб, являясь мультикиназным ингибитором RAF, VEGF рецепторов (VEGFR) 1–3, PDGF-рецептора (PDGFR) и RET, блокирует рост рака щитовидной железы через антипролиферативные и антиангиогенные механизмы [22]. Ленватиниб ингибирует VEGFR1–3, рецепторы факторов роста фибробластов 1–4, RET, C-KIT и PDGFRр [23, 24].
Безопасность и эффективность сорафениба была доказана в двух последовательных фазах рандомизированных исследований [25–29]. Результаты III фазы (DECISION) продемонстрировали увеличение выживаемости без прогрессирования (ВБП) в два раза в группе приема сорафениба 10,8 мес (доверительный интервал (ДИ) 95%; 9.1–12.9) против 5,8 мес (ДИ 95%; 5.3–7.8) (р<0,001) [30]. Контроль над опухолью определялся в виде полного и частичного ответа, а также стабилизации процесса (не менее чем в течение 6 мес) у 54% больных в группе сорафениба против 34% в группе плацебо (р<0,0001). В этом исследовании, радиойодрезистентность определялась как отсутствие поглощения очагом радиоактивного йода (определяемого другими методами медицинской визуализации) при сканировании всего тела I-131 в условиях адекватной эндогенной, экзогенной, рекомбинантной стимуляции тиреотропного гормона (ТТГ). Также рефрактерными к лечению радиойодом считались больные, у которых несмотря на накопление I-131 отмечалась: 1) прогрессия в течение 16 мес после однократного курса РЙТ ≥100 мКи; 2) прогрессия после каждого из нескольких курсов РЙТ, проведенных с интервалом более 16 мес по ≥100 мКи каждый, и 3) если в сумме пациент получил РЙТ в дозе ≥600 мКи. Прогрессия заболевания оценивалась по критериям RECIST в течение предыдущих 14 месяцев [31].
Наиболее частыми побочными действиями сорафениба в данном исследовании были: ладонно-подошвенный синдром (76,3%), диарея (68,6%), алопеция (67,1%), сыпь или шелушение (50,2%), быстрая утомляемость (49,8%), потеря веса (46,9%) и артериальная гипертония (40,6%).
Большинство побочных эффектов проявлялись токсичностью 1–2 степени, однако у 5% больных наблюдались шелушение, сыпь на коже, а также диарея 3–4 степени, ладонно-подошвенный синдром 3 степени проявился у 20%, артериальная гипертензия 3–4 степени у 10% и гипокальциемия 3 степени у 10%.
Следует отметить, что несмотря на то, что основные токсические проявления были 1 или 2 степени, перерыв в лечении, сокращение дозы, или отмена препарата наблюдали у 66,2%, 64,3%, и 18,8% больных соответственно. Это важный момент при планировании лечения пациентов с бессимптомным течением прогрессирующего радиойодрези-стентного ДРЩЖ.
Ленватиниб также продемонстрировал многообещающую активность у пациентов с радиойодре-зистентным ДРЩЖ. В многоцентровом рандомизированном исследовании III фазы (SELECT) медиана ВБП в группе ленватиниба составила 18,7 мес (95% ДИ) против 3,6 (2.1–5.3) мес в группе плацебо (относительный риск (ОР) 0,2 (0.14–0.27)) [32]. Нужно отметить, что при приеме ленватиниба получен объективный ответ опухоли у 64,7% больных, в том числе у четверых (1,5%) достигнут полный ответ. Согласно этим результатам, ленватиниб может быть более эффективным в улучшении выживаемости без прогрессирования заболевания (18.3 против 10,8 мес) и получении объективного ответа опухоли (64,7% против 12,2%) по сравнению с сорафенибом. Эти данные становятся еще более значимыми, если учесть что в исследование SELECT были включены пациенты с более запущенным заболеванием, которые уже могли быть пролечены ингибиторами ти-розинкиназ, тогда как исследование DECISION это исключало.
В этом исследовании рефрактерность к радиоактивному йоду определялась при наличии одного из условий: 1) наличие одного или более определяемых очагов, не накапливающих при сканировании радиоактивный йод; 2) наличие одного или более очагов, прогрессирующих по критериям RECIST 1.1 в течение 12 мес после РЙТ, несмотря на удовлетворительные результаты сканирования во время и после лечения, или 3) если в сумме РЙТ проведена в дозе ≥ 600 мКи, с последней введенной дозой в течение 6 мес до включения в исследование [33].
Наиболее частыми побочными действиями ленватиниба были: артериальная гипертензия (68%), диарея (59%), снижение аппетита (50%), потеря веса (46%), и тошнота (41%). Как и при приеме сорафениба, основная токсичность была 1 или 2 степени, что все же привело к сокращению дозы и отмене препарата в 78,5% и 14,2% случаев соответственно.
Интересно отметить, что эти два основных исследования использовали различные определения прогрессирования заболевания и радиойодрези-стентности ДРЩЖ, что еще больше подчеркивает необходимость принятия решения о критериях рефрактерности к радиоактивному йоду.
В дополнение к исследованиям с одним агентом были изучены комбинации таргетных препаратов. Так, следует отметить исследование II фазы (N = 41) комбинированного использования сорафениба и ингибитора m-TOR (ингибитора мишени рапами-цина в клетках млекопитающих) при прогрессирующем радиойодрезистентном рецидивирующем и/ или метастатическом неанапластическом РЩЖ, которое показало частичный ответ у 19 больных (53%) и стабилизацию заболевания у 15 (42%) из 36 пациентов. Среди 19 пациентов с ДРЩЖ в этом исследовании частичный ответ наблюдался у 11 больных (58%) и стабилизация процесса в 7 случаях (37%) [34]. Еще один ингибитор m-TOR – темсиролимус был оценен во II фазе (N = 37) исследования [35] у пациентов с прогрессирующим рецидивирующим /метастатическим немедуллярным РЩЖ. В этом исследовании частичный ответ наблюдался у 8 больных (22%) и стабилизация процесса у 21 (57%) из 37 пациентов.
На основании наблюдений, свидетельствующих, что активация MAPK/ERK сигнальных путей ингибирует экспрессию генов биосинтеза гормонов щитовидной железы (симпортера йодида натрия, пероксидазы щитовидной железы), изучены механизмы повышения поглощения и органифика-ции йода [36].
В исследовании [37], где пациенты принимали ингибитор МАРК/ERK сигнальных путей – селуме-тиниб при радиойодрезистентности ДРЩЖ, а также при прогрессировании или стабилизации заболевания, несмотря на РЙТ в течение 6 мес и более, у 12 из 20 (60%) пациентов отмечалось появление/увеличе-ние поглощения радиактивного йода и у 8 (40%) достигнут порог дозиметрии при РЙТ. Таким образом, не исключается возможная роль селуметиниба в рестимуляции поглощения радиокативного йода.
Несмотря на достижения последних лет в развитии и использовании таргетной терапии у пациентов резистентным к радиактивному йоду ДРЩЖ, остается ряд важных вопросов по оптимальному лечению.
Учитывая, что радиойодрезистентность может быть представлена клинически гетерогенными пу- тями на основании гистологии и стадии [38], некоторые пациенты могут иметь изначальную реф-рактерность к йоду или некоторые могут иметь множественные очаги, по-разному накапливающие радиойодпрепарат, в том числе те, которые изначально были тропны к йоду, но потом потеряли эту способность.
Тем не менее имеются случаи прогрессии и на фоне значительного поглощения радиойодпрепа-рата, но есть радиойодрезитсентный ДРЩЖ, который и не прогрессирует, но и не поддается лечению.
В связи с этой неоднородностью случаев очень трудно определить понятие резистентности к радиоактивному йоду.
В Москве 21 апреля 2014 была принята резолюция экспертного стола по вопросам таргетной терапии ДРЩЖ, резистентного к терапии радиоактивным йодом [39]. Согласно данному решению, ДРЩЖ следует считать резистентным к терапии радиоактивным йодом при наличии одного или нескольких из следующих признаков:
-
• наличие одного (или более) очага высокодифференцированного РЩЖ, не подлежащего хирургическому удалению и визуализируемого на (и/или) КТ (компьютерной)/магнитно-резо-нансной (МРТ) томографии/позитронной эмиссионной томографии с F-дезоксиглюкозой (ПЭТ с ФДГ), не накапливающего терапевтическую активность радиоактивного йода при условии адекватно выполненной радиойодтерапии (РЙТ) и постлечебной сцинтиграфии всего тела, желательно с использованием однофотонной эмиссионной томографии, сопряженной с КТ;
-
• доказанное, согласно системе RECIST 1.1, прогрессирование опухолевого процесса через ≤12 мес на фоне РЙТ активностями не менее 3,7 ГБк (100 мКи) при условии успешно аблацирован-ного тиреоидного остатка;
-
• отсутствие регрессии очагов опухоли при суммарной лечебной активности радиоактивного йода более 22 ГБк (600 мКи).
После того как опухоль пациента признана резистентной к лечению радиоактивным йодом, должно быть принято принципиальное решение о терапии таргетными препаратами и не менее принципиальное решение о сроках начала этой терапии. Поскольку болезнь у большинства таких пациентов изначально протекает бессимптомно, многие не требуют немедленного лечения.
Например, в исследовании DECISION, у 17% пациентов, получавших плацебо, выживаемость без прогрессирования была более чем 1 год [40]. Кро- ме того, в группе пациентов с «нечувствительными» очагами по ПЭТ с ФДГ медиана выживаемости составила 41 месяц без таргетной терапии [41].
Следовательно, решение о лечении должно быть основано на сочетании факторов, включая размер опухоли и темпы роста, симптомы и расположение опухоли.
Согласно решению группы экспертов [42], пациенты с большими опухолями (> 3 см) или с несколькими очагами (более чем 1–2 см в диаметре), которые быстро прогрессируют (в течение <12 мес), должны быть рассмотрены для начала лечения тар-гетным препаратом. Напротив, у пациентов с меньшей опухолью (<1 см) или с небольшой опухолевой массой несколько разрозненными очагами, которые медленно прогрессируют в течение 12–14 мес, редко требуют немедленного системного лечения. Такие пациенты должны тщательно наблюдаться, используя различные методы визуализации каждые 3–12 мес. Для пациентов с мелкими быстро прогрессирующими (время удвоения <6–12 мес) опухолями или с большими опухолями, но медленнорастущими (время удвоения > 12 мес), четкого решения нет, оно может в значительной степени зависеть от таких факторов, как симптомы, местоположение опухоли, общее состояние, и предпочтение пациента. При солитарных очагах (например в печени, костях) должны быть рассмотрены возможности проведения радиочастотной абляции или дистанционной лучевой терапии до начала системной терапии.
ДАЛЕЕ ПРИВЕДЕМ КЛИНИЧЕСКИЙ СЛУЧАЙ ДЛИТЕЛЬНОГО УСПЕШНОГО ЛЕЧЕНИЯ СОРАФЕНИБОМ
Больной Б., 59 лет. Диагноз: Папиллярный рак щитовидной железы III ст. Т 3N2M0. Из анамнеза заболевания: в начале 2010 г. появились жалобы на общую слабость, недомогание, утомляемость. Обследован по месту жительства, проведено УЗИ щитовидной железы, выявлено объемное образование щитовидной железы. 17.11.2010 г. в республиканской клинической больнице г. Уфа выполнена операция – субтотальная тиреоидэктомия. Гистологическое заключение: папиллярный рак щи- товидной железы. 22.06.2011 г. в республиканском клиническом онкологическом диспансере г. Уфа проведена операция типа Крайля справа. Гистологическое заключение – обширные метастазы папиллярного рака в лимфатические узлы.
В последующем проводилась супрессивная терапия, принимал L-тироксин ежедневно 125 мкг/день.
В августе 2011 г. пациент направлен на радиой-одтерапию в Челябинский областной клинический онкологический диспансер, где 10.08.2011 г. по результатам сцинтиграфии всего тела (СВТ) с I-131 выявлено патологическое накопление радиофармпрепарата (РФП) в зоне удаленной щитовидной железы – 10,9% от СВТ.
Проведен 1-й курс радиойодтерапии I-131, активностью 3 ГБк. По данным постлечебной сцинтиграфии патологическое накопление РФП в зоне удаленной щитовидной железы – 26% от СВТ.
По данным ПЭТ/КТ всего тела с ФДГ от 12.12.2011 г. (рис.1) – в области шеи слева визуализируется лимфоузлы с ПЭТ признаками гиперметаболизма на уровне левого верхнего рога подъязычной кости, кнутри от левой грудинно-ключично-сосцевидной мыщцы и кпереди от сосудистого пучка 10х10 мм, паратрахеальные лимфоузлы верхнего этажа справа 10х5 мм и 9х5 мм, нельзя исключить литический метастаз в Th 11.
Уровень ТТГ(12.02.2012 г.) составил 82 мМЕ/мл.
Далее с 16.02.2012 по 14.02.2013 гг. проведены еще 3 курса РЙТ активностью 3 ГБк.
При контрольном исследовании по ПЭТ/КТ с ФДГ от 24.03.2013 г. – отрицательная динамика, на уровне подъязычной кости в левой половине шеи по-прежнему визуализируется неувеличенные лимфоузлы с повышением уровня накопления РФП в три раза. 03.10.2013 г. проведен 5-й сеанс РЙТ активностью 3,3 ГБк (суммарная доза I-131–15,3 ГБк
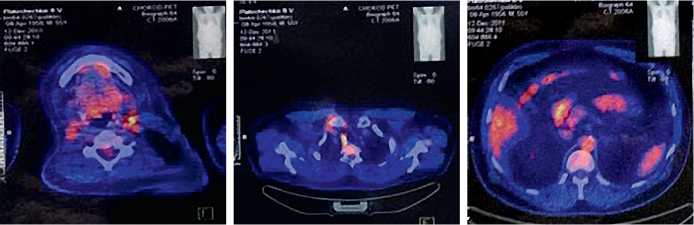
Рис. 1. ПЭТ/КТ с ФДГ всего тела больного Б. от 12.12.2011 г. (признаки накопления РФП в проекции левого верхнего рога подъязычной кости, левой грудинно-ключично-сосцевидной мыщцы и кпереди от сосудистого пучка, паратрахеальные лимфоузлы верхнего этажа справа)
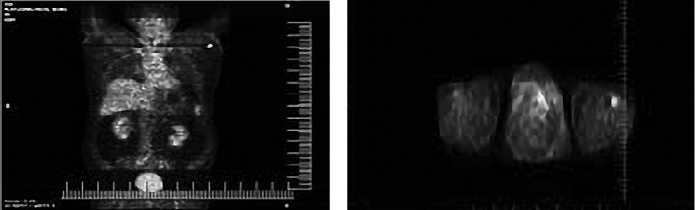
Рис. 2. ПЭТ/КТ с ФДГ всего тела больного Б. от 09.06.2014 г. – единичный метаболически активный подмышечный лимфоузел слева
динамика, по данным ПЭТ/КТ с ФДГ (рис.3) от 09.02.2015 г. – данных на наличие метаболически активных очагов, обусловленных проявлениями основного заболевания, не выявлено.
Из побочных действий препарата отмечен ладонно-подошвенный синдром с типичной картиной, который начал проявляться через неделю после приема и продолжался в течение 6 месяцев.
(417 мКи)). По данным постлечебной сцинтиграфии очагов накопления РФП не выявлено.
Уровень ТГ (28.09.2013 г.) составил 19,3 (0–3 ng/ml).
С учетом отрицательной динамики по ПЭТ/КТ, отсутствие накопления РФП при сцинтиграфии, 15.05.2014 г. пациенту выполнена селективная лимфаденэктомия 2–5 уровня лимфоузлов справа, 7 уровня, удаление опухоли ретротрахеальной области. Гистологическое заключение: метастазы папиллярной карциномы.
В последующем пациент продолжил супрессивную терапию, принимал L-тироксина ежедневно в дозе 200 мкг/день.
В июне 2014 г. по данным ПЭТ/КТ с ФДГ (рис.2) выявлена картина метаболически активного очага ложа удаленной щитовидной железы слева (сцинтиграфическими размерами 9 мм), единичный метаболически активный подмышечный лимфоузел слева – метастаз размерами 16,1–19,5мм.
С сентября 2014 г. пациенту назначен прием Нексавара (сорафениба) в качестве ежедневных пероральных доз 800 мг.
При очередном обследовании после 6 мес тар-гетной терапии отмечена стойкая положительная
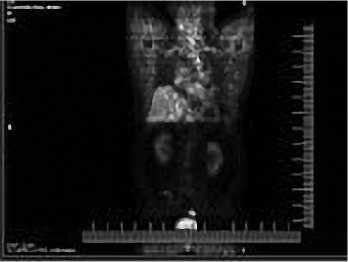
Рис. 3. ПЭТ/КТ с ФДГ всего тела больного Б. от 09.02.2015 г. – признаков накопления РФП не обнаружено
В настоящее время (май 2015 г.) пациент продолжает прием Нексавара в прежнем режиме (9-й месяц). Анализы от 12.05.2015 г.: уровень ТГ <0,2 (0–3 ng/ml); ТТГ 0,0180 мМЕ/л (0,4–4,0); АТ-ТГ <3,0 Ед/мл (<18). По данным ПЭТ/КТ всего тела в динамике нет признаков возобновления опухолевой активности.
Таким образом, в заключение необходимо еще раз подчеркнуть, что появление таргетных препаратов представляет собой крупное достижение для пациентов, резистентным к радиоактивному йоду ДРЩЖ.
ДРЩЖ – это то заболевание, для которого ранее было только несколько вариантов лечения. Недавнее утверждение FDA по применению сорафениба и ленватиниба у этих пациентов дает возможность более широкого использования этих препаратов. Тем не менее и исследователи и практикующие врачи все еще изучают, как лучше использовать молекулярную терапию при ДРЩЖ, в частности испытывают ряд проблем в определении того, кого лечить (т.е. признание радиойодрезистентности) и когда начинать лечение. В практике многих международных институтов пациенты с большими опухолями или несколькими опухолями с быстрым прогрессированием считаются целевой группой для таргетной терапии. Для пациентов с быстрорастущими маленькими опухолями, или медленно-прогрессирующими большими опухолями до начала терапии должны быть рассмотрены дополнительные факторы такие как: локализация опухоли, симптоматика и общее состояние пациента.
Список литературы Современное состояние проблемы лечения резистентного к радиоактивному йоду дифференицированного рака щитовидной железы и клинический случай длительного успешного лечения сорафенибом
- А. Д. Каприн, В. В. Старинский, Г. В. Петрова. Состояние онкологической помощи населению России в 2012 году. М. -2013. Kaprin A. D., Starinskiy V. V., Petrova G. V. Current status of oncological healthcare in Russia in 2012. M. -2013.
- Pellegriti, G., Frasca, F., Regalbuto, C., Squatrito, S. and Vigneri, R. (2013) Worldwide increasing incidence of thyroid cancer: update on epidemiology and risk factors. J Cancer Epidemiol 2013: 965212.
- National Cancer Institute Surveillance, Epidemiology, and End Results program (NCI SEER) stat fact sheet: http://seer.cancer.gov/statfacts/html/thyro.html
- NCI SEER cancer statistics review: http://seer.cancer.gov/csr/1975_2010/results_merged/sect_26_thyroid.pdf
- NCCN (2014) NCCN Clinical Practice Guidelines in Oncology. Cancer-related Fatigue (version 1.2014). Fort Washington, PA: National Comprehensive Cancer Network.
- Cooper, D., Doherty, G., Haugen, B., Kloos, R. and Al., E. (2009) Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 19: 1167-1214.
- Hundahl, S., Fleming, I., Fremgen, A. and Menck, H. (1998) A national cancer data base report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985-1995 . Cancer 83: 2638-2648.
- Sciuto, R., Romano, L., Rea, S., Marandino, F., Sperduti, I. and Maini, C. (2009) Natural history and clinical outcome of differentiated thyroid carcinoma: a retrospective analysis of 1503 patients treated at a single institution. Ann Oncol 20: 1728-1735.
- Pacini, F. and Castagna, M. (2012) Approach to and treatment of differentiated thyroid carcinoma. Med Clin North Am 96: 369-383.
- Xing, M., Haugen, B. and Schlumberger, M. (2013) Progress in molecular-based management of differentiated thyroid cancer. Lancet 381: 1058-1069.
- Amin, A., Badwey, A. and El-Fatah, S. (2014) Differentiated thyroid carcinoma: an analysis of 249 patients undergoing therapy and aftercare at a single institution. Clin Nucl Med 39: 142-146.
- Nixon, I., Whitcher, M., Palmer, F., Tuttle, R., Shaha, A., Shah, J. et al. (2012) The impact of distant metastases at presentation on prognosis in patients with differentiated carcinoma of the Thyroid gland. Thyroid 22: 884-889.
- Durante, C., Haddy, N., Baudin, E., Leboulleux, S., Hartl, D., Travagli, J. et al. (2006) Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab 91: 2892-2899.
- Robbins, R., Wan, Q., Grewal, R., Reibke, R., Gonen, M., Strauss, H. et al. (2006) Real-time prognosis for metastatic thyroid carcinoma based on 2- fluoro-2-deoxy-d-glucose-positron emission tomography scanning. J Clin Endocrinol Metab 91: 498-505.
- Shimaoka, K., Schoenfeld, D., Dewys, W., Creech, R. and Deconti, R. (1985) A randomized trial of doxorubicin versus doxorubicin plus cisplatin in patients with advanced thyroid carcinoma. Cancer 56: 2155-2160.
- Matuszczyk, A., Petersenn, S., Bockisch, A., Gorges, R., Sheu, S., Veit, P. et al. (2008) Chemotherapy with doxorubicin in progressive medullary and thyroid carcinoma of the follicular epithelium. Horm Metab Res 40: 210-213.
- NCCN (2013) NCCN Clinical Practice Guidelines in Oncology. Thyroid carcinoma (version 2.2013). Fort Washington, PA: National Comprehensive Cancer Network.
- Spano JP, Vano Y, Vignot S, et al. GEMOX regimen in the treatmentof metastatic differentiated refractory thyroid carcinoma. Med Oncol 2012; 29:1421-8.
- Sherman SI. Early clinical studies of novel therapies for thyroid can-cers. Endocrinol Metab Clin North Am 2008; 37:511-24, xi.
- US Food and Drug Administration (2013) FDA news release: FDA approves nexavar to treat type of thyroid cancer. Silver Spring, MD.
- US Food and Drug Administration (2015) FDA news release: FDA approves Lenvima for a type of thyroid cancer.
- Wilhelm, S., Adnane, L., Newell, P., Villanueva, A., Llovet, J. and Lynch, M. (2008) Preclinical overview of sorafenib, a multikinase inhibitor that targets bothRaf and VEGF and PDGF receptor tyrosine kinase signaling. Mol Cancer Ther 7: 3129-3140.
- Matsui, J., Yamamoto, Y., Funahashi, Y., Tsuruoka, A., Watanabe, T., Wakabayashi, T. et al. (2008) E7080, a novel inhibitor that targets multiple kinases, has potent antitumor activities against stem cell factor producing human small cell lung cancer H146, based on angiogenesis inhibition. Int J Cancer 122: 664-671.
- Okamoto, K., Kodama, K., Takase, K., Sugi, N., Yamamoto, Y., Iwata, M. et al. (2013) Antitumor activities of the targeted multi-tyrosine kinase inhibitor lenvatinib (e7080) against ret gene fusion-driven tumor models. Cancer Lett 340: 97-103.
- Gupta-Abramson V, Troxel AB, Nellore A, et al. Phase II trialof sorafenib in advanced thyroid cancer. J Clin Oncol 2008; 26:4714-9.
- Kloos RT, Ringel MD, Knopp MV, et al. Phase II trial of sorafenib inmetastatic thyroid cancer. J Clin Oncol 2009; 27:1675-84.
- Cabanillas ME, Waguespack SG, Bronstein Y, et al. Treatment withtyrosine kinase inhibitors for patients with differentiated thyroidcancer: the M D. Anderson experience. J Clin Endocrinol Metab 2010; 95:2588-95.
- Hoftijzer H, Heemstra KA, Morreau H, et al. Beneficial effectsof sorafenib on tumor progression, but not on radioiodine uptake, in patients with differentiated thyroid carcinoma. Eur J Endocrinol 2009; 161:923-31.
- Marotta V, Ramundo V, Camera L, et al. Sorafenib in advancediodine-refractory differentiated thyroid cancer: efficacy, safety andexploratory analysis of role of serum thyroglobulin and FDG-PET.Clin Endocrinol (Oxf) 2012.
- Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioac-tive iodine-refractory, locally advanced or metastatic differentiatedthyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 2014.
- Brose MS, Nutting CM, Sherman SI, et al. Rationale and design of decision: a double-blind, randomized, placebo-controlled phase III trial evaluating the efficacy and safety of sorafenib in patients with locally advanced or metastatic radioactive iodine (RAI)-refractory, differentiated thyroid cancer. BMC Cancer. 2011; 11:349.
- Schlumberger, M., Tahara, M., Wirth, L., Robinson, B., Brose, M., Elisei, R. et al. (2014) A phase 3, multicenter, randomized, double-blind, placebocontrolled trial of lenvatinib (E7080) in patients with131-I-refractory differentiated thyroid cancer (SELECT) . Paper presented at American Society of Clinical Oncology, Chicago, IL, 30 May-3 June 2013.
- Eisai Inc. A multicenter, randomized, double-blind, placebo-controlled, phase 3 trial of lenvatinib (E7080) in 131I refractory differentiated thyroid cancer. http://clinicaltrials.gov/ct2/show/NCT01321554?term=lenvatinib+AND+thyroid+cancer&r. Accessed July 2, 2013.
- Sherman, E., Ho, A., Fury, M., Baxi, S., Haque, S., Lipson, B. et al. (2013) Phase II study of everolimus and sorafenib for the treatment of metastatic thyroid cancer. J Clin Oncol 31: 6024.
- Sherman, E., Ho, A., Fury, M., Baxi, S., Haque, S., Korte, S. et al. (2012) A phase II study of temsirolimus/sorafenib in patients with radioactive iodine (RAI)-refractory thyroid arcinoma. J Clin Oncol 30: 5514.
- Ho, A., Grewal, R., Leboeuf, R., Sherman, E., Pfister, D., Deandreis, D. et al. (2013) Selumetinib-enhanced radioiodine uptake in advanced thyroid cancer. N Engl J Med 368: 623-632.
- http://ClinicalTrials.gov identifier: NCT00970359.
- Sacks, W. and Braunstein, G. (2013) Evolving approaches in managing radioactive iodine-refractory differentiated thyroid cancer. Endocr Pract: 1-36.
- The resolution of the expert council for targeted therapy of radioiodine refractory differentiated thyroid cancer. ¦-§: ¨©ª«§¬ ®«§«¯° ¬ ±²¬ ³ 3, 2014, µ¶·.10-11.
- Worden F. Treatment strategies for radioactive iodinerefractorydifferentiated thyroid cancer/Ther Adv Med Oncol 2014, Vol. 6(6) 267-279 DOI: 10.1177/1758834014548188
- Schreinemakers, J., Vriens, M., Munoz-Perez, N., Guerrero, M., Suh, I., Rinkes, I. et al. (2012) Fluorodeoxyglucose-positron emission tomography scan-positive recurrent papillary thyroid cancer and the prognosis and implications for surgical management. World J Surg Oncol 10:192.
- Schlumberger, M., Brose, M., Elisei, R., Leboulleux, S., Luster, M., Pitoia, F. et al. (2014) Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes Endocrinol 13:70215-70218.


