Современные концепции патогенеза атеросклеротического поражения сосудистой стенки у пациентов с абдоминальным ожирением и различными формами неалкогольной жировой болезни печени
Автор: Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.12, 2017 года.
Бесплатный доступ
Установлена взаимозависимость между наличием патологических изменений в печени и начальными проявлениями стенозирующего атеросклероза. Полученный ранжированный ряд прогностических факторов, связанных со степенью изменений стенки каротидных артерий, делает возможным построение оценки индивидуального риска развития атеросклероза у пациентов с АО и различными формами НАЖБП. Значение полученных результатов заключается в необходимости более тщательного обследования пациентов с НАЖБП для оценки развития не только патологии печени, но и сердечно-сосудистых заболеваний (ССЗ).
Неалкогольная жировая болезнь печени, абдоминальное ожирение, атеросклеротические бляшки, атеросклероз
Короткий адрес: https://sciup.org/140188639
IDR: 140188639 | УДК: 616.34-003.826-096
Текст научной статьи Современные концепции патогенеза атеросклеротического поражения сосудистой стенки у пациентов с абдоминальным ожирением и различными формами неалкогольной жировой болезни печени
К настоящему времени сложилось четкое представление об атеросклерозе как мультифокальном заболевании, в основе которого лежат сложные нарушения в биохимических, иммунологических и молекулярно-генетических процессах [4, 5]. В атерогенез вовлекается сложный комплекс взаимодействий между сосудистой стенкой, форменными элементами крови, растворенными в ней биологически активными веществами и локальным нарушением кровотока (триада Р. Вирхова). В результате атеросклероза происходит постепенное локальное стенозирование коронарных, мозговых и других артерий за счет образования и роста в них атеросклеротических бляшек [16, 17, 20].
Патогенез атеросклероза представляет собой многофакторный и динамичный процесс. До настоящего времени нет всеобъемлющей теории, объясняющей и учитывающей все его стороны [5]. На сегодняшний день большое внимание уделяется изучению роли неалкогольной жировой болезни печени (НАЖБП) в развитии атеросклероза [21, 22]. Показано, что в печени при жировом гепатозе нарушаются распад инсулина и утилизация глюкозы, создаются условия для синтеза атерогенных фракций холестерина и триглицеридов (ТГ), что способствует развитию нарушений углеводного и липидного обменов, раннему появлению атеросклероза и связанных с ним сердечно-сосудистых заболеваний [18, 19].
НАЖБП приводит к развитию неалкогольного сте-атогепатита (НАСГ), который сам может индуцировать фиброгенную реакцию, что может приводить к развитию цирроза [9, 11].
Вовлекаясь в патологический процесс, печень становится не только органом-мишенью, но и сама усиливает метаболические нарушения [5, 9]. Клиническая значимость метаболических нарушений при НАЖБП велика. Их сочетание в значительной степени ускоряет развитие и прогрессирование атеросклероза и связанных с ним сердечно – сосудистых заболеваний [14, 15].
Сегодня НАЖБП рассматривается не только как заболевание, но и как нозологическая форма, напрямую связанная с прогрессированием ССЗ, хронической болезни почек (ХБП), развитием сахарного диабета 2 типа (СД 2) [3, 7, 19]. Более того, активно обсуждается гипотеза о том, что НАЖБП является не просто маркером, но и фактором риска развития ССЗ [10, 12, 14].
Мета-анализ семи исследований, включивших около 3500 человек, продемонстрировал, что НАЖБП, диагностируемая с помощью ультразвукового исследования, находится в высокой коррелятивной взаимосвязи с увеличением ТКИМ ОСА и распространенностью атеросклеротических бляшек [15, 18], а также с нарушением эндотелий-зависимой вазодилатации [15].

Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В.
СОВРЕМЕННЫЕ КОНЦЕПЦИИ ПАТОГЕНЕЗА АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ СОСУДИСТОЙ СТЕНКИ У ПАЦИЕНТОВ С АБДОМИНАЛЬНЫМ ОЖИРЕНИЕМ И РАЗЛИЧНЫМИ ФОРМАМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
В исследовании Targher G. (2006) установлено, что изменения ТКИМ ОСА возникают уже на ранних стадиях гистологически доказанного по результатам пункционной биопсии стеатоза печени (СП) и увеличиваются по мере прогрессирования морфологических изменений при НАЖБП, независимо от классических факторов сердечно – сосудистого риска, ИР [14, 16, 23]. Кроме того, у таких пациентов отмечено изменение жесткостных свойств сосудов [9].
Большое количество исследований посвящено взаимосвязи между НАЖБП и изменениями структурно-функционального состояния сердца. Продемонстрировано, что у пациентов с НАЖБП выявляются эхокардиографические признаки дисфункции левого желудочка [15] и, прежде всего, диастолической дисфункции, а по данным магнитно-резонансной спектроскопии с фосфором-31 – нарушения энергетического метаболизма миокарда [13].
Интересны результаты исследования Fallo c соавт. (2009), показавших, что у пациентов с НАЖБП значимо выше степень гипертрофии левого желудочка [12]. У этих больных уровень активности гаммаглутамилтранспеп-тидазы (ГГТП) выступил в качестве независимого предиктора сердечно – сосудистых осложнений [5, 6, 10].
По мнению некоторых авторов к возможным механизмам, лежащим в основе формирования атеросклероза у пациентов НАЖБП, можно отнести атерогенную дислипидемию, которая выявляется у 20–80% больных и хроническое системное воспаление [22]. Было высказано предположение и о многокомпонентном характере взаимосвязи между НАЖБП, АО и предикторами стенозирующего атеросклеротического поражения сосудов [17].
Таким образом, НАЖБП можно рассматривать как самостоятельный, независимый дополнительный фактор риска развития атеросклероза. Очевидно, что исследования, посвященные уточнению характера взаимосвязи между НАЖБП и ранними проявлениями атеросклеротического поражения сосудистой стенки относятся к актуальным.
Цель исследования : изучить взаимосвязь показателей скорости кровотока в каротидных артериях с патологическими изменениями в печени у пациентов с абдоминальным ожирением (АО) и различными формами НАЖБП.
Материалы и методы
В исследование включено 60 пациентов с АО в возрасте от 18 до 59 лет (ИМТ >30 кг/м2, окружность талии (ОТ) >80 см у женщин и >94 см у мужчин) и НАЖБП, диагностированной по данным ультразвукового исследования печени(УЗИ). У всех пациентов отсутствовали какие-либо клинические проявления патологии печени. Критерии исключения: СД, морбидное и вторичное ожирение, тяжелые соматические и психические заболевания, злоупотребление алкоголем, использование гепатотоксич-ных препаратов, вирусные гепатиты, хронические заболе- вания желудочно-кишечного тракта, сопровождающиеся нарушением всасывания.
В ходе исследования проводился сбор жалоб, анамнеза, определялись антропометрические параметры (рост, масса тела, ОТ, ИМТ). Характер патологических изменений в печеночной ткани (стеатоза и фиброза) определялся с помощью неинвазивного метода диагностики Стеатоскрина, который проводился всем включенным в исследование пациентам (лаборатория Biopredictive, Франция)[1, 2, 8]. Забор крови производился из локтевой вены утром натощак после не менее чем 12 часов голодания. Определялись следующие показатели: гаптоглобин, альфа2 макроглобулин, АЛТ, АСТ, общий билирубин, общий холестерин, аполипопротеин А1, ГГТП, глюкоза, ТГ. Проводилось биохимическое исследование крови с целью выявления синдрома цитолиза, нарушений углеводного и липидного обменов, определялся уровень инсулина крови. Уровни липидов, глюкозы и активность трансаминаз печени определялись на автоматическом биохимическом анализаторе Hitachi-912 фирмы Hoffmann-La Roche Ltd, Швейцария. При уровне гликемии плазмы натощак от 5,6 до 6,9 ммоль/л диагностировалась повышенная гликемия натощак, при уровне гликемии больше 11,1 ммоль/л верифицировался СД. Определение уровня инсулина проводилось на электрохемилюминесцентном анализаторе Liaison фирмы DiaSorin (Италия). Гиперинсулинэмия диагностирвалась при уровне инсулина белее 18 Ед/л (РГА/РОПИП 2015–16). Расчетный показатель ИР – индекс НОМА-IR (Homeostasis Model Assessment – Insulin Resistance) рассчитывался по формуле: глюкоза натощак (ммоль/л) х инсулин натощак (Ед/л)/22,5. ИР диагностировалась при индексе HOMA ≥ 2,27. Измерение скоростей кровотока в сонных артериях проводили по стандартной методике на аппарате Voluson 730 Expert. , оснащенном линейным датчиком с фазированной решеткой с частотой 7,5 МГц [6]. Предиктором стенозирующего атеросклеротического поражения сосудистой стенки принималось увеличение пиковой скорост и кровотока во внутренней сонной артерии более 110 см/с [6]. Всем пациентам было проведено УЗИ печени. УЗИ органов брюшной полости выполнялось аппарате Logiq 7 («General Electric», США) мультичастотным конвексным датчиком (2–5,5 MHz) по общепринятой в эхографии методике [7]. Статистическая обработка результатов исследования проводилась с использованием статистического пакета «Statistica», Ver.6.1 от компании StatSoft и программы Microsoft XL. Критический уровень значимости при проверке статистических гипотез принимался при уровне вероятности р ≤ 0,05.
Результаты и обсуждение
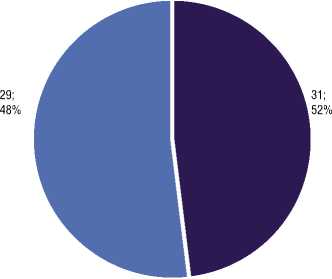
В зависимости от наличия или отсутствия цитолитического синдрома все пациенты были разделены на 2 группы: группа стеатоза (СП) – 29 обследованных (48%) и группа стеатогепатита (НАСГ) (активность трансаминаз превышала норму более чем в 2 раза) – 31 обследованный (52%) (рис. 1). В нашей работе у большинства обследо-
Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В. СОВРЕМЕННЫЕ КОНЦЕПЦИИ ПАТОГЕНЕЗА АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ СОСУДИСТОЙ СТЕНКИ У ПАЦИЕНТОВ С АБДОМИНАЛЬНЫМ ОЖИРЕНИЕМ И РАЗЛИЧНЫМИ ФОРМАМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
^е Стеатоз ^е Стеатогепатит
Рис. 1. Распределение пациентов в зависимости от наличия или отсутствия цитолитического синдрома ванных пациентов с АО установлен НАСГ (52%), что превышает результаты, полученные в исследованиях по распространенности клинических форм НАЖБП при ожирении [2, 16]. По литературным данным распространенность НАСГ среди данной категории больных составляет 18,5–26%, однако в эти работы включались пациенты с различными типами ожирения, тогда как в нашем исследовании наблюдались пациенты только с АО, для которых можно полагать более высокую частоту НАСГ [17, 20]
Возрастные характеристики и гендерный состав всех обследуемых пациентов представлен в таблице 1.
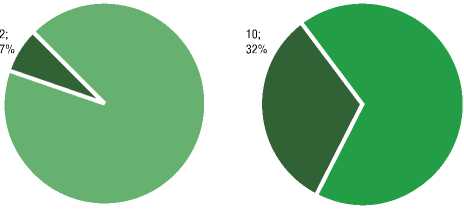
Пациентам обеих групп выполнено исследование Стеатоскрин, по результатам которого каждая из групп была разделена на 2 подгруппы (рис. 2).
После проведения Стеатоскрина в группе стеатоза у 93% обследованных (27 человек) был установлен СП первого и второго уровней в соответствии со шкалой стеатоскрина. Выраженные фиброзные изменения в печени на фоне стеатоза выявлены у 7% (2 пациента). В группе обследованных с НАСГ у 68% (21 человек) был подтвержден СП уровней 1 и 2 и у 32% (10 человек) – тяжелый фиброз уровень 3 и 4.
Средний возраст пациентов, включенных в исследование, составил 44,8 ± 2,6 года. Средняя масса тела больных в группе СП составила 102,0 [81; 6; 130,4] кг для мужчин и 96,2 [78,3; 119,6] кг для женщин, в группе НАСГ – 93,5 [70,3; 125,5] кг и 89,4 [67,3; 112,4] кг, соответственно. Средние значения ИМТ среди мужчин в группе стеатоза были 31,7 [28,4; 35,8] и 32,1 [30,3; 37,6] кг/м2 для женщин, в группе НАСГ – 33,2 [28,3; 37,9] и 34,6 [29,1; 39,8] кг/м2, соответственно. Средние значения ОТ для мужчин в группе стеатоза составили 96,96 [86; 123] см и 103,71 [85; 133] см для женщин, для пациентов с НАСГ – 101,3 [88,1; 136] см и 105,7 [87,2; 128,5] см, соответственно.
Индекс НОМА-IR, характеризующий чувствительность тканей к инсулину, у пациентов с НАСГ имел достоверно более высокие значения по сравнению с паци-
Табл. 1. Распределение пациентов по возрасту и полу в исследуемых группах
|
Показатель |
Стеатоз (n = 29) |
Стеатогепатит (n = 31) |
||
|
Мужчины |
Женщин |
Мужчины |
Женщины |
|
|
Число наблюдений, абс., (%) |
13 (45) |
16 (55) |
15 (48) |
16 (52) |
|
Средний возраст, лет |
50,63 (36,0–59,0) |
46,5 (32,0–56,0) |
44,3 (18,0–59,0) |
50,0 (43,0–59,0) |
■ S1-S2 ■ S4 ■ S1-S2 ■ S3-S4
Стеатоз (п = 29)
Стеатогепатит (п = 31)
Рис. 2. Распределение пациентов с различными формами НАЖБП в зависимости от характера и выраженности патологических изменений в печени. Примечание: S1-S2 – уровни 1 и 2 патологических изменений в печени по шкале Стеатоскрин, которые соответствуют выраженному СП (>5%), выраженный ФП отсутствует; S3-S4 – 3 и 4 уровни, интерпретируемые как тяжелый ФП при отсутствии выраженного СП и выраженный стеатофиброз, соответственно [7, 9]
HOMA-IR
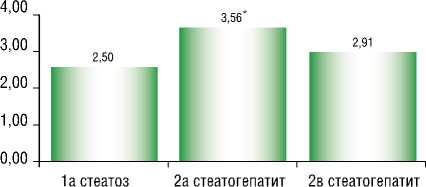
Рис. 3. Индекс НОМА-IR у пациентов с различными формами НАЖБП. Примечание : * – p < 0,001. Индекс Н – НОМА-IR (Homeostasis Model Assessment – Insulin Resistance)
ентами с нормальным уровнем активности трансаминаз (p < 0,001) (рис. 3).
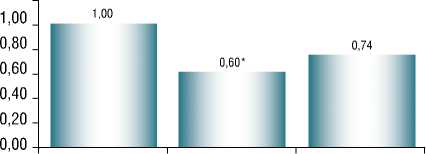
Достоверно чаще отмечались изменения показателей липидного профиля у пациентов с повышенным уровнем активности трансаминаз. Так, уровни общего холестерина (ОХ) и триглицеридов (ТГ) были достоверно выше у этих больных, чем в первой группе (рис. 4а, в). Содержание липопротеинов низкой плотности (ЛПНП) у всех пациентов с НАСГ значимо превышало показатели у больных со СП (рис. 5б). В то же время уровень липопротеинов высокой плотности (ЛПВП) у всех пациентов с НАСГ был достоверно ниже, чем в группе

Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В.
СОВРЕМЕННЫЕ КОНЦЕПЦИИ ПАТОГЕНЕЗА АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ СОСУДИСТОЙ СТЕНКИ У ПАЦИЕНТОВ С АБДОМИНАЛЬНЫМ ОЖИРЕНИЕМ И РАЗЛИЧНЫМИ ФОРМАМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
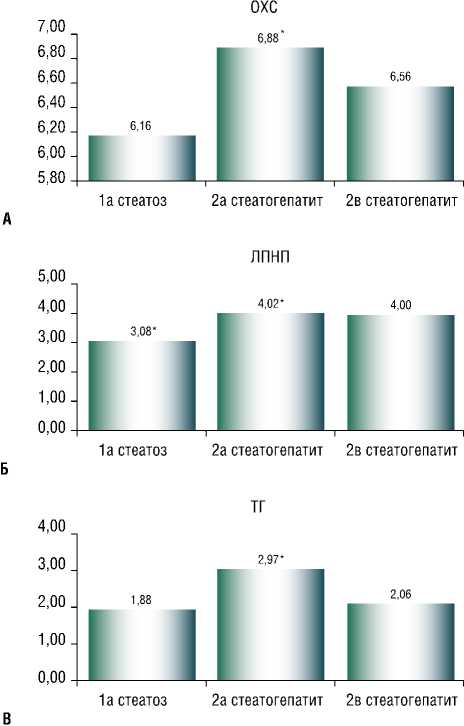
Рис. 4. Уровни ОХ (а), ЛПНП (б) и ТГ (в) у пациентов с различными формами НАЖБП. Примечание : * – Р < 0,001
лпвп
1,20
1а стеатоз 2а стеатогепатит 2в стеатогепатит
Рис. 5. Уровень ЛПВП у пациентов с различными формами НАЖБП. Примечание : * – P < 0,005
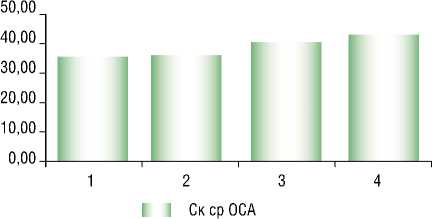
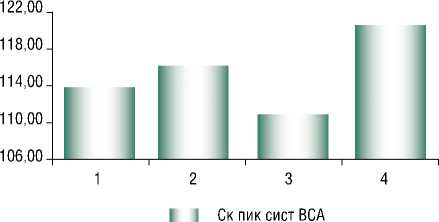
Рис. 6. Средние значения систолической скорости кровотока в ОСА и пиковой систолической скорости кровотока в ВСА у пациентов с различными патологическими изменениями в печени. Примечание : * – P = 0,002
стеатоза (рис. 5). Таким образом, в группе пациентов с НАСГ и более выраженными изменениями в печеночной ткани достоверно чаще отмечали изменения показателей липидного профиля, превышающие пороговые уровни атерогенных фракций холестерина, чем у больных без цитолитического синдрома с патологическими изменениями в печени уровней 1 и 2 по шкале Стеатоскрин.
Признаки стенозирующего атеросклероза, оцененные по параметрам скоростей кровотока во внутренней сонной и общей сонной артериях, были выявлены у большинства обследуемых больных (у 52%) и отличались между наблюдаемыми группами: средние значения систолической скорости кровотока в ОСА и пиковой систолической скорости в ВСА были достоверно выше у пациентов с патологическими изменениями в печени в виде стеатофиброза (рис. 6). При этом у пациентов с патологическими изменениями в печени в виде фиброза по данным стеатоскрина значения пиковой систолической скорости кровотока были максимальными (рис. 7). А у 31% всех обследуемых значение этого показателя превышало пороговое – 110 см/с. У 16% всех обследуемых по данным дуплексного сканирования каротидных артерий
125,00
120,00
115,00
110,00
105,00
100,00
I I Стеатоз печени I I Стеатогепатит
Рис. 7. Значения пиковой систолической скорости кровотока во внутренней сонной артерии у пациентов с различными формами НАЖБП и различными патологическими изменениями в печени. Примечание: 1 – S2 уровень патологических изменений в печени по кале Стеатоскрин. 2 – S3 уровень патологических изменений в печени по кале Стеатоскрин. 3 – S4 уровень патологических изменений в печени по шкале Стеатоскрин
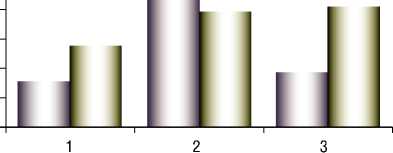
Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В. СОВРЕМЕННЫЕ КОНЦЕПЦИИ ПАТОГЕНЕЗА АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ СОСУДИСТОЙ СТЕНКИ У ПАЦИЕНТОВ С АБДОМИНАЛЬНЫМ ОЖИРЕНИЕМ И РАЗЛИЧНЫМИ ФОРМАМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ были зафиксированы нестабильные бляшки. Корреляционный анализ выявил достоверную положительную взаимосвязь наличия нестабильных бляшек с тяжестью патологических изменений в печеночной ткани по данным Стеатоскрина и выявлением жировой дистрофии печени по данным УЗИ печени (рис. 8а, б).
Вероятным объяснением полученных взаимосвязей служит состояние ИР, в условиях которой печень становится мишенью для воздействия вторичных повреждающих факторов (окислительного стресса, про-воспалительных цитокинов, кишечного эндотоксина), и сама становится источником для синтеза атерогенных фракций холестерина, поддерживает хроническое системное воспаление и усугубляет имеющиеся метаболические нарушения в организме.
Выявлена достоверно положительная взаимосвязь между уровнем ЛПНП и уровнями тяжести патологических изменений в печеночной ткани по данным стеатоскрина в обеих группах обследуемых (r = 0,5608, p = 0,0054 и r = 0,5188, p = 0,0094, соответственно). При этом взаимосвязь ЛПВП с тяжестью НАЖБП была отрицательной (r = -0,4662, p = 0,0216).
Показатели пиковой систолической скорости в ВСА, средней систолической скорости в ОСА и средней скорости в ВСА достоверно положительно коррелировали с уровнями тяжести патологических изменений в печени (r = 0,767; р = 0,002 и r = 0,723; р = 0,002, соответственно).
Метод стеатоскрин позволил выявить отчетливые взаимозависимости анализируемых показателей ИР, липидного обмена и степени патологических изменений в паренхиме печени при различных формах НАЖБП с ранними проявлениями атеросклеротического процесса. Степень проявлений атеросклеротического поражения каротидных артерий у наблюдаемых больных была наиболее выражена при сочетании дислипидемии, нарушений углеводного обмена и наличия патологических изменений в паренхиме печени.
Основным результатом проведенного исследования можно считать получение высоко достоверной зависимости прогностического фактора предиктивно указывающего на высокий риск развития стенозирующего атеросклероза – пиковой систолической скорости кровотока в ВСА – с различными уровнями тяжести патологических изменений в паренхиме печени у изучаемых пациентов (рис. 9). Полученная зависимость подтверждена статистически уравнением простой линейной регрессии (рис. 9).
Материалы исследования позволили установить взаимосвязь между наличием НАЖБП и признаками раннего атеросклероза в рамках синдрома ИР. Повышение уровня атерогенных фракций липидного профиля влияет на развитие жировой инфильтрации печени, которая, в свою очередь, способствует прогрессированию нарушений углеводного и липидного обменов в организме. НАЖБП становится одним из ранних предвестников развития атеросклероза.
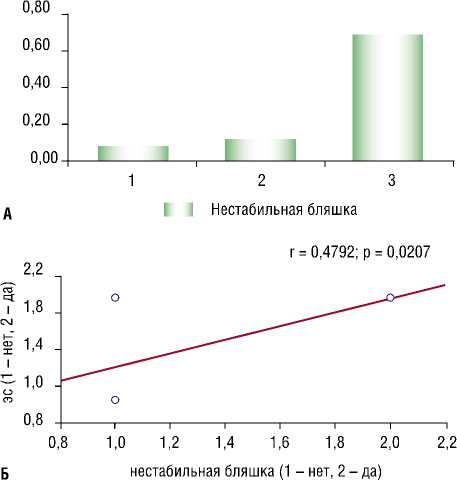
Рис. 8. А – взаимосвязь наличия нестабильных бляшек в каротидных артериях с тяжестью патологических изменений в печеночной ткани по данным стеатоскрина. Приме чание: * – p = 0,002. 1 – S2 уровень патологических изменений в печени по кале Стеатоскрин. 2 – S3 уровень патологических изменений в печени по кале Сте-атоскрин. 3 – S4 уровень патологических изменений в печени по шкале Стеатоскрин.
Б – взаимосвязь наличия нестабильных бляшек в каротидных артериях и жировой дистрофии по данным УЗИ.
Примечание: ЗС – затухание сигнала.
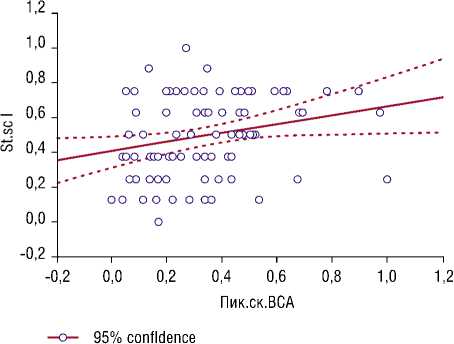
Рис. 9. Зависимость показателей скорости кровотока в каротидных артериях от тяжести патологических изменений в печени. Стеатоскрин = 0,40153 + 0,26419 Пик.ск.ВСА
Результаты, полученные клиническим врачом с помощью данного способа, являются более легко объясняемыми и позволят усовершенствовать процесс при решении вопроса о проведении биопсии или назначении адекватного лечения.
Денисов Н.Л., Гриневич В.Б., Чернецова Е.В., Корноухова Л.А., Вострикова Е.Б., Чуприна С.В., Потапова И.В.
СОВРЕМЕННЫЕ КОНЦЕПЦИИ ПАТОГЕНЕЗА АТЕРОСКЛЕРОТИЧЕСКОГО ПОРАЖЕНИЯ СОСУДИСТОЙ СТЕНКИ У ПАЦИЕНТОВ С АБДОМИНАЛЬНЫМ ОЖИРЕНИЕМ И РАЗЛИЧНЫМИ ФОРМАМИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ
Одним из существенных результатов исследования является усовершенствование диагностического значения патологии печени в развитии атеросклеротического поражения сосудистой стенки.
Выводы
-
1. Наиболее выраженными метаболическими нарушениями, ассоциированными с НАЖБП у пациентов с АО, являются гипертриглицеридемия, нарушенная гликемия натощак и ИР.
-
2. У пациентов с НАЖБП наблюдается проатерогенный сывороточный липидный профиль, который включает низкий уровень ХС ЛПВП, высокий уровень ТГ, мелких плотных частиц ЛПНП.
-
3. НАЖБП тесно взаимосвязана с метаболическими факторами риска и маркерами сердечно-сосудистых заболеваний, что может повышать риск развития и прогрессирования кардиоваскулярных осложнений и позволяет рассматривать НАЖБП как предиктор этих заболеваний.
-
4. У большинства пациентов с НАЖБП (52%) были выявлены ранние признаки стенозирующего атеросклеротического поражения сосудов в виде увеличения пиковой систолической скорости кровотока во внутренней сонной артерии.
-
5. Выявлена прямая достоверная зависимость между различными патологическими изменениями в печени и ранними предикторами стенозирующего поражения сосудов.
Список литературы Современные концепции патогенеза атеросклеротического поражения сосудистой стенки у пациентов с абдоминальным ожирением и различными формами неалкогольной жировой болезни печени
- Чернецова Е.В, Денисов Н.Л. Оценка взаимосвязи выраженности изменений в печени -стеатоза, фиброза, с метаболическими параметрами (общего холестерина, триглицеридов) у пациентов с абдоминальным ожирением и с различными формами НАЖБП. Тезисы. 22 Российская гастроэнтерологическая неделя,10.2016.
- Чернецова Е.В., Денисов Н.Л. Оценка выраженности фиброза и стеатоза в печеночной ткани у пациентов с абдоминальным ожирением и различными формами НАЖБП. Тезисы. 22 Российская гастроэнтерологическая неделя, 10.2016.
- Мохорт Т.В. «Неалкогольная жировая болезнь печени и сахарный диабет: аспекты патогенеза, диагностики и лечения» Медицинские новости, 2016, 4, 4-10.
- Кисляк О.А. Факторы риска сердечно-сосудистых заболеваний в развитии болезней, связанных с атеросклерозом. Клиническая геронтология. -2008. -Т. 14, № 3. -С. 3-11.
- Печень и атеросклероз. XXI объединенная российская гастроэнтерологическая неделя. Сателлитный симпозиум компании PROMED. CS Praha. Эффективная фармакотерапия. Гастроэнтерология №4 (51). 2015.
- Пальмер П.Е. «Руководство по ультрозвуковой диагностике». 2000 г.
- Pais R, Rusu E, Zilisteanu D, Circiumaru A, Micu L, Voiculescu M, Poynard T, RatziuV. Prognostic value of liver fibrosis and steatosis biomarkers in type-2 diabetes and dyslipidaemia. 2014 Nov;.40(9):.1081-93. Epub 2014 Sep 3. World J Gastroenterol. 2014.
- Grattagliano I, Ubaldi E,Napoli L, Marulli CF, Nebiacolombo C, Cottone C, Portincasa P. Utility of noninvasive methods for the characterization of nonalcoholic liver steatosis in the family practice. The "VARES" Italian multicenter study. 2016 Jan 29. pii: S0026-0495(16)00027-5 DOI: 10.1016/j.metabol.2016.01.012
- Sebastiani G, Alshaalan R, Wong P, Rubino M, Salman A, Metrakos P, Deschenes M, Ghali P. Cardiovascular risk across the histological spectrum and the clinical manifestations of non-alcoholic fatty liver disease: An update. 2015 Jun 14;21(22):6820-34. World J Gastroenterol. 2015 DOI: 10.3748/wjg.v21.i22.6820
- Ikura Y. Transitions of histopathologic criteria for diagnosis of nonalcoholic fatty liver disease during the last three decades Vol. 12, N6. -P. 894-900 World J Hepat ol. 2014.
- Athyros VG, Tziomalos K, Katsiki N, Doumas M, Karagiannis A, Mikhailidis DP. Low-fasting triglyceride levels are associated with non-invasive markers of advanced liver fibrosis among adults in the United States. 2015 Jul;42(1):106-16. Epub 2015 Apr 27 DOI: 10.1111/apt.13216
- Golabi P, Sayiner M, Fazel Y, Koenig A, Henry L, Younossi ZM. Simple biochemical parameters and a novel score correlate with absence of fibrosis in patients with nonalcoholicfatty liver disease. 2015 Jul;34(4):281-5. Epub 2015 Sep 4 DOI: 10.1007/s12664-015-0580-5
- Lee Min-Kyung, Park Hye-Jeong, Jeon Won Seon, et al. Higher association of coronary artery calcification with nonalcoholic fatty liver disease than with abdominal obesity in middle-aged Korean men: the Kangbuk Samsung Health Study//Cardiovascular Diabetology. -2015. -Vol. 14. -Р. 88.
- Privitera G1, Spadaro L1, Alagona C1, Calanna S1, Piro S1, Rabuazzo AM1, Purrello F2. Hepatic insulin resistance in NAFLD: relationship with markers of atherosclerosis and metabolic syndrome components. Acta Diabetol. 2016 Jun;53(3): 449-59. Epub 2015 Oct 26 DOI: 10.1007/s00592-015-0816-y
- Fracanzani AL, Tiraboschi S, Pisano G, Consonni D, Baragetti A, Bertelli C, Norata D, Valenti L, Grigore L, Porzio M, Catapano A, Fargion S. Progression of carotid vascular damage and cardiovascular events in non-alcoholic fatty liver disease patients compared to the general population during 10 years of follow-up.
- Atherosclerosis. 2016 Mar;246:208-13. Epub 2016 Jan 12. 16. Loffroy R, Terriat B, Jooste V, Robin I, Brindisi MC, Hillon P, Vergès B, Cercueil JP, Petit JM. Liver fat content is negatively associated with atherosclerotic carotid plaque in type 2 diabetic patients. Quant Imaging Med Surg. 2015 Dec; 5(6): 792-8. 10.3978/j.issn.2223-4292.2015.12.03 DOI: 10.1016/j.atherosclerosis.2016.01.016
- Sinn DH, Cho SJ, Gwak GY, Cho J, Gu S, Seong D, Kang D, Kim H, Yi BK, Paik SW. MD. Nonalcoholic Fatty Liver Disease for Identification of Preclinical Carotid Atherosclerosis. Medicine(Baltimore). 2016 Jan;95(3):e2578Doi:10.1097.
- Jacobs K, Brouha S, Bettencourt R, Barrett-Connor E, Sirlin C, Loomba R. Association of Nonalcoholic Fatty Liver Disease With Visceral Adiposity but Not Coronary Artery Calcification in the Elderly. Clin Gastroenterol Hepatol. 2016 Jan 25. Pii: S1542-3565(16)00053-7 DOI: 10.1016/j.cgh.2016.01.010
- Abenavoli L1, Milic N1, Di Renzo L1, Preveden T1, Medic-Stojanoska M1, De Lorenzo A1. Metabolic aspects of adult patients with nonalcoholic fatty liver disease. World J Gastroenterol. 2016 Aug 21;22(31):7006-16.
- Day СР. Best Pract. Res. Clin. Gastroenterol. 2002; 16:663-78.
- Anakwue, R.C. Cardiovascular Disease Risk Profiling in Africa: Environmental Pollutants are not on the Agenda R.C. Anakwue, A.C. Anakwue electronic resource. Cardio. Toxicol. -2014.
- Yki-Järvinen H1,2. Diagnosis of non-alcoholic fatty liver disease (NAFLD), Diabetologia. 2016 Apr 18.
- Targher G., Bertolini L., Padovani R., et al.//Diabetes Care. -2004. -№ 27. -Р. 2498-2500. Relations Between Carotid Artery Wall Thickness and Liver Histology in Subjects With Nonalcoholic Fatty Liver Disease.


