Современные критерии отбора пациентов для реконструкции висцеральными аутотрансплантатами верхних отделов аэродигестивного тракта при лечении злокачественных опухолей головы и шеи
Автор: Ратушный Михаил Владимирович, Поляков Андрей Павлович, Каприн Андрей Дмитриевич, Решетов Игорь Владимирович, Ребрикова Ирина Валерьевна, Мордовский Александр Валентинович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Введение. Значительная распространенность опухолей верхних отделов аэродигестивного тракта, сложность и стойкость нарушения функций дыхания, речи, глотания, сопровождающиеся длительной и нередко стойкой утратой трудоспособности, ставят проблему реабилитации и качества жизни больных в ряд важнейших социальных задач. Материал и методы. Нами накоплен опыт реконструкции глотки и пищевода различными фрагментами желудочно-кишечного тракта у 121 пациента со злокачественными опухолями. На основе собственного клинического опыта нами были сформированы основные критерии отбора пациентов после ларингэктомии для реконструкции верхних отделов аэродигестивного тракта висцеральными аутотрансплантатами. Это были полнослойные фрагменты органов брюшной полости, которые включали в себя слизистую оболочку желудка, тонкой или толстой кишки. У ряда больных выбор аутотрансплантата ограничивался большим сальником. Результаты. В 9,9 % наблюдений был отмечен некроз аутотрансплантата. Питание через рот было восстановлено у 93,9 % оперированных больных. В 90,5 % случаев после установки голосового протеза была восстановлена речевая функция. Способ аутотрансплантации подвздошно-толстокишечного лоскута позволил в один хирургический этап выполнить не только удаление пораженных опухолью органов, но и одномоментно восстановить утраченные пищепроводную и голосовую функции, не прибегая к помощи искусственных протезов, а используя только собственные ткани. Показатели 5-летней выживаемости в группе больных при одномоментной реконструкции составили 36,4 %, в группе с отсроченной реконструкцией - 67,3 %. Заключение. Использование висцеральных аутотрансплантатов при реконструкции верхних отделов аэродигестивного тракта после ларингэктомии позволяет восстановить пациентам как пищепроводную, так и голосовую функции.
Висцеральные аутотрансплантаты, реконструкция глотки, реконструкция пищевода, опухоли головы и шеи, ларингэктомия
Короткий адрес: https://sciup.org/140254500
IDR: 140254500 | УДК: 617.51/.617.53-006.04-089.843 | DOI: 10.21294/1814-4861-2021-20-3-28-38
Текст научной статьи Современные критерии отбора пациентов для реконструкции висцеральными аутотрансплантатами верхних отделов аэродигестивного тракта при лечении злокачественных опухолей головы и шеи
В 2018 г. в РФ впервые выявлено 7 128 новых случаев заболевания злокачественными опухолями гортани и 2 472 новых случая заболевания горта-ноглотки. От опухолей гортани за 2018 г. умерло 3 994 больных. Средний возраст умерших – 64,3 года [1]. Впервые выявленный диагноз рака глотки III стадии составляет 35,6 %, IV стадии – 47,1 %; гортани III стадии – 37,1 %, IV стадии – 21,4 %. Показатель летальности на первом году от момента установления диагноза при поражении глотки составляет 41,5 %, а гортани – 23 % [2]. В целом 5-летняя выживаемость при раке шейного отдела пищевода низкая (от 10 до 20 %) [3]. Среди злокачественных образований данной локализации доля эпителиальных опухолей составляет около 90 %. У 60–80 % имеются регионарные метастазы, в 50 % случаев рецидивы возникают в течение первого года наблюдения. При I–II стадии 5-летняя выживаемость достигает 60 %, при III–IV стадии – 17–32 % [4, 5].
Лечение пациентов с опухолями таких социально и функционально важных локализаций представляет большую проблему, что связано с преобладанием больных с III–IV стадией, а также обусловлено редкостью выявления болезни на ранних стадиях и недостаточным использованием наиболее эффективных методов лечения. За последние годы достигнуты большие успехи в области консервативной хирургии опухолей гортани и глотки, разработаны новые протоколы лечения для сохранения органов с химиотерапией и лучевой терапией. Современное лечение плоскоклеточного рака гортаноглотки и шейного отдела пищевода, как правило, включает в себя несколько методов. Наблюдается тенденция к резервированию хирургии в качестве процедуры спасения после неудачи других способов лечения [6]. У значительного количества пациентов отмечается резистентность опухолей к лучевой и лекарственной терапии. Лечение рецидивных опухолей возможно только хирургическим путем [7].
При местнораспространенном раке гортано-глотки для пациентов c символом T4a или наличием рецидива/продолженного роста после лучевой или химиолучевой терапии в настоящее время опе- рацией выбора остаются лишь тотальная ларингэктомия с парциальной фарингэктомией, тотальная ларингфарингэктомия или тотальная ларингфа-рингэктомия с экстирпацией пищевода. Иногда интраоперационно имеется возможность восстановить глоточную трубку путем максимального сохранения непораженной слизистой оболочки с противоположной от опухоли стороны, ее мобилизации и пластического формирования неоглотки. Но все же при распространенных процессах хирург стоит перед выбором: либо первичное восполнение дефицита тканей глотки путем увеличения времени операции за счет формирования перемещенных или свободных лоскутов для закрытия дефекта либо формирование фарингостом, фарингоэзофа-гостом и отсроченная пластика, проводимая, как правило, через несколько месяцев после курса послеоперационной лучевой терапии. Выбирая второй способ, хирург, как правило, мотивирует свой выбор соматическими проблемами пациента, нежеланием затягивать операцию, а также возможностью упростить наблюдение за пациентом в послеоперационном периоде в отношении рецидива. Несмотря на постоянное совершенствование методов комбинированного лечения, качество жизни данной группы больных значительно снижается из-за длительного зондового питания (отсроченная пластика проводится через 3–6 мес после операции) и наличия множественных стом, требующих рутинного гигиенического ухода [4].
Перспектива инвалидизации пациентов – формирование фарингостомы, эзофагостомы, трахеостомы, постоянное слюнотечение, необходимость зондового питания и т.д. – наносит непоправимый психологический ущерб. Получая зондовое питание на фоне нарушенных пищеварительных рефлексов, больные быстро истощаются. Часть больных к подобному объему хирургического лечения психологически не готова и нередко отказывается от «калечащей» операции. Решение многочисленных проблем у больных раком гортани и гортаноглотки во многом создает предпосылки и диктует необходимость проведения реабилитационных мероприятий по восстановлению утраченных или ослабленных функций, а также существенно влияет на улучшение качества жизни. Значительная распространенность опухолей верхних отделов аэродигестивного тракта, сложность и стойкость нарушенных функций дыхания, речи, глотания, сопровождающиеся длительной и нередко стойкой утратой трудоспособности, ставят проблему реабилитации и качества жизни больных в ряд важнейших социальных задач.
Качество жизни может быть улучшено с помощью реабилитационных программ, направленных на максимальное восстановление физического, психического здоровья, трудоспособности, социального статуса. Реабилитация онкологических больных – это многоэтапный процесс, принципами которого являются раннее начало реабилитационных мероприятий, дозирование нагрузки, непрерывность, последовательность, комплексный и индивидуальный подход.
Первой целью реконструкции глотки является восстановление естественного пассажа пищевого комка из полости рта в желудок, а также компенсация эстетических нарушений. Соответственно, перед пластическим хирургом ставится задача одномоментного замещения дефектов внутренней выстилки гортаноглотки и наружных покровов шеи с сохранением адекватного просвета сформированного участка пищеварительной трубки [8].
Использование кишечных лоскутов имеет ряд преимуществ перед кожными лоскутами, прежде всего из-за общности гистологического строения слизистых оболочек кишки и глотки, в связи с чем первичное заживление протекает значительно лучше в сравнении с пластикой кожным лоскутом. Применение кишечного трансплантата предполагает наличие замкнутой «пищепроводной трубки» в отличие от пластики любым кожным лоскутом. Это обстоятельство минимизирует возможность возникновения свищей и рубцовых стриктур в послеоперационном периоде [4].
Потеря голосового органа или, другими словами, потеря нормального словесного общения является самым серьезным последствием ларингэктомии у многих пациентов. Пациенты могут рассматривать потерю их голоса как потерю части их самосознания. Поэтому второй целью после реконструкции гортаноглотки является восстановление утраченной голосовой функции. Современные речевые реабилитационные системы облегчают комплексную реабилитацию после ларингэктомии [9].
Материал и методы
В МНИОИ им. П.А. Герцена за период с 1995 г. по настоящее время накоплен опыт реконструкции глотки и пищевода различными фрагментами желудочно-кишечного тракта у 121 больного со злокачественными опухолями (ЗНО) в возрасте от 25 до 73 лет. Преобладающее число составили пациенты с опухолями гортаноглотки – 35,4 %, гортани – 32,2 % и пищевода – 14 %. Среди опухолей пищевода поражение шейного отдела было у 16, среднегрудного отдела – у 1 больного. Реже опухоли локализовались в ротоглотке – 5,8 %, языке – 4,1 %, мягких тканях шеи – 2,5 %, щитовидной железе – 2,5 %, слизистой дна полости рта, паращитовидной железе, трахее и в малигнизированной кисте шеи – по 0,8 % соответственно. Морфологическая структура опухолей была различной, преобладали эпителиальные опухоли – 116 (95,9 %) больных.
Учитывая неоднородную локализацию и гистогенез опухолей, все больные были разделены на две основные группы. У 50 пациентов (41,3 %) с опухолью одномоментно с удалением выполнялась реконструкция верхних отделов аэродигестивного тракта. У 71 пациента (58,7 %) в ремиссии (без явных признаков прогрессирования опухолевого процесса) после ранее проведенного хирургического лечения с пострезекционными дефектами (68 наблюдений) или стенозами верхних пищепроводных путей (3 наблюдения) выполнялась отсроченная реконструкция.
Преобладали пациенты с отсутствием метастазов в регионарных лимфатических узлах – 87 (71,9 %). У 34 (28,1 %) больных было выявлено метастатическое поражение лимфатических узлов, при этом индекс N1 – у 15 (12,3 %), N2 – у 19 больных (15,7 %). Больных с N3 не было.
Все операции были разделены на два основных этапа. Первый этап – резекционный (удаление опухоли), второй этап – реконструктивный (восстановление верхних отделов пищепроводного тракта). В связи с распространенностью опухолевого процесса, а также общим истощением больных эти этапы операций не всегда удавалось реализовать одновременно. При выполнении радикального хирургического вмешательства на первичном очаге у больных со злокачественными опухолями ларинго-фаринго-эзофагеальной локализации дополнительно требуется выполнение операций на лимфоколлекторе шеи, что наносит дополнительную травму больному и может стать причиной развития осложнений или влиять на эффективность лечения и реабилитации. Целесообразно отметить, что большинство операций не ограничивались обширной резекцией или удалением одного органа верхних отделов аэродигестивного тракта (рис. 1).
С целью систематизации дефектов гортано-глотки, сформированных после ларингэктомии, в нашей работе за основу взята классификация фарингоэзофагеальных дефектов по Blackwell and Urken от 2010 г. [10]. По мере накопления собственного клинического опыта, мы определили ключевые анатомические ориентиры для определения границ дефектов гортаноглотки. В некоторой нашей доработке классификация по Blackwell and
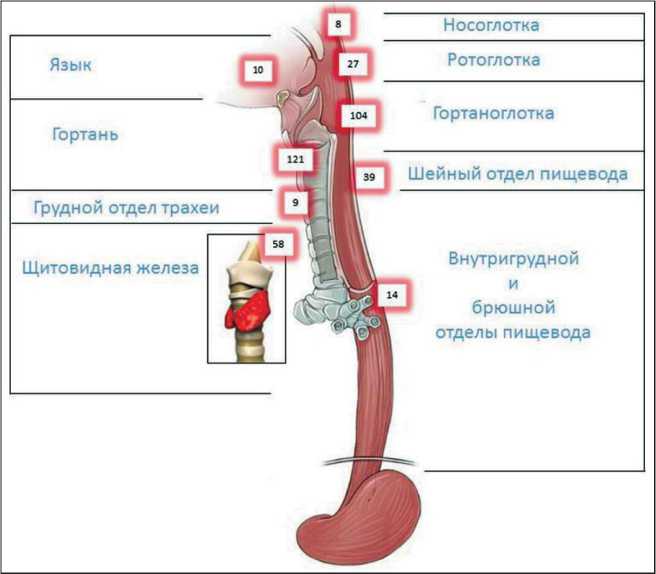
Рис. 1. Схематичное распределение больных по объему выполненных резекций органов
Fig. 1. Schematic distribution of patients in relation to the extent of organ resections
Urken существенно дополнена обозначением всех составляющих пострезекционного сложносоставного дефекта верхнего отдела аэродигестивного тракта (табл. 1). Согласно классификации, все больные были разделены на шесть типов дефектов гортаноглотки после ларингэктомии. У 2 (1,6 %) был 0 тип; I тип – 5 (4,1 %); II тип – 17 (14 %); III тип – 73 (60,3 %); IV тип – 10 (8,2 %); V тип – 14 (11,5 %) пациентов. Преимущественно были отмечены дефекты гортаноглотки III и II типа, которые составили 74,3 %.
На основе собственного клинического опыта нами были сформированы основные критерии отбора пациентов после ларингэктомии для реконструкции верхних отделов аэродигестив-ного тракта различными фрагментами желудочнокишечного тракта:
– операбельные формы первичных (cT) и рецидивных (rT) злокачественных эпителиальных опухолей полости рта, глотки и шейного отдела пищевода с/rТ1–4аN0–2M0;
Таблица 1/table 1
Классификация дефектов гортаноглотки после ларингэктомии
Classification of defects of the laryngopharynx after laryngectomy
Тип дефекта/ Type of the defect
Характеристика/Characteristics
|
0 тип/type |
Ларингэктомия без дефицита тканей/Laryngectomy without tissue deficiency |
|
I тип/type |
Ларингэктомия + дефицит покровных тканей/ Laryngectomy + integumentary tissue deficiency |
|
II тип/type |
Ларингэктомия + парциальная резекция гортаноглотки/ Laryngectomy + partial resection of the laryngopharynx |
|
III тип/type |
Ларингэктомия + циркулярная резекция гортаноглотки + резекция шейного отдела пищевода/ Laryngectomy + circular resection of the laryngopharynx + resection of the cervical esophagus |
|
IV тип/type |
Ларингэктомия + глоссэктомия/Laryngectomy + Glossectomy |
|
V тип/type |
Ларингэктомия + циркулярная резекция гортаноглотки + экстирпация пищевода/ Laryngectomy + circular resection of the laryngopharynx + extirpation of the esophagus |
– операбельные формы первичных (cT) и рецидивных (rT) злокачественных неэпителиальных опухолей области шеи с/rТ1а–2вN0–1M0;
– стенозы глотки и шейного отдела пищевода после ранее проведенного хирургического лечения по поводу ЗНО;
– дефекты пищеварительной трубки на уровне глотки и пищевода после ранее проведенного хирургического лечения по поводу ЗНО;
– отсутствие отдаленных метастазов (М0);
– общее состояние, соответствующее по шкале ECOG (0–3 балла);
– отсутствие выраженной сопутствующей патологии препятствующей микрохирургической аутотрансплантации тканей;
– пациенты, получавшие на различных этапах предшествующего лечения любые варианты лучевой терапии, химиотерапии, химиолучевой терапии, фотодинамической терапии, применения иных физических факторов воздействия на опухоль и последовательного лечения;
– возраст не является ограничивающим фактором включения в исследование.
У 121 пациента выполнена реконструкция аэродигестивного тракта с использованием 122 висцеральных аутотрансплантатов из различных фрагментов желудочно-кишечного тракта. Только в одном наблюдении была выполнена одномоментная аутотрансплантация двух лоскутов. В остальных случаях реконструкция выполнялась одним аутотрансплантатом. Аутотрансплантация выполнялась как одномоментно с резекционным этапом, так и в отсроченном периоде.
Свободная аутотрансплантация висцеральных лоскутов с формированием микрососудистых анастомозов была выполнена у 118 (97,5 %) больных. Транспозиция висцеральных лоскутов для устранения фаринго-эзофагеальных дефектов V типа без использования микрохирургической техники была выполнена у 3 (2,5%) больных.
Нами применялся достаточно широкий спектр висцеральных лоскутов из органов брюшной полости, в том числе и новый – подвздошнотолстокишечный аутотрансплантат, который был специально разработан нами и впервые в РФ внедрен в клиническую практику для одномоментного восстановления целостности пищепроводной трубки и голосовой функций, не прибегая к установке искусственного протеза
Наличие разнообразного пластического материала в брюшной полости позволило нам в зависимости от требований клинической ситуации использовать тот или иной вид аутотрансплантата. Выбирая тот или иной участок желудочно-кишечного тракта для формирования висцерального аутотрансплантата, мы учитывали тип дефекта гортаноглотки, а также состояние реципиентной раны шеи и локализацию реципи-ентных сосудов для реваскуляризации лоскута.
У 121 больного после ларингэктомии нами была выполнена реконструкция гортаноглотки с использованием 122 висцеральных аутотрансплантатов (табл. 2). При этом мы использовали 5 вариантов донорских органов брюшной полости: большой сальник, желудок, тонкую кишку, толстую кишку и комбинацию толстой и тонкой кишки (илеоцекальный угол).
Таблица 2/table 2
Донорские зоны органов брюшной полости, из которых были сформированы висцеральные аутотрансплантаты donor areas of the abdominal organs from which the visceral autografts were
|
Донорские зоны органов брюшной полости/ Donor areas of the abdominal organs |
Кол-во аутотрансплантатов/ Number of autografts |
|
Большой сальник/ Greater omentum |
6 (4,9 %) |
|
Желудок/Stomach |
55 (45 %) |
|
Тонкая кишка/Small intestine |
24 (19,6 %) |
|
Толстая кишка/Large intestine |
33 (27 %) |
|
Толстая + тонкая кишка/Large + small intestine |
4 (3,2 %) |
|
Всего/Total |
122 (100 %) |
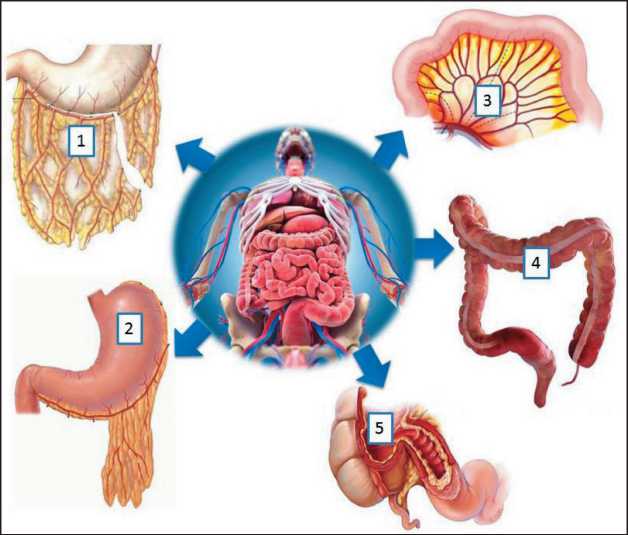
Рис. 2. Донорские зоны органов брюшной полости, из которых были сформированы висцеральные аутотрансплантаты: 1 – большой сальник; 2 – желудок; 3 – тонкая кишка; 4 – толстая кишка; 5 – толстая + тонкая кишка (илеоцекальный угол) Fig. 2. Donor areas of the abdominal organs, from which the visceral autografts were formed: 1 – greater omentum; 2 – stomach; 3 – small intestine; 4 – large intestine; 5 – large + small intestine (ileocecal angle)
только с использованием электрогортани. Со временем в качестве донорских зон, не обладающих агрессивным секретом, нами стали применяться аутотрансплантаты, сформированные из следующих отделов желудочно-кишечного тракта: толстая кишка – 33 (27 %), тонкая кишка – 24 (19,6 %), большой сальник – 6 (4,9 %) и комбинация толстого и тонкого кишечника (илеоцекальный угол) – 4 (3,2 %) больных.
Разнообразие выбора пластического материала определялось морфологическим, функциональным и топографическим критериями каждой из пяти донорских зон желудочно-кишечного тракта (рис. 2). Выбор висцерального аутотрансплантата для конкретного пациента должен отражать компромисс между типом дефекта гортаноглотки и доступными донорскими участками.
Сегментарную микрохирургическую фарингопластику выполняли у 107 больных с использованием следующих висцеральных аутотрансплантатов:
У 21 больного после сегментарной фарингопластики для восстановления голосовой функции выполнено трахеопищеводное шунтирование с установкой голосового протеза. В 10 случаях голос восстановлен с использованием голосообразующего аппарата (электрогортань).
Результаты
Максимальный срок наблюдения за оперированными пациентами достиг 18 лет. В 9,9 % наблюдений был отмечен некроз аутотрансплантата. Питание через рот было восстановлено у 93,9 % оперированных больных после аутотрансплантации висцеральных лоскутов. В 90,5 % случаев после установки голосового протеза была восстановлена речевая функция. Способ аутотрансплантации подвздошно-толстокишечного лоскута позволил в один хирургический этап выполнить не только удаление пораженных опухолью органов, но и одномоментно восстановить утраченные пищепроводную и голосовую функции, при этом не прибегая к помощи искусственных протезов, а используя только собственные ткани. Показатели 5-летней выживаемости в группе больных при одномоментной реконструкции составили 36,4 %, в группе с отсроченной реконструкцией – 67,3 %. (рис. 5). Увеличение показателей 5-летней выживаемости более чем в 2 раза у группы пациентов с отсроченной реконструкцией обусловлено тем, что пластика выполнялась не ранее чем через 6 мес после окончания противоопухолевого лечения, и фактически мы оперировали больных, излеченных от онкологического процесса и находящихся в стойкой ремиссии.
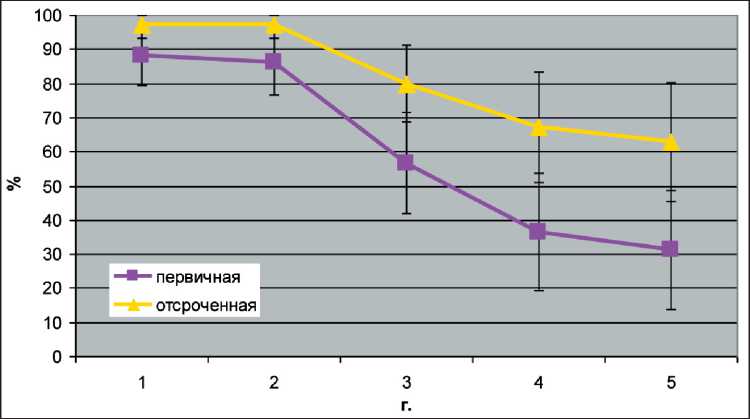
Рис. 3. Кривые выживаемости у пациентов с первичной и отсроченной реконструкцией верхних отделов аэродигестивного тракта висцеральными аутотрансплантатами
Fig. 3. Survival curves in patients with primary (red) and delayed (yellow) reconstruction of the upper aerodigestive tract with visceral autografts
Клинический пример
В 2001 г. в МНИОИ им. П.А. Герцена обратился пациент С., которому на тот момент было 38 лет. Из анамнеза: в течение нескольких месяцев периодические явления дисфагии при приеме твердой пищи. Пациент обратился к врачам по месту жительства в г. Калининграде, где после обследования был заподозрен рак щитовидной железы. Предпринята попытка тиреоидэктомии, однако во время операционной ревизии выявлена внеорган-ная опухоль шеи, вмешательство было ограничено частичным удалением опухоли с левосторонней гемитиреоидэктомией. Для дальнейшего обследования и лечения больной был направлен в Москву.
При поступлении в институт по данным осмотра определялась деформация шеи, за счет опухоли мягких тканей слева, размером до 10 см в диаметре. При пересмотре гистологических препаратов (№№ 54679–33): лейомиосаркома, в щитовидной железе – коллоидный зоб. По данным КТ: опухоль мягких тканей шеи слева, размерами 94×67×82 мм, подрастает к гортани слева и к левой и задней стенкам гортаноглотки (рис. 4).
Тактика лечения больного обсуждена на межотделенческом консилиуме, выработан план хирургического лечения. По решению консилиума от 31.10.01 выполнено удаление опухоли мягких тканей шеи, ларингэктомия с циркулярной резекцией гортаноглотки, трахео-пищеводное шунтирование с установкой голосового протеза, одномоментная микрохирургическая фарингопластика толстокишечно-сальниковым аутотран-
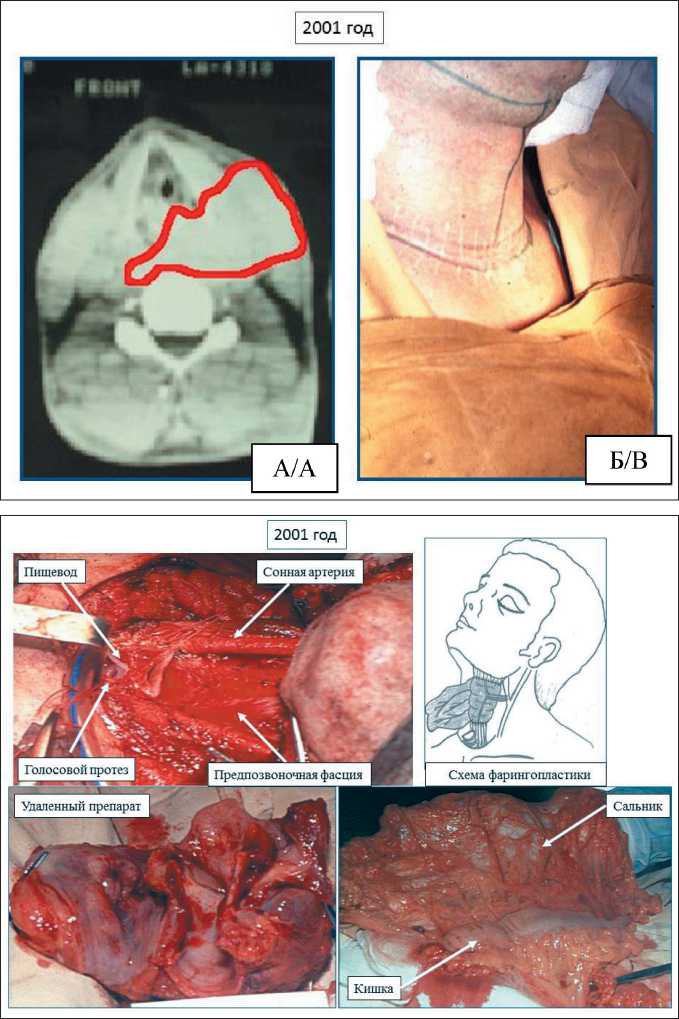
Рис. 4. А – скан компьютерной томографии (красным маркером обведены границы опухоли; Б – интраоперационная разметка доступа на шее Fig. 6. A – computed tomography scan (tumor borders are outlined in red);
B – intraoperative marking of the access on the neck
Рис. 5. Интраоперационные фото: удаление опухоли мягких тканей шеи, ларингэктомия с циркулярной резекцией гортаноглотки, трахео-пищеводное шунтирование с установкой голосового протеза, одномоментная микрохирургическая фарингопластика толстокишечно-сальниковым аутотрансплантатом
Fig. 5. Intraoperative photo: removal of the soft tissue tumor of the neck, laryngectomy with circular resection of the laryngopharynx, tracheo-esophageal bypass surgery with the installation of a voice prosthesis, simultaneous microsur-gical pharyngoplasty with colonic omental autograft
сплантатом. В блок удаляемых тканей включены мягкие ткани шеи, гортаноглотка, гортань и 5 колец трахеи. После завершения резекционного этапа операции сформирован III тип дефекта гор-таноглотки. Дном раны являлась предпозвоночная фасция. По краям – волокна кивательных мышц и магистральные сосуды шеи. Вверху ротоглотка и корень языка, внизу шейный отдел пищевода. С целью голосовой реабилитации произведено трахео-пищеводное шунтирование с установкой голосового протеза. Для фарингопластики был использован толстокишечно-сальниковый аутотрансплантат в виде трубки длиной 17 см (рис. 5). Длина питающей ножки аутотрансплантата (6 см) позволила анастомозировать средние ободочные сосуды с левыми верхними щитовидными сосудами. После пуска кровотока произведена дополнительная реваскуляризация сальникового фрагмента трансплантата путем анастомозирования правых желудочно-сальниковых сосудов с правыми лицевыми сосудами. Формирование органных анастомозов выполняли в определенной последовательности, обусловленной анатомическими особенностями сшиваемых органов. В первую очередь оформляли толстокишечнопищеводное соустье, т.к. временная мобильность противоположного конца кишечной трубки создавала условия для атравматичных манипуляций в наименее доступной зоне трахеопищеводной борозды и наложения прецизионного шва на пищевод, что было крайне важно для обеспечения гладкого заживления ран. В соответствии с диаметром ре- зецированного края шейного отдела пищевода был иссечен нижний край кишечной трубки аутотрансплантата и вскрыт ее просвет. После эвакуации толстокишечного содержимого сопоставлены края сшиваемых органов. Вначале сформирована задняя губа анастомоза путем наложения первого ряда отдельных швов на мышечную оболочку пищевода и серозно-мышечный слой толстокишечного фрагмента аутотрансплантата. Второй ряд швов наложен в слизисто-подслизистом слое. Затем, двухрядно, сформирована передняя губа анастомоза, при этом узлы швов на слизистой погружены в просвет органа. После этого иссечен противоположный конец кишечной трубки аутотрансплантата. Сформировано толстокишечно-оральное соустье по типу «конец в конец» двухрядными швами по аналогичной методике. При этом после формирования задней губы анастомоза устанавливлен назогастральный зонд, проводимый под визуальным контролем через вновь формируемую неоглотку в желудок для кормления больного в послеоперационном периоде. Дигестивные анастомозы на шее укрыты прядью большого сальника. Также сальниковой порцией аутотрансплантата изолированы магистральные сосуды шеи и вход в верхнюю грудную апертуру. Оставшуюся часть сальника использовали для контурной пластики мягких тканей шеи. Отсе-парованные кожно-жировые лоскуты шеи фиксированы между собой частично. Дефект кожных покровов шеи восстановлен расщепленной дермой с бедра. В брюшной полости операция была закон-
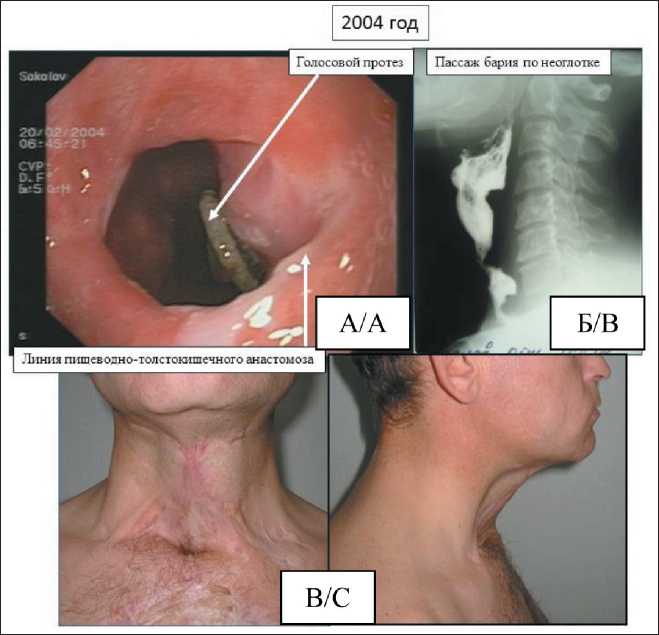
Рис. 6. Фото пациента С. через 3 года после операции:
А – эндофото просвета неоглотки с грибковым поражением голосового протеза;
Б – рентгенологическое исследование неоглотки с контрастированием; В – внешний вид тканей шеи.
Fig. 6. Photo of patient S. 3 years after surgery: A – endophoto of the lumen of the neopharynx with a fungal lesion of the voice prosthesis; B – X-ray examination of the neopharynx with contrast;
С – neck tissues
чена формированием межкишечного анастомоза по типу «конец в конец», дренированием и ушиванием лапаротомной раны.
Течение послеоперационного периода гладкое. Раны зажили первичным натяжением. На 14-е сут после операции восстановлено питание через рот. Проведены первые занятия по произнесению слов с использованием голосового протеза.
При плановом морфологическом исследовании операционного материала (№№ Л 22267–85): малодифференцированая G3 лейомиосаркома мягких тканей шеи с врастанием в пищевод до подслизистого слоя, с инвазией на ограниченном участке хрящей трахеи. Опухоль неоднородна по строению, на большом протяжении представлена структурами высокодифференцированной лейомиосаркомы. В краях резекции элементов опухолевого роста не обнаружено, в 5 лимфоузлах метастазов не выявлено.
На повторном консилиуме рекомендовано проведение 2 курсов химиотерапии по схеме САРО. Пациент выписан в удовлетворительном состоянии. Рекомендованные курсы лекарственного лечения проведены по месту жительства в Калининградском онкологическом диспансере.
При контрольных обследованиях в 2002 и 2003 гг. данных за прогрессирование опухолевого процесса не получено. Подвижность шеи восстанавлива-
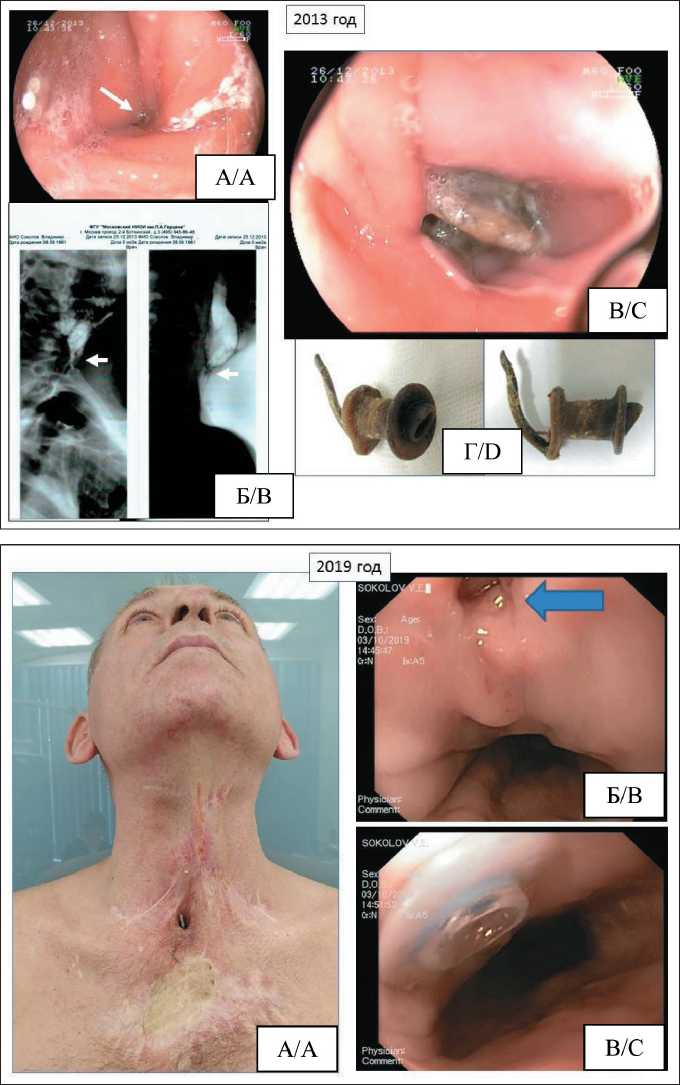
Рис. 7. Фото пациента С. через 12 лет после операции:
А – эндофото зоны стеноза неоглотки; Б – рентгенологическое исследование неоглотки (стрелкой указана область стеноза неоглотки); В – эндофото просвета неоглотки с грибковым поражением голосового протеза; Г – фото извлеченного голосового протеза пораженного колониями грибков
Fig. 7. Photo of patient S. 12 years after the operation: A – endophoto of the zone of neopharyngeal stenosis;
B – X-ray examination of the neopharynx (the arrow indicates the area of neopharyngeal stenosis); С – endophoto of the lumen of the neopharynx with fungal lesions of the voice prosthesis; D – photo of the extracted voice prosthesis affected by colonies of fungi
Рис. 8. Фото пациента С. через 18 лет после операции: А – внешний вид тканей шеи; Б – эндофото неоглотки с трахео-пищеводным соустьем после миграции голосового протеза; В – эндофото просвета неоглотки с вновь установленным новым голосовым протезом
Fig. 8. Photo of patient S. 18 years after surgery: A – appearance of neck tissues; B – endophoto of the neopharynx with tracheo-esophageal fistula after migration of the voice prosthesis; С – endophoto of the neopharyngeal lumen with a newly installed new voice prosthesis
лась в полном объеме. Рубцовый процесс в мягких тканях не выражен. Пациент питался в полном объеме без ограничений. Диспептических явлений не отмечалось. Полностью освоил методику голосообразования с использованием голосового протеза. Речь внятная, громкая. В 2004 г. обратился с жалобами на подтекание слюны через голосовой протез и поперхивание. При обследовании выявлено грибковое поражение голосового протеза (рис. 6). Произведена замена голосового протеза, в течение 9 лет повторных обращений в клинику не было.
В 2013 г. пациент отметил явления дисфагии при приеме твердой и полужидкой пищи. Повторно обратился в МНИОИ им. П.А. Герцена. При обследовании данных за рецидив опухоли нет, но выявлено резкое сужение просвета неоглотки и грибковое поражение голосового протеза (рис. 7). Учитывая неясную причину стеноза, выполнена ревизия мягких тканей шеи, при которой выявлен рубцовый тяж между брыжейкой толстокишечного аутотрансплантата и сальником, вызывающий сужение просвета кишки, без нарушения кровоснабжения. После рассечения спайки просвет
Список литературы Современные критерии отбора пациентов для реконструкции висцеральными аутотрансплантатами верхних отделов аэродигестивного тракта при лечении злокачественных опухолей головы и шеи
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 c.
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2018 году. М., 2019. 236 c.
- Haughey B.H. The jejunal free flap in oral cavity and pharyngeal reconstruction. Otolaryngol Clin North Am. 1994 Dec; 27(6): 1159-70.
- Остринская Т.В., Жуманкулов А.М., Анисимова А.В. Реконструкция постоперационных дефектов при опухолях гортаноглотки и шейного отдела пищевода. Опухоли головы и шеи. 2017; 7: 39-46.
- Keereweer S., de Wilt J.H., Sewnaik A.,Meeuwis C.A., Tilanus H.W., Kerrebijn J.D. Early and long-term morbidity after total laryngopharyngec-tomy. Eur Arch Otorhinolaryngol. 2010; 267(9): 1437-44. 10.1007/ s00405-010-1244-9. DOI: 10.1007/s00405-010-1244-9
- Chepeha D.B. Reconstruction ofthe Hypopharynx and Esophagus. 2015. [Internet]. URL: https://clinicalgate.com/reconstruction-of-the-hypopharynx-and-esophagus/ (cited: 06.04.2018).
- Pujo K., Philouze P., Scalabre A., Ceruse P., Poupart M., Buiret G. Salvage surgery for recurrence of laryngeal and hypopharyngeal squa-mous cell carcinoma: A retrospective study from 2005 to 2013. Eur Ann Otorhinolaryngol Head Neck Dis. 2018; 135(2): 111-117. 10.1016/j. anorl.2017.11.001. DOI: 10.1016/j.anorl.2017.11.001
- Schultz P., Dupret-Bories A., Ciftci S., Fath L. Hypopharyngeal reconstruction using a circular stapler. 2018. [Internet]. URL: https://www.sciencedirect.com/science/article/pii/S1879729618300139?via%3Dihub(cited:09.04.2018).
- Lorenz K.J. Rehabilitation after Total Laryngectomy-A Tribute to the Pioneers of Voice Restoration in the Last Two Centuries. Front Med (Lausanne). 2017 Jun 26; 4: 81. DOI: 10.3389/fmed.2017.00081
- Urken M.L. Multidisciplinary Head and Neck Reconstruction: A Defect Oriented Approach. Philadelphia, PA: Wolters Kluwer/Lippincott Williams & Wilkins; 2010: 689-773.


