Современные подходы к диагностике гиперплазии эндометрия
Автор: Дамиров М.М., Юрченко О.Б., Титова Г.П., Боровкова Н.В., Иерусалимский А.П.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 6 т.14, 2024 года.
Бесплатный доступ
Актуальность. В последние годы отмечается рост частоты разных нозологических форм эндометриальной гиперплазии, которую диагностируют у 38–72 % женщин репродуктивного возраста. Информативность применяемых методов инструментальной диагностики колеблется от 47 до 89 %. В патогенезе гиперплазии эндометрия важную роль играет нарушение баланса процессов пролиферации, диф-ференцировки и гибели клеток. Целью исследования явилось изучение информативности инструментальных методов диагностики у жен-щин с разными видами гиперплазии эндометрия, а также анализ некоторых показателей апоптоза в крови и ткани эндометрия у пациенток с гиперплазией эндометрия без атипии и у пациенток с атипической гиперплазией эндометрия. Объект и методы. Проведено комплексное клинико-инструментально-биохимическое исследование 36 пациенткам репродуктивного возраста (средний возраст 45,7 ± 3,41 года) с разными видами эндометриальной гиперплазии. У всех пациенток применяли клинические, эхографические, гистероскопические и мор-фо-биохимические методы исследований. Исследуемые были разделены на две группы. Первую группу составили 25 (69,4 %) женщин с гиперплазией эндометрия без атипии; вторую группу образовали 11 (30,6 %) пациенток с атипической гиперплазией эндометрия. Прове-дён сравнительный анализ применяемых методов диагностики, который сопоставили с морфологическим методом. Результаты. Выполне-но исследование некоторых показателей апоптоза в крови и ткани эндометрия у женщин изучаемых групп. Установлено, что у пациенток с гиперплазией эндометрия без атипии и атипической гиперплазией эндометрия имело место нарушение регуляции клеточного гомеостаз, за счёт дисбаланса факторов апоптоза и пролиферации клеток. Выводы. Снижение концентрации факторов, инициирующих апоптоз сопровождается снижением индукции программируемой гибели клеток эндометрия. Нарушение регуляции апоптоза приводит к снижению содержания и отмене цикличности изменений количества апоптотических клеток в эндометрии.
Гиперплазия эндометрия, атипическая гиперплазия эндометрия, апоптоз, гистероскопия
Короткий адрес: https://sciup.org/143184017
IDR: 143184017 | DOI: 10.20340/vmi-rvz.2024.6.CLIN.5
Текст научной статьи Современные подходы к диагностике гиперплазии эндометрия
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Compliance with ethical principles. The authors confirm that they respect the rights of the people participated in the study, including obtaining informed consent when it is necessary.
Cite as: Damirov M.M., Yurchenko O.B., Titova G.P., Borovkova N.V., Ierusalimskiy A.P. Modern approaches to the diagnosis of endometrial hyperplasia. Bulletin of the Medical Institute “REAVIZ”: Rehabilitation, Doctor and Health. 2024;14(6):78–86.

Актуальность
Проблема гиперплазии эндометрия (ГЭ) приобрела особую значимость в нашей стране, как и во многих других странах мира, в связи со значительным ростом частоты этой патологии у женщин разных возрастов [1–5].
ГЭ, клинически проявляющаяся аномальным маточным кровотечением, является одной из самых частых причин обращения женщин репродуктивного и перименопаузального возрастов за гинекологической помощью [6–9]. Наметилась тенденция к «омоложению» этой патологии, что проявляется увеличением частоты диагностики разных видов ГЭ у женщин молодого возраста [6, 10, 11]. Рост частоты заболеваемости ГЭ связывают с неблагоприятной экологической обстановкой, с увеличением числа женщин с метаболическими нарушениями, с ростом числа хронических соматических заболеваний [1, 4, 12]. Эти болезни, чаще всего, сочетаясь с нейроэндокринными расстройствами, сопровождающимися нарушениями обмена веществ (ожирение, гипертоническая болезнь, гиперлипидемия, сахарный диабет и др.), образуют синдром системных нарушений со снижением иммунитета, которые создают условия, влияющие на рост частоты ГЭ [2, 9, 13].
Возрастание частоты ГЭ связано не только с истинным её учащением, но и с привлечением внимания широкого круга практических врачей к данной проблеме, с внедрением в клиническую практику новых неинвазивных методов диагностики (ультразвуковое сканирование, магнитно-резонансная томография (МРТ), компьютерная томография (КТ) [1, 5, 11, 14, 15]. Информативность применяемых инструментальных методов в диагностике этой патологии колеблется от 47 до 89 %, причём нередко встречаются случаи как гипо-, так и гипердиагностики заболеваний [2, 6]. Необходимо отметить, что применяемые инструментальные методы являются опе-раторзависимыми, и получаемые при их использовании данные во многом зависят от применяемой для диагностики аппаратуры, квалификации врача и его клинического опыта. В связи с этим проблема диагностики и лечения пациенток с ГЭ остаётся одной из наиболее актуальных в современной медицине.
Термином «гиперплазия» обозначают увеличение числа структурных элементов тканей, возникающее как компенсаторная реакция на утрату ткани того же самого вида или на повышенные функциональные требования, которые нормальное количество тканевых элементов не может удовлетворить, или же как результат нарушенного гормонального контроля ткани (абсолютной и/или относительной гиперэстрогении, возникающей на фоне отсутствия или недостаточного антиэстрогенного влияния прогестерона) [13, 16, 17]. Данные изменения могут быть причиной развития как ГЭ, так и онкологической патологии.
Согласно современной Бинарной классификации эндометриальной гиперплазии, принятой ВОЗ в 2014 году , нашедшей свое отражение в гистологической классификации опухолей женской половой системы (World Health Organization (WHO) Classification of Tumours of Female Reproductive Organs, 2014) , выделяют: ГЭ без атипии и атипическую гиперплазию эндометрия (АГЭ) [1, 2, 6, 18]. На основании генетических, биологических и гистологических данных было предложено использовать новые термины: «доброкачественная гиперплазия эндометрия» и «эндометриальная интраэпителиальная неоплазия» (Endometrial Intraepithelial Neoplasia - EIN) [1,3, 18].
Принятые две формы ГЭ отражают два возможных пути развития заболевания – путь гиперплазии с низкой и высокой вероятностью исхода в рак эндометрия (РЭ). Отмечено, что относительный риск прогрессии до инвазивной карциномы у пациенток с ГЭ без атипии относительно низкий и составляет 1,01–1,03 %, тогда как у женщин с АГЭ он колеблется от 14 до 45 % [1, 2, 6, 19]. Риск развития злокачественной трансформации у пациенток с разными нозологическими формами определяется морфологическими особенностями заболевания, длительностью течения и сопутствующей коморбидной патологией [1, 5, 9, 13, 20].
Aпоптоз и пролиферативная активность – два параллельно протекающих процесса в гормональнозависимых органах [21–23]. Оба процесса регулируют гомеостаз в нормальных, доброкачественных и злокачественных тканях [24]. В основе патогенеза развития ГЭ лежит дисрегуляция пролиферации и апоптотической гибели клеток, что обуславливает нарушение клеточного гомеостаза [2, 21]. Вместе с тем ранее не проводили исследования по изучению некоторых показателей апоптоза в крови и ткани эндометрия у женщин с ГЭ без атипии и у пациенток с АГЭ.
Таким образом, ГЭ – это сложная и многогранная проблема гинекологии. Имеющийся в настоящее время объём данных не даёт целостного представления о патогенезе заболевания и его пусковых механизмах. Разноречивость данных об информативности применяемых дополнительных методов исследования требует совершенствования диагностики и лечения пациенток с этой патологией.
Целью исследования явилось изучение информативности инструментальных методов диагностики у больных с разными видами ГЭ, а также анализ некоторых показателей апоптоза в крови и ткани эндометрия у больных с ГЭ без атипии и у пациенток с АГЭ.
Объект и методы
Материалом исследования явились данные комплексного обследования 36 женщин репродуктивного возраста (средний возраст 45,7 ± 3,41 года), находившихся на лечении в НИИ СП им. Н.В. Склифосовского с 2023 по 2024 гг. У всех женщин изучали анамнез жизни, учитывался преморбидный фон, перенесённые в прошлом общесоматические и гинекологические заболевания, особенности менструальной, половой и генеративной функции. Особое внимание уделяли жалобам, анамнезу заболевания и состоянию репродуктивной функции. Всем женщинам проводили общеклиническое, а также комплексное инструментальное обследование (ультразвуковое исследование органов малого таза; гистероскопия и/или гистерорезектоскопия с раздельным диагностическим выскабливанием (РДВ) эндоцервикса и эндометрия, морфологическое исследование биоптатов, а также сравнительный анализ некоторых показателей апоптоза в крови и ткани эндометрия у пациенток с ГЭ без атипии и у пациенток с АГЭ ).
Для уточнения клинического диагноза проводили обследование пациенток с помощью современных инструментальных методов: трансвагинальное УЗИ органов малого таза в 2D- и 3D-режимах, которое выполняли на ультразвуковом аппарате Voluson S10 (Корея) с использованием трансвагинального датчика 5 МГц. Выполняли продольное и поперечное сканирование внутренних гениталий с определением положения матки, её размеров, характеристики внутренней структуры, срединного маточного эха (М-эха) и состояния придатков матки.
Всем исследуемым была выполнена гистероскопия и/или ГРС с раздельным диагностическим выскабливанием эндоцервикса и эндометрия. Визуализацию внутренней поверхности матки проводили с помощью эндоскопического оборудования фирмы «Storz» (Германия). При выполнении электрохирургической биполярной гистерорезектоскопической технологии в качестве жидкости для расширения полости матки применяли 0,9 % раствор NaCl. Аппаратный поток жидкости – 400 мл/мин, аппаратное давление подаваемой жидкости – 150 мм рт. ст. Все операции проводили под общим обезболиванием.
У всех пациенток перед раздельным лечебнодиагностическим выскабливанием в полость матки вводили мягкий ёршик и аккуратными вращательными движениями собирали биологический материал. Ёршик помещали в пробирку типа «Eppendorf» с раствором Хенкса, затем в течение ближайшего времени пробирку доставляли в лабораторию для проведения исследования. После извлечения ёршика пробирки центрифугировали, отбирали надосадок, а осаждённые клетки эндометрия разводили буферным раствором, содержа- щим ионы кальция. Затем клетки метили аннекси-ном V, меченным FITC и ДНК-специфическим красителем 7 аминоактиномицином D (7AAD). Подсчёт клеток на ранних (Annexin V+/7AAD–) и поздних (Annexin V+/7AAD+) стадиях апоптоза подсчитывали на проточном цитометре. Также у пациенток из кубитальной вены забирали кровь. Методом проточной цитометрии подсчитывали в крови число CD95 позитивных лимфоцитов, а также концентрацию лимфоцитов на ранних и поздних стадиях апоптоза. В плазме крови методом мультиплексного анализа оценивали концентрацию белков, регулирующих внешний путь индукции апоптоза клеток. На платформе Luminex 200 определяли концентрацию в плазме растворимого Fas (sFas), растворимого Fas-лиганда (sFasL), фактора некроза опухолей, а также лиганда, индуцирующего апоптоз, связанный с TNF (TRAIL), с использованием реагентов MILLIPLEX MAP. Результаты полученных исследований выражали в пг/мл и нг/мл.
Заключительным и решающим методом диагностики разных видов эндометриальной гиперплазии являлось гистологическое исследование соскоба слизистой оболочки матки, полученного после её диагностического выскабливания [25–28]. Исследование материала проводили в отделе патологической анатомии института. Морфологическую картину интерпретировали в соответствии с гистологической классификации опухолей женской половой системы (World Health Organization (WHO) Classification of Tumours of Female Reproductive Organs, 2014) [18].
В зависимости от результатов морфологического исследования женщины были распределены на две группы. Первую группу составили 25 (69,4 %) человек, у которых при гистологическом исследовании диагностировали ГЭ без атипии; во вторую группу вошли 11 (30,6 %) пациенток с АГЭ. В группу сравнения для оценки показателей апоптоза лимфоцитов крови были включены 20 здоровых женщин (ЗЖ) доноров репродуктивного возраста, а также 20 пациенток, у которых при диагностическом выскабливании не была диагностирована гинекологическая патология.
Статистическую обработку полученных данных проводили с использованием методов вариационной статистики, подсчитывали медиану (Ме), первый и третий квартили. При сравнении независимых переменных использовали критерий Манна – Уитни. Различия считали достоверными при уровне значимости р < 0,05.
Результаты и обсуждение
Большинство пациенток (22 из 36) с ГЭ были госпитализированы в институт с клиникой аномальных маточных кровотечений из половых путей. Они про- являлись в виде обильных менструальных кровотечений у 15 женщин из 1-й группы и у 7 – из 2-й группы. Межменструальные кровяные выделения беспокоили 11 (30,6 %) женщин (8 пациенток из 1-й группы и 3 – из 2-й группы). У 3-х пациенток при неоднократном эхографическом исследовании органов малого таза было диагностировано утолщение структур срединного М-эхо в 1-ю фазу менструального цикла, что явилось основанием для госпитализации для уточнения клинического диагноза. Следует отметить, что 4 (11,1 %) женщины предъявляли жалобы на вторичное бесплодие.
Анализ перенесённых заболеваний пациентками с ГЭ показал, что в разные возрастные периоды жизни все женщины переболели несколькими инфекционными и общесоматическими заболеваниями. В детском возрасте и в периоде полового созревания, являющимся первым критическим этапом постнатального созревания репродуктивной системы, детскими инфекционными, ОРВИ, хроническим тонзиллитом неоднократно болели 29 (80,5 %) человек с ГЭ. Анализ репродуктивной функции показал, что большинство пациенток с ГЭ (27–75,0 %) имели беременности, однако более половины из них имели одни роды. Большинство женщин с ГЭ неоднократно выполняли искусственное прерывание беременности, причём осложнения возникали у каждой четвертой пациентки. Различные гинекологические операции были произведены у 5 (13,8 %) исслелуемых, что подтверждает точку зрения о роли локальных изменений, происходящих в матке после различных гинекологических заболеваний, в возникновении ГЭ.
Таким образом, у женщин с ГЭ определяется высокая частота многочисленных разносистемных ко-морбидных заболеваний, оказывающих существенное влияние на возникновение метаболических нарушений, играющих важную роль в возникновении и развитии ГЭ. Необходимо отметить, что у большинства женщин эти общесоматические заболевания были диагностированы до выявления ГЭ. Выступая в качестве факторов, повреждающих центральный механизм регуляции половой системы, перенесённые заболевания нарушают функциональное состояние нейроэндокринной системы и служат благоприятным фоном для развития ГЭ. Анализируя анамнестические данные, следует подчеркнуть, что, несмотря на индивидуальные различия, вся группа пациенток с разными видами ГЭ была однородной, что подтверждает современные представления об общем механизме их возникновения.
При проведении ультразвукового исследования у женщин с подозрением на ГЭ особое внимание обращали на толщину и структуру передне-заднего размера срединного М-эха (отражение от эндометрия и стенок полости матки) и сопоставляли полу- ченные данные с параметрами, характерными для репродуктивного возраста и фазы менструального цикла [1, 11, 15]. Тонкое однородное М-эхо соответствовало полному отторжению функционального слоя эндометрия, тогда как локальное или равномерное увеличение толщины передне-заднего размера срединного М-эхо расценивали как подозрение на патологию эндометрия [10, 14].
Для диагностики ГЭ применяли наиболее характерные ультразвуковые признаки, описанные в литературе [1, 11, 15], такие как:
-
• повышение эхогенности эндометрия в пролиферативную фазу цикла;
-
• неоднородная структура эндометрия, мелкие ан- или гипоэхогенные включения;
-
• утолщение эндометрия;
-
• прерывистый наружний контур М-эха;
-
• васкуляризация эндометрия с ИР 0,43–0,60.
Наиболее достоверными из этих признаков являлись возрастание передне-заднего размера срединного М-эхо; повышение эхогенности и неоднородная структура эндометрия (рис. 1). На фоне практически неизмененного эндометрия нередко диагностировали участки повышенной эхогенности, что позволяло заподозрить наличие ГЭ.
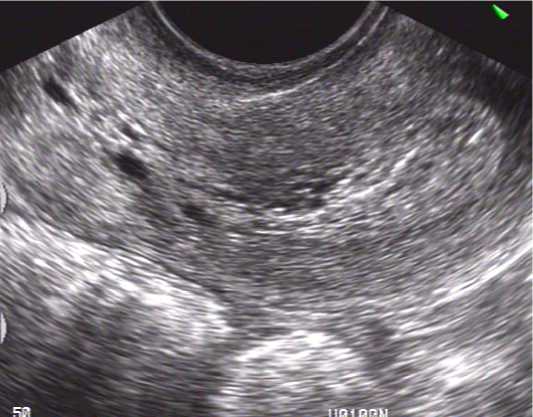
Рисунок 1. Продольное трансвагинальное сканирование. Подозрение на гиперплазию эндометрия
Figure 1. Longitudinal transvaginal scan. Suspected endometrial hyperplasia
Большинство исследователей считают, что достоверных эхографических признаков АГЭ нет [14, 15]. Проф. В.Н. Демидов описывает данное патологическое образование как достаточно однородное по структуре и повышенной эхогенности, с утолщением структуры передне-заднего размера срединного М-эхо [15]. Нами не были установлены патогномоничные изменения структуры эндометрия, позволявшие на сканограммах достоверно диагностировать АГЭ.
Информативность метода в диагностике разных нозологических форм ГЭ составила 72,2 ± 7,57 %, что согласуется с данными других исследователей [11].
Следует отметить, что проведение эхографии органов малого таза позволяло детально изучать структуру матки, но не давало возможности достоверно диагностировать разные нозологические формы ГЭ, поскольку диагностика базируется на визуализации изменений эндометрия на тканевом уровне, недостаточном для точной верификации диагноза. Руководствуясь данным положением, на основании результатов эхографического исследования выносили заключение о подозрении на наличие патологии эндометрия без уточнения его нозологической формы, требующей эндоскопически-морфологической верификации.
Классическим диагностическим методом при подозрении на патологию эндометрия является его хирургическое удаление путём выскабливания [1, 6, 7]. Следует учитывать, что при выполнении раздельного диагностического выскабливания врачами высокой квалификации полное удаление всего эндометрия наблюдается только у 35–50 % пациенток, причём среди не удалённых тканей могут быть как доброкачественные, так и злокачественные ткани [1, 2, 14]. В Национальном руководстве по гинекологии отмечено, что «…даже опытным гинекологам при раздельном диагностическом выскабливании слизистой оболочки матки без гистероскопии не удаётся удалить полностью или диагностировать патологический субстрат в матке в 43–96 % наблюдений» [14]. При раннем инвазивном раке однократное раздельное диагностическое выскабливание позволяет идентифицировать злокачественный процесс только в 62 % наблюдений [9].
Поэтому, диагностическое выскабливание следует проводить только под визуальным гистероскопическим контролем, позволяющим проверить «качество» выскабливания стенок полости матки и для того, чтобы убедиться в полном удалении функционального слоя эндометрия. Нередко диагностика патологии базируется на основании изучения небольшого участка ткани эндометрия. Выскабливание стенок полости матки проводили цугами, чтобы не повредить тканевую структуру эндометрия. Материал, получаемый после такого выскабливания не осложняет работу морфологам и позволяет поставить правильный диагноз.
Для визуализации состояния внутренней поверхности матки всем 36 пациенткам, у которых при эхографическом исследовании диагностировали подозрение на ГЭ, проводили гистероскопию. Давая 5–7-кратное увеличение, гистероскопия позволяла визуально оценивать состояние всех стенок полости матки, а после удаления функционального слоя эндометрия дать заключение о характеристике его базального слоя. Исследование у всех пациенток проводили операционным гистероскопом.
Гистероскопия обладает наибольшей информативностью в выявлении топики патологического процесса в полости матки, являясь «золотым стандартом» обследования пациенток с подозрением на ГЭ [1, 6, 29].
ГЭ без атипии имела различную эндоскопическую характеристику и степени её распространённости (диффузная или очаговая форма поражения). При диффузной форме эндометрий был неравномерно утолщён, с относительно ровной поверхностью, имел различную цветовую окраску от бледнорозовой до бледно-жёлтой. Кроме того, местами определяли расширенные железы и участки с расширенным сосудистым рисунком. В большинстве наблюдений (18 случаев – 72,0 %) диагностировали диффузное поражение ГЭ всех стенок полости матки, тогда как у остальных имело место его очаговое развитие.
При АГЭ наблюдали широкую вариабельность гистероскопической картины. При начальном развитии заболевания эндоскопическая картина имела практически такие же изменения, как при полиповидной ГЭ, только с большим числом расширенных желез. При прогрессировании процесса визуализировали значительно более пышное разрастание эндометрия с большим числом расширенных желез (по типу «саговых зерен») с атипической зоной васкуляризации. Последняя характеризовалась наличием полиморфных не анастомозирующих между собой сосудов, имевших различную форму.
Информативность метода в выявлении разных нозологических форм ГЭ составила 88,9 ± 5,30 %.
Наибольшую информативность в диагностике разных видов эндометриальной гиперплазии представляет собой морфологическое исследование при условии правильного забора материала.
Проведено изучение некоторых показателей апоптоза в крови и ткани эндометрия у пациенток с ГЭ без атипии и у пациенток с АГЭ.
Апоптоз представляет собой активный программируемый процесс со сложной системой регуляции на разных уровнях – от генетического до рецепторного аппарата [21, 24, 30, 31]. Основной биологической функцией апоптоза является поддержание клеточного гомеостаза за счёт элиминации клеток, исчерпавших свой физиологический ресурс, а также клеток с нерепарируемыми повреждениями ДНК. В норме существует баланс между процессами пролиферации и апоптоза клеток в ткани [21, 22, 23]. Регуляция апоптотической гибели клеток уравновешивает процесс их новообразования, что особенно выражено в быстро обновляющихся тканях. Увеличение количества пролиферирующих клеток влечёт за собой усиление процессов апоптоза [21,
-
23]. Подавление (снижение) апоптоза приводит к возникновению и развитию ГЭ.
Результаты показателей апоптоза лимфоцитов крови у пациенток с ГЭ без атипии и с АГЭ представлены в табл. 1. При обследовании венозной крови достоверных различий показателей апоптоза лимфоцитов у пациенток сравниваемых групп не было выявлено. Следует отметить, что концентрация CD95 позитивных лимфоцитов у пациенток обеих групп была выше, чем у здоровых женщин.
Содержание в венозной крови лимфоцитов на ранних (Annexin V+/7AAD–) и поздних стадиях апоптоза у пациенток обеих групп значимо не различалась и соответствовала норме. В то же время в эндометрии у пациенток с гиперплазией с атипией содержание апоптотических клеток было достоверно ниже, чем у женщин с гиперплазией без атипии (табл. 2). Следует отметить отсутствие вариативности этого показателя у пациенток обеих групп, свойственной здоровым женщинам и связанной с мен- струальным циклом. Таким образом, как нами описано ранее [19], при гиперплазии у женщин в эндометрии отмечается снижение индукции апоптотиче-ской гибели клеток, при этом у пациенток с атипией это снижение более выражено.
Концентрация белков, индуцирующих апоптоти-ческую гибель клеток (sFasL, alfa-TNF, TRAIL), в плазме крови пациенток с гиперплазией эндометрия снижалась по сравнению с показателями здоровых женщин (табл. 3). Статистически значимое снижение отмечено для TRAIL, более выраженное снижение которого отмечено у пациенток с атипией. Растворимая форма Fas относится к ингибиторам апопто-тической гибели клеток. Концентрация sFas в крови пациенток с гиперплазией без атипии была повышена почти в 2 раза по сравнению со здоровыми женщинами. В то же время при атипии уровень растворимого Fas в плазме регистрировался в пределах нормы и был достоверно ниже по сравнению с его содержанием у женщин с ГЭ без атипии.
Таблица 1. Показатели апоптоза лимфоцитов крови у пациенток с гиперплазией эндометрия без атипии и с атипией Table 1. Blood lymphocyte apoptosis indices in patients with endometrial hyperplasia without atypia and with atypia
|
Показатели |
Здоровые женщины |
1-я группа - гиперплазия |
2-я группа - гиперплазия |
|
(n = 20) |
эндометрия без атипии |
эндометрия с атипией |
|
|
Me (Q1; Q3) |
(n = 25) |
(n = 11) |
|
|
Me (Q1; Q3) |
Me (Q1; Q3) |
|
CD95+ лимфоциты, % |
23,8 ( 19,6; 28,1) |
35,9 (25,1; 45,6) |
37,1 (30,2; 39,3) |
|
p = 0,024* |
p = 0,006* |
||
|
Лимфоциты на ранней стадии апоптоза, % |
6,43 (5,2; 8,0) |
4,6 (3,4; 5,5) |
6,3 (2,8; 8,3) |
|
Лимфоциты на поздних стадиях апоптоза, % |
0,04 (0,01; 0,10) |
0,02 (0,01; 0,05) |
0,02 (0,01; 0,04) |
Примечание: * – различия по сравнению с нормой значимы, критерий М-U.
Таблица 2. Показатели апоптоза клеток эндометрия у пациенток с гиперплазией эндометрия без атипии и с атипией Table 2. Endometrial cell apoptosis rates in patients with endometrial hyperplasia without atypia and with atypia
|
Показатели |
1 -я группа - гиперплазия эндометрия без атипии (n = 25) Me (Q1; Q3) |
2-я группа - гиперплазия эндометрия с атипией (n = 11) Me (Q1; Q3) |
Р |
|
Клетки эндометрия на ранних стадиях апоптоза, % |
3,0 (1,8; 4,9) |
2,1 (1,4; 3,6) |
0,039 |
|
Клетки эндометрия на поздних стадиях апоптоза, % |
0,26 (0,10; 0,84) |
0,25 (0,10; 0,63) |
0,306 |
Таблица 3. Концентрация в плазме крови белков, участвующих в регуляции внешнего пути апоптоза клеток у пациенток с гиперплазией эндометрия Table 3. Plasma concentration of proteins involved in the regulation of the extrinsic pathway of cell apoptosis in patients with endometrial hyperplasia
|
Показатели |
Здоровые женщины (n = 20) Me (Q1; Q3) |
1-я группа - гиперплазия без атипии (n = 25) Me (Q1; Q3) |
2-я группа - гиперплазия с атипией (n = 11) Me (Q1; Q3) |
|
sFas, ng/ml |
0,82 (0,75; 1,01) |
1,62 (1,11; 1,80) р = 0,001 |
0,66 (0,60; 0,77) р = 0,295; р 1 = 0,002 |
|
sFasL, pg/ml |
66,1 (43,1; 80,9) |
41,0 (12,6; 74,3) р = 0,149 |
40,5 (28,0; 49,2) р = 0,072; р 1 = 0,858 |
|
Фактор некроза опухолей альфа, pg/ml |
16,8 (12,6; 24,3) |
14,5 (10,9; 28,3) р = 0,814 |
13,4 (10,5;14,6) р = 0,108; р 1 = 0,449 |
|
TRAIL, pg/ml |
247 (201; 283) |
206 (172; 229) р = 0,030 |
190 (172; 219) р = 0,019 ; р 1 = 0,858 |
Внешний путь индукции апоптоза клеток осуществляется посредством взаимодействия белков суперсемейства фактора некроза опухоли со своими рецепторами, экспрессированными на цитоплазматической мембране. Поступление сигнала при межклеточном взаимодействии или путём присоединения к советующему рецептору растворимой формы лиганда, определяет выживание клетки или её гибель, что в конечном итоге обеспечивает поддержание клеточного гомеостаза, наиболее важного в быстро обновляющихся тканях. Нарушение процессов элиминации отработавших клеток эндометрия лежит в основе развития гиперплазии и неопластических процессов. Проведённое исследование выявило нарушение индукции апоптотиче-ской гибели клеток эндометрия у пациенток с разными видами ГЭ. Для этой патологии характерно снижение концентрации в плазме крови растворимых факторов, индуцирующих апоптоз клеток. Также при ГЭ без атипии в крови повышается концентрация ингибиторов апоптоза. Нарушение регуляции апоптоза приводит к снижению содержания и отмене цикличности изменений количества апопто-тических клеток в эндометрии. При АГЭ снижение уровня апоптоза клеток эндометрия обусловлено более серьёзными нарушениями регуляции и требует более глубокого изучения.
Заключение
Таким образом, диагностика ГЭ далека от своего совершенства. Среди дополнительных инструментальных методов наибольшей информативностью в диагностике ГЭ обладает гистероскопия. Для лучшей диагностики ГЭ целесообразно проводить интерпретацию сканограмм с одновременным учётом результатов клинического обследования. Комплексное применение инструментальных методов диагностики способствует повышению точности диагностики разных нозологических форм этой патологии. Правильная интерпретация врачом акушером-гинекологом морфологических данных различных видов ГЭ крайне важна, так как позволяет разрабатывать персонифицированную тактику ведения пациентов. Проведённое исследование выявило нарушение индукции апоптотической гибели клеток эндометрия у пациенток с разными видами ГЭ. Для этой патологии характерно снижение концентрации в плазме крови растворимых факторов, индуцирующих апоптоз клеток. В крови у пациенток с ГЭ без атипии повышается концентрация ингибиторов апоптоза. Нарушение регуляции апоптоза приводит к снижению содержания и отмене цикличности изменений количества апоптотических клеток в эндометрии. При АГЭ снижение уровня апоптоза клеток эндометрия обусловлено более серьёзными нарушениями регуляции и требует более глубокого изучения. Следует констатировать, что накопилось много нерешённых вопросов в патогенезе, диагностике и лечении ГЭ, которые требуют научного освещения и дальнейших разработок.
Список литературы Современные подходы к диагностике гиперплазии эндометрия
- Акушерство и гинекология: клинические рекомендации; под редакцией Г.М. Савельевой, В.Н. Серова, Г.Т. Сухих. 4-е изд. Москва; ГЭОТАР-Медиа; 2019:1007. Obstetrics and Gynecology: Clinical Guidelines; edited by G.M. Savelyeva, V.N. Serova, G.T. Dry. 4th ed. Moscow; GEOTAR-Media; 2019:1007. (In Russ).
- Дамиров М.М. Гиперплазия эндометрия. Москва: ГЭОТАР-Медиа; 2023:232. Damirov M.M. Endometrial hyperplasia. Moscow: GEOTAR-Media; 2023:232. (In Russ).
- Коренная В.В., Масс Е.Е., Колода Ю.А., Полетова Т.Н. Гиперпластические процессы эндометрия: новый взгляд на проблему. Эффективная фармакотерапия. Эндокринология. 2018;3(26):34-39. Korennaya V.V., Mass E.E., Koloda Yu.A., Poletova T.N. Hyperplastic processes of the endometrium: a new look at the problem. Effective pharmacotherapy. Endocrinology. 2018;3(26):34-39. (In Russ).
- Оразов М.Р., Михалева Л.М., Муллина И.А. Гиперплазия эндометрия: современный взгляд на проблему. Акушерство и гинекология: новости, мнения, обучение. 2022;10(3):62-67. Orazov M.R., Mikhaleva L.M., Mullina I.A. Endometrial hyperplasia: a modern view of the problem. Obstetrics and gynecology: news, opinions, training. 2022;10(3):62-67. (In Russ).
- Свиридова Н.И., Ткаченко Л.В., Яхонтова М.А., Гриценко И.А., Максимов С.Н., Пурясева К.А. Гиперпластические процессы эндомет-рия: современные подходы к диагностике и лечению. Акушерство, Гинекология и Репродукция. 2024;18(1):83-95. Sviridova N.I., Tkachenko L.V., Yakhontova M.A., Gritsenko I.A., Maksimov S.N., Puryaseva K.A. Hyperplastic processes of the endometrium: modern approaches to diagnostics and treatment. Obstetrics, Gynecology and Reproduction. 2024;18(1):83-95. (In Russ). https://doi.org/10.17749/2313-7347/ob.gyn.rep.2023.464
- Гиперплазия эндометрия: клинические рекомендации. Российское общество акушеров-гинекологов; НП Совет Минздрава РФ. Москва; 2021. Endometrial hyperplasia: clinical guidelines. Russian Society of Obstetricians and Gynecologists; NP Council of the Ministry of Health of the Russian Federation. Moscow; 2021. (In Russ). https://cr.minzdrav.gov.ru/schema/646_1
- Дамиров М.М. Аномальные маточные кровотечения. Москва: ГЭОТАР-Медиа; 2022:192. Damirov M.M. Abnormal uterine bleeding. Moscow: GEOTAR-Media; 2022:192. (In Russ).
- Доброхотова Ю.Э., Сапрыкина Л.В. Гиперплазия эндометрия. 2-е изд. Москва; ГЭОТАР-Медиа; 2019:109. Dobrokhotova Yu.E., Saprykina L.V. Endometrial hyperplasia. 2nd ed. Moscow; GEOTAR-Media; 2019:109. (In Russ).
- Новикова Е.Г., Чулкова О.В., Пронин С.М. Предрак и начальный рак эндометрия у женщин репродуктивного возраста. Москва: МИА; 2005:136. Novikova E.G., Chulkova O.V., Pronin S.M. Precancer and initial cancer of the endometrium in women of reproductive age. Moscow: MIA; 2005:136. (In Russ).
- Гинекология: руководство для врачей; под редакцией В.Н. Серова, Е.Ф. Кира. Москва; Литтера; 2008:840. Gynecology: a manual for doctors; edited by V.N. Serov, E.F. Kira. Moscow; Littera; 2008:840. (In Russ).
- Озерская И.А. Эхография в гинекологии. 2-е изд., перераб. и дополн. Москва: Издательский дом Видар–М; 2013:564. Ozerskaya I.A. Echography in gynecology. 2nd edition, revised and supplemented. Moscow: Vidar-M Publishing House; 2013:564. (In Russ).
- Манухин И.Б., Тумилович Л.Г., Геворкян М.А. Клинические лекции по гинекологической эндокринологии. Москва: МИА; 2001:247. Manukhin I.B., Tumilovich L.G., Gevorkyan M.A. Clinical lectures on gynecological endocrinology. Moscow: MIA; 2001:247. (In Russ).
- Бохман Я.В. Руководство по онкогинекологии. Санкт-Петербург: Фолиант; 2002:542. Bohman Ya.V. Handbook of oncogynecology. Saint Petersburg: Foliant; 2002:542. (In Russ).
- Гинекология: национальное руководство: под ред. В.И. Кулакова, И.Б. Манухина, Г.М. Савельевой [и др.]. Москва; ГЭОТАР-Медиа; 2011:1079. Gynecology: a national manual: eds. V.I. Kulakova, I.B. Manuhina, G.M. Savelyeva [et al.]. Moscow; GEOTAR-Media; 2011:1079. (In Russ).
- Демидов В.Н., Гус А.И. Эхография органов малого таза у женщин: практ. пособие. Вып. 4. Патология полости матки и эндометрия. ВМК. Москва: БИНОМ; 2016. Demidov V.N., Gus A.I. Echography of the pelvic organs in women: practical. manual. Issue 4. Pathology of the uterine cavity and endometrium. VMC. Moscow: BINOM; 2016. (In Russ).
- Кондриков Н.И. Патология матки: руководство для врачей. Москва; Практическая медицина; 2008:348. Kondrikov N.I. Pathology of the uterus: a guide for doctors. Moscow; Practical Medicine; 2008:348. (In Russ).
- Опухоли тела и шейки матки. Морфологическая диагностика и генетика: руководство для врачей; под ред. Ю.Ю. Андреевой, Г.А. Франка. Москва: Практическая медицина;2015: 304. Tumors of the body and cervix of the uterus. Morphological diagnostics and genet-ics: a guide for doctors; edited by Yu.Yu. Moscow: Practical Medicine; 2015: 304. (In Russ).
- Emons Т, Beckmann MW, Schmidt D, Mallmann P. New WHO Classification of Endometrial Hyperplasias. Geburtshilfe Frauenheilkd. 2015;75(2):135-136.
- Подзолкова Н.М., Коренная В.В. Современные представления об этиологии, патогенезе и принципах лечения гиперплазии эндо-метрия. Акушерство и гинекология. 2021;8:192-199. Podzolkova N.M., Korennaya V.V. Modern concepts of the etiology, pathogenesis and principles of treatment of endometrial hyperplasia. Obstetrics and Gynecology. 2021;8:192-199. (In Russ). https://dx.doi.org/10.18565/aig.2021.8.192-199
- Рак эндометрия; под ред. И.В. Берлева, Л.М. Берштейна, А.Ф. Урманчеевой. Санкт-Петербург: Эко-Вектор; 2017:263. Endometrial cancer; edited by I.V. Berleva, L.M. Bershteina, A.F. Urmancheeva. St. Petersburg: Eco-Vector; 2017:263. (In Russ).
- Боровкова Н.В., Дамиров М.М., Олейникова О.Н. и др. Исследования апоптоза клеток эндометрия у больных с гиперпластическими процессами эндометрия. Вестник Тверского государственного университета. Серия: Химия. 2023;4(54):160-169. Borovkova NV, Dami-rov MM, Oleynikova ON, et al. Studies of endometrial cell apoptosis in patients with endometrial hyperplastic processes. Vestnik Tverskogo gosudarstvennogo universiteta. Seriya: Khimiya. 2023;4(54):160-169. (In Russ). https://doi.org/10.26456/vtchem2023.4.20
- Ярилин А.А. Основы иммунологии. Москва: Медицина;1999:608. Yarilin AA Fundamentals of Immunology. Moscow: Medicine;1999:608. (In Russ).
- Манько В.М., Девришов Д.А. Ветеринарная иммунология. Фундаментальные основы. Москва: Агровет; 2011:752. Man'ko VM, Devrishov DA. Veterinary Immunology. Fundamental Principles. Moscow: Agrovet; 2011. (In Russ).
- Никонов А.А. О разногласиях при гистологической диагностике гиперпластических состояний и онкологической патологии эндо-метрия. Вопросы онкологии. 1990;36(9):1071-1076. Nikonov A.A. On disagreements in histological diagnostics of hyperplastic conditions and oncological pathology of the endometrium. Issues of oncology. 1990;36(9):1071-1076. (In Russ).
- Толибова Г.Х., Траль Т.Г., Коган И.Ю., Олина А.А. Эндометрий. Атлас. Москва: Медиабюро StatusPraesens; 2022:181. Tolibova G.Kh., Tral T.G., Kogan I.Yu., Olina A.A. Endometrium. Atlas. Moscow: Media Bureau StatusPraesens; 2022:181. (In Russ).
- Cree I.A., White V.A., Indave B.I., Lokuhetty D. Revising the WHO classification: female genital tract tumours. Histopathology. 2020;76(1): 151-6. https://dx.doi.org/10.1111/his.13977
- Dallenbach-Hellweg G, Schmidt D, Dallenbach F. Atlas of Endometrial Histopathology. 3rd ed. Dallenbach-Hellweg ; Springer-Verlag Berlin Heidelberg; 2009:25.
- Ищенко А.И. Новые технологии и малоинвазивная хирургия в гинекологии. Москва: ГЕОТАР-МЕД; 2004:136. Ishchenko A.I. New technologies and minimally invasive surgery in gynecology. Moscow: GEOTAR-MED; 2004:136. (In Russ).
- Dai H, Zhao S, Xu L, et al. Expression of Efp, VEGF and bFGF in normal, hyperplastic and malignant endometrial tissue. Oncol Rep. 2010;23(3):795-799.
- Driák D., Dvorská M, Švandov I, et al. Changes in expression of some apoptotic markers in different types of human endometrium. Folia Biologica (Czech Republic). 2011;57(3):104-111.


