Современные подходы к лучевому лечению опухолей полости рта
Автор: Титова Вера Алексеевна, Снигирева Галина Петровна, Петровский Владимир Юрьевич, Телышева Е.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.15, 2016 года.
Бесплатный доступ
Рост частоты плоскоклеточного рака орофарингеальной области (ОФО) и преобладание местнораспространенных форм опухоли у 60 % с ранним инфильтративным ростом и метастазированием в региональные лимфатические узлы до 40 % снижают результаты лечения. Сочетание в едином курсе лечения операции, лучевой терапии и химиотерапии не исключает риск локорегиональных рецидивов у 30-60 %, а изолированных метастазов у 18 % больных. У больных в возрасте 50 лет с опухолями ОФО 5-летнее излечение не превышает 40 %. При этом включение в программы лучевого и комбинированного лечения полихимиотерапии (ПХТ) повышает результативность традиционных методов до 69 %. Внедряются новые технологии конформной дистанционной лучевой терапии (КЛТ); высокомощностной (HDR) брахитерапии с радиомодифицирующими агентами и ПХТ, в том числе таргетными препаратами. Однако КЛТ 66-70 Гр обеспечивает локальный контроль при 5-10-летнем наблюдении у 57 %; локорегиональный - у 50 %, с общей выживаемостью - 47 % и 35 % соответственно. Имеются данные о выявлении мутаций в гене EGFR при злокачественных заболеваниях полости рта и глотки. Направленное применение таргетных препаратов - блокаторов EGFR, например цетуксимаба (эрбитукса), в первой линии терапии плоскоклеточного рака головы и шеи увеличивает показатели выживаемости. С другой стороны, повышенная экспрессия гена EGFR может коррелировать с прогрессированием заболевания и плохим прогнозом. Цель исследования - представить новые технологии конформной дистанционной ЛТ с брахитерапией источником 192Ir и химиотерапией у 30 больных раком ОФО с оценкой присутствия ретроспективно исследованной мутации в гене EGFR. Результаты конформной дистанционной лучевой терапии и HDR брахитерапии зависели от локализации опухоли в полости рта, стадии и распространенности процесса, прогностических факторов и схем лечения. КЛТ улучшила результаты мультимодального лечения и качество жизни пациентов: общая выживаемость у больных раком губы составила 100 %; у больных раком языка - 66,7 %, у больных раком слизистой дна рта - 75 %. Мутации гена EGFRv.III не были выявлены ни в одном из исследованных образцов опухоли. Положительный эффект от таргетной терапии эрбитуксом не был зарегистрирован ни у одного из двух пролеченных больных с отсутствием мутаций гена EGFR.
Плоскоклеточный рак полости рта, органосохраняющее комплексное сочетанное лучевое лечение, таргетная терапия эрбитуксом, hdr брахитерапия, ген egfr
Короткий адрес: https://sciup.org/140254070
IDR: 140254070 | УДК: 616.31-006.6:615.849 | DOI: 10.21294/1814-4861-2016-15-5-47-54
Текст научной статьи Современные подходы к лучевому лечению опухолей полости рта
Несмотря на совершенствование диагностических и терапевтических методов, отмечается рост частоты плоскоклеточного рака орофарингеальной области (ОФО) – язык, дно полости рта, слизистая щеки и красная кайма губ, – который, не являясь социально значимым, остается неблагоприятным с позиции преобладания местнораспространенных форм опухоли III–IV стадии у 60 % из впервые обратившихся больных. Опухоли характеризуются ранним инфильтративным ростом и частым метастазированием в региональные лимфатические узлы – до 40 %; у 20 % больных диагностируют их двухстороннее поражение [1–3]. Метастазы в лим- фатических узлах существенно влияют на эффект лечения, и, несмотря на сочетание хирургического лечения, лучевой терапии и химиотерапии, у 30– 60 % больных сохраняется риск прогрессирования заболевания в виде локорегиональных рецидивов/ метастазов, у 18 % – изолированных метастазов [2]. Особую проблему представляют пациенты в возрасте до 50 лет, у которых опухоли ОФО характеризуются агрессивным течением, а 5-летнее излечение не превышает 35–40 %. Улучшение результатов обеспечивается включением в программы лучевого и комбинированного лечения полихимиотерапии (ПХТ) с общей выживаемостью до 69 % [4–6].
Достижения в области лечения опухолей ОФО обусловлены развитием хирургических методов, особенно малоинвазивных технологий с роботизированными комплексами, что расширяет показания для органосохраняющего лечения; расширением возможностей реконструктивно-пластической хирургии с эндопротезированием и биоинженерной пластикой даже при местнораспространенном раке ОФО; адекватным использованием в различных комбинациях физических методов: лазерной абляции, криогенного воздействия, ультразвуковой деструкции и фотодинамической терапии [7–11]. Значительная роль в повышении эффективности лечения рака ОФО принадлежит новым технологиям конформной лучевой терапии (КЛТ) в сочетании с высокомощностной контактной лучевой терапией (ЛТ) в условиях радиомодифицирующих средств [3, 12–18], а также эволюционному развитию системной терапии, в том числе с использованием таргетных препаратов [5, 6, 13, 19–21].
Сочетанное использование дистанционной КЛТ с суммарной очаговой дозой 50 Гр и контактной гамма-терапии – 192Ir, HDR СОД 17 Гр фракциями ¾ Гр на первичную опухоль обеспечивает локальный контроль при 5–10-летнем наблюдении у 57 % больных; локорегиональный – у 50 %, с общей выживаемостью – 47 и 35 % соответственно [16, 18]. Частота лучевых осложнений (ЛО) – язвенных мукозитов III степени – достигает 12 %; остеомиелитов – 1–3 % [22]. Совершенствование аппаратурного оснащения и медицинских технологий ЛТ рака полости рта (например, интенсивно модулируемая лучевая терапия) гарантирует снижение частоты ЛО III степени до 8 % [13, 14].
Прогностическими факторами являются стадия заболевания с учетом метастатического поражения регионарных лимфатических узлов и размеры первичной опухоли, особенно у больных, подвергавшихся ЛТ без лимфаденэктомии. Включение ПХТ в программы радикальной лучевой терапии рака ОФО сопровождается усилением токсического воздействия на окружающие нормальные органы и ткани. В этой ситуации оправданным является применение различных радиомодификаторов.
Злокачественные новообразования характеризуются генетическими и эпигенетическими нарушениями, которые определяют фенотип опухоли. Молекулярно-генетический анализ опухолей позволяет расширять список генов, которые могут быть вовлечены в канцерогенез, что, в свою очередь, имеет большое значение для выбора эффективной противоопухолевой терапии на основе поиска «предикторных маркеров» (ПМ). Одним из них является ген EGFR, кодирущий белок, который относится к группе трансмембранных рецепторных тирозинкиназ и в норме отвечает за передачу пролиферативного сигнала внутрь клетки. Связывание факторов роста со специфическими мембранными рецепторами, обладающими тирозинкиназной активностью, вызывает активацию Ras/Raf/Mek/ Mapk и PI3K/Akt/mTOR сигнальных путей, что приводит к активному клеточному росту, пролиферации опухолевых клеток, инвазии, метастазированию и стимуляции опухолевого ангиогенеза. В ряде злокачественных опухолей (до 20 % опухолей, исследованных в рамках проекта COSMIK) часто выявляются активирующие соматические мутации в гене EGFR (точечные замены, делеции, амплификация), которые влияют на экспрессию или активность рецептора эпидермального фактора роста (EGFR). При многих опухолях наблюдается повышенная экспрессия гена EGFR, которая коррелирует с прогрессированием заболевания и плохим прогнозом. Наличие определенного типа соматических мутаций в гене EGFR связано с высокой чувствительностью опухоли к ингибиторам тирозинкиназ (гефитиниб, эрлотиниб). Одна из наиболее изученных и часто встречающихся мутаций в этом гене – EGFRvIII, представляющая собой делецию фрагмента кодирующей части гена со второй буквы 30-го по первую букву 297 кодона [c.89_889del1801]. Прогностическая значимость этого мутантного гена пока до конца не изучена, хотя и имеются данные об использовании его в качестве маркера не инвазивного мониторинга опухолевого роста. Кроме того, мутация EGFRvIII может быть использована как важный ПМ – ее наличие ассоциировано с устойчивостью к моноклональным антителам против EGFR и потенциальной чувствительностью к гефитинибу и эрлотинибу. Имеются немногочисленные данные о выявлении мутаций в гене EGFR при злокачественных заболеваниях полости рта и глотки [23–25]. Среди них именно для опухолей ОФО привлекает внимание использование таргетных препаратов с их способностью избирательно связываться непосредственно с клетками опухоли [5, 19, 23]. При этом плоскоклеточный рак ОФО может характеризоваться гиперэкспрессией рецепторов к эпидермальному фактору роста (EGFR), а моноклональные антитела способны избирательно блокировать эти рецепторы. Поэтому обоснованным следует считать применение таргетных препаратов – блокаторов EGFR [13, 21]. Это касается моноклональных антител, среди которых эффективным рассматривается цетуксимаб (эрбитукс) для лечения плоскоклеточного рака головы и шеи [12]. Эрбитукс и ХТ в первой линии терапии плоскоклеточного рака головы и шеи увеличивают показатели выживаемости. Медиана выживаемости без прогрессирования увеличивается до 5–5,6 мес против 3,3 мес после ХТ. Медиана общей выживаемости увеличивается при приеме таргетных препаратов с ХТ до 9,8–10,1 мес против 7,4 мес.
Актуальность анализа делеции EGFRvIII для ответа на ингибиторы тирозинкиназ (гефитиниб, эрлотиниб) до сих пор остается под вопросом. У пациентов с рецидивом глиомы, которые получали эрлотиниб или гефитиниб, экспрессия EGFRvIII в сочетании с экспрессией гена PTEN была описана как положительный ПМ [6, 21]. В противоположность этому никакой связи между коэкспрессией генов EGFRvIII и PTEN и ответом на лечение эрлотинибом (анализ рецидивов) не было выявлено в большом рандомизированном исследовании [23]. Имеются данные, что мутации в гене EGFR при раке головы и шеи коррелируют с повышением клинического ответа на проводимую лекарственную терапию [26].
Высокая экономическая составляющая современных методов лечения злокачественных опухолей ОФО требует, наряду с традиционными клинико-диагностическими концепциями лечения, анализа ряда качественных характеристик опухолевого процесса, которые могут оказать независимое влияние на результаты лечения и прогноз исхода заболевания. Поэтому роль ПМ признается достаточно высокой с позиции индивидуализации лечения и прогнозирования эффекта, в том числе ЛТ [5, 23]. Однако проведение исследований, уточняющих наличие или отсутствие ПМ, сегодня сопряжено с экономическим обременением самих пациентов, так как административные органы, обслуживающие онкологических больных, не включают в алгоритм обязательного исследования целый ряд ПМ, влияющих на персонифицированный выбор метода лечения.
Настоящая работа направлена на усовершенствование методов комплексного лечения опухолей ОФО и попытку определения клинической значимости некоторых ПМ рака с позиции имеющегося международного опыта их применения, в частности делеционной мутации EGFR vIII [18, 27].
Целью исследования являлось изучение эффекта современной КЛТ с ретроспективной оценкой статуса гена EGFR опухолей ОФО у пациентов, получивших КЛТ.
Материал и методы
В ФГБУ РНЦРР МЗ РФ с 1989 г. разрабатываются технологии комплексного и комбинированного лечения (радикальная сочетанная и послеоперационная ЛТ, фотодинамическая терапия) опухолей ОФО [11, 28] и изучаются способы мониторирования радиационного эффекта с широким привлечением современных методов визуализации, рекомендуемых для диагностики опухолей ОФО [29]. За 2013–2014 гг. в Центре под наблюдением находилось 30 больных раком ОФО, у которых ретроспективно был проведен анализ мутационного статуса гена EGFR (определение делеции EGFR vIII) в опухоли у 30 больных: рак языка – 15 больных; рак дна полости рта – 9; рак нижней губы – 6 больных. Среди них женщин было 6; мужчин – 24. Возраст больных варьировал от 32 до 85 лет, средний возраст 58 лет (при раке языка – 50,9 года; раке дна рта – 45,6 года; раке губы – 70,6 года). У
29 больных морфологически был диагностирован плоскоклеточный ороговевающий рак (97 %) и у 1 больного – низко дифференцированный. Опухоли ОФО I стадии были диагностированы у 4 больных (13 %); II стадии – у 21 (70 %); III стадии – у 2 (7 %) и I стадии – у 3 больных (10 %). Метастазы в лимфатических узлах шеи клинически и морфологически были подтверждены у 5 больных (16,7 %) и отдаленные метастазы – у 1 больного (3 %). У всех пациентов исходным промоутером заболевания явилось протезирование зубов с последующей травмой языка или слизистой щеки; у всех пациентов был выявлен вирус папилломы человека 6 типа, что согласуется с данными литературы [26, 29, 30].
Органосохраняющая сочетанная КЛТ рака ОФО проведена при соматических противопоказаниях к хирургическому лечению у 27 больных; 3 пациентов были оперированы в специализированных стационарах и поступили для проведения послеоперационной КЛТ. Системная полихимиотерапия проведена 18 (60 %) больным: препаратами платины и 5-фторурацила – 5; препаратами платины и таксанами – 8; препаратами платины в монорежиме с целью радиомодификации – 5 пациентам. В курсах радикальной сочетанной ЛТ конформная ДЛТ на ЛУЭ-6 МэВ с мультилифколлимацией была реализована на 1 этапе лечения в условиях индивидуальных фиксаторов положения – масок; РОД 2–3 Гр на первичную опухоль и зоны регионарного метастазирования СОДэкв 46 Гр (рис. 1).
Внутритканевая / аппликационная (ВТ/А) ЛТ проводилась после элиминации мукозита на 2-м этапе сочетанной КЛТ. В рамках совместного исследования с кафедрой общей стоматологии РУДН при опухолях ОФО нами была разработана методика изготовления индивидуальных аппликационных систем – моулдов для контактной ЛТ [29] (рис. 2).
Внутритканевая или аппликационная ЛТ с программируемым перемещением малогабаритного источника ионизирующего излучения 192Ir с высокой мощностью дозы на брахитерапевтических аппаратах была реализована 21 (70 %) больному и предусматривала интенсивное радиационное воздействие на остаточную первичную опухоль, которая включалась в объем облучения (CTV) (рис. 3). Условия облучения: режим фракционирования – РОД 2–3 Гр дважды в день через 4 ч; облучение проводилось 5 раз в неделю, СОД экв 30 Гр. У 3 больных в связи с отсутствием условий СОД от конформной дистанционной ЛТ на визуально и УЗИ / МРТ-определяемую остаточную опухоль были увеличены до 70–80 Гр. Предлуче-вая подготовка включала КТ / МРТ-планирование дистанционного и внутритканевого компонентов с введением КТ / МРТ-совместимых эндостатиче-ских устройств. Дозиметрическое сопровождение осуществляли с использованием оптимизирован-
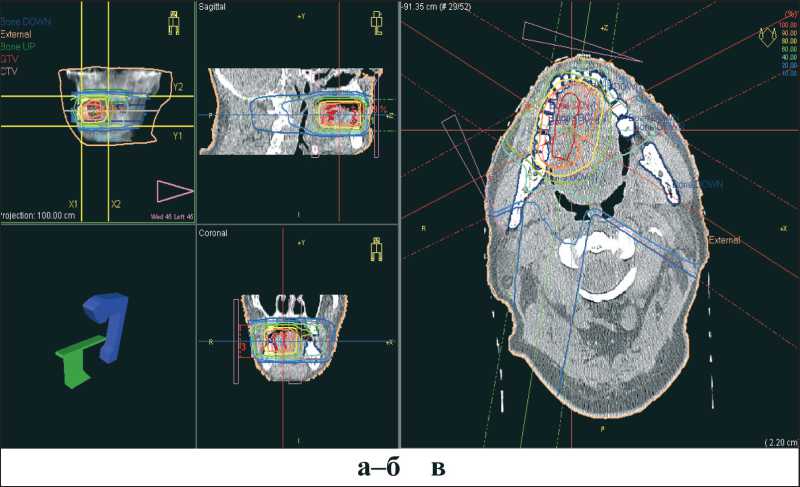
Рис. 1. Суммарное многоплоскостное изодозное распределение для ДЛТ рака дна рта на ЛУЭ 6 Мэв с коллимацией пучков в сагиттальной (а), фронтальной (б) и поперечной (в) плоскостях
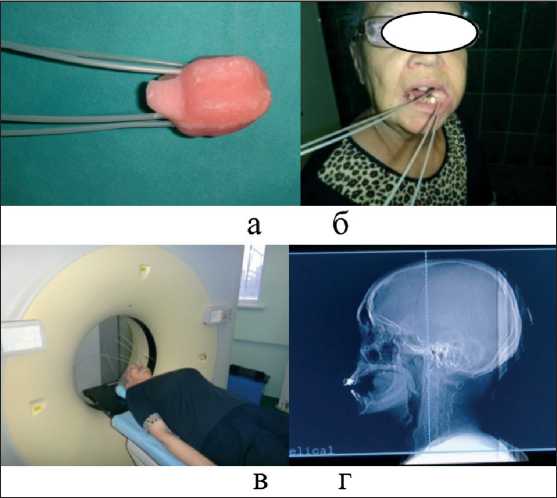
Рис. 2. Аппликационная высокомощностная ЛТ: индивидуально изготовленный из мягких стоматологических масс «моулд» с размещенными интрастатами (а); «моулд» в положении лечения (б); РКТ-топометрия для контроля положения аппликатора (в); и рентгенограмма в сагиттальной плоскости с позицией «моулда» в полости рта (г)
ных программ 3D планирования для обеспечения адекватного терапевтического распределения в опухоли с приоритетной защитой нормальных органов и тканей. Терапевтический мониторинг ЛТ проводили после СОД 30, 40, 70 Гр по визуальному контролю, определению линейных размеров и объема опухоли и визуализируемых лимфатических узлов по результатам УЗИ. Всем 30 больным раком ОФО было ретроспективно проведено исследование мутационного статуса гена EGFR для оценки возможности использования полученных данных в последующем в качестве ПМ при определении чувствительности (устойчивости) опухолевых клеток к лучевой и таргетной терапии. Исследования проводились на материале, полученном из парафиновых блоков, которые прошли морфологический контроль и были признаны соответствующими критериям для достоверного анализа ДНК опухолевых клеток. ДНК определяли с помощью набора реагентов «FFPE ExtractDNA» (ЗАО «Евроген», Москва) и оценивали ее концентрацию и качество с помощью набора реагентов «aXY-Detect» (ООО «Синтол», Москва). Концентрацию ДНК оцени-
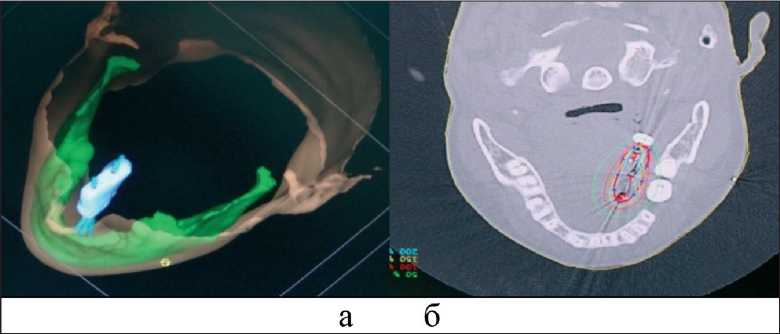
Рис. 3. Схема визуализации интрастатов в области опухоли, расположенной на слизистой дна рта (а), и проекция терапевтического изодозного распределения в области опухоли от ВТЛТ: пунктирная линия – мишень облучения; сплошная линия – терапевтический изодозный контур, соответствующий РОД (б)
вали с помощью флуориметра Qubit и набора реагентов «Quant-IT HS DNA Kit» (Life Technologies, США). Анализ делеционной мутации EGFRvIII в гене EGFR проводился методом ПЦР в режиме реального времени.
Результаты и обсуждение
Непосредственно после окончания ЛТ полная регрессия при плоскоклеточном раке была достигнута у 20 (67 %), частичная регрессия – у 6 (20 %), стабилизация опухолевого процесса – у 4 (13 %) больных. У всех 18 пациентов, получавших системную ПХТ с ЛТ, была отмечена гематологическая токсичность I–II степени. Мукозиты II–III степени и дерматиты I–II степени по классификации RTOG после окончания ЛТ развились у 9 (30 %) пациентов, ранее получавших неоадъювантную ПХТ. Из 30 подвергнутых анализу образцов опухоли делеции EGFRvIII не было выявлено ни в одном случае.
Период наблюдения за лечеными больными раком ОФО с отсутствием мутаций в гене EGFR варьировал от 9 до 27 мес, в среднем – 15,6 мес. Высокая степень риска неизлеченности при ЛТ и неэффективность дальнейшей операции и таргет-ной терапии эрбитуксом была подтверждена у 2 из 30 обследованных пациентов (более 6 %). Однако прогрессирование опухоли через 2 года после химиолучевой терапии с летальным исходом констатировано у 4 (13 %) больных с опухолями ОФО III–IV стадии. Трое (10 %) больных после хирургического лечения на первом этапе и комплексной терапии живы без признаков опухоли 2 года. Трое (10 %) больных оперированы по поводу остаточной опухоли, из них – одна больная раком нижней губы II стадии (СЛТ без химиотерапии); двое больных раком языка II стадии (КЛТ с еженедельной радиомодификацией препаратами платины). В целом, по данным Центра, использование современных технологий лучевой терапии, неоадъювантной ПХТ в сочетании с радиомодификацией обеспечило общую выживаемость у 100 % больных раком красной каймы губ; 66,7 % больных раком языка и 75 % больных раком слизистой оболочки дна рта.
Клиническое наблюдение
Больная К., 32 года. Клинический диагноз – рак слизистой языка III стадии (Т2N1М0). Противоопухолевое органосохраняющее лечение в 2012 г. – 2 курса НАПХТ, радикальная сочетанная СЛТ и лимфаденэктомия. Морфологический диагноз – низкодифференцированный плоскоклеточный рак. Делеционной мутации EGFRvIII в гене EGFR не было обнаружено.
Анамнез заболевания: после прикуса языка слева в ноябре 2011 г. больная обнаружила появление опухоли в области средней трети языка, лечилась консервативно. С января 2012 г. очаг уплотнения на языке трансформировался в язвенный дефект. Клинически установлен рак языка Т2N0М0. В связи с отказом от хирургического лечения больной после НАПХТ с 17.02.2012 по 11.03.2012 была проведена КЛТ на первичный очаг и регионарные лимфатические коллекторы РОД 3 Гр по 90 % изодозе PTV до СОД экв. 41 Гр на фоне симультанной монохимиотерапии (карбоплатин 50 мг/м2 1 раз в нед). По данным УЗИ в средней трети шеи слева был визуализирован метастатический узел с нечеткими контурами неоднородной структуры, размерами 11 × 5 мм. Цитология: плоскоклеточный неороговевающий рак. Онкомаркер SCC – 0,5 нг/мл (норма – до 1,5 нг/мл). Больной выполнена шейная лимфаденэктомия и проведено 4 курса АПХТ с использованием препаратов платины и таксанов. В течение 1-го года наблюдения – ремиссия. В связи с местным рецидивом через 14 мес после комплексного лечения была произведена половинная резекция языка. Морфологически плоскоклеточный рак с периневральным и интраневральным характером роста без лечебного патоморфоза. Терапия эрбитуксом у данной больной оказалась неэффективной.
Заключение
Проведенная в условиях радиологической клиники работа с двумя независимыми этапами исследований позволяет констатировать, что современная КЛТ гарантирует достаточно высокий непосредственный эффект лечения в сочетании с химиотерапией. Однако у 25–30 % больных ее результаты сомнительны. Ни у одного из 30 леченых больных, включенных в исследование, не были выявлены делеции в гене EGFR. Может ли отсутствие мутаций в гене EGFR рассматриваться фактором неблагоприятного прогноза для ЛТ рака ОФО и неэффективности использования ряда тар-гетных препаратов? Чтобы ответить на этот вопрос, необходимо на большем клиническом материале определить целесообразность проведения хирургического лечения на первом этапе у больных с отсутствием мутаций в гене EGFR или использования более агрессивной программы лучевой терапии. Следующий этап клинических исследований в Центре будет направлен на независимое определение наличия или отсутствия мутаций в гене EGFR и оценку эффективности послеоперационной КЛТ в группе больных раком ОФО.
Список литературы Современные подходы к лучевому лечению опухолей полости рта
- Корытова Л.И., Сокуренко В.П., Масленникова А.В. Современные тенденции в терапии местнораспространенного рака ротоглотки и полости рта. СПб.: Фолиант; 2011, 110 с.
- Романов И.С., Алиева С.Б. Эволюция применения химиотерапии при плоскоклеточном раке полости рта. Сибирский онкологический журнал. 2010; 3: 77-78.
- Чойнзонов Е.Л., Старцева Ж.А., Мухамедов М.Р., Спивакова И.О., Черемисина О.В., Грибова О.В., Кульбакин Д.Е., Суркова П.В. Локальная гипертермия в комбинированном лечении больных раком гортани и гортаноглотки. Сибирский онкологический журнал. 2014; 5: 5-9.
- Алиева С.Б., Ткачев С.И., Задеренко И.А., Романов И.С. Варианты проведения химиолучевой терапии у больных местнораспространенным плоскоклеточным раком глотки. Опухоли головы и шеи. 2011; № 1: 26-31.
- Статистика злокачественных новообразований в России и странах СНГ в 2012 г./Под ред. М.И. Давыдова, Е.М. Аксель. М.: Издательская группа РОНЦ; 2014, 226 с.


