Современные подходы к выявлению ранней субклинической кардиотоксичности, индуцированной химиотерапией, у больных раком молочной железы
Автор: Авалян А.А., Саидова М.А., Ощепкова Е.В., Чазова И.Е.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
В последние десятилетия в развитых странах мира были достигнуты успехи в лечении рака молочной железы (РМЖ), как в силу раннего выявления рака, так и благодаря использованию современных методов лечения (таргетная и химиотерапия, лучевая терапия и хирургическое лечение). В связи с этим, увеличилось время безрецидивного течения онкозаболевания и продолжительность жизни больных. Однако ряд противоопухолевых препаратов, применяемых при лечении РМЖ, обладает кардиотоксичностью [1]. Показано, что сердечно-сосудистые заболевания являются второй ведущей причиной смертности среди женщин, перенесших РМЖ [27]. Снижение систолической функции сердца является наиболее распространенным проявлением кардиотоксичности противоопухолевой терапии [7]. К другим проявлениям кардиотоксичности относятся артериальная гипертония (АГ), острый коронарный синдром, аритмии и тромбозы. В последние годы для выявления кардиотоксичности противоопухолевой терапии применяются такие методы, как электрокардиография (ЭКГ); эхокардиогра-фии (ЭхоКГ) с классическим определением фракции выброса левого желудочка (ФВ ЛЖ) по методу Simpson’s biplane и показателя глобальной продольной деформации ЛЖ (GLS) по данным технологии недопплеровского изображения миокарда в двумерном режиме (2D Speckle Tracking Imaging); определение уровня биомаркеров повреждения миокарда и магнитнорезонансная томография (МРТ) сердца. Таким образом, ранняя диагностика и своевременное выявление кардиотоксических эффектов противоопухолевых препаратов при лечении женщин РМЖ являются одними из задач сформировавшегося в последние годы направления в медицине - кардиоонкологии [1].
Кардиоонкология, артериальная гипертония, кардиотоксичность, технология спекл трекинг, химиотерапия, рак молочной железы
Короткий адрес: https://sciup.org/143165157
IDR: 143165157
Текст научной статьи Современные подходы к выявлению ранней субклинической кардиотоксичности, индуцированной химиотерапией, у больных раком молочной железы
АКТУАЛЬНОСТЬ
В структуре злокачественных новообразований РМЖ является наиболее распространенным видом рака у женщин во всем мире [22]. Ранняя диагностика рака и достижения современной терапии привели к более длительной ремиссии заболевания и продлению продолжительности жизни больных РМЖ. Однако ряд противоопухолевых препаратов обладает кардиотоксичностью. К факторам риска развития кардиотоксичности относятся [5,7]:
-
• кумулятивная доза химиопрепарата;
-
• возраст больного(> 65 лет и <18 лет);
-
• женский пол;
-
• наличие сердечно-сосудистых заболеваний (ССЗ);
-
• тип химиопрепарата;
-
• общая доза, режим и путь введения химиопрепарата;
-
• одновременное введение других кардиотоксических препаратов;
-
• сочетание химиотерапии с лучевой терапией;
-
• облучение средостения в анамнезе.
Артериальная гипертония (АГ), являясь одним из наиболее распространенных ССЗ, часто сопровождает течение онкозаболевания. В Российской Федерации, по данным эпидемиологического исследования ЭССЕ (Эпидемиология Сердечнососудистых заболеваний в регионах), АГ выявлена у 45,4% мужчин и 41,6% женщин [21]. По данным госпитального Регистра злокачественных онкологических заболеваний, в который было включено 17712 больных, АГ была наиболее частым сопутствующим заболеванием (38%) у онкологических больных [20]. Для АГ и злокачественных новообразований определены общие факторы риска, среди которых □ малоподвижный образ жизни, ожирение, курение, злоупотребление алкоголем и др. [20]. Увеличение продолжительности жизни людей, достигающих старческого возраста способствует росту сердечно-сосудистых и онкологических заболеваний.
Помимо токсического воздействия на миокард, химиотерапия может поражать сосудистую стенку артерий. По данным Paaladinesh Thavendiranathan повышение жесткости артерий является одним из ранних проявлений вазотоксическиого эффекта химиотерапии, которая является причиной прогрессирования АГ или ее развития на фоне лечения [19].
В метаанализе, проведенном Ranpura с соавт., включившем 12656 больных с онкологическими заболеваниями различной локализации, получавших лечение бевацизумабом, частота индуцированной АГ составила 23,6%, из которых 7,9% соответствовали 2 или 3 степени АГ [23]. Таким образом, АГ является одним из осложнений химиотерапии. В то же время, наличие исходной АГ или ее развитие в процессе химиотерапии является одним из факторов риска развития кардиотоксичности.
Среди механизмов кардиотоксичности, индуциированной химиотерапией, различают:
-
• прямое токсическое действие на кардиомиоциты;
-
• воздействие на систему коагуляции;
-
• аритмогенный эффект (чаще - путем удлинения интервала QT);
-
• гипертензивное действие;
-
• неспецифическое воспаление миокарда и / или перикарда [6].
По повреждающему действию на миокард химиопрепараты делятся на два типа [4]:
К I типу относятся препараты с прямым токсическим воздействием на сердце, что приводит к апоптозу кардиомиоцитов и, как следствие, к необратимой дисфункции миокарда
ЛЖ. Данный тип характерен для антрациклинов, при лечении которыми риск развития кардиотоксичности зависит от кумулятивной дозы.
К II типу относятся препараты, при лечении которыми развивается кардиотоксичность, которая имеет обратимый характер. Для препаратов II типа, в отличие от I типа, не характерна зависимость от кумулятивной дозы, одним из таких химиопрепаратов является трастузумаб.
Наибольшим цитотоксическим действием обладают антра-циклины, моноклональные антитела, ингибиторы тирозинки-назы, алкилирующие препараты и интерферон альфа [2-4].
В связи с высокой эффективностью при лечении злокачественных новообразований различной локализации антраци-клины включены во многие схемы лечения онкологических заболеваний. С увеличением дозы антрациклинов увеличивается риск развития дисфункции миокарда ЛЖ, что определяет неблагоприятный прогноз для больного, перенесшего онкозаболевание, в плане развития симптомов сердечной недостаточности (СН). В ряде исследований было продемонстрировано, что 5% частота СН ассоциировалась с кумулятивной дозой доксорубицина, равной 400 мг/м2, риск СН возрастал до 48% при кумулятивной дозе доксорубицина 700 мг/м2. Установлена значительная вариабельность в ответ на лечение антрациклинами у онкологических больных [7].
По времени развития дисфункции миокарда ЛЖ при лечении антрациклин содержащими противоопухолевыми препаратами у больных РМЖ различают острое и хроническое поражение миокарда [6, 11]. Острая кардиотоксичность обычно проявляется в виде различных наджелудочковых нарушений ритма сердца, неспецифическими изменениями на ЭКГ (удлинение интервала QT и QT корригированный) и преходящей бессимптомной дисфункцией ЛЖ (снижение ФВЛЖ)) [6]. Показано, что острая кардиотоксичность развивается в менее чем в 1% случаев после инфузии химиопрепарата и обычно обратима. Хроническая кардиотоксичность может возникнуть в течение первого года после завершения противоопухолевого лечения (ранняя кардиотоксичность) или позже (поздняя кардиотоксичность) [7].
Предшествующей развитию хронической СН при проведении химиотерапии кардиотоксическими препаратами может быть период субклинического поражения миокарда ЛЖ, которая не проявляется симптомами СН и не выявляется с помощью традиционного определения фракции ФВЛЖ по методу Simpson’s biplane.
Таким образом, кардиотоксичность у больных РМЖ может варьировать от субклинической дисфункции миокарда ЛЖ до необратимой СН с фатальным исходом [6]. В связи с чем, при проведении химиотерапии мониторирование структурнофункционального состояния ЛЖ и уровня АД у онкологических больных для выявления субклинической дисфункции миокарда ЛЖ и разработке мер по кардиопротекции является актуальным.
МЕТОДЫ ВЫЯВЛЕНИЯ КАРДИОТОКСИЧНОСТИ
По данным европейских и российских рекомендаций [7, 25] (далее рекомендации) основными методами диагностики кардиотоксичности являются: электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), определение биомаркеров повреждения миокарда и магнитно-резонансная томография (МРТ) сердца.
Электрокардиография. Всем больным с онкологическими заболеваниями рекомендуется проведение ЭКГ до начала и после лечения противоопухолевыми химиопрепаратами.
Кардиотоксичность химиотерапии может проявляться в виде тахикардии, изменения сегмента ST-T, нарушениями ритма и проводимости, а также удлинением продолжительности интервала QT [7]. Показано, что из всех химиопрепаратов чаще наблюдается удлинение интервала QT при лечении триоксидом мышьяка, который применяется для лечения некоторых лейкозов и миеломах [8]. Удлинение интервала QT может быть вызвано не только противоопухолевыми препаратами, а также электролитными нарушениями, приемом противорвот-ных лекарственных средств, антибиотиков и др. [9].
Эхокардиография. В выявлении субклинической кардиотоксичности большую роль представляет ЭхоКГ. У онкологических больных в ходе подготовки к химиотерапии, во время и после терапии рака рекомендуется проведение ЭхоКГ как одного из наиболее информативных методов диагностики структурно-функционального состояния сердца [9, 10]. В клинической практике для выявления кардиотоксичности применяются, прежде всего, общепринятые показатели, в частности, ФВЛЖ по методу Simpson’s biplane. В различных исследованиях использовались разные пороговые значения для определения клинически значимого снижения ФВЛЖ. Так, по данным Американского общества эхокардиографии и Европейской ассоциации по визуализирующим методом в кардиологии, снижение ФВ ЛЖ более 10% от исходного уровня и ниже 53% являются признаками развития кардиотоксичности на фоне проведения химиотерапии [11]. По данным рекомендаций, принятых на Европейском обществе кардиологов [7], снижение ФВ ЛЖ более 10% от исходного уровня и ниже 50% являются критериями кардиотоксичности. Некоторые авторы определяли кардиотоксичность противоопухолевой терапии как снижение ФВЛЖ ≥ 5% от исходного уровня у больных с симптомами СН и ФВ ЛЖ ≥ 10% – у больных с отсутствием симптомов СН и ФВ ЛЖ <55% [26]. Минимизация ошибок в определении ФВЛЖ, которая может иметь место в практике врача, нивелируются экспертным классом УЗИ аппарата, квалификацией специалиста, проведением исследования одним и тем же врачом [7].
Показано, что ФВ ЛЖ не достаточно чувствительна для выявления ранних субклинических изменений сократительной функции миокарда [13]. В связи с этим в последнее время большое внимание уделяется новым эхокардиографическим технологиям – недопплеровского изображения миокарда в двумерном и трехмерном режимах (2D и 3D Speckle Tracking Imaging) [7,18,25]. Получены предварительные данные, что эти методы позволят выявлять ранние изменения, предшествующие снижению ФВ ЛЖ и развитию симптомов СН [18].
Технология недопплеровского изображения миокарда в двумерном режиме применяется для оценки параметров деформации ЛЖ. Под деформацией понимают изменение длины мышечного волокна в течение сердечного цикла, измеряемое в процентах (%). Метод основан на анализе движения черных или белых пятен (speckle) на стандартном эхокардиографическом изображении в двумерном режиме (B-режим) в течение сердечного цикла с помощью специального программного обеспечения. Положение каждого пятна определяется и прослеживается на последовательных кадрах. Качество визуализации обеспечивается высокой частотой смены кадров (50-100кадр/сек). Путем покадрового отслеживания определяется расстояние, на которое перемещается пятно от кадра к кадру и, учитывая частоту смены кадров – скорость движения пятна. Сегменты с плохим качеством изображения исключаются из анализа программным обеспечением. В программном обеспечении заложено построение кривых деформации для каждого сегмента миокарда. Таким образом, по движению пятнистых структур получаются данные о деформации всех участков миокарда, оцениваются продольная, радиальная и циркулярная деформации миокарда [12].
Ограничением метода является невозможность его проведения у больных с нарушениями ритма сердца [12]. Важно отметить, что для правильного и оптимального определения границ эндокарда необходима хорошая визуализация и высокое качество двумерных изображений.
На сегодняшний день из всех показателей деформации ЛЖ наиболее изученным является показатель продольной глобальной деформации (GLS), который оценивается из трех верхушечных позиций и представляет топографию 17 анализируемых сегментов ЛЖ в виде так называемого “бычьего глаза”. До настоящего времени не существует общепринятых нормативов для этого показателя, который зависит от возраста, пола больных, используемого эхокардиографического прибора [11]. Вместе с тем, рядом исследователей в ходе выполненных работ у здоровых лиц были установлены средние значения для показателя GLS, которые составляют >-20,0%[11]. Согласно рекомендациям, диагностическим критерием развития субклинической кардиотоксичности считается снижение показателя GLS от исходного уровня более 15% [7]. Ряд авторов полагают, что показатель GLS до химиотерапии и после лечения противоопухолевыми препаратами даст возможность выявлять раннюю кардиотоксичность до выраженного снижения ФВЛЖ и развития симптомов СН [7,10]. В исследовании Stoodley с соавт. проведена сравнительная оценка ФВ ЛЖ и показателя глобальной продольной деформации ЛЖ у женщин с РМЖ до химиотерапии и через неделю после ее окончания. Было показано статически значимое снижение показателя GLS, в то время как ФВЛЖ достоверно не менялась [14]. Похожие результаты были получены в исследовании A. Boyd с соавт., в котором также было показано статистически значимое снижение показателя GLS при проведении химиотерапии, при этом ФВ ЛЖ снижалась, но оставалась в пределах нормальных значений [15].
Вместе с тем, ограниченное число исследований и отсутствие убедительных доказательств значимости снижения показателя GLS при проведении химиотерапии у онкологических больных пока не дает основания для прерывания лечения или уменьшения дозы химиопрепарата, основываясь только на снижении этого показателя [7].
Технология недопплеровского изображения миокарда в трехмерном режиме, в отличие от двумерного режима, позволяет провести одновременную оценку всех параметров деформации ЛЖ (глобальная продольная, циркулярная и радиальная), что значительно упрощает процедуру выявления деформации. С помощью данной технологии также определяется новый параметр деформации – Global Area Strain (GAS). Предполагается, что трехмерный режим недопплеровского изображения миокарда позволит провести более полный анализ состояния функции ЛЖ у больных РМЖ при проведении химиотерапии [18]. В литературе имеются единичные данные по применению технологии недопплеровского изображения миокарда в трехмерном режиме у больных РМЖ. В исследовании Ciro Santoro с соавт. проведено изучение деформационных свойств миокарда ЛЖ по данным двумерного и трехмерного режимов технологии недопплеровского изображения у 100 женщин РМЖ, получающих антрациклин содержащую химиотерапию. Авторы отметили снижение всех па-
Технология недопплеровского изображения миокарда в двумерном режиме
Исходно После 8 курсов химиотерапии
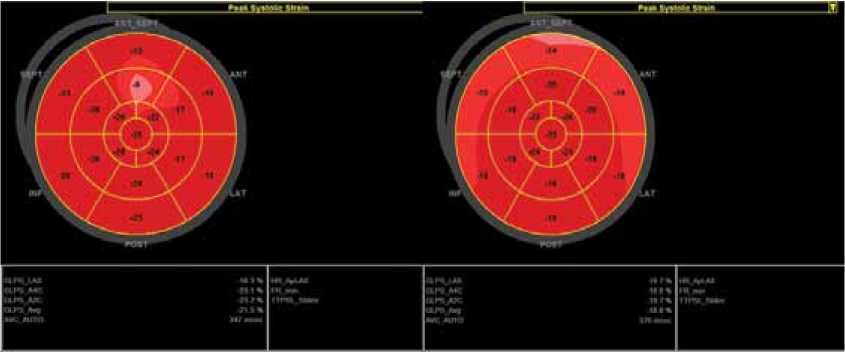
GLS=-21,5% GLS=-18,8%
Технология недопплеровского изображения миокарда в трехмерном режиме
Исходно
GLS=-15,0% GСS=-12,0% GRS=34,0% GAS=-25,0%
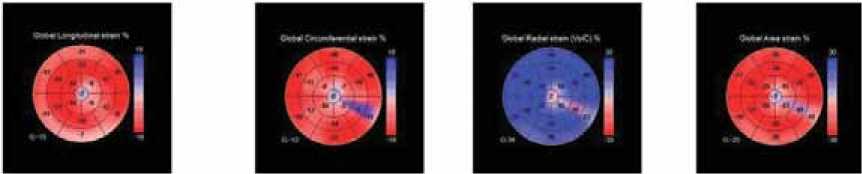
После 8 курсов антрациклинсодержащей химиотерапии
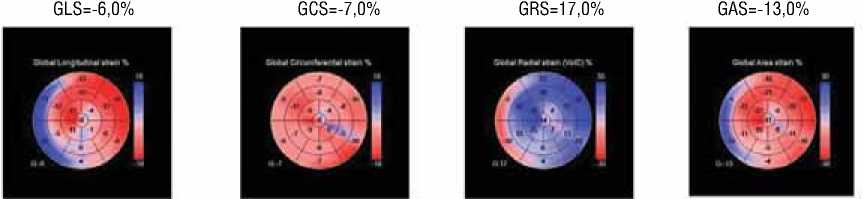
Рисунок 1. Значения деформаций ЛЖ по данным технологии недопплеровского изображения миокарда в двумерном и трехмерном режимах (2D и 3D SpeckleTrackingImaging) исходно и после 8 курсов химиотерапии
раметров деформации по данным двумерного и трехмерного режимов, но наиболее значимым было снижение показателей GLS и GAS по данным трехмерного режима. Таким образом, было показано преимущество технологии недопплеровского изображения миокарда в трехмерном режиме в выявлении субклинической кардиотоксичности по сравнению с двумерным режимом [18].
В ФГБУ «НМИЦ кардиологии» Минздрава России проводится исследование, целью которого является выявление ранней субклинической кардиотоксичности у больных РМЖ при проведении антрациклин содержащей химиотерапии. Деформационные свойства миокарда ЛЖ изучаются методом ЭхоКГ с применением технологии недопплеровского изображения миокарда в двумерном и трехмерном режимах в сопоставлении с традиционным определением ФВ. Предварительные результаты у отдельных больных РМЖ до и после лечения антрациклин содержащей химиотерапии показывают преиму- щество трехмерного режима технологии недопплеровского изображения миокарда в оценке ухудшения деформационных свойств миокарда ЛЖ.
На рисунке 1 приведён клинический случай больной А., 40 лет, с установленным диагнозом злокачественного новообразования ткани молочной железы, рака правой молочной железы. При первоначальном осмотре кардиологом (до химиотерапии) АД, частота сердечных сокращений, ЭКГ, ЭхоКГ – в пределах нормальных значений. Лечение РМЖ проводилось в течение 2 месяцев антрациклин содержащими химиопрепаратами, включая доксорубицин, а также цисплатин и паклитаксел. ФВ ЛЖ по методу Simpson’s biplane исходно составила 68%, после химиотерапии – 62%. В двумерном режиме технологии недопплеровского изображения миокарда показатель GLS исходно был в пределах нормальных значений (-21,5%), после химиотерапии составил -18,8%, таким образом, отмечалось его снижение, который не достиг диагности- ческого критерия субклинической кардиотоксичности. Исследование в трехмерном режиме показало более выраженное снижение всех параметров деформации на фоне проведения химиотерапии: показатель GLS снизился на 60,0%, показатель GCS – на 41,0%, показатель GRS – на 50,0% и GAS – на 48,0% от исходного уровня. Таким образом, у данной больной трехмерный режим оказался более эффективным в выявлении субклинической кардиотоксичности при проведении химиотерапии.
Биомаркеры повреждения миокарда. В последние годы в кардиоонкологии с целью оценки риска развития кардиотоксичности на фоне противоопухолевой терапии используются сердечные биомаркеры: высокочувствительные тропонины и натрийуретические пептиды.
В диагностике инфаркта миокарда в качестве чувствительных и специфических диагностических маркеров широко используются сердечные тропонины, такие как тропонин T (TnT) и тропонин I (TnI). Эти биомаркеры стали также использовать для выявления кардиотоксичности, индуцированной химиотерапией. В литературе имеются данные о чувствительности тропонинов в зависимости от применяемой дозы химиопрепарата. Показано, что повышение тропонинов при лечении злокачественных новообразований связано с лечением высокими дозами антрациклинов [16]. Однако в исследовании Sawaya и Ky с соавт. было показано, что сердечные тропонины имеют прогностическую ценность в плане риска развития кардиотоксичности у больных РМЖ, получающих умеренные дозы антрациклинов в сочетании с трастузумабом. Повышение тропонинов ассоциировалось с отсроченным развитием симптомов СН [17]. На сегодняшний день не определен уровень диагностически значимого повышения высокочувствительных тропонинов, как маркеров риска развития кардиотоксичности во время и после химиотерапии.
При химиотерапии в качестве маркера кардиотоксичности также используются натрийуретические пептиды (предсердный натрийуретический пептид (ANP), мозговой натрийуретический пептид (BNP) и пептид-предшественник (pro-BNP)). Натрийуретические пептиды представляют собой пептидные гормоны, которые стимулируют натрийурез в ответ на избыточное механическое напряжение или перегрузку объемом полостей сердца [16]. В исследовании Feola с соавт. было выявлено повышение уровня NT-pro BNP на протяжении двух лет после лечения антрациклин содержащими химиопрепаратами. Повышение натрийуретических пептидов авторы связывают со снижением ФВ ЛЖ ≥ 10% [24].
Вместе с тем, повышение концентрации биомаркеров указывает на повышенный риск развития кардиотоксичности. В настоящее время нет доказательств для прерывания или отмены химиотерапии, основываясь только на повышении уровня сердечных биомаркеров в процессе лечения [7].
Больные с бессимптомным снижением ФВ ЛЖ, соответствующего определению кардиотоксичности, особенно с сопутствующим повышением натрийретических пептидов, согласно рекомендациям ЕОК (2016), могут быть рассмотрены как больные со структурным заболеванием сердца с сохранной ФВ ЛЖ, которые требуют мониторирования структурнофункционального состояния миокарда ЛЖ [7].
МРТ – один из современных информативных методов оценки структурно-функционального состояния сердца. Метод позволяет оценить объемы полостей сердца, сократительную функцию миокарда, толщину стенок и др. В связи с чем, данный метод является перспективным в оценке субклиниче- ской кардиотоксичности. В литературе имеются единичные исследования, в которых показано, что при химиотерапии в кардиомиоцитах развиваются признаки воспаления, которые, как предполагают авторы, являются субклиническими признаками кардиотоксичности [19]. По данным рекомендаций, участки рубцевания и фиброза миокарда, полученные с помощью накопления гадолиния в позднюю фазу, возможно, также имеют прогностическое значение в развитии кардиотоксичности [7].
На сегодняшний день вопрос роли МРТ в диагностике кардиотоксичности противоопухолевого лечения является малоизученным и требует дальнейших исследований.
ЗАКЛЮЧЕНИЕ
В выявлении субклинической кардиотоксичности классические методы определения систолической функции сердца являются недостаточно чувствительными. На сегодняшний день перспективными являются новые ЭхоКГ технологии недопплеровского изображения миокарда в двумерном и трехмерном режимах с определением деформационных свойств миокарда левого желудочка; МРТ, а также определение уровня биомаркеров повреждения миокарда (высокочувствительные тропонины и натрийуретические пептиды). Получены предварительные данные, что эти методы являются более чувствительными в выявлении ранней субклинической кардиотоксичности, а, следовательно, и проведения мер по своевременной кардиопротекции с целью улучшения прогноза и качества жизни больных РМЖ.
Конфликт интересов: все авторы заявляют об отсутствии конфликта интересов.
Список литературы Современные подходы к выявлению ранней субклинической кардиотоксичности, индуцированной химиотерапией, у больных раком молочной железы
- Yuand Jones. Breast cancer treatment-associated cardiovascular toxicity and effects of exercise countermeasures. Cardio-Oncology (2016) 2:1 DOI 10.1186/s40959-016-0011-5
- Чазова И.Е., Ощепкова Е.В., Канторова А.Ю. -Коморбидность сердечно-сосудистых и онкологических заболеваний: проблемы диагностики кардиотоксических эффектов химио-и лучевой терапии. Терапевтический архив. 2015;87(9): 4-10 DOI: 10.17116/terarkh20158794-10
- А.А. Авалян, М.Ю. Кириллова, В.Н. Шитов, Е.В. Ощепкова, М.А. Саидова, М.Б. Стенина, И.Е. Чазова. Поиск ранних маркеров кардиотоксичности противоопухолевого лечения у больных раком молочной железы в зависимости от уровня артериального давления. Системные гипертензии 2017; 14 (3): 21-27 DOI: 10.26442/2075-082X_14.3.21-27
- Fausto Pizzino, Giampiero Vizzari, Charles A. Bomzeretall. Diagnosis of Chemotherapy-Induced Cardiotoxicity. Journal of Patient-Centered Research and Reviews 8-13-2014:121-127
- D. Bovelli, G. Plataniotis, F. Roila. Cardiotoxicity of chemotherapeutic agents and radiotherapy-related heart disease: ESMO Clinical Practice Guidelines. Annals of Oncology. 21 (Supplement 5): 277-282,2010
- Maria Florescu et all. Chemotherapy-inducedCardiotoxicity. A Journal of Clinical Medicine 2013; 8(1): 59-67
- Jose Luis Zamorano, Patrizio Lancellotti, Daniel Rodriguez Mun'oz, Victor Aboyans, Riccardo Asteggiano et al. 2016 ESC Position Paper on cancer treatment and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal. 2016,August
- Lenihan DJ, Kowey PR. Overview and management of cardiac adverse events associatedwith tyrosine kinase inhibitors. Oncologist 2013;18:900-908
- Yeh ET, Bickford CL. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management. J Am CollCardiol. 2009;53:2231-2247
- Daher IN, Kim C, Saleh RR, Plana JC, Yusuf SW, Banchs J. Prevalence of abnormal echocardiographic findings in cancer patients: a retrospectiveevaluation of Echocardiography for identifying cardiac abnormalities in cancer patients. Echocardiography. 2011;28:1061-7.
- Juan Carlos Plana et al. Expert Consensus for Multimodality Imaging Evaluation of Adult Patients during and after Cancer Therapy: A Report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging J Am SocEchocardiogr. 2014;27:911-39
- Sergio Mondillo, Maurizio Galderisi, Donato Mele, Matteo Cameli, MD et al. Speckle-Tracking Echocardiography: A New Technique for Assessing Myocardial Function. J Ultrasound Med. 2011; 30:71-8
- Cardinale D, Colombo A,Lamantia G. et al. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy. J Am CollCardiol. 2010;55:213-20
- Stoodley PW, Richards DA, Boyd A, et al. Altered left ventricular longitudinal diastolic function correlates with reduced systolic function immediately after anthracycline chemotherapy. Eur Heart J Cardiovasc Imaging. 2013 Mar;14(3): 228-34
- Anita Boyd, Paul Stoodley, David Richards, et al. Anthracyclines induce early changes in left ventricular systolic and diastolic function: A single centre study-PLoS One. 2017 Apr 13;12(4):e0175544; 15.
- Moazeni et al. Anthracycline induced cardiotoxicity: biomarkers and "Omics" technology in the era of patient speci c care. Clin Trans Med (2017) 6:17 DOI 10.1186/s40169-017-0148-3
- Ky B, Putt M, Sawaya H, French B, Januzzi JL Jr, Sebag IA et al. (2014) Early increases in multiple biomarkers predict subsequent cardiotoxicity in patients with breast cancer treated with doxorubicin, taxanes, and trastuzumab. J Am CollCardiol 63(8):809-816
- Ciro Santoro1 et al. 2D and 3D strain for detection of subclinical anthracycline cardiotoxicity in breast cancerpatients: a balance with feasibility. European Heart Journal -Cardiovascular Imaging, Volume 18, Issue 8, 2017, Pages 930-936, doi. org/10.1093/ehjci/jex033
- Paaladinesh Thavendiranathan et al. Cardiac MRI in the Assessment of Cardiac Injury and Toxicity From Cancer Chemotherapy. A Systematic Review. CircCircCardiovasc Imaging. 2013;6:1080-1091, DOI:10.1161/CIRCIMAGING.113.000899
- Piccirillo JF, Tierney RM, Costas I, et al. Prognostic importance of comorbidity in a hospital-based cancer registry. JAMA 2004;291(20):2441-7.
- Чазова И.Е., Жернакова Ю.В., Ощепкова Е.В. и др. Распространенность факторов риска сердечно-сосудистых заболеваний в российской популяции больных артериальной гипертонией. Кардиология. 2014; 10:4-12.
- Pedro Veronese, Denise Tessariol Hachul, Mauricio Ibrahim Scanavacca et al. Effects of anthracycline, cyclophosphamide and taxane chemotherapy on QTc measurements in patients with breast cancer. PLoS ONE. 2018; 2-10. doi.org/10.1371/journal.pone.0196763
- Ranpura V, Pulipati B, Chu D, Zhu X, Whu S. Increase risk of high-grade hypertension with bevacizumab in cancer patients: a meta-analysis. Am J Hypertens. 2010;23(5):460-8.
- Feola M, Garrone O, Occelli M et al. Cardiotoxicity after anthracycline chemotherapy in breast carcinoma: effects on left ventricular ejection fraction, troponin I and brain natriuretic peptide. Int J Cardiol. 2011;148(2):194-198. doi: 10.1016/j. ijcard.2009.09.564
- Чазова И.Е,.Тюляндин С.А, Виценя М.В. и др. Руководство по диагностике, профилактике и лечению сердечно-сосудистых осложнений противоопухолевой терапии. Часть: Системные гипертензии. 2017;14(3); 6-20
- Seidman A, Hudis C, Pierri MK, Shak S, Paton V, Ashby Metal. Cardiac dysfunction in the trastuzumab clinical trials experience. J ClinOncol. 2002 Mar 1;20 (5):1215-21
- M.A. Nicolazzi, A. Carnicelli, M. Fuorlo et al. Anthracycline and trastuzumab-induced cardiotoxicity in breast cancer. European Review for Medical and Pharmacological Sciences 2018; 22:2175-2185


