Современные представления о регуляции неспецифической защиты в организме
Автор: Кривохижина Л.В., Осиков М.В.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Интегративная физиология, восстановительная и адаптивная физическая культура
Статья в выпуске: 4 (44) т.1, 2005 года.
Бесплатный доступ
Представлены современные данные о регуляции количественного состава и функциональной активности фагоцитов как центрального звена неспецифической защиты в организме.
Короткий адрес: https://sciup.org/147152039
IDR: 147152039
Текст научной статьи Современные представления о регуляции неспецифической защиты в организме
Представлены современные данные о регуляции количественного состава и функциональной активности фагоцитов как центрального звена неспецифической защиты в организме.
На современном этапе развития медицинской науки фагоцитарная система рассматривается как центральное звено неспецифической защиты организма от инфекции и как регуляторная система, направленная на стабилизацию внутренней среды организма [14,28].
Гранулоциты и мононуклеарные фагоциты контролируют первую линию обороны организма от инфекций, обеспечивают неспецифическую противоинфекционную защиту за счет реализации своих функций, синтеза и секреции регуляторных цитокинов, запускающих общие ответные реакции организма на повреждение. Реализация их функций заключается в способности к хемотаксису, адгезии, фагоцитозу, дегрануляции, киллингу и перевариванию поглощенных частиц [6,24,25].
Реализация функциональной активности фагоцитирующих клеток находится, в том числе, под контролем различных отделов нервной системы и регуляторных нейрогенных пептидов. Одной из функций лимбической системы мозга является обеспечение сохранения гомеостаза и осуществление защитно-приспособительных реакций организма. По концепции Г.Н. Крыжановского, возникновение пароксизмов эпилептиформной активности и манифестация генератора патологически усиленного возбуждения в структурах лимбико-диэнцефальной системы является типовым механизмом нарушения регуляции функций иммунной системы [11]. В частности, это проявляется нарушением неспецифических факторов про-тивоинфекционной резистентности (фагоцитоз, бактерицидность) и повышением восприимчивости к инфекциям [13].
На различных экспериментальных моделях продемонстрирована роль нейромедиаторов в модуляции функций фагоцитирующих клеток. Тормозной медиатор ЦНС у-аминомасляная кислота (ГАМК) в повышенных дозах до 200 мг/кг оказывает стимулирующее действие на неспецифические реакции иммунитета [3]. Со времени работ С. Метальникова накоплен обширный материал о влиянии нейромедиаторов вегетативной нервной системы на активность фагоцитирующих клеток [41]. Данные, полученные радиолигандным методом, свидетельствуют о наличии адрено- и холинорец-пторов на различных популяциях фагоцитирующих клеток [32]. Показано, что адреналин и изопротеренол (0,01-1 мкмоль/л) угнетают фагоцитоз частиц опсонизированного зимозана и высвобождение фагоцитами Д-глюкуронидазы [35]. Эффекты адреналина предупреждаются добавлением /3-адреноблокатора пропранолола (1 мкмоль/л), а-адре-ноблокатор фентоламин не отменял действия адреналина. В противоположность адреномиметикам ацетилхолин и пилокарпин (0,01-1 мкмоль/л) существенно усиливают фагоцитарную активность нейтрофильных гранулоцитов. Их влияние предупреждается атропином, но не Н-холино-литическими веществами (тубокурарин). Аналогичные данные получены для мононуклеарных фагоцитов [40].
Некоторые гормоны обладают способностью существенно изменять функциональную активность фагоцитирующих клеток. Так, гормоны щитовидной железы Т3 и Т4 оказывают стимулирующее влияние на фагоцитарную активность нейтрофилов крови как в витральных условиях, так и при введении в организм [7]. Аналогичными свойствами обладает инсулин при длительном введении препарата [10]. Один из пептидов тимуса - тимопен-тин усиливает фагоцитарную активность нейтрофилов и макрофагов у иммуносупрессированных морских свинок. In vitro в диапазоне концентраций 1 мг/мл -10 пг/мл он ингибирует, а в концентрации ниже 10 пг/мл не влияет на фагоцитарный процесс [48].
Среди множества агентов гормональной природы, способных модулировать функции фагоцитов, особое внимание привлекают глюкокортикоидные гормоны (ГК). Установлено, что ГК дозозависимо угнетают фагоцитарные функции нейтрофилов, изменяют их бактерицидную активность, секрецию нейтральных протеаз [39]. ГК ингибируют синтез фагоцитами цитокинов: интерлейкина ИЛ-1, ИЛ-2, ИЛ-12, туморнекротиче-ского фактора а (ТНФа), интерферона у (ИФНу), а также простагландинов, лейкотриенов, брадикинина, гистамина, фосфолипаз, нитроксидных радикалов, адгезивных молекул и, кроме того, снижают экспрессию рецепторов для цитокинов на мембране фагоцитов [21]. Влияние ГК на процессы экспрессии определенных генов, транскрипцию мРНК опосредовано транскрипционным фактором NFkB. Оказывая влияние на миграционную и адгезивую способность фагоцитов, ГК способны резко ограничивать приток нейтрофилов и моноцитов в очаг воспаления, что одновременно является причиной снижения противоинфекци-онной защиты организма.
Кроме описанных выше нейрогуморальных факторов регуляции количественного состава и функциональной активности фагоцитирующих клеток особое место занимают регуляторные эффекты, опосредованные цитокинами. При остром воспалительном процессе в ответ на инфекционные агенты происходит индукция синтеза ИЛ-1, ИЛ-2, ИЛ-6, ИЛ-8, ТНФа, ИФНу и других цитокинов [9, 22]. Ключевые провоспалительные цитокины ИЛ-1 и ТНФа, выступающие обычно как синергисты, стимулируют экспрессию на поверхности эндотелиальных клеток и нейтрофилов адгезивных молекул, обеспечивая трансэндотелиальную миграцию лейкоцитов в очаге воспаления. ИЛ-1 обусловливает двухфазную лейкемоидную реакцию, первый этап которой характеризуется временной лейкопенией в результате сосудистой адгезии нейтрофилов, а второй - нейтрофильным лейкоцитозом, связанным с выходом клеток из костномозгового депо. ИЛ-1 индуцирует экзоцитоз специфических и азурофильных гранул. На уровне регуляции внутриклеточных процессов ИЛ-1 способствует мобилизации внутриклеточного и связанного с мембраной кальция и активации биосинтеза лейкотриенов. Вместе с тем ИЛ-1 не оказывает хемотаксического действия на нейтрофилы и не стимулирует в них дыхательный взрыв, продукция активных форм кислорода (АФК) увеличивается лишь в случае сочетанного воздействия на нейтрофилы ИЛ-1 и активатора протеинкиназы С форбол-12-меристат-13 -ацетата [22].
ТНФа оказывает разностороннее активирующее влияние на нейтрофилы. Количество высокоаффинных рецепторов к ТНФа на поверхности 1 нейтрофила непостоянно и зависит от температуры: от 2200 до 6000 при 4° С и около 600 при 37° С. Возможно, регистрируемое снижение числа рецепторов при 37° С обусловлено усилением их интернализации и деградации [38]. Обработка нейтрофилов ТНФа приводит к усилению фосфорилирования специфических белков с молярной массой 64 кД и как следствие к изменениям физико-химических свойств плазматической мембраны, проявляющихся в модуляции рецепторного аппарата нейтрофилов, активации ферментов НАДФН-оксидазного комплекса и метаболизма арахидоновой кислоты [42]. Стимулирующая активность ТНФа в отношении высвобождения АФК адгезированными нейтрофилами феноменальна: оптимальная концентрация этого цитокина на 3-5 порядков ниже, а высвобождение АФК в 10-100 раз выше, чем при воздействии других естественных стимуляторов (С5а, лейкотриен В4, арахидоновая кислота) [29].
ИЛ-8, нейтрофилактивирующий фактор (NAF, NAP-1) синтезируется в том числе, и нейтрофилами. Интересно, что они продуцируют ИЛ-8
в течение первых 5-6 часов после стимуляции липополисахаридом (ЛПС) в сочетании с ИЛ-1га, ТНФа, ИЛ-10. Причем, последние два цитокина действуют на специфические рецепторы на нейтрофилах и обеспечивают вторую фазу продукции ИЛ-8 примерно через 20 часов после стимуляции клеток. ИЛ-10 не влияет на ЛПС-индуцированную продукцию ИЛ-8, но блокирует продукцию ТНФа и ИЛ-10, полностью отменяя вторую фазу продукции ИЛ-8 нейтрофилами. ИФНу, наоборот, временно отменяет синтез ИЛ-8 на первом этапе, но увеличивает его в позднюю фазу за счет усиления продукции ТНФа и ИЛ-1/3. В очаге воспаления ИЛ-8 является потенциальным хемоаттрактантом для нейтрофилов и может влиять на трансмиграцию лейкоцитов в случае синтеза его эндотелиальными клетками. ИЛ-8 активирует нейтрофилы, связываясь со специфическим рецептором, принадлежащим к семейству G-белков, в результате чего повышается плотность /32-интегринов, усиливается адгезия нейтрофилов к покоящимся эндотелиальным клеткам и субэндотелиальному экстрацеллюлярному матриксу, но уменьшается адгезия к цитокинактивированному эндотелию, экспреси-рующему Е-селектин [43]. Полагают, что последнее может быть связано со слущиванием L-селектина на активированных ИЛ-8 нейтрофилах [46].
Спектр действия колониестимулирующих факторов (ГМ-КСФ и Г-КСФ) на фагоциты еще более широк. Они стимулируют рост и дифференцировку ранних и поздних гранулоцитарных и макрофагальных предшественников, формирование колоний этих клеток в культуре костного мозга, способствуют мобилизации зрелых клеток из костного мозга, увеличивая пул циркулирующих фагоцитов. В этом плане КСФ опосредуют действие других цитокинов, например, ИЛ-1.
Кроме того, ГМ-КСФ и Г-КСФ модулируют функции зрелых нейтрофилов, усиливая экспрессию адгезивных молекул, стимулируя хемотаксис, фагоцитоз, продукцию АФК, фагоцитарную активность в отношении различных микроорганизмов [12].
ИЛ-6, проявляя как провоспалительный цитокин сходную с ИЛ-1 и ТНФа активность в отношении нейтрофилов, имеет, однако, ряд функциональных особенностей. В отличие от ИЛ-1 и ТНФа он усиливает не поглотительную, а киллер-ную активность нейтрофилов [16]. Действуя преимущественно в поствакцинальном периоде, он может индуцировать апоптоз нейтрофилов и обладать противовоспалительными свойствами, ингибируя продукцию ИЛ-1 и ТНФа за счет индукции синтеза их антагонистов и ингибиторов. К последним, например, относится ИЛ-1га - эндогенный антагонист рецептора ИЛ-1, который блокирует синтез ИЛ-8, ИЛ-1 и ТНФа, снижает адгезию нейтрофилов. Таким образом, ИЛ-6 является негативным цитокином в регуляции активности нейтрофилов и формирует фенотип фагоцитов, функционирующих в затухающем очаге воспаления [30].
Похожим действием на функции нейтрофилов обладают ИЛ-10 и трансформирующий фактор роста (ТФР/3), препятствующие адгезии нейтрофилов к эндотелию, продукции АФК и секреции про-воспалительных цитокинов [45]. Последние при определенных условиях также могут оказывать негативную регуляцию функций нейтрофилов: ИЛ-1 может угнетать адгезию нейтрофилов, а ТНФа - снижать экспрессию на их поверхности рецепторов, ингибировать хемотаксис и ускорять апоптоз.
Интересно, что сами нейтрофилы могут регулировать степень своей активности. Это может происходить в результате снижения экспрессии рецепторов к цитокинам путем их шеддинга и интернализации внутрь клетки. Нейтрофилы могут выступать в роли продуцентов уже известных цитокинов - ИЛ-1, ИЛ-6, ИЛ-8, ТНФа, ТФР/3, КСФ и др., которые уча ствуют в регуляции их функции, действуя как паракринно, так и аутокринно (рис. 1) [22]
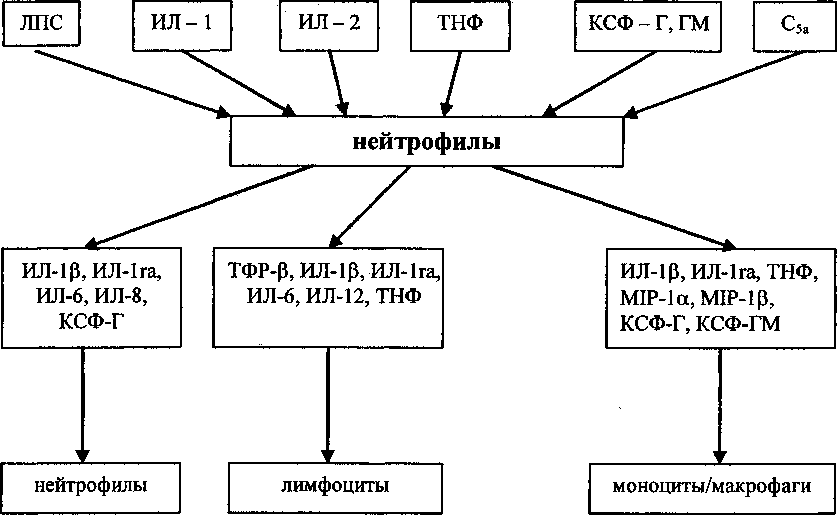
Рис. 1. Продукция нейтрофилами иммунорегуляторных цитокинов и клетки - мишени для них [27]
Мононуклеарные фагоциты обеспечивают неспецифическую антибактериальную защиту организма не только за счет фагоцитарной функции. Секреция макрофагами провоспалительных, а затем противовоспалительных цитокинов обеспечивает контроль первой линии обороны организма от инфекций благодаря рекрутированию и активации самих макрофагов и других защитных клеток (гранулоцитов, естественных киллеров) (рис. 2).
Показано, что нейтрофилы выделяют продукты пептидной природы - нейтрофилокины с молекулярной массой 15-68 кД. Причем, нейтрофилокины интактных клеток обладают иммунодепрессивными свойствами, а активированных - иммуностимулирующими. Первые снижают хемотаксис, образование АФК, фагоцитарную, лизосомную активность нейтрофилов. Вторые, наоборот, стимулируют эти функции [1,6].
Возвращаясь к цитокинзависимой регуляции неспецифической защиты организма, необходимо отметить индукцию провоспалительными цитокинами синтеза реактантов острой фазы (РОФ) - эмпири чески сформированную группу биологически активных веществ, концентрация которых изменяется при воспалительной реакции. Некоторые из них обладают способностью регулировать неспецифические защитные и иммунные реакции организма.
Изучение функций РОФ позволило убедительно продемонстрировать роль некоторых из них в регуляции ключевых событий неспецифической резистентности организма. Наиболее изучены в этом отношении С-реактивный белок (СРВ) и сывороточный амилоид Р (САР), входящие в семейство пентраксинов [17].
В нейтрофилах и моноцитах СРВ и САР активируют многие синтетические процессы (синтез РНК и белка), в том числе синтез и секрецию цитокинов ИЛ-1/3, ИЛ-6, ТНФа [18]. СРВ активирует секрецию ИЛ-8 в культурах очищенных гранулоцитов здоровых людей [4].
Пентраксины регулируют процессы адгезии и миграции фагоцитов. СРВ является хемоаттрактантом для нейтрофилов: активирует направленную миграцию их по градиенту концентрации [5].
СРБ повышает экспрессию /Зг-интегрина СД18 на нейтрофилах человека, не влияя на экспрессию СД 1 lb, а САР повышает экспрессию обе- их молекул. Кроме того, СРБ ингибирует в нейтрофилах экспрессию рецепторов фибронектина VLA-5 (СД 29/СД 49е) и рецепторов ИЛ-8 Н1 типа.
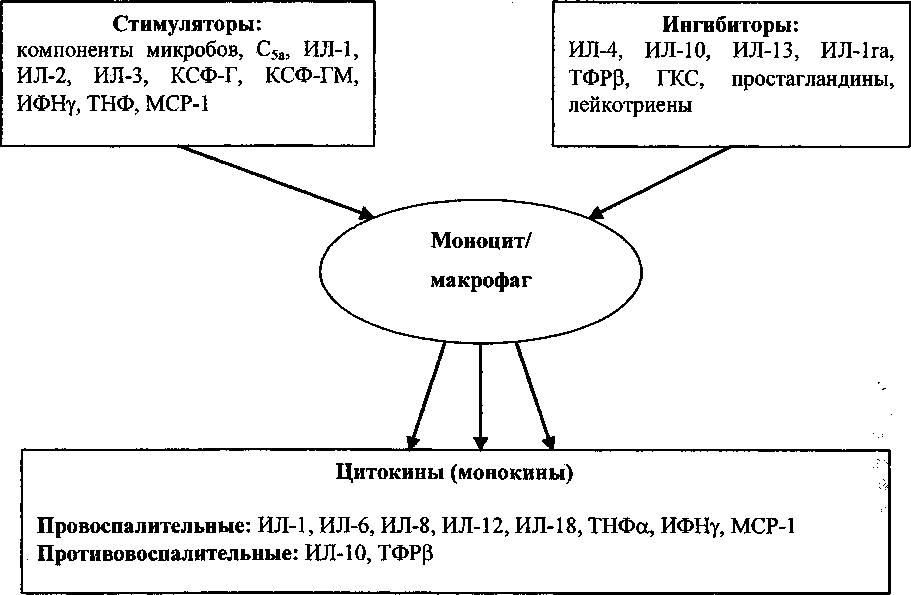
Рис. 2. Продукция цитокинов моноцитами/макрофагами
В условиях экспериментального воспаления СРБ снижает накопление нейтрофилов в очаге, активируя сбрасывание клетками L-селектина, что ограничивает экспансию воспалительной реакции и характеризует СРБ как противовоспалительный фактор. Влияние пентраксинов на продукцию АФК фагоцитами неоднозначно и может быть определено как модуляция: исходно высокий кислородный метаболизм клеток они снижают, а исходно низкие показатели, наоборот, стимулируют [20].
Заметными иммунорегулирующими свойствами обладает агкислый гликопротеин (oii-КГП, орозомукоид). Показано, что этот белок супрес-сирует ответ лимфоцитов на некоторые митогены и клеточно опосредованную цитотоксичность [36]. агКГП снижает активность естественных и антителозависимых киллеров, стимулирует синтез ИЛ-1/3 и ИЛ-1 га в культурах мононуклеаров периферической крови человека [46].
В модельных экспериментах установлено, что сорбция агКГП на нейтрофилах приводит к подавлению продукцию ими АФК [2], а сам белок способен активно связывать и транспортировать низкомолекулярные продукты основного характера. агКГП - естественный фактор ограничения деструктивных процессов в местах воспалительной реакции [26].
Характер влияния гаптоглобина (ГГ) на функции лейкоцитов свидетельствует о его противовоспалительной активности. ГГ ингибирует метаболизм нейтрофилов, снижает реакцию моноцитов на хемоаттрактаны, угнетает пролиферативный ответ мононуклеаров крови человека in vitro на митогены и подавляет продукцию антител. Показано, что влияние ГГ на фагоциты опосредуется интегринами СД НЬ/СД 18, с которыми этот РОФ взаимодействует [34]. Полагают, что воздействие ГГ на моноциты через интегрины может активировать синтез цитокинов типа ИЛ-1 и ИЛ-6 и влиять на синтез РОФ в печени [47].
Представитель нейтральных РОФ «г-мак-роглобулин и особенно его комплексы с активными протеиназами обладают иммуномодулирующими свойствами. Эндоцитоз комплексов сопровождается ингибицией контактных функций макрофагов (снижается экспрессия 1а-антигенов в ответ на ИФНу) и ативацией синтеза и секреции некоторых белков (например, активатора плазминогена). Кроме того а2-макроглобулин способен связывать цитокины и ростковые факторы [33].
В регуляции функциональной активности фагоцитов принимают участие матриксные металлопротеиназы (ММР), активность которых возрастает во время воспалительной реакции. В частности,
ТНФа- конвертирующий фермент (ТАСЕ) осуществляет шеддинг L-селектина в активированных лейкоцитах, тем самым регулируя их миграцию и переход в ткань [45].
Одним из представителей РОФ третьего эшелона является Цп - исключительно активный гликопротеин а2-глобулиновой фракции сыворотки крови человека и высших позвоночных [19]. В эксперименте показано, что Цп оказывает анти-экссудативное действие, способствует торможению активации кининовой системы, существенно уменьшает степень альтерации, приводит к ускоренному морфологическому восстановлению тканей в очаге воспаления [11]. В литературе есть сообщения о косвенном антимикробном эффекте Цп. В очаге воспаления лейкоциты усиленно выделяют в среду содержимое своих гранул, в том числе лактоферрин. Повышение уровня Цп с усилением контактной передачи лактоферрину Fe3+ предупреждает использование Fe3+ патогенными микробами [37].
Установлено, что Цп приводит к увеличению количества циркулирующих в крови лейкоцитов в условиях интактного и подавленного цитостатиком кроветворения за счет стимуляции лейкопоэза, о чем свидетельствует увеличение количества ядросодержащих клеток и лейкоцитов различной степени зрелости в костном мозге, рост лейкоэритробластического отношения. [15]. Кроме того, Цп изменяет функциональную активность лейкоцитов: усиливает адгезивную способность лейкоцитов к интактному и активированному гистамином эндотелию, стимулирует фагоцитарную функцию и активность катионных белков, модулирует продукцию АФК фагоцитами.
Таким образом, регуляция функциональной активности фагоцитов как центрального звена неспецифической защиты организма является многогранной и обеспечивается широким спектром нейро-гуморальных механизмов. Данные сведения представляют интерес не только в фундаментальном аспекте, но и могут являться целью патогенетической коррекции различных дисфункций фагоцитов при патологических ситуациях и им-мунокоррегирующих воздействиях.
Список литературы Современные представления о регуляции неспецифической защиты в организме
- Теплова С.Н., Алексеев Д.А. Секреторный иммунитет. -Челябинск, 2002. -200 с.
- Тотолян A.A., Фрейдлин И.С. Клетки иммунной системы. -М.: Наука, 2000. -231 с.
- Ускорение заживления ожоговых ран у мышей под влиянием α1-кислого гликопротеина/B. В. Саломатин, Т.М. Соболевская, Т.В. Курилова,Р.И. Лившиц//Патол. физиол. и эксперим. терапия. -1989. -№ 6-С. 37-40.
- Фрейдлин И.С., Тотолян A.A. Клетки иммунной системы. -СПб.: Наука, 2001. -390 с.
- Хаитов P.M., Пинегин Б.В. Современные подходы к оценке основных этапов фагоцитарного процесса//Иммунология. -1995. -№ 4. -C. 3-8.
- Шичкин В.П. Патогенетическое значение цитокинов и перспективы цитокиновой/антицитокиновой терапии//Иммунология. -1998. -№ 1. -С. 9-13.
- Ярилин A.A. Система цитокинов и принципы ее функционирования в норме и при патологии//Иммунология. -1997. -№ 6. -С. 7-13.
- Antiinjlamatory properties of hepatic acute phase proteins: prefe rential induction of IL-1 receptor antagonist over IL-1Я synthesis by human peripheral blood mononuclear cells/H. Tilg, E. Vannier, G. Vachino et al.//J. Exp. Med -1993. -Vol. 178. -№ 5. -P. 1629-1636. 31.
- Characterization of beta-adrenergic receptor of rat peritoneal macrophage/С.K. Abrass, S. W. O'Connor, P.J. Scarpace, J. B. Abrass//J. Immunol. -1985. -Vol. 35. -№ 2. -P. 1338-1341.
- Heumann D., Vischer TL. Immunomodulation by α2-macroglobulin and α2-macroglobulin -protease complexes: the effect on human T-lymphocyte response//Eur. J. Immunol. -1988. -Vol. 18. -№ 5. -P. 755-760.
- Identification of haptoglobin as an altrnative ligandfor CD18/S.M. El Ghmati, E.M. van Hoeyveld, J.A.G. van Strijp//J. Immunol. -1996. -Vol. 156. -№ 7. -P. 2542-2552.
- Ignarro L.J., Likt T.F., George W.J. Hormonal control of lysosomal enzyme relase from human neutrophils. Effects of autonomic agents on enzyme relase, phagocytosis, and cyclic nucleotide levels//J. Exp. Med. -1974. -Vol. 139. -№ 6. -P. 1396-1414.
- Immunoregulatory function of human acute phase reactive proteins/J. Kudo, H. Okubo, T. Ikuta et al.//Biomed. Res. -1982. -Vol. 3. -№ 4. -P. 422-428.
- Interaction of lactoferrin with ceruloplasтіп/E.T. Zakharova, M.M. Shavlovski, M.G. Bass et al.//Arch. Biochem. Biophys. -2000. -Vol. 374. -№ 2. -P. 222-228.
- Jaatella M. Biologic activaties and mechanisms of action of tumor necrosis factor α/cachectin//Laboratory Investigation. -1991. -Vol. 64. -№ 6. -P. 724-741.
- Jones Carolyn J.P., Morris K.J., Jayson Malcolm I.K. Prednisolone ingibits phagocytosis by polymorphonuclear leucocytes via steroid receptor mediated events//Ann. Rheum. Diseases. -1983. -Vol. 18. -P. 671-680.
- Koff W.C., Dunegan M.A. Neuroendocrine hormones suppres macrophage -mediated lysis of herpes simplex virus -infected cells//J. Immunol. -1986. -Vol. 136. -№ 1. -P. 705-709.
- Metalnikov S. Role dy Systeme nerveoux et des facteurs biologigues et psyshique dans l'immuniteté. -Paris, 1934. -157 p.
- Neale M., Fiera R., Matthws N. Involvement of phospholipase A2 activation in tumor cell killing by tumor necrosis factor//Immunol. -1988. -Vol. 64. -№ 1. -P. 81-86.
- Neutrophil activating factor induces polimorphonuclear leucocyte adherence to endothelial cells and to subendothelial matrix proteins/H.J. Carveth, F.F. Bohnasach, T.M. McIntyre et al.//Biochem. Biophys. Res. Com. -1989. -Vol. 162. -№ 1. -P. 387-393.
- Preece G., Murphy G., Ager A. Metalloproteinase -mediated regulation of L-selectin levels on leucocytes//J. Biol. Chem. -1996. -Vol. 271. -P. 11634-11640.
- Richards C.D., Brown T.J., Shoyab M. Recombinant oncostatin M stimulates the production of acute phase proteins in HepG2 cells and primary rat hepatocytes in vitro//J. Immunol. -1992. -Vol. 148. -P. 1731-1736.
- Rollins B.J. Chemokines//Blood -1997. -Vol. 90. -№ 3. -P. 909-928.
- Structure and functional expression of the human macrophage inflammatory 1α (MIP-1α)/RANTES receptor/G.L. Gao, H.L. Tiffany,D. Kuhns et al.//J. Exp. Med. -1993. -Vol. 177. -P. 1421 -1427.
- Waymack J.P., Alexander J.W. Immunostimulation by TP-5 in immunocompromized patients and animals current status of investigation//Comp. Immun. Microbiol. Infect. Dis. -1986. -Vol. 9. -P. 225-232.
- Васильева Г.И., Иванова И.А., Тюкавкина С.Ю. Кооперативное взаимодействие моно-и полинуклеарных фагоцитов, опосредованное моно-и нейтрофилокинами//Иммунология. -2000. -№ 5. -С. 11-17.
- Влияние α1-кислого гликопротеина на хемилюминесценцию и перекисное окисление липидов при экспериментальной термической травме/В.В. Саломатин, А.Г. Лютов, С.А. Еникеева и др.//Вопр. мед. химии. -1993. -Т. 39. -№ 3. -С. 24-26.
- Влияние нейроактивных аминокислот на некоторые показатели естественного иммунитета/Л.А. Франгулян, P.A. Манулян, Н.П. Бабаян и др.//Нейрогуморальная регуляция иммунного гомеостаза: Тез. докл. IV Всесоюз. симпоз. -Л., 1986. -С. 122-123.
- Влияние пентраксинов на продукцию интерлейкина-8 и его нейтрофил-активирующие свойства/Е. В. Галкина, П. Г. Назаров, А. В. Полевщиков и др.//Иммунология. -1998. -№ 6. -С. 12-13.
- Галкина Е.В., Назаров Н.Г., Полевщиков A.B. Влияние белков острой фазы воспаления и ИЛ-8 на процессы трансэндотелиалъной миграции нейтрофилов//Медицинская иммунология. -1999. -Т. 1. -№ 3-4. -С. 11-12.
- Долгушин И.И., Бухарин О.В. Нейтрофилы и гомеостаз. -Екатеринбург, 2001. -256 с.
- Иванов В.И. Фагоцитарная активность лейкоцитов на фоне воздействия гормональными препаратами//Сб. науч. тр. Моск. вет. академии. -1975. -Т. 79. -№ 3. -С. 151-155.
- Изучение противовоспалительного действия препарата церулоплазмин в эксперименте/М.В. Миндюк, Б.В. Кочаровский, Л.Н. Басилия и др.//Гематология и переливание крови. -Киев. -1988. -Вып. 23. -С. 57.
- Кетлинский C.A., Калинина Н.М. Цитокины мононуклеарных фагоцитов в регуляции реакций воспаления и иммунитета//Иммунология. -1995. -№ 3. -С. 30-44.
- Кишов М.Г. Влияние инсулина на иммунологические показатели в норме и патологии//Нейрогуморальная регуляция иммунного гомеостаза. Тез. докл. IV Всесоюз. симпоз. -Л., 1986. -С. 42-43.
- Крыжановский Г.Н., Магаева С.В., Макаров С.В. Нейроиммунопатология. -М., 1997. -282 с.
- Кулаков В.В., Коробко А.Г., Пинегин Б.В. Влияние некоторых цитокинов на цитостатическую и цитотоксическую функции нейтрофилов периферической крови человека//Иммунология. -1997. -№ 3. -С. 48-50.
- Магаева С.В. Иммунодефицитное состояние при экспериментальной патологии гиппокампа: Автореф. дис.... д-ра биол. наук. -М., 1979. -39 с.
- Маянский А.Н. Фагоцитоз: проблемы и перспективы//Вестник РАМН. -1993. -№ 4. -С. 52-56.
- Осиков М. В. Патофизиологическая роль церулоплазмин а при лейкоцитозах и лейкопениях: Дисс.... канд. мед. наук. -Челябинск, 2003. -260 с.
- Печковский Д.В., Потапнев М.П., Вознюк A.B. Усиление бактерицидности, но не фагоцитарной активности нейтрофилов человека под влиянием интерлейкина-6//Иммунология. -1993. -№ 6. -С. 29-30.
- Полевщиков A.B., Назаров П.Г. С-реактивный белок и сывороточный амилоид Р: роль в иммунорегуляцш//Иммунология. -1998. -№ 4. -С. 4-10.
- Полевщиков A.B., Назаров П.Г., Берестовая Л.К. Влияние С-реактивного белка на синтез РНК и белка в нейтрофилах//Вопр. мед. химии. -1993. -№ 1. -С.43-45.
- Пучкова Л.В., Алейникова Т.Д., Вербина И.А. Биосинтез двух молекулярных форм церулоплазмина в печени крысы и их полярная секреция в кровоток и в желчь//Биохимия. -1993. -Т. 58. -Вып. 12. -С. 1893-1901.
- Регуляция кислородного метаболизма лейкоцитов крови человека С-реактивным белком/A.B. Полевщиков, E.П. Киселева, Л.К. Берестовая, П.Г. Назаров//Физиология человека. -1995. -№ 2. -С. 122-128.
- Сергеев П.В., Духанин A.C. Роль мембранотропных эффектов глюкокортикоидов в реализации их фармакологической активности: Обзор//Бюл. экперим. биологии и медицины. -2002. -Т. 134. -№ 9. -С. 244-253.
- Симбирцев A.C. Биология семейства интерлейкина-1 человека: Обзор//Иммунология. -1998. -№ 3. -С. 9-17.


