Современные возможности диагностики и лечения разрывов менисков коленного сустава
Автор: Кудрачев Т.Р., Азаркин К.М., Гончарук Ю.Р., Лычагин А.В., Тимашев П.С., Липина М.М., Петров П.И., Кавалерский Г.М.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Обзор литературы
Статья в выпуске: 4 (50), 2022 года.
Бесплатный доступ
Мениски коленного сустава являются важными анатомическими структурами, повреждение и потеря которых стремительно ведет к развитию остеоартроза. На сегодняшний момент при лечении разрыва мениска приоритетной задачей является восстановление менисковой ткани. Для реконструкции необходимо воссоздать архитектуру и расположение клеток внутри мениска. Решением данной проблемы давно занимается регенеративная медицина.Цель данной работы. Обзор современной отечественной и зарубежной литературы, посвященной теме восстановления ткани мениска при помощи методов тканевой инженерии с использованием скаффолдов. В обзоре отражена актуальность проблемы лечения повреждений менисков коленного сустава, подробно обсуждаются возможности использования современных достижений регенеративной медицины, а также 3Д печати скаффалдов мениска.Материалы и методы.В ходе работы был проведен обзор отечественных и зарубежных публикаций за последние 5 лет. Поиск отечественных публикаций проводился в базе данных elibrary.ru, зарубежных - в базах данных PubMed, Scopus, MEDLINE, Cochrane library. В поиск включили оригинальные доклинические исследования invivo, связанные с тканевой инженерией менисков коленного сустава.Выводы. Использование комбинированных скаффолдов с целью замещения ткани мениска является перспективным направлением регенеративной медицины. Доступные коммерческие варианты скаффолдов показывают хорошие краткосрочные результаты лечения, возможности образования неоменисковой ткани на месте лизированных скаффолдов. Для достижения полной регенерации и восстановлению всех функции мениска исследователи продолжают активно разрабатывать и исследовать в эксперименте различные материалы и методы модификации каркасов.
Регенерация менисков, лечение менисков, тканевая инженерия, скаффолды менисков
Короткий адрес: https://sciup.org/142237450
IDR: 142237450 | УДК: 617.3 | DOI: 10.17238/2226-2016-2022-4-57-66
Текст обзорной статьи Современные возможности диагностики и лечения разрывов менисков коленного сустава
Повреждения менисков встречаются в 55-84,8% случаев всех травм коленного сустава[1], при этом разрывы медиального мениска наблюдаются в 3-10 раз чаще, чем латерального. Каждый год во всём мире выполняется примерно 2 миллиона артроскопических операции на коленном суставе, что сопряжено с прямыми медицинскими затратами в размере 4 миллиардов долларов США [2]. Тотальная менискэктомия, хотя и была распространенным методом лечения в прошлом, в настоящее время есть тенденция к уменьшению числа таких операций. Отдаленные результаты после полной резекции мениска выявили неблагоприятные последствия данной операции. Отмечена деградация подлежащего суставного хряща и последующее развитие раннего остеоартрита. [3] По мере развития клинической медицины и фундаментальной науки мы должным образом осознаем мениск как необходимую структуру. Мениск играет ключевую роль в обеспечении конгруэтности суставных поверхностей, перераспределении нагрузки, повышении стабильности, а также участвует в питании и лубрикации коленного сустава.
В данном литературном обзоре мы рассмотрим методы реконструкции менисков посредством тканевой инженерии, основываясь на понимании структуры ткани и возможных методов диагностики ее качества.
-
2. Материалы и методы
-
3. Анатомия мениска коленного сустава
-
4. Ультраструктура мениска
Проанализированы оригинальные доклинические исследования in vivo, связанные с тканевой инженерией мениска коленного сустава. Поиск осуществлялся при помощи информационных баз данных: Pubmed, SCOPUS, MEDLINE, Cochrane library. Критериями включения являлись: наличие полнотекстового формата статей, дата публикации 2015-2022 год, язык оригинальной статьи русский или английский, описанная экспериментальная модель животного: овцы, кролики, мелкие грызуны. Найдено 113 статей. После удаления повторов и оценки по критериям включения отобрано 40 работ. В обзор не включены статьи, в которых описаны скаффолды с применением клеточных технологий.
Мениски коленного сустава являются фиброзно-хрящевыми анатомическими структурами, которые фиксированы к плато большеберцовой кости передним и задним рогами. Внешней стороной они крепятся к капсуле коленного сустава. Внутренняя сторона мениска свободно находится в полости сустава. Robert S´migielski выделяет 5 зон медиального мениска и 5 зон латерального мениска, основываясь на анатомической связи данных зон с другими структурами коленного сустава[4].
С учетом особенностей кровоснабжения менисков, условно выделены 3 зоны: красная (зона с достаточным кровоснабжением), розовая (переходная) и белая (где отсутствует кровоснабже ние). Внутренняя треть мениска является аваскулярной зоной и ее питание осуществляется путем диффузии посредством синовиальной жидкости.
Знание анатомо-физиологических особенностей разных зон мениска способствует выбору оптимального метода лечения при разрывах различной локализации[5].
Мениск коленного сустава на 72% состоит из воды. Оставшаяся сухая масса составляет экстрацеллюлярный матрикс и клетки[6]. Различают три субпопуляции клеток мениска: фибробластоподобные клетки, находящиеся в сосудистой зоне, хондроцитоподобные клетки – в аваскулярной зоне, и клетки, распределенные в поверхностных слоях белой зоны [7]. Их общая функция - синтез и отложение внеклеточного матрикса в ответ на механические раздражители. Распределение различных клеток в архитектуре мениска (сегменты и зоны) в последнее время находится в центре внимания исследователей, так как это может помочь в создании биоинженерных имплантатов.[2]
Большая часть экстрацеллюлярного матрикса представлена коллагеном. Petersen et al. различают три слоя коллагена в ткани мениска: поверхностная сеть фибрилл, образующая сетчатую матрицу на участках суставных поверхностей бедренной и большеберцовой кости; пластинчатый слой, лежащий ниже фибриллярной сети и состоящий из радиально ориентированных пучков коллагеновых волокон; и центральный основной слой коллагеновых фибрилл, идущий по окружности от переднего рога к заднему. [8]
Коллаген, входящий в состав мениска представлен разными типами. Во внешней трети преобладает коллаген первого типа, во внутренней части мениска – коллаген второго типа. Сплетение коллагеновых волокон позволяет преобразовывать вертикальную сжимающую нагрузку в “напряжение по окружности”. Такая архитектоника позволяет менискам равномерно распределять нагрузку, уменьшая травматизацию суставного хряща[9-10] .
Изолированные разрывы менисков возникают из-за вращательных или сдвигающих сил, воздействующих на тибиофеморальный сустав, особенно когда через мениски действует повышенная осевая нагрузка. [7]
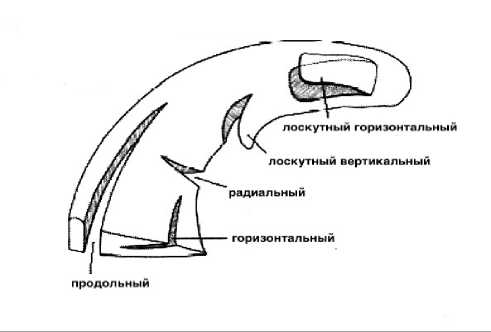
Существует несколько классификаций разрывов менисков коленного сустава. Международная классификация повреждения менисков, разработанная в 2006 году Международным обществом артроскопии, хирургии коленного сустава и спортивной медицины (ISAKOS) [11], основана на морфологической характеристике повреждения.
☐ Продольный разрыв - может располагаться в любом месте вдоль края мениска. Это повреждение может привести к разрыву по типу ручки лейки.
☐ Горизонтальный разрыв начинается у внутреннего края мениска и распространяется к капсуле.
☐ Радиальный разрыв - также начинается у внутреннего края и распространяется по направлению к капсуле. Этот тип разрыва обычно локализуется на границе средней и задней третей латерального мениска. Эти разрывы могут полностью проходить через край мениска, пересекая мениск.
☐ Лоскутные разрывы могут быть как вертикальными, так и горизонтальными. Вертикальный проходит как через нижнюю, так и через верхнюю поверхности мениска. Горизонтальный является последствием горизонтального разрыва. Либо нижняя, либо верхняя поверхность мениска может оставаться интактной при горизонтальном лоскутном разрыве.
☐ Комбинированный разрыв - разрыв в нескольких плоскостях.
-
5. Диагностика разрывов мениска
-
6. Лечение разрывов менисков
В практике применяют как классические динамические тесты для диагностики повреждения менисков, так и визуализирующие методики.
При использовании только клинических тестов необходимо опираться на несколько различных тестов, поскольку точность тестов колеблется от 60 до 95 % в зависимости от клинического опыта исследователя[12]. МРТ является наиболее распространенным инструментальным методом диагностики. Чувствительность и специфичность МРТ в диагностике разрывов мениска варьирует в диапазоне от 77% до 100% [13]–[15]как на аппаратах 1,5 и 3 Тл, так и при низкой напряженности поля (0,2 и 0,3 Тл) [16], [17]. При этом Де Смет и Граф [18] сообщают, что чувствительность МРТ к обнаружению повреждений латерального мениска снижается при наличии в анамнезе острого разрыва ПКС - 94% для разрывов латерального мениска без повреждения ПКС и 69% при наличии разрыва передней крестообразной связки.
Золотым стандартом диагностики является артроскопия, однако, данный вид диагностики не применяется повсеместно ввиду инвазивности и дороговизны метода. [19] На данный момент не рекомендовано проводить диагностическую артроскопию без дополнительной лечебной манипуляции по отношению к разрыву мениска.
В настоящее время для оценки интраартикулярных повреждений коленного сустава исследуются несколько новых оптических методов: спектроскопия в ближней инфракрасной области (БИК), спектроскопия в среднем инфракрасном диапазоне и оптическая когерентная томография (ОКТ). Инфракрасная спектроскопия является одним из наиболее эффективных спектроскопических методов диагностики внутрисуставных повреждений. Многие биологические ткани содержат связи C-H, O-H, N-H и S-H, которые отвечают за поглощение или рассеяние света в инфракрасном диапазоне.[20] Таким образом, данные оптические методы позволяют получить информацию о патологических изменениях поврежденных тканей на молекулярном уровне. БИК-спектроскопия — это быстрый неинвазивный метод, который можно применять для диагностики в режиме реального времени. Этот метод показал многообещающие результаты в исследовании биомеханических свойств суставного хряща, его гистологической оценки и определении биохимического состава[21].
Лечение разрывов менисков зависит от многих факторов. Учитываются возраст пациента, анамнез, генез и локализация разрыва. После проведения дополнительных исследований: функциональных тестов и МРТ коленного сустава, встает выбор между консервативным и оперативным лечением. [22]
Существует несколько хирургических вариантов лечения разрывов мениска. Они включают полную и частичную менискэктомию; шов мениска и его реконструкцию, когда для замены сегмента отсутствующего мениска используется аллографт или скаффолд мениска. Восстановление мениска является приоритетной задачей в тех случаях, когда отсутствует или устранена нестабильность сустава, имеются только периферические разрывы мениска, и в случаях повреждений у молодых и физически активных пациентов [23]
-
6.1. Шов мениска
Согласно консенсусу ESSKA от 2019 года, шов мениска рекомендовано выполнять при продольных разрывах длиной более 10 мм, включая разрывы по типу «ручки лейки», радиальные разрывы зон 1 и 2 по классификации Купера и разрывы корней менисков.[23]
-
6.2. Трансплантация менисков
-
7. Тканевая инженерия менисков
Описаны разные техники шва мениска: изнутри-кнаружи, снаружи-внутрь и all-inside. Однако дегенеративные, сложные или большие разрывы, особенно те, которые находятся в бессосудистой области невозможно восстановить при помощи швов. Дополнительно существует риск несостоятельности шва мениска, который отмечается 5% - 43,5%(в среднем в 15%) случаев.[24]15%
Для потенцирования регенерации в области шва мениска были предложены вспомогательные методики для аугментации: трепанация мениска и абразивная техника [25], использование обогащённой тромбоцитами плазмы (PRP) и фибринового клея. По данным систематического обзора, субъективное улучшение показателей функциональных тестов отмечено после восстановления мениска с помощью биологической аугментации, однако, преимущества в отношении усиления регенеративных процессов по сравнению со стандартным швом мениска подвергаются сомнению.[26]
Когда врачи сталкиваются с инкурабельными разрывами мениска или с пациентами, перенесшими тотальную или субтотальную менискэктомию, трансплантация менискового аллотрансплантата (MAT) может рассматриваться в качестве предпочтительного метода лечения. К ограничениям аллотрансплантации можно отнести узкий перечень показаний к ее выполнению. Методика может быть применена у пациентов в возрасте до 55 лет, со стабильным коленным суставом и без значительных отклонений оси конечности от нормальных значений. Степень артроза, присутствующего до операции, оказывает решающее влияние на конечный результат. Эта операция противопоказана при тяжелом остеоартрите. [27]
Наиболее часто используются глубокозамороженные и кри-оконсервированные менисковые аллотрансплантаты. Наблюдается тенденция к использованию свежих аллотрансплантатов. [28]. Основной технической трудностью в подборе трупного материала является несоответствие размера и формы донорского мениска и области его имплантации в коленный сустав реципиента. В случае трансплантации комплекса мениска и костного блока дополнительная травматичность процедуры объясняется необходимостью адаптации костного блока к суставу. Кроме того, сохраняется выраженный послеоперационный болевой синдром, который замедляет процесс восстановления после трансплантации мениска и отдаляет сроки возвращения в профессиональный спорт.[29] Основная цель MAT - предотвратить или отсрочить дегенерацию сустава. Однако результаты современных исследований показывают, что не удается добиться достаточных хондропротективных свойств от данной методики. [30]
Помимо трансплантации мениска в литературе описано использование аутографта для замены мениска при помощи сухожилия длинной малоберцовой мышцы при дефиците ткани латерального мениска. [31]
Тканевая инженерия в настоящее время является наиболее перспективным методом восстановления ткани мениска. Вышеописанные методы трансплантации мениска допустимы только для полного замещения мениска коленного сустава. Для частичной замены возможно использование скаффолда мениска.
На данный момент в Европе доступны два вида менисковых скаффолда, предназначенных для реконструкции или замещения частичных дефектов мениска:
-
1) Коллагеновый имплантат мениска (Collagen Meniscal Implant – CMI) (Ivy Sports Medicine, Грефельфинг, Германия) изготавливаемый из коллагена 1-ого типа бычьего ахиллового сухожилия. Применяется в клинической практике с 1997 года.
-
2) Полимерный синтетический каркас Actifit (Orteq Bioengineering, Лондон, Великобритания) изготовлен из смеси поликапролактона и уретана. Вошедший в практическое использование несколькими годами ранее [1]Gräfelfing, Germany [33]
-
7.1. Методы изготовления скаффолдов мениска
В актуальных исследованиях отмечена безопасность и хорошие ранние и среднесрочные клинические результаты при использовании данных скаффолдов [34], [33] .Через 12 месяцев после имплантации скаффолдов был взят биопсийный материал для гистологической оценки, которая показала богатую сосудами фиброзноподобную ткань в импланте CMI, в то время как Actifit имел хрящеподобную аваскулярную структуру. В обоих случаях экстрацеллюлярный матрикс и клетки имели гетерогенный характер расположения внутри скаффолда, что может свидетельствовать о неравномерном распределении нагрузки на каркас. Ни в одном из скаффолдов не отмечены признаки некроза в новообразованной ткани мениска. [34] Суставной хрящ выглядит интактно и без появления новых повреждений у большинства пациентов в двух группах.
При двухлетнем наблюдении данных МРТ отмечали заполнение места скаффолда новой тканью и изменение изначальной формы скаффолда. Размеры скаффолда уменьшились на 61% у группы пациентов CMI и на 79% у группы пациентов с Actifit, что связывают с действием неравномерных нагрузок в суставе. [33]
Большинство исследователей отмечают трудности, связанные с фиксацией скаффолда к капсуле сустава. Механическая слабость и изменение формы каркасов после их трансплантации обуславливают необходимость в поиске и разработке новых моделей скаффолдов мениска. [35]
Концепция тканевой инженерии, основанная на возможной комбинации скаффолда, клеток и биоактивных агентов с целью усиления регенеративного потенциала, представляет из себя многообещающую стратегию лечения повреждений менисков.
Начиная обсуждение с конструкции бесклеточного каркаса следует упомянуть о двух важных факторах, которые определяют использование скаффолдов: выбор метода изготовления и материала для создания каркаса.
При выборе метода учитывают возможность регулирования величины пор, пористости и направления волокон скаффолда. Данные характеристики важны для пролиферации клеток и процесса неоваскуляризации. Также необходимо оценить экономическую целесообразность применения того или иного метода.
Технология изготовления губчатых каркасов основана на физической/химической обработке материала скаффолда с соответствующим изменением давления и/или температуры. В настоящее время подобные методики менее популярны, поскольку следовые концентрации реагентов, используемых в процессе изготовления, могут оказывать негативное влияние на клетки и окружающий экстрацеллюлярный матрикс мениска. Ввиду того, что свойства таких каркасов изотропны, и их внутренняя структура в значительной степени зависит от процесса изготовления, очень трудно контролировать размер и геометрию пор, их распределение, взаимосвязь и общую пористость.[36]
Технология электроспиннинга позволяет изготавливать биоразлагаемые волокна различного диаметра, которые, как предполагается, могут имитировать ультраструктуру и механические свойства нативного мениска. В ряде исследований описан данный вид производства скаффолдов[37],[38]. Метод основан на преобразовании растворов полимеров в однородные волокна посредством накопления материала на коллекторе под воздействием на раствор электромагнитным полем. Для изготовления скаффолда необходимой формы требуется применение формующих заготовок. Дополнительная сложность для воспроизведения анатомии нативного мениска состоит в том, что волокна, которые испускаются из сопла при прохождении через электромагнитное поле распределяются в тонкослойнный двухмерный скаффолд неравномерно. Это не позволяет одномоментно создать точную 3Д структуру и вынуждает прибегать к методикам химического или физического сшивания слоев. Другой проблемой является пористость получаемых материалов. Небольшой размер пор волокнистого материала затрудняет проникновение клеток в более глубокую зону каркасов, при этом большинство клеток после посева прикрепляются и распространяются только по поверхности скаффолда. [39] Подобные ограничения объясняют, почему ряд исследователей используют данную технологию только в комбинации с другими аддитивными методами. [37]
К аддитивным методам производства относят:
-
- 3D-нанесение / прямая запись чернилами,
-
- стереолитография (SLA),
-
- селективное лазерное спекание (SLS),
-
- моделирование методом плавленого осаждения (FDM)
-
- печать на 3Д биопринтере на основе экструзии [40].
-
7.2. Различные материалы скаффолдов
Данные методики позволяют создавать скаффолды с заданными параметрами (диаметр волокон и свойства пор).В литературе последних лет наиболее часто упоминается моделирование методом послойнного наплавления (FDM)[41, с.], [42]
Технология FDM печати позволят быстро напечатать конструкт из различных синтетических полимеров, при условии удачной настройки принтера и наличия сопла необходимого диаметра. В актуальных исследованиях толщина пор [41, с.], [42] варьирует от 200 до 400 мкм. В одном из исследований в ходе эксперимента было определено, что наилучшие регенеративные свойства клеток привитых на поликапролактоновый скаффолд были получены при размере пор 215 мкм( в сравнении с порами размером 320мкм и 515 мкм) [43].
Другие возможности открываются при использовании 3D-печати с двумя соплами и применением термопластичного материала (например, поликапролактона) и гидрогелевого компонента. В этом случае механическая стойкость первого компонента дополняется способностью создания благоприятной для клеток среды за счет гидрогеля. Конструкции могут быть изготовлены путем чередования нитей поликапролактона с гидрогелем, насыщенным клетками. [44]
В качестве альтернативы, предварительно изготовленные 3D-печатные скаффолды могут быть пропитаны гидрогелями. [41],[45]
В некоторых исследованиях применяется электрогидродинамически струйная 3D-печать для создания более высокоточных конструкций. [46],[47] Это многообещающая технология, разработанная на основе электроспиннинга, которая позволяет осуществлять точное нанесение волокон послойно с индивидуальным дизайном. Скаффолды, произведенные данным методом, способны поддерживать фиксацию, проникновение и пролиферацию клеток, а также формирование внеклеточного матрикса, благодаря четко очерченным порам.[46] В недавнем исследовании показано, что подобные скаффолды имеют больший модуль Юнга по сравнению с коллагеновым каркасом (CMI) и больший показатель предела текучести по сравнению со скаффолдами напечатанными на FDM принтере. [47] Однако данный метод сопряжен с высокими финансовыми затратами в связи с дорогостоящим оборудованием и расходным материалом.
Основные требования, предъявляемые к материалам скаф-фолдов:
-
1) Биосовместимость каркаса и продуктов его деструкции с тканями хозяина
-
2) Возможность регулирования времени биодеградации. В идеале время деградации должно совпасть со временем образования новой ткани мениска.
-
3) Механические свойства, достаточные для поддержания прочности каркаса на протяжении времени его замещения неоменисковой тканью.
-
8. Ростовые факторы
Скаффолды могут состоять как из синтетических материалов, так и из природных. К последним относят коллаген[48], желатин, гиалуроновую кислоту[49], агарозу и другие гидрогели.[50],[51]. Природные биоматериалы нашли широкое применение благодаря их способности к биодеградации и биосовместимости. Однако механическая прочность биологических скаффолдов ниже, чем у скаффолдов изготовленных из синтетических материалов. Имеются данные о том, что каркасы из природных полимеров значительно быстрее подвергаются деградации, уменьшаются в размере и разрушаются в момент фиксации их к капсуле сустава. [33]
В качестве альтернативного метода производства биомиметического бесклеточного каркаса J. C. Ruprecht и T. D. Waanders предложили использовать процесс децеллюляри-зации неповрежденной ткани резецированного мениска, чтобы сохранить нативную структуру и организацию на уровне волокон коллагена. Кроме того, данный тип скаф-фолда, как ожидается, будет иметь гораздо меньший иммуногенный потенциал. Среди основных проблем, связанных с использованием децеллюляризованной ткани, плотная структура внеклеточного матрикса (ECM), неправильное прилегание и несоответствие размеров суставным по- верхностям, что снижает клеточную инфильтрацию этих каркасов. [8]
В качестве синтетических материалов наиболее широко применяются следующие: поликапролактон (PCL)[42] полиуретан, полимолочная кислота[52] и полимолочно-ко-гликолевая кислота (PLGA)[53]. Отмечено, что синтетические полимеры обладают большей механической стабильностью. Перед использованием таких каркасов на модели животного следует обратить внимание на продукты распада скаффолда и на время деградации материала в различных биологических средах. Так, в ходе деградации полиуретана образуются канцерогенные вещества, а продукты распада PLGA создают вокруг себя кислую среду, которая непригодна для развития и дифференцировки клеток[53]. Некоторые материалы разлагаются быстрее, чем успевает образоваться неоменисковая ткань. [54]
Поликапролактон (PCL) является наиболее часто используемым материалом для изготовления скаффолдов из имеющихся биосовместимых синтетических материалов. В зависимости от молекулярной массы срок деградации варьирует от 1 года до трех лет, что позволяет конструкции долго сохранять механическую прочность[42]. Материал прост в обращении при печати и доступен в любой форме для использования в различных аддитивных технологиях. [52] Однако поликапролактон обладает гидрофобными свойствами, и способность клеток к прикреплению на его поверхности возможна только при наличии биоактивных молекул. В исследовании был предложен поликапролактоновый каркас с введением оптимизированного Са-альгинатного гидрогеля с наличием экстрацеллюлярного матрикса (2%), показавший хорошую регенеративную способность в сравнении с экспериментальной группой. [41]
За последние 5 лет в доклинических исследованиях [55],[56],[45] активно используют гидрогели. Гидрогели представляют собой полужидкие гидрофильные коллоиды, состоящие из сети сшитых природных или синтетических полимерных цепей. Им можно легко придать нужную форму и равномерно смешать с клетками и факторами роста. Физические свойства гидрогелей определяются содержанием в них воды. Более высокая пористость способствует диффузии клеток. Однако гидрогелиевый скаффолд не способен нести нагрузку соответствующую каркасу нативного мениска, что ограничивает его изолированное использование в качестве скаффолда [57].
Было продемонстрировано, что определенные факторы роста играют ключевую роль в метаболической активности фиброхондроцитов мениска: регулируют развитие, гомеостаз, обновление и регенерацию клеток. Наиболее часто с целью регенерации ткани или фиброхондроцитов мениска используют следующие факторы роста:
-
- основной фактор роста фибробластов (bFGF);
-
- трансформирующий фактор роста бета 1 и 3 (TGFB1, TGFB3) - инсулиноподобный фактор роста
-
- фактор IGF-1 [58].
-
9. Обсуждение
Тем не менее, определение наиболее подходящего сочетания ростовых факторов, подходящих доз и кинетики высвобождения остаются нерешенными проблемами.
Последние достижения в области тканевой инженерии менисков сосредоточены на разработке зонально организованных тканевых конструкций, которые пытаются имитировать анизотропную ультраструктуру человеческого мениска. [59]
Тканевая инженерия менисков является перспективной и активно развивающейся областью регенеративной медицины. Продолжается поиск материалов и методов изготовления скаф-фолда мениска, удовлетворяющих все условия по восстановлению структуры и функции мениска. Каркас должен обладать хорошими механическими свойствами и иметь достаточную толщину пор для успешной миграции и пролиферации клеток внутри конструкции. Материал скаффолда не должен быть токсичным, одновременно с этим должен обладать достаточной биоактивностью для обеспечения жизнеспособности клеток. С этой задачей могут справиться биологические компоненты в виде экстрацеллюлярного матрикса и ростовых факторов. В связи с этим, все чаще прибегают к его модификации биохимическими стимулами, использование мезенхемальных стволовых клеток, а также возможное применение физиологической стимуляции в биореакторах.[60]
В доклинических экспериментах применение мезенхимальных стволовых клеток различного происхождения улучшает микроокружение скаффолда и способствует дальнейшей регенерации менисков. Разные типы клеток, как и разные матричные материалы могут быть использованы для индуцирования зональных изменений в скаффолде. [61]
Таким образом, идеальный скаффолд мениска должен способствовать анаболической активности, а именно эндогенному восстановлению тканей и регенерации с помощью биомиметического каркаса, который обеспечивает клеточное прикрепление и рост, способствуя идеальной интеграции каркаса с тканью [62]
В настоящее время для производства скаффолдов мениска все чаще используют аддитивные технологии. 3D-принтеры и методы 3D-визуализации становятся более популярными, и появляется возможность разработки персональных каркасы для менисков. Актуальной идеей является комбинирование синтетических и природных материалов.
Природные полимеры, такие как коллаген и желатин, обычно содержат молекулы, которые могут взаимодействовать с клетками, улучшая биологические характеристики гибридных полимерных каркасов. Параллельно с этим синтетические полимеры обеспечивают настраиваемые физические свойства, такие как механическая поддержка и контролируемая скорость деградации. [63]
Доклинические исследования рекомендовано проводить не только на маленьких животных, но и на крупных моделях, например, на модели овцы. Мениски крупных животных имеют большую схожесть с человеческими по размеру и анатомии. Также возможно отработать хирургическую технику, от которой также зависит конечный исход регенерации мениска. [64]
Целью данного обзора было осветить как роль мениска в биомеханике, так и структуру, методы диагностики и лечения разрывов мениска. Развитие биоинженерных технологий дает возможность совершенствовать методы производства и материалы скаффолдов, что подтверждается ежегодным ростом числа проводимых экспериментальных исследований. Множество вопросов, как и прежде остаются спорными. Дальнейшее обсуждение и анализ имеющихся хирургических и фундаментальных техник, а также динамика их развития и актуальность планируется к описанию нами в следующих публикациях.
Список литературы Современные возможности диагностики и лечения разрывов менисков коленного сустава
- Абдуразаков У. А., Набиев Е. Н., Байзаков А. Р. Анатомо-функциональные особенности менисков и причины их повреждений // Вестник Казахского национального медицинского университета. 2020; 1:298-302. [Abdurazakov U.A., Nabiyev E.N., Baizakov A.R. Anatomical- functional features of meniscus and the causes of their damages. Vestnik Kazahskogo nacional’’nogo medicinskogo universiteta. 2020; 1:298-302. (In Russian)]
- Verdonk R., Espregueira Mendes J., Monllau J. (eds) Meniscal Transplantation. Heidelberg, Springer Berlin publ. 2013;119
- Allen P. R., Denham R. A., Swan A. V. Late degenerative changes after meniscectomy. Factors affecting the knee after operation. The Journal of bone and joint surgery. British volume, 1984; 66(5):666–671. doi: 10.1302/0301-620X.66B5.6548755.
- Śmigielski R., Becker R., Zdanowicz U., Ciszek B. Medial meniscus anatomy-from basic science to treatment. Knee surgery, sports traumatology, arthroscopy: official journal of the ESSKA. 2015; 23(1):8–14. doi: 10.1007/s00167-014-3476-5.
- Arnoczky S. P., Warren R. F. Microvasculature of the human meniscus. The American journal of sports medicine. 1982; 10(26):90–95. doi: 10.1177/036354658201000205.
- Fox A. J., Bedi A., Rodeo S. A. The basic science of human knee menisci: structure, composition, and function. Sports health. 2012; 4(4):340–351. doi: 10.1177/1941738111429419.
- Twomey-Kozak J., Jayasuriya C. T. Meniscus Repair and Regeneration: A Systematic Review from a Basic and Translational Science Perspective. Clinics in sports medicine. 2020; 39(1):125–163. doi: 10.1016/j.csm.2019.08.003.
- Petersen W., Tillmann B. Collagenous fibril texture of the human knee joint menisci, Anatomy and Embryology (Berlin). 1998; 197(4):317–324. doi: 10.1007/s004290050141.
- Renström P., Johnson R. J. Anatomy and biomechanics of the menisci. Clinics in sports medicine. 1990; 9(3):523–538. doi: 10.1016/S0278-5919(20)30704-3.
- Guo W., Liu S., Zhu Y., Yu C., Lu S., Yuan M., Gao Y., Huang J., Yuan Z., Peng J., Wang A., Wang Y., Chen J., Zhang L., Sui X., Xu W., Guo Q. Advances and Prospects in Tissue-Engineered Meniscal Scaffolds for Meniscus Regeneration. Stem cells international. 2015; 517520. doi: 10.1155/2015/517520.
- Anderson A. F., Irrgang J. J., Dunn W., Beaufils P., Cohen M., Cole B. J., Coolican M., Ferretti M., et all. Interobserver reliability of the International Society of Arthroscopy, Knee Surgery and Orthopaedic Sports Medicine (ISAKOS) classification of meniscal tears. The American journal of sports medicine. 2011; 39(5):926–932. doi: 10.1177/0363546511400533.
- Malanga G. A., Andrus S., Nadler S. F., McLean, J. Physical examination of the knee: a review of the original test description and scientific validity of common orthopedic tests. Archives of physical medicine and rehabilitation. 2003; 84(4):592–603. doi: 10.1053/apmr.2003.50026.
- Anderson M. W., Raghavan N., Seidenwurm D. J., Greenspan A., Drake C. Evaluation of meniscal tears: fast spin-echo versus conventional spin-echo magnetic resonance imaging. Academic radiology. 1995; 2(3):209–214. doi: 10.1016/s1076-6332(05)80166-7.
- Magee T., Shapiro M., Williams D. Usefulness of simultaneous acquisition of spatial harmonics technique for MRI of the knee. American journal of roentgenology. 2004; 182(6):1411–1415. doi: 10.2214/ajr.182.6.1821411.
- Reeder J. D., Matz S. O., Becker L., Andelman S. M. MR imaging of the knee in the sagittal projection: comparison of three-dimensional gradient- echo and spin-echo sequences. American journal of roentgenology. 1989; 153(3):537–540. doi: 10.2214/ajr.153.3.537.
- Magee, T., & Williams, D. (2006). 3.0-T MRI of meniscal tears. American journal of roentgenology. 2006; 187(2):371–375. doi: 10.2214/AJR.05.0487.
- Cotten A., Delfaut E., Demondion X., Lapègue F., Boukhelifa M., Boutry N., Chastanet P., Gougeon F. MR imaging of the knee at 0.2 and 1.5 T: correlation with surgery. AJR. American journal of roentgenology. 2000; 174(4):1093–1097. doi: 10.2214/ajr.174.4.1741093.
- De Smet A. A., Graf B. K. Meniscal tears missed on MR imaging: relationship to meniscal tear patterns and anterior cruciate ligament tears. American journal of roentgenology. 1994; 162(4):905–911. doi: 10.2214/ajr.162.4.8141016.
- Coşkun Bilge A., Tokgöz N., Dur H., Uçar M. The value of magnetic resonance imaging in diagnosing meniscal tears: A retrospective cohort study. Journal of Surgery and Medicine. 2019; 3(1):64-69 doi: 10.28982/josam.515244.
- Hofmann G. O., Marticke J., Grossstück R., Hoffmann M., Lange M., Plettenberg H. K., Braunschweig R., Schilling O., Kaden I., Spahn G. Detection and evaluation of initial cartilage pathology in man: A comparison between MRT, arthroscopy and near-infrared spectroscopy (NIR) in their relation to initial knee pain. Pathophysiology: the official journal of the International Society for Pathophysiology. 2010;17(1):1–8. doi: 10.1016/j.pathophys.2009.04.001.
- Ala-Myllymäki J., Danso E. K., Honkanen J. T. J., Korhonen R. K., Töyräs J., Afara I. O. Optical spectroscopic characterization of human meniscus biomechanical properties. Journal of biomedical optics. 2017; 22(12):1–10. doi: 10.1117/1.JBO.22.12.125008.
- Giuffrida A., Di Bari A., Falzone E., Iacono F., Kon E., Marcacci M., Gatti R., Di Matteo B. Conservative vs. surgical approach for degenerative meniscal injuries: a systematic review of clinical evidence. European review for medical and pharmacological sciences. 2020; 24(6):2874–2885. doi: 10.26355/eurrev_202003_20651.
- Kopf S., Beaufils P., Hirschmann M. T., Rotigliano N., Ollivier M., Pereira H., Verdonk R., Darabos N., Ntagiopoulos P., Dejour D., Seil R., Becker R. Management of traumatic meniscus tears: the 2019 ESSKA meniscus consensus. Knee surgery, sports traumatology, arthroscopy : official journal of the ESSKA. 2020; 28(4):1177–1194. doi: 10.1007/s00167-020-05847-3.
- Pujol N., Barbier O., Boisrenoult P., Beaufils P. Amount of meniscal resection after failed meniscal repair. The American journal of sports medicine. 2011; 39 (8):1648-1652. doi:10.1177/0363546511402661
- Okuda K., Ochi M., Shu N., Uchio, Y. Meniscal rasping for repair of meniscal tear in the avascular zone. Arthroscopy. 1999; 15(3):281-286. doi: 10.1016/s0749-8063(99)70035-6.
- Keller R.E., O’Donnell E.A., Medina G.I.S., Linderman S.E., Cheng T.T.W., Sabbag O.D., Oh L.S. Biological augmentation of meniscal repair: a systematic review. Knee surgery, sports traumatology, arthroscopy. 2022;30(6):1915-1926. doi: 10.1007/s00167-021-06849-5. Epub 2022
- Ryu R.K., Dunbar V.W.H., Morse G.G. Meniscal allograft replacement: a 1-year to 6-year experience. Arthroscopy. 2002; 18(9):989-994. doi: 10.1053/jars.2002.36104.
- Pereira H., Fatih Cengiz I., Gomes S., Espregueira-Mendes J., Ripoll P.L., Monllau J.C., Reis R.L., Oliveira J.M. Meniscal allograft transplants and new scaffolding techniques. EFORT Open Reviews. 2019; 3(6):279-295. doi: 10.1302/2058-5241.4
- Southworth T. M., Naveen N. B., Tauro T. M., Chahla J., Cole B. J. Meniscal Allograft Transplants. Clinics in sports medicine. 2020; 39(1):93–123. doi:10.1016/j.csm.2019.08.013
- Gelber P. E., Verdonk. P., Getgood A. M., Monllau J. C. Meniscal transplantation: state of the art. Journal of ISAKOS: Joint Disorders and Orthapaedic Sports Medicine. 2017; 2(6):339–349. doi: 10.1136/jisakos-2017-000138.
- Milenin O., Strafun S., Sergienko R., Baranov K. Lateral Meniscus Replacement Using Peroneus Longus Tendon Autograft. Arthroscopy techniques. 2020; 9(9):1163–1169. doi:10.1016/j.eats.2020.04.016
- Myers K. R., Sgaglione N. A., Goodwillie A. D. Meniscal scaffolds. The journal of knee surgery. 2014; 27(6):435–442. doi: 10.1055/s-0034-1388656.
- Reale D., Previtali D., Andriolo L., Grassi A., Candrian C., Zaffagnini S., Filardo G. No differences in clinical outcome between CMI and Actifit meniscal scaffolds: a systematic review and meta-analysis. Knee surgery, sports traumatology, arthroscopy: official journal of the ESSKA. 2022; 30(1):328-348. doi:10.1007/s00167-021-06548-1
- Bulgheroni E., Grassi A., Campagnolo M., Bulgheroni P., Mudhigere A., Gobbi A. Comparative Study of Collagen versus Synthetic-Based Meniscal Scaffolds in Treating Meniscal Deficiency in Young Active Population. Cartilage. 2016; 7(1):29-38. doi: 10.1177/1947603515600219.
- Kon E., Filardo G., Zaffagnini S., Di Martino A., Di Matteo B., Marcheggiani Muccioli G.M., Busacca M., Marcacci M. Biodegradable polyurethane meniscal scaffold for isolated partial lesions or as combined procedure for knees with multiple comorbidities: clinical results at 2 years. Knee surgery, sports traumatology, arthroscopy: official journal of the ESSKA. 2014;22(1):128–134. doi: 10.1007/s00167-012-2328-4.
- Sun J., Vijayavenkataraman S., Liu H. An Overview of Scaffold Design and Fabrication Technology for Engineered Knee Meniscus. Materials. 2017; 10(1):29. doi: 10.3390/ma10010029.
- Gao S., Chen M., Wang P., Li Y., Yuan Z., Guo W., Zhang Z., Zhang X., Jing X., Li X., Liu S., Sui X., Xi T., Guo Q. An electrospun fiber reinforced scaffold promotes total meniscus regeneration in rabbit meniscectomy model. Acta biomaterialia. 2018;73:127-140. doi: 10.1016/j.actbio.2018.04.012.
- Grogan S. P., Baek J., D’Lima D. D. Meniscal tissue repair with nanofibers: future perspectives. Nanomedicine (London, England). 2020;15(25):2517–2538. doi: 10.2217/nnm-2020-0183.
- Chen M., Gao S., Wang P., Li Y., Guo W., Zhang Y., Wang M., Xiao T., Zhang Z., Zhang X., Jing X., Li X., Liu S., Guo Q., Xi T. The application of electrospinning used in meniscus tissue engineering. Journal of biomaterials science. Polymer edition. 2018; 29(5):461–475. doi:10.1080/09205063.2018.1425180.
- Moroni L., Burdick J.A., Highley C., Lee S.J., Morimoto Y., Takeuchi S., Yoo J.J. Biofabrication strategies for 3D in vitro models and regenerative medicine. Nature reviews. Materials. 2018; 3(5):21–37. doi: 10.1038/s41578-018-0006-y.
- Chen M., Feng Z., Guo W., Yang D., Gao S., Li Y., Shen S., Yuan Z., Huang B., Zhang Y., Wang M., Li X., Hao L., Peng J., Liu S., Zhou Y., Guo, Q. PCL-MECM-Based Hydrogel Hybrid Scaffolds and Meniscal Fibrochondrocytes Promote Whole Meniscus Regeneration in a Rabbit Meniscectomy Model. ACS applied materials and interfaces. 2018; 11(44):41626–41639. doi: 10.1021/acsami.9b13611.
- Zhang Z. Z., Wang S. J., Zhang J. Y., Jiang W. B., Huang A. B., Qi Y. S., Ding J. X., Chen X. S., Jiang D., Yu J. K. 3D-Printed Poly(ε-caprolactone) Scaffold Augmented With Mesenchymal Stem Cells for Total Meniscal Substitution: A 12- and 24-Week Animal Study in a Rabbit Model. The American journal of sports medicine. 2017; 45(7):1497–1511. doi: 10.1177/0363546517691513.
- Zhang Z. Z., Jiang D., Ding J. X., Wang S. J., Zhang L., Zhang J. Y., Qi Y. S., Chen X. S., Yu J. K. Role of scaffold mean pore size in meniscus regeneration. Acta biomaterialia. 2016;43:314–326. doi: 10.1016/j.actbio.2016.07.050.
- Jian Z., Zhuang T., Qinyu T., Liqing P., Kun L., Xujiang L., Diaodiao W., Zhen Y., Shuangpeng J., Xiang S., Jingxiang H., Shuyun L., Libo H., Peifu T., Qi Y., Quanyi G. 3D bioprinting of a biomimetic meniscal scaffold for application in tissue engineering. Bioactive materials. 2020;6(6):1711–1726. doi: 10.1016/j.bioactmat.2020.11.027.
- Bahcecioglu G., Hasirci N., Bilgen B., Hasirci V. A 3D printed PCL/hydrogel construct with zone-specific biochemical composition mimicking that of the meniscus. Biofabrication. 2019;11(2):025002. doi: 10.1088/1758-5090/aaf707.
- Wu Y. Electrohydrodynamic jet 3D printing in biomedical applications. Acta biomaterialia. 2021; 128: 21-41. doi: 10.1016/j.actbio.2021.04.036.
- Korpershoek J. V., Ruijter M., Terhaard B. F., Hagmeijer M. H., Saris D. B. F., Castilho M., Malda J., Vonk L. A. Potential of Melt Electrowritten Scaffolds Seeded with Meniscus Cells and Mesenchymal Stromal Cells. International journal of molecular sciences. 2021; 22(20):11200. doi: 10.3390/ijms222011200.
- Baek J., Sovani S., Choi W., Jin S., Grogan S. P., D’Lima D. D. Meniscal Tissue Engineering Using Aligned Collagen Fibrous Scaffolds: Comparison of Different Human Cell Sources. Tissue engineering, Part A. 2018; 24(1-2):81–93. doi: 10.1089/ten.tea.2016.0205.
- Ghodbane S. A., Patel J. M., Brzezinski A., Lu T. M., Gatt C. J., Dunn M. G. Biomechanical characterization of a novel collagen-hyaluronan infused 3D-printed polymeric device for partial meniscus replacement. Journal of biomedical materials research. Part B, Applied biomaterials. 2019;107(8):2457–2465. doi: 10.1002/jbm.b.34336.
- Rajalekshmi R., Jayasree P., Annie J., Roy J. Injectable self-crosslinking hydrogels for meniscal repair: A study with oxidized alginate and gelatin. Carbohydrate Polymers. 2020; 234:115902. doi: 10.1016/j.carbpol.2020.115902.
- Stone K. R., Steadman J. R., Rodkey W. G., Li S. T. Regeneration of meniscal cartilage with use of a collagen scaffold. Analysis of preliminary data. The Journal of bone and joint surgery, American volume. 1997; 79(12):1770–1777. doi:10.2106/00004623-199712000-00002
- Li H., Li P., Yang Z., Gao C., Fu L., Liao Z., Zhao T., Cao F., Chen W., Peng Y., Yuan Z., Sui X., Liu S., Guo Q. Meniscal Regenerative Scaffolds Based on Biopolymers and Polymers: Recent Status and Applications. Frontiers in cell and developmental biology. 2021; 9: 661802. doi: 10.3389/fcell.2021.661802.
- Cojocaru D. G., Hondke S., Krüger J. P., Bosch C., Croicu C., Florescu S., Lazarescu A., Patrascu J. M., Jr, Patrascu J. M., Dauner M., Gresser G. T., Endres M. Meniscus-shaped cell-free polyglycolic acid scaffold for meniscal repair in a sheep model. Journal of biomedical materials research. Part B, Applied biomaterials. 2020; 108(3):809–818. doi: 10.1002/jbm.b.34435.
- An Y. H., Woolf S. K., Friedman R. J. Pre-clinical in vivo evaluation of orthopaedic bioabsorbable devices. Biomaterials. 2000; 21(24):2635–2652. doi: 10.1016/S0142-9612(00)00132-0.
- Bahcecioglu G., Hasirci N., Bilgen B., Hasirci V. Hydrogels of agarose, and methacrylated gelatin and hyaluronic acid are more supportive for in vitro meniscus regeneration than three dimensional printed polycaprolactone scaffolds. International journal of biological macromolecules. 2018; 122:1152–1162. doi: 10.1016/j.ijbiomac.2018.09.065.
- Rey-Rico A., Cucchiarini M., Madry H. Hydrogels for precision meniscus tissue engineering: a comprehensive review. Connective tissue research. 2017; 58(3-4):317–328. doi: 10.1080/03008207.2016.1276576.
- Ahmed E. M. Hydrogel: Preparation, characterization, and applications: A review. Journal of advanced research. 2015; 6(2):105–121. doi: 10.1016/j.jare.2013.07.006.
- Williams L. B., Adesida A. B. Angiogenic approaches to meniscal healing. Injury. 2018; 49(3):467–472. doi: 10.1016/j.injury.2018.01.028.
- Abbadessa A., Crecente-Campo J., Alonso M. J. Engineering Anisotropic Meniscus: Zonal Functionality and Spatiotemporal Drug Delivery. Tissue engineering. Part B, Reviews. 2021; 27(2):133–154. doi: 10.1089/ten.teb.2020.0096.
- Veronesi F., Di Matteo B., Vitale N. D., Filardo G., Visani A., Kon E., Fini M. Biosynthetic scaffolds for partial meniscal loss: A systematic review from animal models to clinical practice. Bioactive materials. 2021; 6(11):3782–3800. doi: 10.1016/j.bioactmat.2021.03.033.
- Shimomura K., Rothrauff B. B., Tuan R. S. Region-Specific Effect of the Decellularized Meniscus Extracellular Matrix on Mesenchymal Stem Cell-Based Meniscus Tissue Engineering. The American journal of sports medicine. 2017; 45(3):604–611. doi: 10.1177/0363546516674184.
- Kwon H., Brown W. E., Lee C. A., Wang D., Paschos N., Hu J. C., Athanasiou K. A. Surgical and tissue engineering strategies for articular cartilage and meniscus repair. Nature reviews. Rheumatology. 2019; 15(9):550–570. doi: 10.1038/s41584-019-0255-1.
- Peng Y., Lu M., Zhou Z., Wang C., Liu E., Zhang Y., Liu T., Zuo J. Natural biopolymer scaffold for meniscus tissue engineering. Frontiers in bioengineering and biotechnology.2022;10:1003484. doi: 10.3389/fbioe.2022.1003484.
- Bansal S., Keah N. M., Neuwirth A. L., O’Reilly O., Qu F., Seiber B. N., Mandalapu S., Mauck R. L., Zgonis M. H., Large Animal Models of Meniscus Repair and Regeneration: A Systematic Review of the State of the Field. Tissue engineering. 2017; 23(11):661–672. doi: 10.1089/ten.tec.2017.0080.


