Современные возможности эндоскопического стентирования и реканализации дыхательных путей при стенозирующих опухолях трахеи и бронхов
Автор: Коржева И.Ю., Багателия З.А., Чеченин Г.М., Горбан Д.Г., Мальцева И.М., Поддубный В.В., Жестков К.Г.
Журнал: Московский хирургический журнал @mossj
Статья в выпуске: 4 (50), 2016 года.
Бесплатный доступ
В статье представлены результаты эндоскопического лечения больных с опухолевыми критическими стенозами трахеи и бронхов методом стентирования ВДП в городской клинической многопрофильной больнице.
Критические стенозы трахеи и бронхов, стентирование
Короткий адрес: https://sciup.org/142211269
IDR: 142211269
Текст научной статьи Современные возможности эндоскопического стентирования и реканализации дыхательных путей при стенозирующих опухолях трахеи и бронхов
Основные статистические показатели распространенности злокачественных новообразований легких, трахеи и бронхов и свидетельствуют о неуклонном росте доли этой патологии в структуре онкологической заболеваемости. Мировой опыт последних десятилетий свидетельствует о значительной эволюции метода внутрипросветной хирургии при опухолях трахеи и бронхов. В настоящее время клиницисты располагают широким арсеналом методов эн-дотрахеобронхиальной хирургии, что позволяет дифференцированно подходить к их выбору в зависимости от операбельности, локализации опухоли и выраженности стеноза дыхательных путей [1, 5, 7, 10]. Современная трахеоброн-хоскопия дает возможность отказаться от экстренной операции и подготовить больного к плановой хирургической операции с минимальным риском [4, 7, 8]. Кроме того, при невозможности выполнения радикальной операции эндоскопические методы реканализации трахеи, такие как стентирование, применяются как самостоятельные методики восстановления проходимости трахеи.
Современные трахеобронхиальные стенты могут быть разделены на 4 группы: 1) полимерные стенты — Dumon Stent (Novatech, Abayone, France) и Polyflex Stents (Rusch, Kernen, Germany); 2) металлические саморасправляющиеся стенты — PalmazStent (Corning/Johnson&Johnson, Warren, N.J., USA), Wallstent (Schneider, Switzerland) и HanaroStent (M.I.Tech, Корея); 3) закрытые металлические стенты — Ultraflex Stent (Microvasive-Boston Scientific, Natick, Mass., USA); 4) гибридные стенты — Dynamic stents (Rusch, Kernen, Germany) [2, 3, 6, 9].
Цель работы: анализ результатов опыта стентирования трахеи и бронхов при опухолевых стенозах в условиях городского многопрофильного стационара.
Материалы и методы
За 6 лет (2010 – 2016 г.г.) в эндоскопическом отделении ГКБ им. С.П.Боткина накоплен определённый клинический опыт по эндобронхиальной хирургии у больных со стенозирующими злокачественными опухолями трахеи и бронхов.
За это время эндоскопическое лечение было проведено 54 больным. Мужчин было 45, женщин — 9. Средний возраст пациентов составил 58 лет. Примечательно, что все эти пациенты были госпитализированы по каналу скорой медицинской помощи с диагнозом: ХОБЛ. Бронхиальная астма, тяжёлое течение, некупируемый приступ. Наибольшую часть группы составили пациенты с опухолями трахеи — 43 больных, среди них у 32 диагностирован первичный рак трахеи, у 7 – прорастание опухоли пищевода в трахею, у 4 – прорастание опухоли щитовидной железы. Злокачественная опухоль, обтурирующая просвет бронхов 1 или 2 порядка, была диагностирована у 11 больных, среди которых у 5 пациентов выявлено прорастание опухоли переднего средостения в главный бронх, у 6 – прорастание опухоли пищевода. Эндоскопическое стентирование было проведено всем 54 пациентам.
После диагностической фибротрахеобронхоскопии эндоскопические операции выполняли с помощью гибких фибробронхоскопов фирмы Olympus (Япония) и электрохирургической установки ЕRBE ICC 200 (Германия). Стентирование проводили, как правило, под местной анестезией под визульным эндоскопическим, реже – под рентгенологи- ческим контролем. Премедикацию выполняли за 30 минут до начала манипуляций и осуществляли с использованием мидазолама (дормикума) в среднем 0,07 мг/кг в/м); атропина — 0,01 мг/кг п/к. Для местной анестезии использовался 5% р-р лидокаина (6–8 мл).
В зависимости от локализации, протяженности и выраженности опухолевого стеноза нами использована дифференцированная тактика при выборе анестезиологического обеспечения. При стенозе I–II степени верхней, средней или нижней третей трахеи протяженностью от 2 см и более, использовали местную анестезию с сохранением самостоятельного дыхания. При стенозе II - III ст. средней и нижней третей трахеи с угрозой асфиксии оптимальным явилась неинвазиваная высокочастотная вентиляция. При этом методом выбора для реканализации просвета было механическое срезывание экзофитной части опухоли трахеи (при мощности тока более 60 Вт).
По морфологии все злокачественные эпителиальные новообразования трахеи и бронхов разделились на две основные группы: опухоли из эпителиальной выстилки (плоскоклеточный, мелкоклеточный, железисто-плоскоклеточный рак) и опухоли из эпителия бронхиальных желез; детальный анализ гистологического типа опухолей представлен в таблице 1.
Исключительно экзофитный тип роста встречался только на ранних стадиях развития опухоли, а в дальнейшем (при размере более 10 мм), как правило, отмечался смешанный экзо- и эндофитный характер роста. Частота типов роста опухоли представлена в таблице 2. Наиболее часто опухоль прорастала все слои стенки трахеи, с преобладанием инфильтрирующего роста.
Экзофитно растущая часть опухоли имела вид белесоватого полипа, стенозирующего просвет трахеи. Только в 1-м случае рака трахеи с выраженным экзофитным ростом опухоль достигала больших размеров (более 5,0 см), при этом отмечалось выраженное растяжение и истончение стенки бронха, приобретающей белесый однородный вид, местами с остатками хрящевых пластинок (Эндофото 1А).
Протяженность поражения при смешанном типе роста была значительно больше, чем при эндотрахеальном (5-7 см). Ограниченное поражение (2-4 см) встречалось в единичных наблюдениях. При этом выбухание стенки и изменения слизистой не отражают истинную распространенность опухоли.
При эндоскопически определяемой границе опухоли протяженностью до 2 см перитрахеальное распространение ее достигало 5-6 см. При поражении задней стенки опухоль сдавливала пищевод, прорастала его стенку, зачастую с образованием пищеводно-трахеального свища.
Плоскоклеточный рак трахеи имел некоторые макроскопические особенности: плотная неподвижная экзофитная опухоль с крупнобугристой поверхностью, приподнятая
Таблица 1
Гистологический тип опухоли и ее типичная локализация
|
Гистологический тип |
Локализация в трахее |
||
|
Верхняя треть |
Средняя треть |
Нижняя треть |
|
|
Плоскоклеточный |
3 |
7 |
3 |
|
Аденокистозный |
3 |
3 |
5 |
|
Крупноклеточный |
1 |
2 |
0 |
|
Мелкоклеточный |
1 |
1 |
6 |
|
Аденокарцинома |
4 |
7 |
6 |
|
Прочие формы |
0 |
1 |
0 |
|
Не установлен |
0 |
1 |
0 |
Таблица 2
Распределение больных в зависимости от формы роста опухоли
В отличие от плоскоклеточного, узел мелкоклеточного рака обычно выглядел крупным, белесоватым, мясистого вида с обширными некрозами и кровоизлияниями, с выраженными дегенеративными изменениями и ослизнением. Эндоскопически опухоль обычно распространялась вдоль трахеи в подслизистый слой. Экзофитный компонент, как правило, был слабо выражен.
Ряд эндоскопических особенностей имел рак бифуркации трахеи. При экзофитном росте анатомия бифуркации не была нарушена. Обычно определялась зона начального роста. Опухолевая инфильтрация распространялась на оба ската, устья или начальные отделы главных бронхов по их медиальным и задним стенкам, а также на мембранозную стенку надбифуркационного сегмента на протяжении 3 см.
При смешанном росте анатомические структуры бифуркации не дифференцировались. Слизистая оболочка во всех отделах представляла собой крупнобугристые разрастания. Инфильтрация циркулярно распространялась на главные бронхи с сужением их просвета. Отмечалась грубая продольная складчатость слизистой оболочки, выбухание в просвет задней стенки трахеи в надбифуркационном сег-

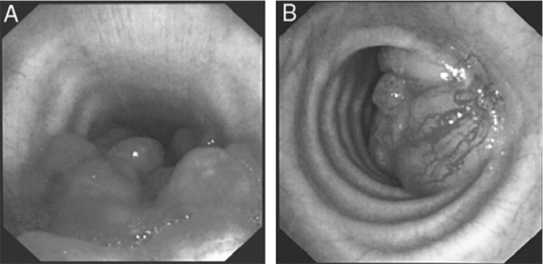

Рис. 1. Покрытый СМР трахеальный стент
Рис. 2. Покрытый СМР бронхиальный стентн
Эндофото 1: Экзофитно растущие опухоли трахеи А - Плоскоклеточный рак трахеи; В - Мелкоклеточный рак трахеи
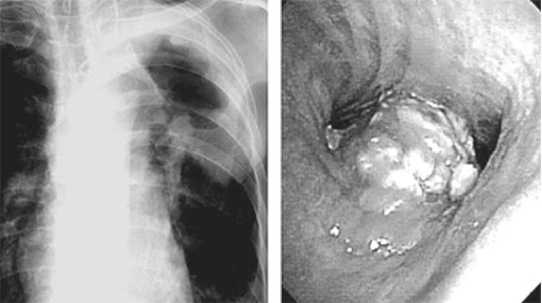
Эндофото 2: Бифуркационный рак трахеи
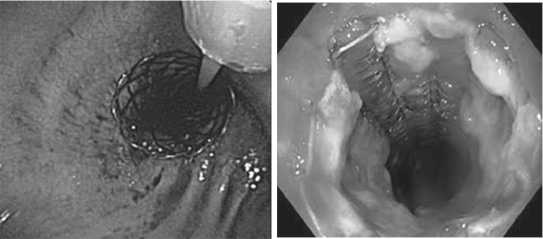
Эндофото 3. Непокрытый бронхи- Эндофото 4. Полное раскрытие альный СМРС в просвете правого покрытого СМРС в трахее главного бронха менте. Иногда деформация происходила за счет выбухания одного или обоих трахеобронхиальных углов. Как правило, это было связано со сдавлением первичной опухолью или с поражением лимфатических узлов, образующих единый конгломерат, который муфтообразно охватывал всю бифуркацию.
В качестве примера дифференциальной макроскопической диагностики приводим эндоскопическое описание роста очага мелкоклеточного рака с перитрахеальным ростом у б-го М., 67 лет: бифуркация трахеи развернута. Карина, передний и задний треугольники не дифференцируются. Структуры бифуркации очень плотные, подвижность от- сутствует. Слизистая оболочка с локальным отеком, яркой гиперемией, шероховатая, с участками фрагментации. Выбухает передняя стенка главного бронха, суживая просвет на 1/3 диаметра. Такие же изменения отмечены по задней стенке начальных отделов правого главного бронха (Эндофото 2).
Результаты
За период 2010 г. – июнь 2016 г. в эндоскопическом отделении ГКБ им. С.П. Боткина всего установлено 56 само-раскрывающихся стентов (СМРС), двум больным потребовалось билатеральное стентирование. По видам СМРС распределились следующим образом (таблица 3).
У 54 больных со стенозирующими злокачественными опухолями удалось добиться полного или частичного восстановления просвета непосредственно после эндоскопического этапа лечения в 100% наблюдений (Эндофото 3 и 4). У всех пациентов после установки стента отмечено улучшение дыхания и значительное уменьшение одышки. У 10 больных потребовалось выполнение 3-5 санационных бронхоскопий. Среди осложнений отмечены 3 (5%) случая миграции стентов, которые были устранены эндоскопически под местной анестезией. Умеренную боль после имплантации отмечали 15 (28%) пациентов. Болевой синдром был купирован медикаментозно. Ни в одном случае извлекать стент не пришлось. Серьезных осложнений, такие как перфорация стенки трахеи, клинически значимые кровотечения, пневмоторакс или пневмомедиастинум не отмечено.
Вывод
Используемые в клинической практике ГКБ им. С.П.Боткина методы эндотрахеобронхиальной хирургии и стентирования позволяют эффективно решить задачи ургентного этапа оказания помощи больным со стенозирующими опухолями трахеи и бронхов – восстановления просвета дыхательных путей и компенсации дыхательной недостаточности, что дает возможность подготовить этих пациентов к радикальному хирургическому лечению, либо, при его невозможности – к химио/лучевой терапии. В случаях неоперабельных опухолей, используемая методика дает возможность увеличить продолжительность и улучшить качество жизни данной категории больных.
Установленные модели СМРС
Таблица 3
|
Модель СМРС (страна-производитель) |
Трахеальный СМРС (общее кол-во 43) |
Бронхиальный СМРС (общее кол-во 11) |
||
|
Покрытый |
Непокрытый |
Покрытый |
Непокрытый |
|
|
HanaroStent (M.I.Tech, Ю.Корея) |
10 |
4 |
2 |
0 |
|
TaeWoong Medical ( Ю.Корея) |
12 |
5 |
3 |
2 |
|
Ultraflex Stent (Boston Scientific, USA) |
8 |
4 |
2 |
2 |
Список литературы Современные возможности эндоскопического стентирования и реканализации дыхательных путей при стенозирующих опухолях трахеи и бронхов
- Поддубный Б.К., Белоусова Н.В., Унгиадзе Г.В. Диагностическая и лечебная эндоскопия верхних дыхательных путей. Практическая медицина. Москва. 2006.
- Соколов В.В., Телегина Л.В., Трахтенберг А.Х. Эндотрахеобронхиальная (бронхоскопическая) хирургия. В кн: Клиническая онкопульонология. Под ред. Трахтенберга А.Х., чиссова В.И. ГЭО-ТАР МЕДИЦИНА. М.: 2000; 372-393.
- Соколов В.В., Чиссов В.И., Филоненко Е.В. и соавт. Способ диагностики злокачественных опухолей полых органов. Методические рекомендации. Москва. 2001.
- Cavaliere S., Venuta F., Foccoli P. et al. Endoscopic Treatment of Malignant Airway obstructions in 2,008 Patients. CHEST. 1996; 110: 1536-1542. 1996; 110: 1536-1542.
- Chhajed P.N., Eberhardt R., Dienemann H. Therapeutic Bronchoscopy Interventions Before Surgical Resection of Lung Cancer. Ann. Thorac. Surg. 2006; 81: 1839-1843.
- Dineen K.M., Jantz M.A., Silvestri G.A. Tracheobronchial stents. J. Bronchol. 2002; 9: 127-137.
- Freitag L., Macha H-N., Loddenkemper R. Interventional bronchoscopic procedures. Eur. Respir. Mon. 2001, 17, 272-304.
- Ikeda N., Hayashi A, Iwasaki K, Honda H, Tsuboi M, Usuda J. Comprehensive diagnostic bronchoscopy of central type early stage lung cancer. Lung Cancer. 2007; Jun: 56(3): 295-302.
- Miyazawa T., Yamakido M., Ikeda S. Implantation of Ultraflex Nitinol Stents in Malignant Tracheobronchial Stenoses. CHEST. 2000; 118/4: 959-965.
- Wahidi M.M., Herth F.J.F., Ernst A. State of the Art: Interventional Pulmonology Chest. 2007; 131(1): 261-274.


