Современные взгляды и подходы к выбору кондуитов при операциях аортокоронарного шунтирования: основные понятия и термины, нуждающиеся в пересмотре
Автор: Шенгелия Л.Д., Коншина М.О., Санакоев М.К., Фатулаев З.Ф., Донаканян С.А., Мерзляков В.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Аортокоронарное шунтирование остается наиболее распространенным и жизненно необходимым методом лечения пациентов с многососудистым поражением коронарных артерий, а также у пациентов с ИБС и сахарным диабетом. На отдаленные результаты операции аортокоронарного шунтирования влияет множество факторов, в том числе выбор используемых для шунтирования кондуитов. В настоящее время наиболее распространенными при аортокоронарном шунтировании кондуитами являются: внутренняя грудная артерия, лучевая артерия, большая подкожная вена. Известно, что признанным «золотым стандартом» аортокоронарного шунтирования является анастомоз между левой внутренней грудной артерией и передней межжелудочковой ветвью левой коронарной артерии. Кондуитами второго порядка являются лучевая артерия и большая подкожная вена. В настоящее время идут активные дискуссии на тему, какой тип кондуитов эффективнее и долговечнее, поскольку продолжительное функционирование кондуитов позволяет обезопасить пациентов от риска возникновения повторных симптомов ИБС и развития жизнеугрожающих осложнений. Учитывая тот факт, что каждый кондуит имеет свои патофизиологические, анатомические и гистологические особенности, на наш взгляд объединение лучевой и внутренней грудной артерий под термином «аутоартериальное шунтирование» и анализ данных кондуитов в единой группе может привести к неверной интерпретации данных и формированию недостоверных заключений
Аортокоронарное шунтирование, лучевая артерия, большая подкожная вена, левая внутренняя грудная артерия, бимаммарное шунтирование
Короткий адрес: https://sciup.org/140307866
IDR: 140307866 | DOI: 10.25881/20728255_2024_19_3_112
Текст обзорной статьи Современные взгляды и подходы к выбору кондуитов при операциях аортокоронарного шунтирования: основные понятия и термины, нуждающиеся в пересмотре
С момента выполнения первой операции аортокоронарного шунтирования (АКШ) прошло более 45 лет и в настоящее время оно является не только самой распространенной операцией в сердечно-сосудистой хирургии, но «золотым стандартом» лечения больных ИБС. Ежегодное количество операций АКШ по всему миру составляет около 750 тыс. [1]. Многие данные свидетельствуют о превосходстве АКШ над стентированием в плане лучших отдаленных результатов выживаемости, меньшего числа повторных реваскуляризаций, случаев инфаркта миокарда после операции [2–4]. По мнению Taggart не все пациенты, включенные в исследования по сравнению эффективности АКШ, подобраны адекватно. Это связано с тем, что нередко в крупных исследованиях исследуются пациенты с одно- и двухсосудистым поражением [5]. В то же время есть группы более тяжелых пациентов с многососудистым поражением и коморбидной патологией, у которых выполнение стентирования будет менее эффективно, чем АКШ. Выполнение стентирования целесообразно рас- смотреть в случае изолированного поражения системы огибающей или правой коронарной артерий (КА). В то время как выполнение АКШ целесообразного у пациентов с многососудистым поражением или поражением ствола левой КА. В связи с накопленным опытом, широким распространением и совершенствованием хирургической техники операции АКШ, анестезиологического пособия, пред- и послеоперационного ведения все более важным вопросом становится улучшение отдаленных результатов операции. Основными аспектами данной задачи являются увеличение срока функционирования кондуитов, увеличение продолжительности и качества жизни пациентов, свобода от повторных инфарктов миокарда (ИМ), снижение числа госпитализаций по поводу ИБС, поддержание адекватного уровня толерантности к физической нагрузке. Не зависимо от хирургической техники наложения дистальных и проксимальных анастомозов, состояние приемного русла, приверженности к медикаментозной терапии в послеоперационном периоде, фактор выбора кондуитов является одним из основных и широко обсуждаемых.

Шенгелия Л.Д., Коншина М.О., Санакоев М.К. и др.
СОВРЕМЕННЫЕ ВЗГЛЯДЫ И ПОДХОДЫ К ВЫБОРУ КОНДУИТОВ ПРИ ОПЕРАЦИЯХ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ: ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ, НУЖДАЮЩИЕСЯ В ПЕРЕСМОТРЕ
В настоящее время существует три основных типа кондуитов в коронарной хирургии: внутренняя грудная артерия (ВГА), большая подкожная вена (БПВ) и лучевая артерия (ЛА). Признанным «золотым стандартом» АКШ является анастомоз между левой ВГА и передней межжелудочковой ветвью левой КА. Большое дискуссии вызывает выбор кондуита второго порядка – ЛА или БПВ. Многие данные противоречивы, одни авторы отдают предпочтение артериальным кондуитам, другие – венозным. Несмотря на то, что многие данные свидетельствуют об эффективности артериальных кондуитов, БПВ остается самым распространенным кондуитом второго порядка. Отдельной темой для обсуждения является бимаммарное шунтирование и показания к использованию правой ВГА.
Широко используемый в современной литературе термин « аутоартериальное АКШ » в нашем понимании является не совсем корректным. Это связано с тем, что под этим термином объединяют два на наш взгляд весьма различных кондуита – АГА и ЛА. Как правило, термин «аутоартериальное шунтирование» противопоставляют термину «аутовенозное шунтирование», для сравнения указанных типов кондуитов с кондуитами из БПВ. Данный подход не является объективным, так как ЛА и ВГА имеют несколько важных отличий, исключающих их объединение в одну группу и требующих исключительно раздельного анализа.
Во-первых, совершенно некорректно сравнивать сосуд, находящийся in situ, который лишь дистально отсечен и пришит к новому руслу, при этом полностью сохранив свой физиологический исток и иннервацию, с сосудом, который полностью иссечен из зоны физиологического положения. Отсутствие иннервации может провоцировать развитие спазмов, которые также влияют на эффективность потока и продолжительность функционирования кондуита.
Во-вторых, данные кондуиты по факту получают различное кровоснабжение. В частности, ВГА на всем протяжении своего функционирования получает кровоснабжение из vasa vasorum и из ЛА кровоснабжается только со стороны эндотелия.
Во-третьих, данные сосуды осуществляют кровоснабжение миокарда в разные фазы сердечного цикла: ЛА, проксимально пришитая к аорте кровоснабжает миокард в диастолу, что аналогично кондуитам из БПВ. В свою очередь, ВГА являясь продолжением подключичной артерии кровоснабжает миокард в систолу.
В-четвертых, предрасположенность к спазму является более характерной чертой для артерий, используемых в качестве свободного кондуита, а значит для ЛА, так как использование ВГА в качестве свободного кондуита встречается гораздо реже и, как правило, носит вынужденный характер. Несомненно, ВГА тоже имеет свойство спазмироваться, однако, в случае ЛА частота спазмов существенно выше, при этом они более устойчивы к медикаментозной терапии по сравнению с ВГА. Развитие труднокупируемых спазмов кондуита, может предрасполагать к его закрытию. По этой причине включение ЛА в одну группу с ВГА также не целесообразно.
В-пятых, данные сосуды имеют различный диаметр и свои гистологические особенности. В частности, медиа ЛА в два с половиной раза толще, чем медиа ВГА. Именно эта особенность строения определяет высокий спазмогенный потенциал ЛА. Диаметр ЛА также больше диаметра ВГА, что также обусловливает различные скоростные характеристики потока в указанных кондуитах. Кроме того, так как ВГА является более тонким и хрупким сосудом, хирургические манипуляции с ней технически более сложные.
В-шестых, одним из факторов, влияющих на продолжительность функционирования кондуита является перенесенная ишемия, со временем между полным отсечением кондуита и экстракцией из его ложа и момента пуска кровотока по шунту. В данном случае подобные изменения претерпевает только ЛА, а ВГА в свою очередь не испытывает периода гипоксии после завершения ее выделения.
Согласно вышеперечисленным фактам, мы считаем, что использование термина «аутоартериальное шунтирование» нецелеcообразным, так как оно может вводить в заблуждение и привести к неправильной трактовке результатов. Второй, третий и шестой пункты делают кондуиты ЛА более схожими с венозными кондуитами, нежели с кондуитами ВГА.
В связи с отсутствием единого мнения по вопросу выбора кондуитов, четких показаний к выбору того или типа сосуда, а также единых рекомендаций и согласительных документов важным является накопление и анализ имеющегося материала, а также проведение новых исследований с целью систематизации данных и формирования более глубокого понимания проблемы. Отдельного изучения требуют вопросы конкурентного кровотока при выборе артериальных кондуитов, а также устойчивость ЛА к спазму в отдаленном периоде. Тем не менее, вне зависимости от полученных результатов необходим анализ отдаленных результатов всех типов кондуитов. Это связано с тем, что в клинической практике врача сердечно-сосудистого хирурга регулярно встречаются ситуации, при которых выбор кондуитов существенно ограничен. К таким ситуациям относятся: ВПБ подкожной вены, фле-бэктомия или склеротерапия вен в анамнезе, рассыпной тип строения вен нижних конечностей, разомкнутый тип строения ладонной дуги, распространенное псориатическое поражение верхних и нижних конечностей. В отдельных случаях противопоказаниями к взятию кондуитов верхней или нижней конечности могут являться распространенный псориаз или рубцовые изменения на после перенесенных травматологических вмешательств. Относительными противопоказаниями к выполнению бимаммарного шунтирования могут являться избыточная масса тела, пожилой возраст, а также наличие у пациента сахарного диабета.

Сложность в проведении объективной оценки эффективности и сроков функционирования кондуитов заключается в том, что качество и тип кондуитов являются лишь одним из параметров, влияющим на срок его функционирования. Необходимо понимать, что к дисфункции анастомоза или кондуита могут приводить и такие факторы как: состояние дистального русла, качество и характер поражения самой КА, качество и техника наложения анастомоза, конкурентный кровоток [15–21].
Важным фактором, который также потенциально может влиять на продолжительность функционирования кондуита по мнению некоторых авторов является привычное различных сосудов давление. К примеру, давление в вене составляет 25–30 мм рт. ст., в то время как среднее давление в артериальной системе – 70 мм рт. ст. Кроме того, скорость потока крови в венах и артериях также отличается. По этим причинам можно предположить, что артерии являются более длительно функционирующим кондуитом, так как давление в кондуите, пришиваемом к восходящей аорте, соответствует давлению в артериальной системе [6]. Тем не менее, мы считаем, что данные факты являются лишь одними из факторов, влияющих длительность функционирования шунта, так как встречаются случаи окклюзии артериальных кондуитов при функционирующих венозных у одного пациента.
Гистологические особенности различных типов кондуитов
Важным аспектом, определяющим длительность функционирования кондуита, является его гистологическая структура. Разумеется, структура всех кондуитов основывается на единых принципах, имея много общего. Несмотря на это, каждый тип кондуита имеет свои существенные гистологические особенности, во многом определяющие его функциональный статус. Как известно, сосуды состоят из трех слоев: интимы, медии и адвентиции. В артериях имеется внутренняя эластическая мембрана, которая разделяет интиму и медию и наружная эластическая мембрана, разделяющая медию и адвентицию [7–10].
Интима состоит из плоских, полигональных эндотелиальных клеток, имеющих непосредственный контакт с кровью. Эти клетки синтезируют и выделяют биологически активные вещества, такие как оксид азота и простациклин, которые оказывают антиагрегантное действие на тромбоциты [7].
В артериях толщина интимы увеличивается с возрастом. Повреждение интимы является первым звеном в последующем каскаде патогенетических механизмов, приводящих к развитию атеросклероза и гиперплазии неоинтимы [11]. Нередко атеросклеротические процессы развиваются в зоне утолщения интимы.
Медиа состоит из внеклеточного матрикса и гладкомышечных клеток. Стенка БПВ состоит из гладкомышечных клеток, частично организованных в циркулярный и продольный слои, продольный находится внутри, циркулярный снаружи.
Артерии разделяются на артерии эластического и мышечного типа в зависимости от соотношения клеточного и фиброзного компонентов. Внутренняя эластическая мембрана артерий может препятствовать миграции клеток, тем самым препятствуя развитию атеросклероза и гиперплазии неоинтимы. Эластиновые волокна, более выраженные в артериях, делают их более восприимчивыми к нейрогуморальным воздействиям. В свою очередь тонкая медиа вен предрасполагает их к развитию варикозных изменений [7].
Интима малой подкожной вены отделена от медии рудиментарной внутренней эластической мембраной. Медиа также состоит из двух слоев – внутреннего продольного – с включениями коллагеновых волокон и наружного циркулярного слоя (Рис. 1). В местах локализации венозных клапанов, интима несколько утолщается [7; 11].
Толщина и структура адвентиции варьирует. Она состоит из продольно ориентированных гладкомышечных клеток с волокнами коллагена и эластина. Также в этом слое проходят vasa vasorum, осуществляющие кровоснабжение сосуда [7].
ВГА обладает некоторыми уникальными гистологическими особенностями, предотвращающими развитие гиперплазии эндотелия и атеросклеротического процесса, объясняющими ее преимущество по сравнению с другими типами кондуитов (Рис. 3). Эндотелий ВГА может синтезировать гораздо большее число вазодилататоров (оксид азота, простациклин) по сравнению с другими типами кондуитов. Эта особенность также предотвращает развитие спазма артерии. Кроме того, в эндотелии отмечается меньшая проницательность межклеточных соединений, по сравнению с БПВ. Это препятствует попаданию в субэндотелиальное пространство
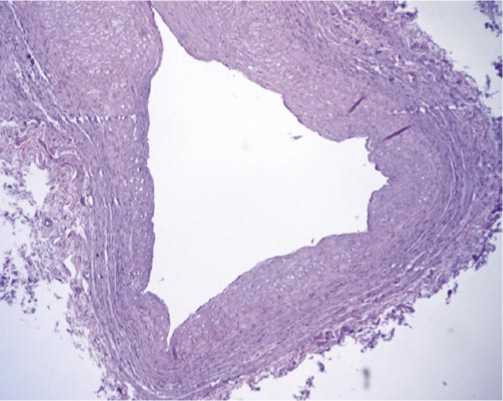
Рис. 1. Гистологическое строение большой подкожной вены. Микрофотография. Окраска гематоксилином и эозином. Увеличение х50. Особенностью венозных кондуитов является наличие классических углублений и карманов внутреннего слоя сосуда.

Шенгелия Л.Д., Коншина М.О., Санакоев М.К. и др.
СОВРЕМЕННЫЕ ВЗГЛЯДЫ И ПОДХОДЫ К ВЫБОРУ КОНДУИТОВ ПРИ ОПЕРАЦИЯХ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ: ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ, НУЖДАЮЩИЕСЯ В ПЕРЕСМОТРЕ
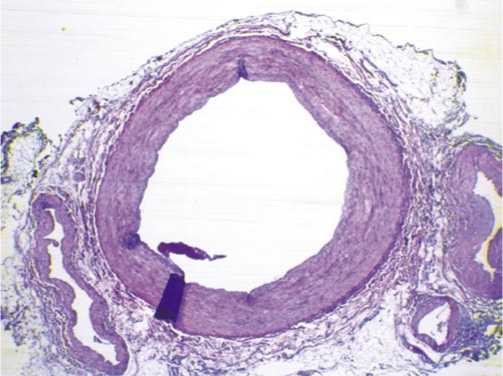
Рис. 2. Гистологическое строение ВГА. Микрофотография. Окраска гематоксилином и эозином. Увеличение х50. Визуалируется ВГА и две прилегающие вены.
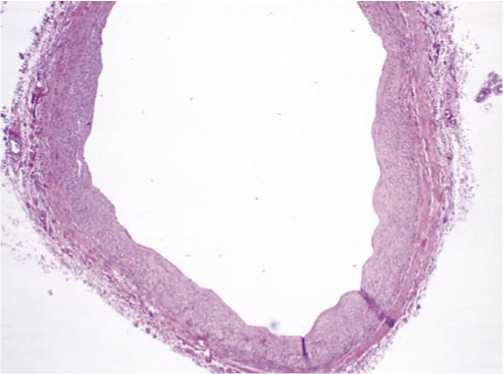
Рис. 3. Гистологическое строение ЛА. Микрофотография. Окраска гематоксилином и эозином. Увеличение х50. Обращается на себя внимание хорошо выраженная медиа.
липопротеинов, ответственных за последующее развитие атеросклеротического процесса. Внутренняя эластическая мембрана маммарной артерии по сравнению с другими артериями хорошо развита и не фенестрирована. Это позволяет не только защитить медию артерии от каких-либо негативных стимулов внутри просвета, потенциально предотвращает развитие гиперплазии неоинтимы за счет препятствия миграции гладкомышечных клеток медии в интиму. Кроме того, в медии ВГА больше эластических волокон и меньше гладкомышечных клеток, что снижает риск развития вазоспазма и атеросклероза. Число слоев эластических волокон медии ВГА варьирует от 7 до 11. В гладкомышечных клетках медии отмечается меньший уровень экспрессии тканевого фактора и высокий уровень синтеза активатора плазминогена, что также препятствует утолщению интимы и развитию атеросклероза. Адвентиция содержит гораздо меньшее число vasa vasorum [12–14].
Также в структуре ВГА обращает на себя внимание факт проксимально-дистального градиента соотношения медии/интимы. В дистальном сегменте соотношение медии/интимы в 1,5 раза больше, чем в дистальном [14]. Можно предположить, что по этой причине использование дистального сегмента ВГА при АКШ не рекомендовано.
В ЛА более тонкая интима, одна внутренняя эластическая мембрана и сравнительно толстая медиа. Толщина медии ЛА превышает таковую во ВГА, что делает ее более предрасположенной к развитию спазмов, а также окклюзии (Рис. 3).
Гиперплазия неоинтимы как одна из основных причин дисфункции кондуитов после операций АКШ представляет сложный, многокомпонентный процесс, требующий дальнейшего изучения [15]. Ее развитие представляет собой большую проблему современной кардиологи и сердечно-сосудистой хирургии. Это связано с тем, что несмотря на технически качественное наложение коронарного анастомоза между венозным кондуитом и КА, развитие гиперплазии неоинтимы в просвете кондуита может привести к его дисфункции в отделенном периоде. Формирование дисфункции кондуита сводит на нет усилия хирургов, резко снижая эффективность операции АКШ и приводя к рецидивированию симптомов, а также подвергая пациента риску развития жизнеуро-жающих осложнений, в частности ИМ. Под термином гиперплазия неоинтимы подразумевается утолщение внутреннего слоя артерии или венозного кондуита в ответ на повреждение, приводящее к сужению просвета сосуда. Впоследствии сужение просвета сосуда может привести его полной окклюзии или тромбозу. При развитии гиперплазии неоинтимы во внутреннем слое как артерияй, так и вен отмечается накопление фибробластов и гладкомышечных клеток с отложением внеклеточного матрикса. Следствием подобных избыточных накоплений является разрастание интимы в просвет сосуда с формированием так называемой неоинтимы. По мере ее формирования площадь отверстия сосуда сокращается [16].
К причинам, которые могут спровоцировать развитие неоинтимы являются имплантация стента в коронарную артерию, механическое воздействие на кондуит при его заборе, механическое повреждение при раздувании кондуита, высокое давление, хирургическое воздействие на кондуит в зоне наложения анастомоза [17]. В отношении последнего пункта совершенно очевидно, что давление в пришитом проксимальной частью к восходящей аорте венозном кондуите гораздо выше, чем привычное для венозной системы давление. Это в определенной степени предрасполагает венозный кондуит к развитию гиперплазии эндотелия, что требует более бережной техники хирургического забора вены для максимального снижения степени хирургической травмы кондуита, его эндотелия в частности. Также этой причиной можно

объяснить гистологически разную адаптацию венозных и артериальных кондуитов по мере развития гиперплазии неоинтимы. В артериальных кондуитах, несмотря на формирование неоинтимы толщина медии не меняется, в венозных кондуитах происходит одновременное утолщение как интимы, так и медии.
Механизмы, лежащие в основе гиперплазии неоинтимы как патологического процесса, в полной степени неизвестны и требуют детального изучения. Сам процесс разрастания интимы является результатом клеточной миграции, пролиферации и отложения внеклеточного матрикса. Особый интерес вызывает механизм миграции в ткани неоинтимы гладкомышечных клеток и появление у них способности к пролиферации, учитывая тот факт, что в норме они обладают низкой пролиферативной способностью. Предполагается, что это опосредовано действием биологически активных веществ – интерлейкинов 6, 8, а также макрофагов и тромбоцитов [17; 18].
Еще один элемент в каскаде процессов гиперплазии эндотелия связан с периодом гипоксии, отмечаемом между завершением забора кондуита и реперфузией после наложения проксимальных анастомозов. Это касается кондуитов из БПВ и ЛА. Кроме того, сосудистая стенка отсеченного кондуита лишается кровоснабжения со стороны адвентиции, получая оксигенированную кровь только со стороны эндотелия сосуда. Следует отметить, что БПВ и ЛА после полного отсечения и изъятия из своего физиологического ложа становятся денервированными сосудами. Следствием денервации сосуда являются вазоспазм и высвобождение провоспалительных цитокинов, так же задейстованных в патогенезе гиперплазии эндотелия. Гипоксия, которой подвергается кондуит после забора также связана высвобождением свободных радикалов, обладающих способностью оказывать повреждающее действие на интиму кондуита за счет повреждения белков, липидов и ядерного материала клетки. Согласно одной из теорий, опосредованная выбросом свободных радикалов и реактивных форм кислорода активация матриксных металлопротеиназ приводит к разрушению эластина и коллагена, составляющих основу внутренней эластической мембраны, что приводит к миграции гладкомышечных клеток из медии в интиму с последующим формированием гиперплазии неоинтимы [19].
При изучении патогенеза гиперплазии неоинтимы на клеточном уровне была изучена важная роль в механизмах патогенеза расположенного в митохондриях белка Сиртуина 3 (SIRT3). Одна из его функций заключается в снижении выработки реактивных форм кислорода за счет деацетилирования фактора транскрипции FoxO3a, который проникает в ядро клетки и связывается с промоторами генов, кодирующих супероксид дисмутазу и каталазу [15]. Однако, возрастом экспрессия SIRT3 в миокарде и в венах снижается, что коррелирует снижение способности миокарда противостоять оксидативному стрессу и с процессами гиперплазии неоинтимы [20]. Снижение уровня SIRT3 также приводит к нарушению работы эндотелиальной NO-синтетазы и снижению синтеза оксида азота. Оксид азота представляет собой ключевой регулятор функции эндотелия. Он синтезируется NO-синтетазой, которая имеет три изоформы. В эндотелиальных клетках сосудов располагается эндотелиальная NO-синтетаза. Являясь паракринным фактором, оксид азота контролирует сосудистый тонус, ингибирует функцию тромбоцитов, предотвращает адгезию лейкоцитов, ингибирует клеточную пролиферацию, в том числе пролиферацию сосудистых гладкомышечных клеток [21–23]. Исследования, направленные на поиск способов увеличения экспрессии SIRT3, могут предотвратить развитие гиперплазии неоинтимы в кондуитах и увеличить срок их функционирования [15].
Немаловажным аспектом, предрасполагающим к дисфункции эндотелия, является механическое повреждение, связанное с раздуванием вены под давлением. Целью данной манипуляции является проверка состоятельности перевязанных и клиппированных участков в условиях высокого давления. Однако, раздувание вены под высоким давлением приводит к ее чрезмерному растяжению, механическим надрывам эндотелия, растяжению гладкомышечных клеток медии [15].
Конкурентный кровоток. Формирование конкурентного кровотока связано с сопоставимой интенсивностью потока крови в нативной КА и в кондуите. Как правило, конкурентный кровоток развивается при наличии пограничного поражения КА – менее 75% и характерен для артериальных кондуитов. Артериальные кондуиты за счет мышечного компонента сосудистой стенки обладают способностью ауторегуляции интенсивности потока в зависимости от потребности. Это значит, что поток в кондуите может варьировать в зависимости от потока в КА. В случае пограничного стеноза интенсивность кровотока в КА может быть высокой и сопоставимой с потоком в артериальном кондуите. Венозные кондуиты не обладают ярко выраженным мышечным компонентом в сосудистой стенке, тенденцией к спазму и не создают градиента при токе крови из аорты в КА. То есть давление в зоне дистального анастомоза практически равно давлению в аорте. По этой причине конкурентный кровоток при использовании венозных кондуитов не развивается [6]. Конкурентный кровоток является одной из причин дисфункции артериальных кондуитов в раннем послеоперационном периоде. Для избежания конкурентного кровотока в случае пограничного стеноза рекомендовано использование венозных кондуитов.
Заключение
Таким образом, в настоящее время хирургическая техника операции АКШ, анестезиологическое пособие, до- и послеоперационное ведение пациентов хорошо изучены. Одним из основных вопросов является улучшение отдаленных результатов и долгосрочной эффективности операции. По этой причине, важным является вопрос выбора кондуитов. Доказано, что кондуитом первого поряд-
Шенгелия Л.Д., Коншина М.О., Санакоев М.К. и др.
СОВРЕМЕННЫЕ ВЗГЛЯДЫ И ПОДХОДЫ К ВЫБОРУ КОНДУИТОВ ПРИ ОПЕРАЦИЯХ АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ: ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ, НУЖДАЮЩИЕСЯ В ПЕРЕСМОТРЕ ка является ВГА. Однако несмотря на то, что существует несколько основных типов кондуитов второго порядка в коронарной хирургии, отсутствует единое мнение в отношении показаний к их применению. Кроме того, большое количество факторов могут влиять на эффективность хирургического вмешательства, в том числе и технические аспекты операции, погрешности медикаментозной терапии, послеоперационного наблюдения, модификации образа жизни пациентов. Учитывая отсутствие единых взглядов в отношении выбора кондуитов в коронарной хирургии, мы считаем проведение дальнейших исследований позволит получить более глубокое понимание данной проблемы [24–26].
Список литературы Современные взгляды и подходы к выбору кондуитов при операциях аортокоронарного шунтирования: основные понятия и термины, нуждающиеся в пересмотре
- Taggart D. Best practices in coronary revascularization procedures: are we where we should be? Curr Opin Cardiol. 2014; 29(6): 528-33. doi: 10.1097/HCO.0000000000000111.
- Голухова Е.З., Керен М.А., Завалихина Т.В., Булаева Н.И. и др. Прогнозирование неблагоприятных госпитальных исходов после изолированного коронарного шунтирования: результаты одноцентрового когортного исследования // Вестник Российской академии медицинских наук. – 2023. – №78(3). – С.176-184.
- Мамедова С.К.К., Мерзляков В.Ю., Ключников И.В., Тетвадзе И.В. Отдаленные результаты аортокоронарного шунтирования на работающем сердце и в условиях искусственного кровообращения у больных хронической ишемической болезнью сердца // Грудная и сердечно-сосудистая хирургия. – 2022. – №64(6). – С.596-604.
- Жалилов А.К., Мерзляков В.Ю., Ключников И.В., Саломов М., Мамедова С. Результаты коронарного шунтирования у больных с острым инфарктом миокарда с подъемом сегмента ST // Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. – 2022. – №4(2). – С.203-207.
- Taggart D. Contemporary coronary artery bypass grafting Front. Med. 2014; 8(4): 395-398. doi: 10.1007/s11684-014-0374-7.
- Kiesera T, Headb S, Kappetein A. Arterial grafting and complete revascularization: challenge or compromise? Curr Opin Cardiol. 2013; 28: 646-653. doi:10.1097/HCO.0000000000000001.
- Garnizone M, Vartina E, Pilmane M. Morphologic comparison of blood vessels used for coronary artery bypass graft surgery ffiliations expand. 2022; 81(3): 584-593. doi: 10.5603/FM.a2021.0084.
- Zacharias A, Habib R, Schwann T, Riordan C, Durham S, Shah A. Improved survival with radial artery versus vein conduits in coronary bypass surgery with left internal thoracic artery to left anterior descending artery grafting. Circulation. 2004; 109: 1489-96.
- Eifert S, Mair H, Boulesteix A, et al. Mid-term outcomes of patients with PCI prior to CABG in comparison to patients with primary CABG. Vasc Health Risk Manag. 2010; 6: 495-501.
- Кривенкова Е.М., Мерзляков В.Ю., Скопин А.И., Мамедова С.К.К. Современное состояние проблемы шунтирования передней межжелудочковой ветви левой коронарной артерии с применением левой внутренней грудной артерии // Грудная и сердечно-сосудистая хирургия. – 2023. – №65(1). – С.16-23.
- Smith M, Long D, Damiano E, et al. Near-Wall μ-PIV reveals a hydrodynamically relevant endothelial surface layer in venules in vivo. Biophysical J. 2003; 85(1): 637-645. doi: 10.1016/s0006-3495(03)74507-x.
- Davierwala P, Mohr F. Internal mammary artery grafting: rationale and evidence. Int J Surg. 2015; 16: 133-9. doi: 10.1016/j.
- Otsuka F, Yahagi K, Sakakura K, Virmani R. Why is the mammary artery so special and what protects it from atherosclerosis? Ann Cardiothorac Surg. 2013; 2(4): 519-526. doi: 10.3978/j.issn.
- Kraler S, Libby P, Evans P, Akhmedov A, et al. The Internal Mammary Artery and its Resilience to Atherogenesis: Shifting from Risk to Resistance to Address Unmet Needs. Thromb Vasc Biol. 2021; 41(8): 2237-2251. doi: 10.1161/atvbaha. 121.316256.
- Lu H, Sun L, Chen W, Zhou Y, Liu K, Chen J, et al. 3 therapy attenuates aging expression, oxidative stress parameters and neointimal hyperplasia formation in vein grafts. Annals of Vascular Surgery. 2019. doi: https://doi.org/10.1016/j.avsg.
- Vermaa S, Lovrena F, Pana Y, Yanagawaa B, et al. Pedicled no-touch saphenous vein graft harvest limits vascular smooth muscle cell activation: the PATENT saphenous vein graft study. European Journal of Cardio-Thoracic Surgery. 2014; 45: 717-725. doi: 10.1093/ejcts/ezt560.
- Collins M, Li X, Lv I, Protack Y, Muto A, Jadlowiec C, et al. Therapeutic strategies to combat neointimal hyperplasia in vascular grafts. Expert Rev Cardiovasc Ther. 2012; 10(5): 635-647. doi:10.1586/erc.12.33.
- Muto A, Fitzgerald T, Pimiento J, et al. Smooth muscle cell signal transduction: implications of vascular biology for vascular surgeons. J Vasc Surg. 2007; 45(Suppl A): A15-A24.
- Бузиашвили Ю.И., Кокшенева И.В., Петросян К.В. и др. Влияние генетических маркеров эндотелиновой системы и дисфункции эндотелия на прогноз после чрескожного коронарного вмешательства // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. – 2019. – №20(9-10). – С.799-805.
- Wang X, Shao Y, Ma C, Chen W, et al. Decreased SIRT3 in aged human mesenchymal stromal/stem cells increases cellular susceptibility to oxidative stress. J Cell Mol Med. 2014; 18: 2298-310.
- Gheibi S, Jeddi S, Kashfi K, Ghasemi A. Regulation of vascular tone homeostasis by NO and H2S: Implications in hypertension. Biochem Pharmacol. 2018; 149: 42-59.
- Tanner F, Meier P, Greutert H, Champion C, Nabel E, Luscher T. Nitric oxide modulates expression of cell cycle regulatory proteins: a cytostatic strategy for inhibition of human vascular smooth muscle cell proliferation. Circulation. 2000; 101: 1982-9.
- Kapadia M, Eng J, Jiang Q, Stoyanovsky D, Kibbe M. Nitric oxide regulates the 26S 471 proteasome in vascular smooth muscle cells. Nitric Oxide. 2009; 20: 279-88.
- Ишмухаметов Г., Заварзина Д., Исмаил-заде И.К., Гребенник В. Выбор кондуитов в хирургии коронарных артерий // Грудная и сердечно-сосудистая хирургия. – 2020. – №62(6). – С.513-9. doi: 10.24022/0236-2791-2020-62-6-513-519.
- Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С., Землянов А.В. Выбор кондуитов в коронарной хирургии // Вестник НМХЦ им. Н.И. Пирогова. – 2019. – №14(1). – С.97-104.
- Голубев Е.П. Хирургия ишемической болезни сердца // Новости сердечно-сосудистой хирургии. – 2019. – №3(2). – С.45-147.


