Современный взгляд на лимфатическую систему сердца и влияние ее патологии на функцию миокарда
Автор: Шевченко Ю.Л., Гудымович В.Г., Тромбачев А.Э.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 3 т.19, 2024 года.
Бесплатный доступ
Современная научная литература в подавляющем большинстве уделяет внимание артериальному и в меньшей степени венозному звену кровоснабжения миокарда. Однако, практически остается неосвещенным система лимфооттока от структур сердца. Настоящий обзор литературы посвящен лимфатическому руслу сердца. Показаны исторические аспекты его открытия, приведены современные данные, касающиеся эмбрионального развития, анатомического строения и функции лимфатических структур сердца, особенностей лимфооттока от миокарда. Продемонстрированы современные методы оценки развития, строения и функции лимфатических структур сердца, основанные на использовании специфических маркеров лимфоидных структур. Отдельное внимание уделено возможностям стимуляции лимфатической системы с целью предотвращения развития интерстициального иммобилизирующего фиброза сердца, а также сердечной недостаточности при острых нарушениях кровообращения и воспалительных изменениях миокарда.
Сердечная недостаточность, лимфатическая сеть миокарда, интерстициальный кардиальный фиброз
Короткий адрес: https://sciup.org/140307865
IDR: 140307865 | DOI: 10.25881/20728255_2024_19_3_105
Текст обзорной статьи Современный взгляд на лимфатическую систему сердца и влияние ее патологии на функцию миокарда
Лимфоотток от структур сердца до сих пор изучен недостаточно. Существованием и важностью сердечных лимфатических сосудов в течение многих лет пренебрегали. Однако, ряд исследований показал, что лимфатические нарушения могут играть весьма значимую роль в различных вариантах патологии сердца. В последнее время этой системе стало уделяться больше внимания, поскольку было обнаружено, что она не только помогает поддерживать внутримиокардиальное давление и предотвращает отек тканей, но и играет важную роль при патологии сердца, такой как атеросклероз и интерстициальный фиброз. Ряд исследований продемонстрировали возможность того, что такие заболевания сердца, как ишемия и инфаркт, можно лечить путем прямого воздействия на лимфатическую сосудистую сеть. Так, терапевтическое введение VEGF-C может повышать скорость и качество рубцевания миокарда при экспериментальном инфаркте миокарда у мышей и крыс. Положительный результат может этого быть связан с усилением лимфангиогенеза лимфатических капилляров сердца, но в противном случае он также может быть связан с устойчивой функциональностью более глубоких лимфатических собирательных сосудов. Лимфатическая сеть сердца заслуживает повышенного внимания в плане изучения лимфатического транспорта как средства борьбы с неблагоприятными явлениями в миокарде.
Исторические аспекты изучения лимфодренажа миокарда
Возможному наличию системы лимфооттока в сердце не придавалось внимания до 1866 года, когда профессор патологической анатомии Цюрихского университета Карл Эберт совместно с его учеником из Санкт-Петербурга Алексеем Беляевым в журнале «Архив патологической анатомии» опубликовали статью, описавшую субэндокардиальное сплетение лимфатических сосудов, располагавшееся в тканях сердца вплоть до атриовентрикулярных и полулунных клапанов как в сердце человека, так и других млекопитающих [1].


Рис. 1. Заглавная страница первого научного труда, посвященного лимфатической системе сердца [1].

Рис. 2. Карл Джозеф Эберт – профессор патологической анатомии из Цюриха.
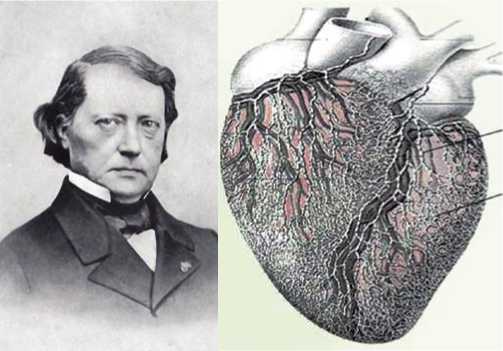
Рис. 3. Французский анатом Констан Саппи (а) и схематическое изображение анатомии сердечной лимфатической системы человека из его книги (рис. из Anatomie, physiologie, pathologie des vaiss-eaux lymphatiques consider e es chez I’homme et les vert e bres. Paris, A. Delahaye & E. Lacrosnier, 1874. , цит. по [2]).
В 1874 году французский анатом Констан Саппи опубликовал сборник по анатомии лимфатических сосудов человека, показывающий в том числе и богатство лимфатической сети сердца (Рис. 3) [2].
В 1924 году Отто Карл Аагаард путем инъекции красителя в миокард описал лимфатические сосуды, входящие в створки атриовентрикулярных клапанов, наличие субэндокардиальных, миокардиальных и субэпикардиальных лимфатических сплетений у животных, однако, не смог обнаружить подобные каналы в сердце человека [3].
Эти открытия были подтверждены в дальнейшем в 1939 году в работах Пола Р. Патека из Калифорнийского университета (Лос-Анджелес, США), который продемонстрировал на собаках наличие миокардиального лимфодренажа путем инъекции в миокард китайских чернил. Однако, визуализировать лимфатическую сеть атриовентрикулярных клапанов у собак с помощью инъекционных методов ему не удалось [2; 3].
Гистологические исследования митрального клапана собаки после введения разбавленной туши в свободный край передней митральной створки работающего сердца позволили выявить Miller A.J. и соавт. (1961) обширную сеть сосудов, хорошо видимую на предсердной поверхности клапана, а также тонкостенные сосуды; количество и калибр которых увеличивались у животных с хроническими нарушениями лимфооттока [3].
Ряд исследований, начиная с 60-х годов ХХ столетия и до сегодняшних дней показали, что лимфатическая сеть важна для жидкостного гомеостаза сердца и что отек его тканей, связанный с недостаточной эвакуацией лимфы, приводит к сердечной дисфункции [2–4].
Эмбриология лимфатических сосудов сердца
Исследования эмбрионального развития лимфатической системы сердца весьма трудоемки и наиболее полные данные появились лишь в течение последних десятилетий. Основаны они, прежде всего, на изучении закономерностей формирования лимфатической системы сердца в эмбриональном и раннем постнатальном периоде развития мышей. Первым признаком развития лимфатических сосудов является наличие Lyve-1-позитивных клеток, расположенных в субэпикардиальной области (Lyve-1 – эндотелиальный гиалуронановый рецептор лимфатических сосудов 1). Цепочки Lyve-1-положительных клеток располагаются первоначально вдоль атриовентрикулярной борозды диафрагмальной поверхности, а затем – вдоль магистральных артерий. В дальнейшем появляются просветленные канальцы, расположенные рядами или решеткой, более заметные в дорсальном атриовентрикулярном соединении, вдоль ветвей главных венозных и коронарных артерий, а также у основания аорты и легочного ствола, распространяясь по направлению к верхушке сердца. На более поздних стадиях некоторые сегменты лимфатических сосудов частично окружены гладкомышечными клетками. Возможными механизмами лимфангиогенеза являются: присоединение Lyve-1-позитивных клеток к существующим канальцам, удлинение лимфатической решетки, прорастание и слияние канальцев [5].
Первое появление лимфатических сосудов в эмбриональном сердце наблюдается примерно на 12,5-й день эмбрионального развития (стадия E12,5) в области вентрального выносящего тракта. На стадии E14.5 лимфатические сосуды с маркерами LYVE1 + PROX1 + VEGFR3 + вырастают из венозного синуса и распространяются на дорсальную поверхность левого и правого желудочков на стадии E16.5. На поздних сроках беременности и в раннем постнатальном периоде лимфатическая сосудистая сеть расширяется и покрывает всю эпикардиальную поверхность сердца (включая дорсальную и вентральную поверхности) и продолжает созревать к 2-недельному

возрасту. Начиная с E15.5, лимфатические сосуды обнаруживаются в непосредственной близости от развивающихся коронарных вен и после этого остаются связанными с венозной сосудистой сетью. Хотя взаимосвязи между лимфатическими и венозными эндотелиальными клетками наблюдаются на ранних этапах, эти связи теряются по мере созревания лимфатической сосудистой сети. При исследовании клонов мышей Tie2-Cre и Pdgfr β -CreERT2 (несущих маркеры сосудистых эндотелиальных клеток) выявлено, что лимфатические сосуды сердца произошли из смешанного пула предшественников, включая венозное и предполагаемое гематогенное эндотелиальное происхождение [6].
Весьма интересно исследование Fedyai V.V. (1966), изучившего анатомию лимфатических сосудов сердца человека от плода до взрослого человека в возрасте до 101 года. Он обнаружил, что лимфатическая сосудистая система у людей достигает зрелости примерно в 17 лет и с возрастом лимфатическая система подвергается патологической регрессии [7; 8]. Подобное постнатальное созревание лимфатических сосудов сердца было описано Klotz L. и соавт. (2015) у мышей [9]. Авторы также подвергают сомнению взгляд на развитие лимфатических сосудов из венозных предшественников. Обнаружено, что лимфатическая сосудистая сеть эмбрионального сердца мыши включает гетерогенный состав клеточных популяций, в состав которых входят как внесердечный венозный эндотелий, так и новый источник лимфатических предшественников, которые могут возникать из гемогенного эндотелия желточного мешка. Этапы развития лимфатической системы сердца представлены на рис. 4 [9]. При окрашивании с использованием ранних маркеров лимфатических эндотелиальных клеток (VEGFR-3 и Prox1) появление лимфатических сосудов отмечено на стадии E12.5. Они прорастали из внесердечных областей, проксимальных к выводному тракту, на вентральной стороне. На стадии E14.5 на поверхности желудочка наблюдались лимфатические сосуды, отходящие от области венозного синуса на дорсальной стороне. На E16.5 крупные дорсальные сосуды распространялись снизу от области притока, в то время как вентрально более мелкие сосуды возникли между предсердиями. К моменту E18.5 сосуды продолжали расширяться и проецировались к верхушке сердца как на дорсальной, так и на вентральной поверхностях. После рождения (P0) сосуды формировали более обширную разветвленную сеть и расширились дальше по вентральной стороне сердца новорожденного. К 10-му дню после родов (P10) сердечные лимфатические сосуды обеспечивали поверхностное покрытие большей части эпикардиальной поверхности сердца и, по-види-мому, полностью завершали развитие к P15.
Понимание эмбрионального развития лимфатической сети сердца имеет важное значение для представления о гомеостазе жидкости в его тканях. Следует отметить, что после повреждения, наиболее частым вариантом которого является инфаркт миокарда, лим-
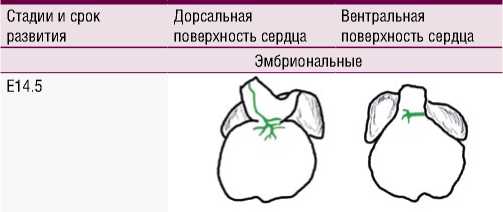
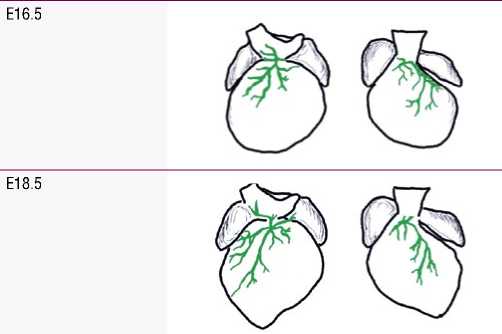
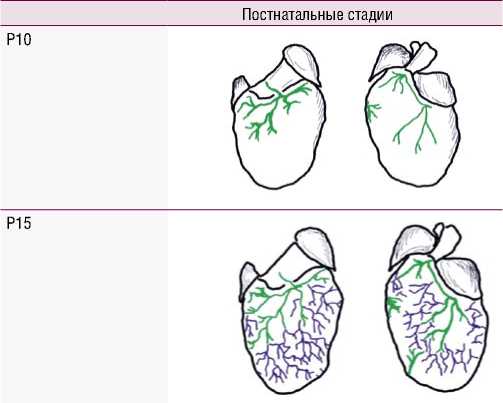
Рис. 4. Схема эмбрионального и постнатального развития лимфатической сосудистой сети сердца мыши (по Klotz L. et al., 2015 [9]) (объяснения в тексте).
фатические сосуды сердца подвергаются глубокому ангиогенному ответу, сопровождающемуся усилением регуляции генной программы развития лимфатической системы. Центральной молекулой, которая направляет пролиферацию и миграцию лимфатических эндотелиальных клеток во время эмбриогенеза, является фактор роста эндотелия сосудов C (VEGF-C), которая также способствует повторному генерированию лимфатических сосудов и лимфатической сети в целом [10]. Эктопическая стимуляция VEGF-C после травмы приводила к улучшению сердечной функции. Лимфангиогенез в условиях
воспаления облегчал разрешение отека тканей и способствовал мобилизации макрофагов, а индукция VEGF-C облегчала проявления воспаления на мышиных моделях. Следовательно, механизмы, связывающие развитие лимфатической сети, могут представлять терапевтическую мишень. Индукция лимфатических сосудов может обеспечить улучшение путей оттока воспалительных клеток, чтобы склонить чашу весов в пользу заживления ран в поврежденном сердце взрослого человека [9].
Вышеизложенные факты также позволяют проводить весьма достоверные параллели с развитием иммобилизирующего кардиального фиброза, определяющего возникновение и прогрессирование явлений сердечной недостаточности у пациентов.
Общая анатомия и функция лимфатических сосудов сердца
Лимфатическая сеть сердца также, как и других органов и анатомических областей, включает лимфатические сосуды, лимфатические узлы и лимфоидные органы. Основным отличием лимфатических капилляров от кровеносных является структурная «открытость» – слепые концы в своих дистальных сегментах. Эта особенность обеспечивает максимальную эффективность в дренировании интерстициальной жидкости и иммунных клеток. Капилляры, сливаясь, формируют более глубокие лимфатические структуры, называемые собирательными сосудами, которые оснащены клапанами и мышечной стенкой, которая способствует транспорту лимфы. Поток лимфатических сосудов однонаправлен и предназначен для оттока внесосудистой жидкости, макромолекул и иммунных клеток обратно в венозную систему для поддержания баланса интерстициальной жидкости. Три лимфатических сплетения отвечают за направление циркуляции сердечной лимфы, которая начинается в субэндокардиальном сплетении и направляется к миокардиальному сплетению, а затем к субэпикардиальному сплетению [2; 11].
Cердечная лимфатическая сосудистая сеть млекопитающих охватывает все слои сердца: субэпикард, миокард и субэндокард [12]. Были проанализированы поток и состав сердечной лимфы у собак. Предположение, что лимфатическая жидкость течет по направлению из субэндокардиального в субэпикардиальное лимфатическое сплетение и впоследствии покидает сердце через лимфатические стволы, направляясь в регионарные лимфатические узлы, было доказано. Коллоидные частицы, введенные в миокард, быстро (всего за несколько секунд) появлялись в лимфатических сосудах субэпикардиальной области. Лимфатические капилляры расположены равномерно в миокардиальной, субэпикардиальной и субэндокардиальной областях, образуя непрерывное сплетение [13; 14].
Считается, что сердечный лимфатический поток стимулируется пассивной насосной деятельностью, например, сокращениями миокарда. Во время диастолы давление крови в желудочках перемещает лимфу из субэндокардиальных лимфатических сосудов в миокардиальные, тогда как во время систолы сокращение миокарда вынуждает лимфу из лимфатических сосудов миокарда в субэпикардиальные лимфатические сосуды [15].
Лимфатические капилляры имеют диаметр 15–20 мкм и соединяются с более крупными каналами от 60 до 100 мкм. Эти каналы проходят в верхней части межжелудочковой перегородки параллельно атриовентрикулярной борозде. Вершины сосочковых мышц пронизаны лимфатическими сплетениями длиной 30–45 мкм с единичными протоковыми сосудами длиной 150 мкм. Субэпикардиальное сплетение человека имеет сходную картину с капиллярными сплетениями собак и свиней и проходит по поверхностям предсердий и желудочков с некоторыми незначительными различиями. Лимфатические сосуды сердца собак и свиней располагалась на поверхности предсердий вдоль трехстворчатого и митрального клапанов, направленных к кольцам, где они сливаются с более крупным каналом диаметром 110–225 мкм; однако их дальнейшее течение не было определено. Желудочковые поверхности атриовентрикулярных клапанов лишены лимфатических сосудов [16].
Лимфатические сосуды, дренирующие сердце, лежат в субсерозном слое его оболочки. В венечной борозде формируются два сплетения сосудов вокруг начала соответственно правой и левой коронарных артерий. Поверхностные лимфатические сосуды сливаются в более крупные, которые группируются в две системы вокруг основных коронарных артерий (Рис. 5).
Вокруг коронарных артерий образуются сплетения основных притоков передних и задних собирательных стволов. Крупные лимфатические сосуды располагаются между коронарными артериями и предсердно-желудочковым соединением как справа, так и слева [17].
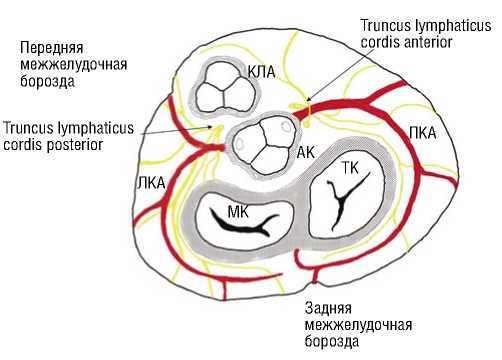
Рис. 5. Схематическое изображение формирования переднего и заднего лимфатических стволов (КЛА – клапан легочной артерии, АК – аортальный клапан, МК – митральный клапан, ТК – трикуспидальный клапан, ПКА – правая коронарнаяя артерия, ЛКА – левая коронарная артерия).

Выделяют следующие области лимфатического дренирования структур сердца:
-
• зона дренирования переднего собирательного ствола (правый желудочек и артериальный конус);
-
• зона дренирования заднего собирательного ствола (вся поверхность левого желудочка и небольшая часть правого желудочка непосредственно справа от передней межжелудочковой борозды; в этой бороздке лежат два-три залегающих продольно лимфатических сосуда, которые обеспечивают ток лимфы наиболее часто в задний собирательный ствол) [17].
Лимфоотток от большей части правого желудочка направляется по переднему лимфатическому стволу (tru-ncus lymphaticus cordis anterior) к экстраперикардиальной группе лимфатических узлов, расположенных в верхнем средостении в тесном контакте с левой безымянной веной (lymphoglandulae cordis anteriores) (Рис. 6).
Лимфоотток от левого желудочка направляется задним лимфатическим стволом (truncus lymphaticus cordis posterior) к экстраперикардиальной железе (lymphoglan-dula cordis posterior), которая входит в правую верхнюю трахеобронхиальную группу и находится в тесном родстве с ней. к верхней полой вене, аорте и правой легочной артерии [17].
Ряд исследований продемонстрировал, что поток лимфы направляется из эндокарда после того, как интерстициальная жидкость попала в лимфатические капилляры, в эпикард, где наблюдалось скопление лимфатических сосудов с активностью, способной продвигать поток лимфы вперед (Рис. 7) [4].
Желудочки имеют более развитую сеть лимфатических сосудов по сравнению с предсердиями. Лимфатические сосуды появляются в сердечных клапанах, потенциально играя важную роль. Когда сердечный лимфодренаж нарушен, сеть лимфатических капилляров в митральном клапане увеличивается. У собак и свиней лимфатические сосуды есть в обоих атриовентрикулярных клапанах – трикуспидальном и митральном. Но у человека лимфатические сосуды есть только в митральном клапане [3].
В настоящее время благодаря усовершенствованным методам, позволяющим отличать кровеносные сосуды от лимфатических, лимфатическую систему больше не рассматривают как вторичную по отношению к системе кровообращения. Кроме того, отмечается заметная изменчивость путей оттока лимфы (или лимфатических коллекторов) в сердцах человека и животных.
Нарушения лимфатического оттока в миокарде
При ишемии миокарда, отсутствии кровоснабжения сердца, происходит гибель кардиомиоцитов. Одновременно в интерстициальном пространстве миокарда накапливается жидкость, приводя к его отеку. Механизм его – увеличение проницаемости микрососудов миокарда и скорости фильтрации, превышающей скорость тока лимфы [4; 18].
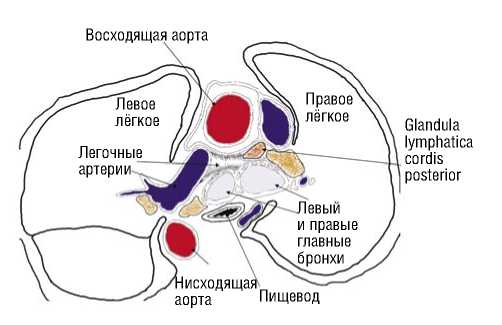
Рис. 6. Схема – горизонтальный срез на уровне заднего лимфатического узла сердца. Спереди располагается восходящая аорта и верхняя полая вена, окруженные перикардом, который на этом уровне переходит на стенку верхней полой вены. Позади этих двух сосудов и снаружи перикарда лежит задний лимфатический узел сердца
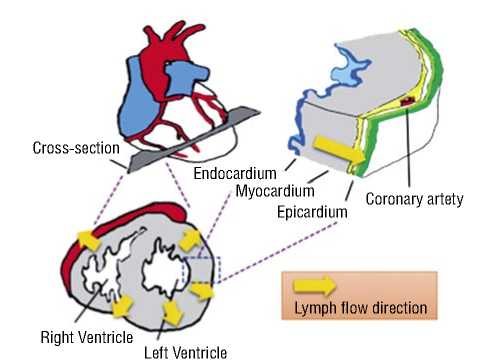
Рис. 7. Сердечный лимфодренаж сердца взрослой мыши. Поперечное сечение сердца с демонстрацией направления оттока сердечной лимфы от эндокарда, миокарда к эпикарду (поток указан стрелками) [4].
Многие торакальные хирургические процедуры включают иссечение внутригрудных и медиастинальных лимфатических сосудов. Широко распространено мнение, что лимфатическая система средостения подлежит хирургическому вмешательству и что разрушение лимфатической системы средостения не имеет существенного неблагоприятного физиологического эффекта. Повреждение лимфатических сосудов сердца может привести к тканевой лимфедеме миокарда и нарушению его функции [15]. Следует отметить, что лимфодренаж миокарда может быть восстановлен за счет ремоделирования коллатерального кровообращения [19].
Лимфатический отек миокарда может вызывать миокардиальный фиброз. Как острое, так и хроническое накопление интерстициального отека миокарда (вне-сосудистой жидкости) может существенно ухудшать

насосную функцию сердца, а избыток жидкости в интерстициальном пространстве миокарда может усиливать интерстициальный фиброз, усугубляя эти нарушения. Laine GA, Allen SJ. (1991) на экспериментальной модели показали, что миокардиальная слабость в хронических моделях значительно усугубляется после снижения сердечного лимфотока [20]. Фиброз опосредован увеличением синтеза коллагена I и III типов, ростом фибробластов [21]. Усиленный синтез коллагена начинался по данным авторов (исследование проводилось на кроликах) в течение семи дней после лимфатической обструкции и прекращался через 60 дней.
Развитие повреждения (инфаркта) миокарда инициирует выработку цитокинов, которые, в свою очередь, активируют фибробласты, секретирующие коллаген [22]. Сформировавшаяся фиброзная ткань компенсирует потерю кардиомиоцитов и обеспечивает прочность миокарда для защиты от разрыва – развивается заместительный фиброз. Однако, иммобилизирующий фиброз сердца другого генеза также имеет негативные последствия, среди которых и нарушение лимфодрена-жа интерстициальной жидкости, нарушение сердечной функции и участие в неблагоприятном ремоделировании желудочков [23].
Перегрузка камер сердца давлением и объемом, сахарный диабет, нарушение липидного обмена при ожирении и многие другие причины влияют на регуляцию синтеза коллагеновых волокон, сопровождающуюся прогрессированием интерстициального и периваскулярного фиброза, что становится типичным проявлением различных кардиомиопатий. Сдавление периферических отделов венечных сосудов (артериол, венул и лимфатических сосудов) приводит к симптомокомплексу рефрактерной к медикаментозному лечению коронарной недостаточности [23–25].
Возможности лечебного воздействия на лимфатическую сеть сердца
После инфаркта миокарда, когда разрушено много тканей, для восстановления интерстициального кровотока необходимо восстановление даже базальной плотности лимфатических сосудов. Базальный лимфангиогенный ответ довольно устойчив [3].
Постинфарктное ремоделирование вызывает необратимые изменения в лимфатической сети сердца, приводит к развитию интерстициального отека и фиброза, способствуя усугублению ХСН [26].
Иммобилизирующий фиброз сердца может быть одним из исходов нарушенного лимфатического оттока. Во время фазы заживления при повреждении миокарда необходима стимуляция лимфатических сосудов для оттока избыточного накопления белков и жидкости. При невозможности – расширяется интерстициальное пространство, ухудшается диффузия кислорода, усугубляется гипоксия и увеличиваются масштабы повреждения кардиомиоцита [27].
Медикаментозная активация лимфангиогенеза может быть одним из перспективных методов терапии в раннем постинфарктном периоде, а стимуляция уже подвергшейся ремоделированию лимфатической системы сердца способствует более эффективным компенсаторным процессам при ХСН [26].
Экспериментальная активация рецепторов кардиомиоцитов к эстрогену усиливает лимфангиогенез в периинфарктной зоне и уменьшает размер рубца [26]. Так, исследователи из клиники Шарите (Берлин) Mahmo-odzadeh S. и соавт. (2014) показали, что гиперстимуляция эстрогеновых рецепторов альфа (ER α ) усиливала экспрессию маркеров ангио- и лимфангиогенеза (Vegf, Lyve- 1) и неоваскуляризацию в периинфарктной зоне. А у особей женского пола формирование фиброза было выражено в меньшей степени [28].
Вероятно положительного эффекта можно достичь применением глюкокортикостероидов в ранние сроки развития болезни. Перспективным направлением лечения будет использование ингибиторов металлопротеиназ с целью блокады развития иммобилизирующего кардиального фиброза. Вполне возможно, что эффективным может быть и применение цитостатических препаратов. Не исключается использование ультразвуковой ударноволновой терапии для уменьшения плотности соединительной ткани за счет разрыва ее волокон [23]. Yotsumoto G. и соавт. (1998) показали благоприятное влияние вводимой во время кардиоплегии гиалуронидазы на отек миокарда собак, вызванный ишемией/реперфузией. Причем, в исследуемой группе значительно увеличивался объем лимфатической жидкости, получаемый из афферентного протока сердечного лимфатического узла. Это характеризовалось ускоренным постишемическим восстановлением сердечной функции [29].
Учитывая роль VEGF-C в заживлении ран и индукции лимфангиогенеза, его использование приносит терапевтический эффект при лимфедеме [30]. При исследовании влияния лимфангиогенеза на сердечную функцию с использованием терапии VEGF-C после инфаркта миокарда выявлено, что она улучшает сердечную функцию после инфаркта миокарда, одновременно ограничивая фиброз и затяжное воспаление [9]. Ремоделирование лимфатических капилляров, конечно же, не является решающим фактором положительного развития изменений. Более значимой терапевтической целью может быть поддержание функции более глубоких собирающих лимфатических сосудов [27]. Вышеуказанные исследования позволяют формировать новый многообещающий подход к восстановлению сердца после инфаркта миокарда и подчеркивают потенциальную возможность того, что дополнительная работа над лимфатической сосудистой сетью сердечной системы может привести к лечению дисфункции сердца.
Особо стоит отметить, что у больных, перенесших острый инфаркт миокарда, с одной стороны, необходимо как можно раньше в программу лечения включить меры
предупреждения развития индуцированного иммобилизирующего интерстициального фиброза здоровой части миокарда. С другой стороны, такой терапией можно замедлить формирование полноценного рубца в зоне инфаркта и таким образом повысить риск разрыва стенки сердца. Поэтому следует учитывать сроки формирования надежного рубца и проявлять разумную сдержанность в расширении физической активности после острого инфаркта миокарда. Однако все это требует дальнейших исследований [23].
Заключение
Таким образом, научные факты по эмбриологии, анатомии и функции лимфатической сети сердца, накопленные на данный момент, позволяют сделать вывод о важном ее значении в норме и при различных патологических явлениях, характеризующихся воспалительными изменениями и повреждением ткани сердца. Активизация лимфооттока может способствовать улучшению гомеостаза кардиомиоцитов, отчасти предотвращать прогрессирование или уменьшать проявления гипоксии мышечных клеток в остром периоде и блокировать развитие иммобилизирующего интерстициального фиброза сердца. Результаты уже проведенных исследований позволяют надеяться на создание нового направления научного поиска, а также практического применения полученных данных для профилактики и лечения хронической сердечной недостаточности.
Список литературы Современный взгляд на лимфатическую систему сердца и влияние ее патологии на функцию миокарда
- Eberth CJ, Belajeff A. Tiber die Lvmphagefiisse des Herzens. Arch. path. Anat. 1866; 37: 124.
- Garmy-Susini B, Pizzinat N, Villeneuve N, et al. Le système lymphatique cardiaque. Médecine/Sciences. 2017; 33(8-9): 765-770.
- Miller AJ, Ruth P, Lopis NK. Lymphatics of the mitral valve of the dog: demonstration and discussion of the possible significance. Circulation research. 1961; 9(5): 1005-1009.
- Huang LH, Lavine KJ, Randolph GJ. Cardiac Lymphatic Vessels, Transport, and Healing of the Infarcted Heart. JACC Basic Transl Sci. 2017; 2(4): 477-483. doi: 10.1016/j.jacbts.2017.02.005.
- Juszyński M, Ciszek B, Stachurska E. et al. Development of lymphatic vessels in mouse embryonic and early postnatal hearts. Dev Dyn. 2008; 237(10): 2973-86. doi: 10.1002/dvdy.21693.
- Ratajska A, Gula G, Flaht-Zabost A, et al. Comparative and Developmental Anatomy of Cardiac Lymphatics. Scientific World Journal. 2014; 9. doi: 10.1155/2014/183170.
- Fedyai VV. Age changes in the intrinsic lymphatics of the heart. Fed Proc Transl Suppl. 1966; 25(1): 177-80.
- Harris NR, Bálint L, Dy DM, et al. The ebb and flow of cardiac lymphatics: a tidal wave of new discoveries. Physiol Rev. 2023; 103(1): 391-432. doi: 10.1152/physrev.00052.2021.
- Klotz L, Norman S, Vieira JM, et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 2015; 522(7554): 62-7. doi: 10.1038/nature14483.
- Rauniyar K, Jha SK, Jeltsch M. Biology of Vascular Endothelial Growth Factor C in the Morphogenesis of Lymphatic Vessels. Front Bioeng Biotechnol. 2018; 6: 7. doi: 10.3389/fbioe.2018.00007.
- Бородин Ю.И. Лимфатический дренаж сердца. Морфо-функциональный аспект // Вестник лимфологии. – 2013. – №4. – С.4.
- Patek PR. The morphology of the lymphatics of the mammalian heart. American Journal of Anatomy. 1966; 64(10): 203-249, 1939.
- Kubik S. Anatomy of the lymphatic system. Textbook of Lymphology. 2003; 2: 166.
- Sacchi G, Weber E, Agliano M, Cavina NL. Comparing Lymphatic vessels of the human heart: precollectors and collecting vessels. A morpho-structural study. Journal of Submicroscopic Cytology and Pathology. 1999; 31(4): 515-525.
- Cui Y, Urschel JD, Petrelli NJ. The effect of cardiopulmonary lymphatic obstruction on heart and lung function. Thorac Cardiovasc Surg. 2001; 49(1): 35-40. doi: 10.1055/s-2001-9917.
- Johnson RA, Blake TM. Lymphatics of the heart. Circulation. 1966; 33(1): 137-142.
- Shore LR. The Lymphatic Drainage of the Human Heart. J Anat. 1929; 63(3): 291-313.
- Dongaonkar RM, Stewart RH, Geissler HJ, Laine GA. Myocardial microvascular permeability, interstitial oedema, and compromised cardiac function. Cardiovasc Res. 2010; 87(2): 331-9. doi: 10.1093/cvr/cvq145.
- Santos AC, de Lima JJ, Botelho MF, Pacheco MF, et al. Cardiac lymphatic dynamics after ischemia and reperfusion-experimental model. Nucl Med Biol. 1998; 25(7): 685-8. doi: 10.1016/s0969-8051(98)00037-7.
- Laine GA, Allen SJ. Left ventricular myocardial edema. Lymph flow, interstitial fibrosis, and cardiac function. Circ Res. 1991; 68(6): 1713-21. doi: 10.1161/01.res.68.6.1713. PMID: 2036720.
- Kong D, Kong X, Wang L. Effect of cardiac lymph flow obstruction on cardiac collagen synthesis and interstitial fibrosis. Physiol Res. 2006; 55(3): 253-258. doi: 10.33549/physiolres.930727.
- Hofmann U, Beyersdorf N, Weirather J, Podolskaya A, et al. Activation of CD4+ T lymphocytes improves wound healing and survival after experimental myocardial infarction in mice. Circulation. 2012; 125(13): 1652-63. doi: 10.1161/CIRCULATIONAHA.111.044164.
- Шевченко Ю.Л. Иммобилизирующий интерстициальный фиброз сердца // Новое в фундаментальной и клинической медицине. – М.: Изд-во НМХЦ им. Н.И.Пирогова, 2022. – С.46-95.
- Гюльмагомедова М.В. Лимфатическое русло сердца при сахарном диабете (аналитический обзор литературных данных) // Вестник Новгородского государственного университета. – 2016. – Т.97. – №6. – С.139-143.
- Wu L, Ong S, Talor MV, et al. Cardiac fibroblasts mediate IL-17A-driven inflammatory dilated cardiomyopathy. J Exp Med. 2014; 211: 1449-1464. doi: 10.1084/jem.20132126.
- Корнева Ю.С., Украинец Р.В. Значение лимфатической системы сердца в развитии и прогрессировании сердечной недостаточности и новых терапевтических подходах ее коррекции при постинфарктном ремоделировании // Кардиоваскулярная терапия и профилактика. – 2020. – №19(3). – С.2281. doi: 10.15829/1728-8800- 2020-2281.
- Henri O, Pouehe C, Houssari M. Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction. Circulation. 2016; 133: 1484-1497.
- Mahmoodzadeh S, Leber J, Zhang X, Jaisser F, et al. Cardiomyocyte-specific Estrogen Receptor Alpha Increases Angiogenesis, Lymphangiogenesis and Reduces Fibrosis in the Female Mouse Heart Post-Myocardial Infarction. J Cell Sci Ther. 2014; 5(1): 153. doi: 10.4172/2157-7013. 1000153.
- Yotsumoto G, Moriyama Y, Yamaoka A, et al. Experimental study of cardiac lymph dynamics and edema formation in ischemia/reperfusion injury--with reference to the effect of hyaluronidase. Angiology. 1998; 49(4): 299-305. doi: 10.1177/000331979804900408.
- Szuba A, Skobe M, Karkkainen MJ. Therapeutic lymphangiogenesis with human recombinant VEGF-C. FASEB J. 2002; 16: 19851987.


