Современный взгляд на восстановление стенок глазницы у пациентов с опухолями полости носа и придаточных пазух с применением имплантатов из никелида титана
Автор: Штин Валентин Игоревич, Новиков Валерий Александрович, Чойнзонов Евгений Лхамацыренович, Шилова Ольга Геннадьевна, Никитчук Александр Владимирович, Фролова Ирина Георгиевна, Суркова Полина Валериевна, Кульбакин Денис Евгеньевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Введение. Большинству пациентов с распространенными опухолями полости носа и придаточных пазух показаны расширенные операции, которые приводят к образованию краниофациальных дефектов, что требует реконструкции костных структур лицевого и мозгового черепа различными имплантатами. Цель исследования - оценить эффективность применения имплантации тонкопрофильных эндопротезов из никелида титана при хирургическом лечении опухолей полости носа и придаточных пазух. Материал и методы. В исследование вошли 60 пациентов, проходившие лечение по поводу злокачественных опухолей полости носа и придаточных пазух Т3-4N0-1M0 в НИИ онкологии г. Томска с 2002 по 2020 г и получившие комбинированное лечение с использованием предоперационной лучевой терапии и хирургического вмешательства с эндопротезированием костных структур субкраниальной области и стенок орбиты. В основной группе (n=30) восстановление стенок орбиты проводилось индивидуальными тонкопрофильными имплантатами из никелида титана с памятью формы. В группе контроля (n=30) применялись типовые пористые и тканевые имплантаты из никелида титана, требующие подгонки во время вмешательства и затрудняющие течение репаративных процессов в послеоперационном периоде вследствие своей толщины, а также тканевые имплантаты, не позволявшие выполнить точное восстановление стенок орбиты ввиду своей структуры. Результаты. Хирургическая реабилитация с восполнением стенок глазницы тонкопрофильными имплантатами из никелида титана с памятью формы позволяет сократить длительность операции и повысить прецизионность процесса восстановления резецированных стенок орбиты. Особенности архитектоники рамочных имплантатов не препятствуют прорастанию тканей реципиентной зоны, что сокращает сроки течения послеоперационных раневых процессов и препятствует развитию воспаления в зоне имплантации. Методика позволяет адекватно восстанавливать естественное положение и функцию глаза.
Имплантаты, опухоли носа и придаточных пазух, тонкопрофильные эндопротезы
Короткий адрес: https://sciup.org/140254507
IDR: 140254507 | УДК: 616.213.6+616.216]-006-089.843:617.76 | DOI: 10.21294/1814-4861-2021-20-3-39-47
Текст научной статьи Современный взгляд на восстановление стенок глазницы у пациентов с опухолями полости носа и придаточных пазух с применением имплантатов из никелида титана
Рак слизистой полости носа и околоносовых пазух встречается в 0,3–3,5 случаях на 100 тыс. населения в год, составляя 0,2–5 % в общей структуре онкологической заболеваемости [1–4]. Комбинированное лечение, включающее лучевую терапию и расширенно-комбинированные операции, является наиболее эффективным методом лечения злокачественных опухолей придаточных пазух носа [5–8]. При этом результаты лечения находятся в прямой зависимости от радикальности выполненной операции. Зачастую такие хирургические вмешательства приводят к образованию обширных краниофациальных дефектов, в связи с этим реконструкция костных структур лицевого и мозгового черепа различными имплантатами, а также восстановление мягких тканей лица становятся неотъемлемой частью хирургического лечения данных больных [9–15].
Согласно базовым принципам восстановительной и реконструктивной хирургии лица, заложенным еще в конце прошлого столетия, трансплантат должен соответствовать структуре, консистенции, форме, объему и функции органа, который восстанавливается. Особую важность эти постулаты имеют для восстановления стенок глазницы. Сохранение естественного положения глазного яблока в орбите имеет большое значение не только с косметической точки зрения, но и функциональной [16–23]. Смещение глазного яблока в любой плоскости оказывает влияние на работу зрительного анализатора в целом [3, 4, 24]. В связи с этим правильное положение глаз является одним из ключевых параметров для проведения успешной реабилитации [11, 25]. В настоящее время накоплен огромный опыт использования различных материалов с целью восстановления стенок глазницы [1, 4, 24, 25]. Одним из первых способов реконструкции нижней стенки орбиты принято считать методику немецкого врача Ф. Кенига [26], который использовал порции височной мышцы. В дальнейшем с этой целью применялись фрагменты ребер, наружный край лопатки, лучевая кость, расщепленные свободные костные аутотрансплантаты свода черепа, хрящ перегородки носа, кортикальная пластинка гребня подвздошной кости, костные трансплантаты из бедренной кости и сегменты костей голени [2, 10, 20, 22]. Недостатками этих методик являются значительная травматичность, длительная эпителизация послеоперационной полости. Кроме того, отсутствие жесткого каркаса способствует деформации лица в отдаленном периоде. Ряд авторов рассматривали возможность использования полимерных материалов, а именно силикона и изготовленных в комбинации с последним титановых имплантатов [1]. В настоящее время часто используются титановые стандартные микропластины, которые моделируются согласно объему дефекта интраоперационно. Одним из серьезных недостатков всех этих методик является несоответствие имплантатов параметрам анатомического дефекта черепа конкретного индивидуума [13, 27]. Это связано с низкой точностью измерения дефекта, использованием линейных измерений, а не объемных параметров. Основной проблемой материалов, использующихся для восстановления дефектов лицевого скелета, являются присоединение вторичной инфекции и воспаление в зоне имплантации, значительно ухудшающие прогноз протезирования [14, 28]. Особенно это актуально для пациентов, получавших химиолучевое лечение. Таким образом, выбор варианта реконструктивных действий должен решаться индивидуально с учетом распространения опухолевого процесса и анатомического строения зоны оперативного вмешательства [26, 29]. Помимо этого, необходим дальнейший поиск оптимального материала для имплантации, отвечающего всем современным требованиям.
Цель исследования – оценить эффективность применения имплантации тонкопрофильных эндопротезов из никелида титана при хирургическом лечении опухолей полости носа и придаточных пазух.
Материал и методы
Ретроспективное когортное исследование основано на анализе историй болезни 60 пациентов, которые проходили лечение по поводу злокачественных опухолей полости носа и придаточных пазух Т3–4N0–1M0 в НИИ онкологии г. Томска с 2002 по 2020 г. Распределение пациентов по полу: мужчины – 59 %, женщины – 41 %. Чаще на лечение поступали пациенты в возрасте 40–60 лет – 48 %. Все пациенты получили комбинированное лечение с использованием предоперационной лучевой терапии и хирургического вмешательства с эндопротезированием костных структур субкраниальной области и стенок орбиты.
В связи с тем, что исследование заняло довольно продолжительное время, нами досконально были изучены все достоинства и недостатки использования имплантатов из никелида титана в реконструктивной хирургии средней зоны лица. Что в итоге привело к появлению совершенно новой технологии имплантации, которая используется в настоящее время. С целью объективизации оценки эффективности описываемой технологии пациенты были подразделены на 2 группы: 30 пациентов, которым с целью реконструкции использовались тонкопрофильные имплантаты из никелида титана с памятью формы (основная группа); 30 пациентов, восстановление костных структур лицевого черепа и орбиты которым выполнялось с применением пористых (n=15) и тканевых имплантатов (n=15) из никелида титана (контрольная группа).
Данное разделение пациентов наиболее полно отражает поступательное развитие и совершенствование технологии восстановления стенок орбиты с применением имплантатов из никелида титана. Первым этапом этого развития была методика восстановления стенок орбиты с применением пористых и тканевых имплантатов. Пористые имплантаты изготавливались из пористого нике-лида титана (ТН–10) толщиной 0,3–0,4 мм. Такая толщина подбиралась экспериментально, исходя из условий прочности, эластичности и необходимого радиуса прогиба. Тканевые сетчатые имплантаты изготавливались по текстильной технологии из никелид-титановой нити толщиной от 40 до 60 мкм с расстоянием между соседними нитями (разрядка плетения) 180–210 мкм. Интервал между соседними нитями был определен из условий возможности и оптимума взаимной подвижности нитей для обеспечения структурной эластичности. Размеры и форма имплантатов подбирались индивидуально с учетом предполагаемой площади дефекта лицевого скелета. С этой целью использовались антропометрические измерения области орбиты пациента, либо протез формировался на основании стереолитографической модели черепа пациента. Изготовленный имплантат устанавливался на края костного дефекта при возможности поднадкостнично. В большинстве случаев требовалась подгонка имплантата к реципиентной зоне, что увеличивало длительность и усложняло хирургическое вмешательство. В связи с особенностями хирургического вмешательства, а также длительностью заживления раневой поверхности в зоне имплантации была разработана технология изготовления и установки тонкопрофильных имплантатов из никелида титана с памятью формы. Указанная методика была вторым этапом, включившим в себя все полезные качества пористых и тканевых имплантатов: выраженные каркасные свойства, коррозионную стойкость. В то же вре- мя методика позволила устранить недостатки, присущие пористым имплантатам. Имплантаты изготавливались на основании индивидуальной стереолитографической модели черепа пациента. Также для случаев, когда не представляется возможным изготовление стереолитографического шаблона, была разработана методика моделирования имплантата с использованием данных спиральной компьютерной томографии. При этом зона исследования включает область от лобной пазухи до нижнего края нижней челюсти, исследование выполняют в аксиальной проекции с последующей мультипланарной реконструкцией в трёх проекциях. Анализ компьютерных томограмм включает анатомическую идентификацию видимых структур орбиты; оценку формы, структуры и размеров опухоли; взаимосвязь с соседними анатомическими областями; денситометриче-ский анализ. На основании полученных данных создается рамка из микропористой проволоки из никелида титана. Данная рамка повторяет контуры протезируемого участка, имеет заданные углы изгиба (эквивалент изгибов костных структур), т.е. обладает памятью формы. На изготовленную индивидуальную тонкопрофильную рамку при помощи никелидтитановой нити фиксируется широкоячеистая ткань из никелида титана (рис. 1). Данную конструкцию отличают легкий вес, выраженная каркасная функция (за счет рамки из никелида титана), способность к лучшей биоинтеграции с тканями (за счет ячеистости ткани, микропористости проволочной рамки и нити), наличие заданной памяти формы. В ходе оперативного вмешательства эндопротез устанавливается на сохраненные костные структуры (по возможности поднадкостнично) и укрепляется титановыми шурупами (рис. 2). Чаще использовались три точки опоры, что делало установленную конструкцию наиболее устойчивой и позволяло добиться физиологического положения поддерживаемых тканей.
С целью объективизации результатов проводились оценка и сравнение последних в исследуемой и контрольной группе по следующим характеристикам: оценка правильности положения имплантата в орбите (рентгенологическое обследование); качество восстановления положения и функции глазного яблока (офтальмологическое обследование); длительность репаративных процессов в зоне имплантации (эндоскопическое обследование с морфологическим исследованием биоптатов тканей в зоне имплантации); количество и характер осложнений эндопротезирования.
Спиральная компьютерная томография (СКТ) проводилась на аппарате «Somatom Emotiоn 6» (Siemens) срезами толщиной 1,25 мм с последующим стандартным алгоритмом реконструкции. Сканирование выполняли до, во время и после внутривенного болюсного введения контрастного
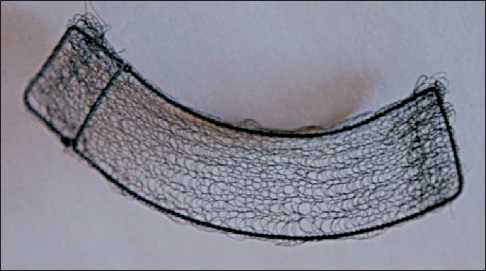
Рис. 1. Тонкопрофильный комбинированный эндопротез стенок орбиты
Fig. 1. Thin-profile combined orbital wall implant
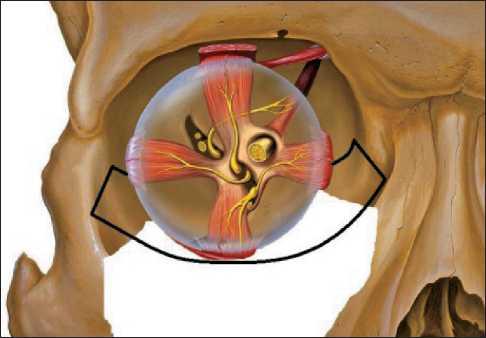
Рис. 2. Схематическое изображение установленного тонкопрофильного эндопротеза стенок орбиты
Fig. 2. Schematic representation of the installed thin-profile implant for the orbital walls препарата – «омнипак» в объеме 100 мл, со скоростью введения 4 мл/сек. Спиральная компьютерная томография выполнялась до и после выполнения хирургического этапа лечения. Контроль расположения имплантата в полости глазницы во время хирургического вмешательства осуществлялся при помощи мобильной рентгенографической установки С-дуги, модель Fluorostar 7900 (GE Medical Systems). В послеоперационном периоде компьютерную томографию проводили на 30-е сут и через 3 мес после окончания лечения. Исследовали положение эндопротеза и глазного яблока в орбите в сравнении со структурами здоровой стороны. С использованием компьютерной томографии проводили динамическое наблюдение за послеоперационной полостью с целью исключения рецидива опухоли.
В процессе выполнения работы был разработан комплекс диагностических мероприятий, позволяющий оценить состояние органа зрения с учетом дальнейших восстановительных мероприятий, исходя из условий «нормального» функционирования зрительного анализатора. Комплекс включал в себя методики, рекомендованные «Стандартом медицинской помощи больным со злокачественным новообразованием глаза и его придатков», регламентированным приказом МЗиСР РФ.
Изучение репаративных процессов в послеоперационной полости осуществлялось эндоскопически с использованием аппарата Olimpus 1Т 40 BF на 11-е сут после операции. В дальнейшем осмотр послеоперационной полости проводился каждые 5 сут до момента выписки пациента из стационара. Данные эндоскопии фиксировались с использованием цифровой фото- и видеотехники. Оценивались положение имплантата, характер течения репаративных процессов в послеоперационной полости в зависимости от используемой методики протезирования. Осуществлялся забор тканей, покрывающих эндопротез, на морфологическое исследование.
Результаты
Использование интраоперационного контроля с применением С-дуги дало возможность устанавливать имплантаты в соответствии с естественным положением резецированных стенок глазницы у 100 % пациентов обеих групп. При дальнейшем наблюдении было установлено изменение положения имплантатов и взаимосвязь степени смещения со структурой имплантата. Оценка положения эндопротеза в послеоперационном периоде проводилась по данным компьютерной томографии в сравнении с конфигурацией костных структур здоровой стороны. В основной группе смещение рамочного тонкопрофильного имплантата выявлено в 5 (16 %) случаях. Степень смещения составила от 3 до 8 мм относительно вертикальной оси. В одном случае дислокация имплантата была выявлена на 15-е сут после операции, при этом в объем резекции вошли стенки глазницы, кроме верхней, следствием чего было недостаточное крепление имплантата за сохраненные костные структуры. Пациенту была проведена корригирующая операция в отсроченном периоде. У 2 (6 %) пациентов смещение имплантата было установлено через 3 мес после операции. Оно было обусловлено выраженной рубцовой деформацией мягких тканей лица, вызванной резекцией верхней челюсти, стенок орбиты и скуловой кости. Одному пациенту была выполнена коррекция. Второй пациент от дополнительных реабилитационных манипуляций отказался. В 2 (6 %) случаях смещение имплантата было связано с воспалением в зоне имплантации, что способствовало прорезыванию имплантата через ткани послеоперационной полости и его смещению. В одном случае осложнение удалось купировать местным противовоспалительным лечением. В одном случае возникла необходимость удаления имплантата и последующей отсроченной хирургической реабилитации.
В контрольной группе пациентов, восстановление стенок глазницы которым проводилось с применением тканевых и пористых имплантатов, смещение эндопротеза выявлено в 12 (40 %) случаях. Наиболее часто нестабильность была выявлена при использовании тканевых имлантатов (23 %). Степень смещения составила от 4 до 11 мм относительно вертикальной оси. Смещение имплантатов было установлено на 2–3-ю нед после операции. Отсутствие ребер жесткости приводило к недостаточной конгруэнтности с реципиентной зоной и смешению имплантата. В 3 случаях степень смещения потребовала выполнения отстроченной хирургической коррекции. Дислокация пористых имплантатов чаще была связана с воспалением, развивающимся в послеоперационной полости – в 5 (16 %) случаях. Степень смещения составила от 3 до 15 мм относительно вертикальной оси. Толщина пористой пластины имплантата приводила к удлинению интервала полного закрытия последнего тканями реципиентной зоны, что способствовало присоединению вторичной инфекции и развитию нестабильности имплантата. Смещение имплантатов выявлялось в сроки от 3 нед до 2 мес. У 3 пациентов было выполнено корригирующее вмешательство.
В ходе эндоскопического наблюдения за течением репаративных процессов установлено, что наиболее длительно процессы заживления протекали у пациентов контрольной группы, восстановление стенок орбиты которым проводилось с применением пористых имплантатов. Очищение раневой поверхности происходило на 17-е сут после операции. Через 40 сут после операции раневая поверхность и большая часть эндопротеза были покрыты грануляционной тканью. Фиброзирование грануляционной ткани с образованием рубца и эпителизацией заканчивалось через 3 мес после операции. Длительность процессов заживления способствовала присоединению вторичной инфекции и развитию воспаления в зоне имплантата, которое наблюдалось в 100 % случаев использования протезов из пористого никелида титана. У пациентов контрольной группы, восстановление стенок глазницы которым проводилось с применением тканевых эндопротезов, первые две фазы заживления заканчивались через 25 сут после операции. Очищение раны происходило на 15-е сут, на 25–30-е сут после операции грануляционная ткань полностью закрывала послеоперационную раневую поверхность и имплантат. Фиброзирование грануляционной ткани с эпителизацией происходило в среднем через 70 дней после операции. Меньшая толщина имплантата, а также полная конгруэнтность с реципиентной зоной способствовали более раннему заживлению раневой поверхности с меньшим количеством воспалений в послеоперационной полости. Воспалительные изменения в данной группе наблюдались в 30 % случаев,
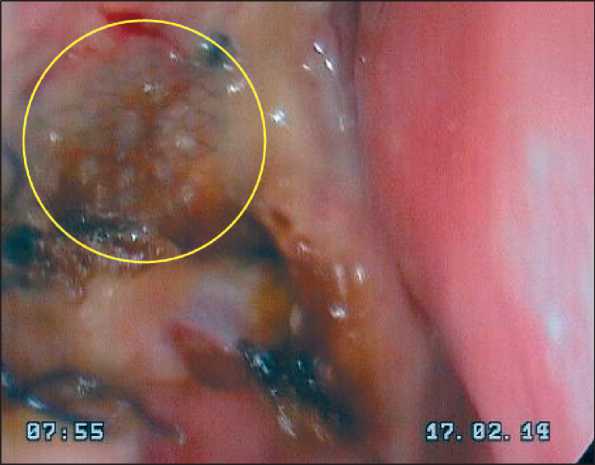
Рис. 3. Эндофотография области эндопротеза на 10-е сут после операции. Выделен участок имплантата не покрытый грануляционной тканью
Fig. 3. Endoscopic image on the 10th day after surgery. Shows the implant area that is not covered with granulation tissue
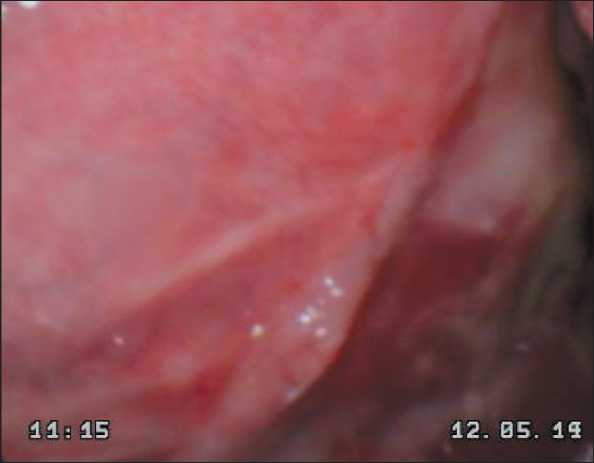
Рис. 4. Эндофотография области эндопротеза на 50-е сут после операции. Полная эпителизация зоны имплантации
Fig. 4. Endoscopic image shows complete epithelialization of the implant area on the 50th day after surgery
купировались местным противовоспалительным лечением. У пациентов основной группы структура и форма имплантата исключали необходимость длительного прорастания тканей реципиентной зоны в эндопротез. В связи с этим уже через 14 дней грануляционная ткань полностью покрывала всю зону имплантации (рис. 3). Эпителизация раневой поверхности обычно заканчивалась на 40–50-е сут (рис. 4). Воспаление в зоне имплантации возникло в 2 (6 %) случаях и было купировано местным противовоспалительным лечением.
Использование тонкопрофильных имплантатов позволило сократить длительность репаративных процессов практически вдвое по сравнению с пористыми имплантатами (рис. 5). Это позволило избежать воспаления в зоне имплантации в 94 % случаев. Наиболее часто воспалительные осложнения возникали в контрольной группе при использовании пористых имплантатов (50 %). При применении тканевых имплантатов воспаление реципиентной зоны было установлено в 30 %. Учитывая эти данные, можно сделать вывод о большей безопасности в плане воспалительных осложнений тонкопрофильных имплантатов с памятью формы, использовавшихся в основной группе.
При обследовании органа зрения основным симптомом, выявляемым после оперативного лечения в обеих группах, явились диплопия и чувство жжения. В раннем послеоперационном периоде (7 дней) офтальмологические симптомы различной степени выраженности чаще наблюдались в контрольной группе – в 63 % случаев, в основной группе – в 26,6 %. Данные изменения в раннем послеоперационном периоде были связаны с послеоперационным отеком параорбитальной клетчатки и прямо коррелировали с объемом вмешательства. В обеих группах в 100 % случаев диплопия на- блюдалась при отведении глаза кверху и кнаружи. Ощущение жжения обычно проходило к концу 2 нед после операции, причем данные изменения регрессировали одинаково в обеих группах в 100 %. При оценке степени диплопии через 2 нед в контрольной группе она сохранялась в 30 % случаев, в основной группе – в 16 % наблюдений. Изменения подвижности глазного яблока с развитием диплопии в обеих группах были обусловлены смещением имплантатов различной степени и воспалительными изменениями в зоне имплантации. Офтальмологическое обследование через 1 мес после операции выявило нарушение положения глазного яблока в орбите с диплопией у 40 % пациентов контрольной группы, что было связано с длительностью процессов заживления и частыми воспалительными осложнениями в зоне имплантации. Выраженные рубцовые изменения на фоне воспаления позволя-
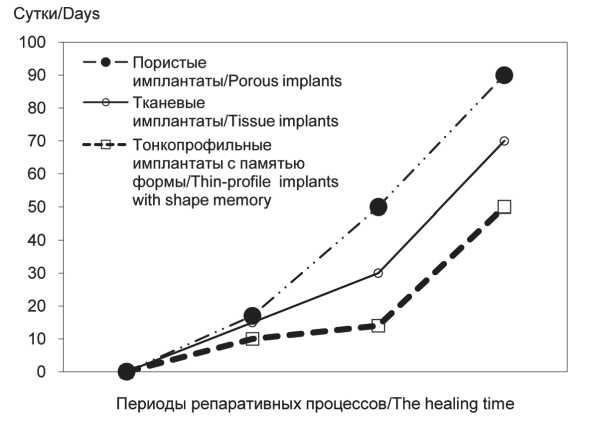
Рис. 5. Сроки заживления послеоперационной раневой поверхности в исследуемой и контрольной группах
Fig. 5. The healing time for a surgical wound in the study and control groups
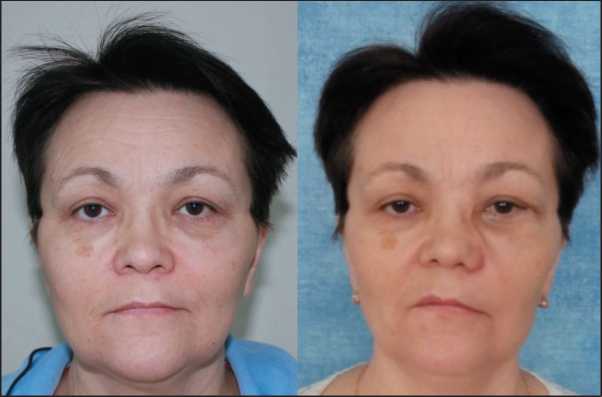
Рис. 6. Фото пациентки до хирургического вмешательства и через 3 мес после операции
Fig. 6. Photo of the patient before surgery and 3 months after surgery ли устраненить данные изменения с применением корригирующих вмешательств. К окончанию 3 мес после операции в контрольной группе диплопия той или иной выраженности сохранялась в 30 % случаев. В основной группе через 1 мес после операции диплопия наблюдалась в 13 %, через 3 мес – в 6 % случаев.
Изменения характера зрения имела прямую взаимосвязь со смещением глазного яблока вследствие дистопии импланта или наличия воспалительных явлений. При суммарном смещении глазного яблока до 2 мм сохраняется большая вероятность сохранения бинокулярного зрения либо короткие сроки его восстановления. При смещении от 3 до 6 мм вероятность сохранения бинокулярного зрения уменьшается от 50 % к 0 соответственно, при дислокации более 7 мм вероятность развития бинокулярного зрения равна 0.
Заключение
Хирургическая реабилитация с восполнением стенок глазницы тонкопрофильными имплантатами из никелида титана с памятью формы позволяет сократить длительность оперативного вмешательства, повысить прецизионность процесса восстановления резецированных стенок орбиты. Структура имплантата позволяет восстанавливать большие дефекты лицевого скелета без угрозы смещения эндопротеза. Особенности архитектоники рамочных имплантатов не препятствуют прорастанию тканей реципиентной зоны, что сокращает сроки течения раневых процессов и препятствует развитию воспаления. Методика позволяет адекватно восстанавливать естественное положение и функцию глаза (рис. 6).
Список литературы Современный взгляд на восстановление стенок глазницы у пациентов с опухолями полости носа и придаточных пазух с применением имплантатов из никелида титана
- Минкин А.У. Комплексная диагностика и лечение предраковых заболеваний и злокачественных опухолей верхней челюсти, полости носа и придаточных пазух. Архангельск, 2011. 255 с. [Minkin A.U. Comprehensive diagnosis and treatment of precancerous diseases and malignant tumors of the upper jaw, nasal cavity and paranasal sinuses. Arkhangelsk, 2011. 255 p. (in Russian)].
- Новиков В.А., Штин В.И., Фролова И.Г., Трухачёва Н.Г., Шилова О.Г., Никитчук А.В., Кучерова Т.Я., Молчанов Н.А. Современные подходы к лечению и реабилитации больных опухолями придаточных пазух носа с применением никелида титана и компьютерных технологий. Сибирский онкологический журнал. 2007; 2: 63–68. [Novikov V.A., Shtin V.I., Frolova I.G., Trukhacheva N.G., Shilova O.G., Nikitchuk A.V., Kucherova T.Ya., Molchanov N.A. Novel approaches to treatment and rehabilitation of patients with cancer of nasal accessory sinuses using Titanium Nickelid and computer-bases tecnologies. Siberian Journal of Oncology. 2007; 2: 63–68. (in Russian)].
- Медведев Ю.А., Шаманаева Л.С., Петрук П.С., Ян Cинь, Соловьева А.А. Применение имплантатов из тканевого никелида титана для реконструкции нижней стенки глазницы. Стоматология. 2014; 3: 35–38. [Medvedev Yu.A., Shamanaeva L.S., Petruk P.S., Yang Sin, Solovieva A.A. Nickelid titanium mesh for orbital floor reconstruction. Stomatology. 2014; 3: 35–38. (in Russian)].
- Медведев Ю.А., Шаманаева Л.С., Шаманаев С.В., Поляков К.А., Петрук П.С. Эндопротезирование нижней стенки глазницы. Голова и шея. 2017; 1: 18–22. [Medvedev Y.A., Shamanayeva L.S., Shamanayev S.V., Polyakov K.A.1, Petruk P.S. Endoprosthesis of lower orbital wall. Endoprosthesis of lower orbital wall. Head and Neck. 2017; 1: 18–22. (in Russian)].
- Bhattacharyya N. Survival and staging characteristics for nonsquamous cell malignancies of the maxillary sinus. Arch Otolaryngol Head Neck Surg. 2003 Mar; 129(3): 334–7. doi: 10.1001/archotol.129.3.334.
- Hausamen J.E. The scientific development of maxillofacial surgery in the 20-th century and an outlook into the future. J. Craniomaxillofacial. Surg. 2001; 29(1): 2–21.
- Jones N.F., Hardesty R.A., Swartz W.M., Ramasastry S.S., Heckler F.R., Newton E.D. Extensive and complex defects of the scalp, middle third of the face, and palate: the role of microsurgical reconstruction. Plast Reconstr Surg. 1988 Dec; 82(6): 937–52. doi: 10.1097/00006534-198812000-00001.
- Nishino H., Ichimura K., Tanaka H., Ishikawa K., Abe K., Fujisawa Y., Shinozaki T. Results of orbital preservation for advanced malignant maxillary sinus tumors. Laryngoscope. 2003 Jun; 113(6): 1064–9. doi: 10.1097/00005537-200306000-00028.
- Пачес А.И. Опухоли головы и шеи. М., 1997. 460 с. [Paches A.I. Tumors of the head and neck. Moscow, 1997. 460 p. (in Russian)].
- Решетов И.В., Кравцов С.А., Маторин О.В., Поляков А.П. Пластические операции при лечении злокачественных опухолей верхней челюсти и орбиты с использованием костно-мышечных лоскутов с включением ребра. Анналы пластической, реконструктивной и эстетической хирургии. 1998; 3: 42–43. [Reshetov I.V., Kravtsov S.A., Matorin O.V., Polyakov A.P. Plastic surgery in the treatment of malignant tumors of the upper jaw and orbit using musculoskeletal flaps with the inclusion of the rib. Annals of Plastic, Reconstructive and Aesthetic Surgery. 1998; 3: 42–43. (in Russian)].
- Kaercher T., Buchholz P., Kimmich F. Treatment of patients with keratoconjunctivitis sicca with Optive: results of a multicenter, open-label observational study in Germany. Clin Ophthalmol. 2009; 3: 33–9.
- Konig F. Technick ausgedehnter oberkieforcarcinoma. Arch Klin Chir. 1900. 775 p.
- Чеботарев С.Я., Мирзаян Г.Р., Белов И.Ю., Примак Н.А., Гуляев Д.А. Устранение дефектов основания черепа и средней зоны лица после хирургического лечения распространенных краниомак-силлярных опухолей. Сибирский онкологический журнал. 2016; 15(4): 62–69. [Chebotarev S.Ya., Mirzayan G.R., Belov I.Yu., Primak N.A., Gulyaev D.A. Correction the skull base and midface defects after surgical treatment of the widespread cranio-maxillary tumors. Siberian Journal of Oncology. 2016; 15(4): 62–69. (in Russian)].
- Чуйков М., Матякин Е.Г., Азизян Р.И., Ахундов А.А., Мудунов А.М., Подвязников О., Федотов Н.Н., Чучков М.В., Агапов В.В. Ортопедическая реабилитация онкологических больных с дефектами верхней челюсти. Современная онкология. 2006; 8(3): 28–34. [Chuikov M., Matyakin E.G., Azizyan R.I., Akhundov A.A., Mudunov A.M., Podvyaznikov O., Fedotov N.N., Chuchkov M.V., Agapov V.V. Orthopedic rehabilitation of cancer patients with upper jaw defects. Modern Oncology. 2006; 8(3): 28–34. (in Russian)].
- Giri P.S., Paddy E.K., Garter L.S., Krishnan L., Smalley S.S., Evans R.G. Optimum management of advanced squamous cell carcinoma of the maxillary sinus. Int J Rad Oncol Biol Phys. 1990; 19: 242.
- Андреев В.Г., Барышев В.В., Дементьев А.В. Одномоментная функциональная пластика нижней стенки орбиты после удаления опухоли верхней челюсти. Сибирский онкологический журнал. 2010;
- 4: 43–46. [Andreev V.G., Baryshev V.V., Dementyev A.V. Single-stage functional reconstruction of lower wall of the orbit after maxillary tumor removal. Siberian Journal of Oncology. 2010; 4: 43–46. (in Russian)].
- Барышев В.В., Андреев В.Г. Метод одномоментной функциональной реконструкции нижней стенки глазницы. Российская оториноларингология. 2011; 2(51): 38–40. [Baryshev V.V., Andreev V.G. The method of single-stage reconstruction of lower wall of the orbit. Russian Otorhinolaryngology. 2011; 2(51): 38–40. (in Russian)].
- Бельченко В.А., Рыбальченко Г.Н., Баранюк И.С. Клинико-анатомическое обоснование использования трансантрального оперативного доступа при переломах нижней стенки глазницы. Часть II. Стоматология. 2014; 93(3): 23–27. [Belchenko V.A., Rybalchenko G.N., Baraniuk I.S. Clinical and anatomical rationale for transanthral approach in orbital floor fractures. Part II. Stomatology. 2014; 93(3): 23–27. (in Russian)].
- Бернадский Ю.И. Травматология и восстановительная хирургия черепно-челюстно-лицевой области. М., 1999. 456 c. [Bernadsky Yu.I. Traumatology and reconstructive surgery of the cranio-maxillofacial area. Moscow, 1999. 456 p. (in Russian)].
- Груша О.В., Груша Я.О. 500 пластик орбиты: анализ осложнений. Вестник офтальмологии. 2006; 1: 22–24. [Grusha O.V., Grusha Ya.O. 500 plastic of the orbit: an analysis of complications. Bulletin of Ophthalmology. 2006; 1: 22–24. (in Russian)].
- Rootman J., Stewart P., Goldberg R.A. Orbital surgery: A conceptual approach. Plymouth: Lippencott-Raven Publ., 1996. 394 p.
- Медведев Ю.А., Петрук П.С., Шаманаева Л.С., Волкова В.А., Давидов А.Р. Применение катетера Фолея при проведении реконструктивно-восстановительных операций на средней зоне лицевого черепа. Стоматология. 2016; 3: 31–37. [Medvedev Yu.A., Petruk P.S., Shamanaeva L.S., Volkova V.A., Davidov AR. The use of Foley catheter in reconstructive procedures involving the middle third of the facial skeleton. Stomatology. 2016; 95(3): 31–37. (in Russian)]. doi: 10.17116/stomat201695331-37
- Joseph J.M., Glavas I.P. Orbital fractures: a review. Clin Ophthalmol. 2011 Jan 12; 5: 95–100. doi: 10.2147/OPTH.S14972.
- Филатова И.А., Тишкова А.П., Берая М.З., Полякова Л.Я., Тхелидзе Н.Р. Компьютерная _______томография в диагностике и определении тактики лечения у пациентов с посттравматической патологией глаза и орбиты. Вестник офтальмологии. 2005. 6: 9–14. [Filatova I.A., Tishkova A.P., Beraia M.Z., Poliakova L.Ia., Tkhelidze N.R. Computed tomography in diagnosing and determining treatment policy in patients with posttraumatic pathology of the eye and orbit. Bulletin of Ophthalmology. 2005. 6: 9–14. (in Russian)].
- Штин В.И. Способ восстановления стенок орбиты после операций по поводу местнораспространенных опухолей полости носа и придаточных пазух. Сибирский онкологический журнал. 2007; Прил. № 2: 130–131. [Shtin V.I. A method of restoring the walls of the orbit after operations for locally advanced tumors of the nasal cavity and paranasal sinuses. Siberian Journal of Oncology. 2007; Suppl. 2: 130–131. (in Russian)].
- Marsh J.L., Vannier M.W., Stevens W.G., Warren J.O., Gayou D., Dye D.M. Computerized imaging for soft tissue and osseous reconstruction in the head and neck. Clin Plast Surg. 1985 Apr; 12(2): 279–91.
- Шалумов А.З., Левченко О.В., Шарифуллин Ф.А., Насибуллин А.М., Булычева Е.Г., Крылов В.В. Рентгеновская компьютерная томография челюстно-лицевых повреждений, сочетанных с черепно-мозговой травмой. Нейрохирургия. 2009; 4: 42–49. [Shalumov A.Z., Levchenko O.V., Sharifullin F.A., Nasibullin A.M., Bulycheva E.G., Krylov V.V. X-ray computed tomography of maxillofacial injuries associated with traumatic brain injury. Neurosurgery. 2009; 4: 42-49. (in Russian)].
- Соколов Н.Н. Непосредственная эпителизация полости рта после резекции верхней челюсти. Новый хирургический архив. 1969; 43: 321–327. [Sokolov N.N. Immediate epithelialization of the oral cavity after resection of the upper jaw. New Surgery Archive. 1969; 43: 321–327. (in Russian)].
- Чойнзонов Е.Л., Балацкая Е.Л., Кицманюк З.Д., Дубский С.В. Реабилитация больных опухолями головы и шеи. Томск, 2003. 296 с. [Choynzonov E.L., Balatskaya E.L., Kitsmanyuk Z.D., Dubskiy S.V. Rehabilitation of patients with head and neck tumors. Tomsk, 2003. 296 p. (in Russian)].


