Создание межвидового гибрида Capsicum annuum L. и C. frutescens L. с использованием биотехнологических подходов
Автор: Джос Елена Алексеевна, Шумилина Дарья Владимировна, Пышная Ольга Николаевна, Мамедов Мубариз Иса Оглы, Байков А.А., Матюкина А.А.
Журнал: Овощи России @vegetables
Рубрика: Селекция и семеноводство сельскохозяйственных растений
Статья в выпуске: 4 (60), 2021 года.
Бесплатный доступ
Актуальность. В последнее время вместе с возрастающей популярностью перца C. annuum L. увеличивается интерес и к другим видам этого рода, которые обладают рядом селекционно важных свойств. Важнейшим методом обогащения генофонда культурных растений является отдаленная гибридизация, посредством которой идет передача ценных признаков от диких видов к культурным. Создание нового сорта -длительный процесс, который растягивается во времени на несколько лет. В связи с этим перед селекционерами стала задача получить чистые линии для создания гибрида перца с заданными свойствами, применяя современные биотехнологические методы, которые ускорят этот процесс. Одним из них является метод культуры микроспор, позволяющий массово получать гаплоидные растения, что сокращает время создания константных родительских линий. Материал и методика. Целью работы было создание межвидового гибрида острого перца (C. annuum L. х C. frutescens L.) с высокими декоративными свойствами, комплексом хозяйственно ценных признаков, с хорошими вкусовыми качествами. Исследования проводили в пленочной теплице ФГБНУ ФНЦО в Московской области. Материалом исследований явилась сортопопуляция острого перца Capsicum frutescens Cz-544-14, использованная в качестве отцовской линии, которая была гетерогенной и чистая линия C.annuum L. (Рб-551), созданная методом классической селекции. Результаты. Гибрид перца острого Fi Рождественский букет был создан в результате гибридизации видовых родительских форм, полученных различными методами (биотехнологическими и классическими). Для ускорения получения выровненной отцовской формы С. frutescens L. была использована технология удвоенных гаплоидов через культуру микроспор. В результате чего получены удвоенные гаплоидные растения, отвечающие запланированной модели (компактный низкий габитус, фиолетовая окраска плода в технической спелости и красная в биологической). Полученный гибрид сочетал все необходимые хозяйственные признаки: высокую декоративность, компактность, букетное расположение плодов, высокие вкусовые качества и аромат. Таким образом, использование в селекционном процессе отдаленной межвидовой гибридизации в сочетании с биотехнологическими подходами позволяет ускорить получение новых, форм перца острого, отвечающих запросам рынка.
Перец острый, виды перца, гибридизация, чистая линия, удвоенные гаплоиды, биотехнологические методы, растения-регенеранты
Короткий адрес: https://sciup.org/140257608
IDR: 140257608 | УДК: 635.649:631.526.325:573.6 | DOI: 10.18619/2072-9146-2021-4-27-33
Текст научной статьи Создание межвидового гибрида Capsicum annuum L. и C. frutescens L. с использованием биотехнологических подходов
П ерец является распространенной культурой, так как используется для потребления как в свежем виде, так и для приготовления специй. Род Capsicum происходит из тропической зоны Америки и включает в себя 38 видов, однако только 5 из них используют в сельском хозяйстве и выращивают для питания человека: C. annuum L., C. chinense Jacq.,C. frutescens L., C. pubescens Ruizet Pav., C. baccatum L. (var. pendulum) [1, 2]. В последнее время вместе с возрастающей популярностью перца C. annuum L. увеличивается интерес и к другим видам этого рода, которые обладают рядом селекционно важных свойств, спрос на новые сорта острого перца растет [3]. Важнейшим методом обогащения генофонда культурных растений является отдаленная гибридизация, посредством которой идет передача ценных признаков от диких видов к культурным. Она позволяет расширить спектр генетической изменчивости, а также дает возможность получения нетрадиционных форм с хозяйственно ценными признаками. К современным сортам предъявляют следующие требования: высокая товарность, качество плодов, декоративность, устойчивость к абиотическим и биотическим факторам окружающей среды. C. frutescens L. – один из интересных видов перца, который приобретает популярность благодаря высокому качеству плодов, устойчивости к ряду заболеваний и разнообразию форм [4, 5]. Использование в селекции видов перца с устойчивостью к болезням, с высоким содержанием биологически активных веществ позволяет создавать продуктивные гибриды, которые не только обладают повышенной питательной ценностью, но и устойчивостью к болезням, что позволяет не применять пестициды в процессе выращивания [6, 7, 8]. Виды перца C. frutescens L. и C. annuum L. хорошо скрещиваются с образованием фертильных гибридов.
Первым этапом создания гибридов является получение чистых родительских линий. Современным методом быстрого получения чистых линий перца является культура пыльников и микроспор. Для перца гаплоидные растения впервые были получены в культуре пыльников рядом исследователей: Kuo, George, Narayanaswamy и Wang [9, 10, 11]. Дальнейшие изучения факторов, влияющих на эффективность образования эмбриоидов в культуре микроспор и пыльников, показали, что важными факторами является генотип донорного растения [12, 13, 14] и питательная среда. В частности, было показано, что результативным является культивирование пыльников и микроспор на двухслойной среде [15, 16]. Кроме того, было показано, что добавление мальтозы к питательной среде с сахарозой оказывает положительное влияние на эмбриогенез,а добавление к агаризованной части среды активированного угля положительно влияет на правильное развитие эмбриоидов [15, 16, 17, 18].
Целью нашей работы являлось создание межвидового гибрида перца острого с высокими декоративными свойствами и комплексом хозяйственно ценных признаков, в том числе с высоким содержанием биологически активных веществ. Для ускорения получения чистых родительских линий была применена культура микроспор.
Материал и методы
Исследования проводили в пленочной теплице ФГБНУ ФНЦО в московской области. Материалом исследований явилась гетерогенная сортопопуляция перца острого C. frutescens L. Сз-544-14 и чистая линия C. annuum L. (Рб-551), созданная методом классической селекции.
Получение удвоенных гаплоидов. Удвоенные гаплоидные (DH) растения C. frutescens Сз-544-14 регенерировали в соответствии с протоколом, описанным ранее [19], с некоторыми модификациями.
Донорные растения выращивали при температуре 24-25°С и фотопериоде 16 часов, освещенность 10 000 люкс.
Стерилизация бутонов. Бутоны стерилизовали 30 секунд в 96% этаноле, затем в течение 10-15 минут в 50% водном растворе коммерческого препарата «Белизна» с добавлением Твина-20 (1 капля на 100 мл раствора), затем многократно промывали в стерильной дистиллированной воде до исчезновения пены.
Выделение микроспор. Стерильные бутоны помещали в питательную среду Nitsch и Nitsch с добавлением 13% сахарозы (30 бутонов в 6 мл среды). В пробирку так же помещали стерильный магнит, после чего на магнитной мешалке проводили измельчение бутонов. Суспензию микроспор фильтровали через нейлоновый фильтр с размером ячеек 40 µм и осаждали 5 мин на центрифуге типа 5804 R (Eppendorf) при 100 g. Осадок ресуспендировали в среде и повторяли центрифугирование. Промывку микроспор повторяли дважды.
Культивирование микроспор. После выделения и промывки микроспор культивирование их проводили на двухслойной среде Nitsch и Nitsch [20] с добавлением 13% сахарозы, 2% мальтозы, 30 мг/л глутатиона и с добавлением 1% активированного угля и 0,3% фитогеля в агаризованной части среды.
Получение растений-регенерантов. Появившиеся эмбриоиды на стадии крупных глобул, а также сердцевидной или торпедовидной фазах своего развития, помещали в чашки Петри на среду В-5, содержащую 2% сахарозы, 0,5 г/л активированного угля, 0,1 мг/л гиббереллиновой кислоты и 3,0 г/л фитогеля, в стеклянных или пластиковых сосудах [21]. Для образования вторичных эмбриоидов экспланты переносили на среду 1/2 МСМ с 2% сахарозы, 0,1 мг/л БАП и 3,0 г/л фитогеля [22]. Дальнейшее культивирование проводили на стеллажах с люминесцентными лампами при 25°С и фотопериоде 14 часов, освещенности 2,5 тыс. люкс. Развившиеся проростки переносили на среду 1/2 МС с 2% сахарозы, 0,5 г/л активированного угля и 3,0 г/л фитогеля для получения сеянцев [23]. Развившиеся укорененные растения переносили в сосуды с почвой для укоренения, первые 10 дней растения были прикрыты пластиковыми прозрачными стаканчиками для сохранения повышенной влажности воздуха и лучшей акклиматизации. Определение пло-идности проводили по числу хромосом в меристематических клетках кончиков корешков или в мейотиче-ских клетках микроспор. Однако для большого числа растений эти исследования трудоемки. Поэтому использовали и косвенный метод определения плоид-ности по числу хлоропластов в замыкающих клетках устьиц листьев перца [24].
Гибридизация. Учитывая, что перец является факультативным самоопылителем, все скрещивания проводили с кастрацией в фазе хорошо развитых бутонов за день до раскрытия цветка. Пыльцу для опыления выбирали с бутонов непосредственно перед их раскрытием и до растрескивания пыльников [25; 26]. Межвидовую гибридизацию проводили путем опыления отцовской пыльцой кастрированных цветков материнских растений. Кастрацию проводили в фазе хорошо развитых бутонов. Опыление выполняли в день кастрации в утренние часы, с 6 до 11, свежесобранной пыльцой с последующей изоляцией опыленных цветков. Завязавшиеся на момент скрещивания плоды и раскрытые цветки удаляли. В течение вегетации проводили фенологические наблюдения по фазам развития согласно методическим указаниям [27] и по методике UPOV [28]. Агротехника выращивания селекционного материала – общепринятая для условий Цен-тральной Нечерноземной зоны России. Статистическую обработку данных проводили по Доспехову [29] с использованием пакета прикладных программ MICROSOFTEXCEL 7,0.
Содержание пигментов определяли спектрофотометрическим методом. Хлорофиллы и каротиноиды экстрагировали 100%-ным ацетоном. Их концентрацию определяли по формулам Lichtethaler [30] и Hornero-Mendez [31].
Результаты и их обсуждение
Для решения поставленной цели было проведено изучение различных видовых форм перца острого ( C. annuum L., C. chinense Jacq., C. frutescens L., C. pubes-cens Ruizet Pav., C. baccatum L.) по морфологическим и хозяйственно ценным признакам: урожайность и содержание биологически активных веществ (БАВ).
Для создания гибрида были отобраны два образца – C. frutescens L. Сз-544-14 и C. annuum L. (Рб-551), анализ характеристик данных линий позволил предположить, что гибрид между данными линиями может обладать рядом преимуществ. Исходная популяция отцовской родительской линии C. frutescens L. Сз-544-14 была гетерогенной (табл. 1).
Классическими методами, на протяжении 5 лет, отбор форм с требуемыми характеристиками (Тип 1 – раннеспелые, детерминантного типа, компактные, высотой 25-30 см, с округлой формой плода, фиолетовой окраской в технической и красной – в биоло-гиче-ской спелости) не был успешен, не удавалось достичь выравненности. В качестве донора для культуры микроспор использовали растения с фенотипом, соответствующим заданным характеристикам родительской формы. Для исключения попадания соматических клеток в инкубационную среду было проведено изолирование микроспор из пыльников и культивирование их на двухслойной питательной среде. Через 30 дней от
Таблица 1. Гетерогенность популяции C. frutescens L. Сз-544-14
Table 1. Heterogeneity of the population of C. frutescens L. Cz-544-14
|
Растения |
Высота растения, см |
Тип растения |
Окраска листа |
Цветок |
Плод |
||
|
форма |
окраска |
масса |
|||||
|
Тип 1 |
25-30 |
детерминантное / компактное |
фиолетовая |
фиолетовый |
округлая |
красная |
6-10 |
|
Тип 2 |
100-120 |
детерминантное / раскидистое |
фиолетовая |
белый с фиолетовой каймой |
треугольная |
красная |
10-14 |
|
Тип 3 |
50-70 |
детерминантное / неопределенное |
темно-зеленая с антоцианом |
фиолетовый |
сердцевидная |
оранжевая |
6-12 |

Рис.1.Развитие эмбриоидов и растений регенерантов в культуре микроспор Capsicum frutescensL.Сз-544-14 А – эмбриоид на сердцевидной стадии развития, образовавшийся спустя 30 суток после начала инкубирования микроспор, B – развитие растений-регенерантов из эмбриоидов, полученных в культуре микроспор
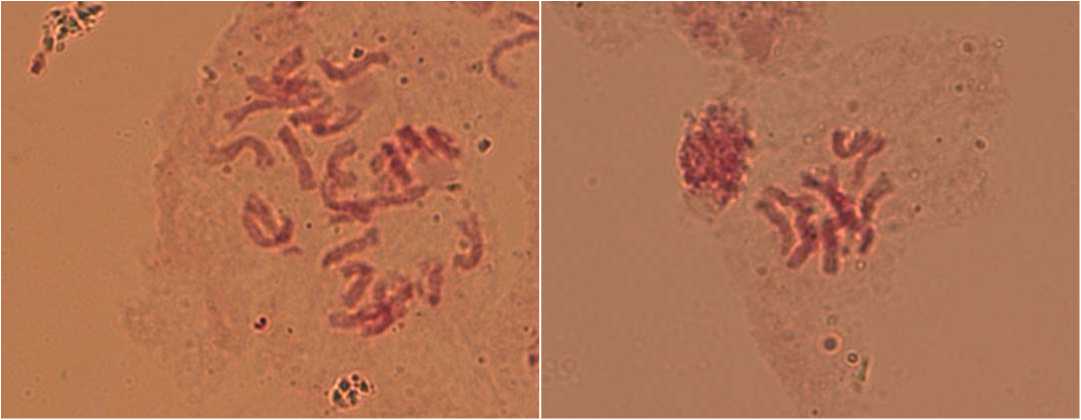
Удвоенное гаплоидное растение 2n=24
Гаплоидное растение n=12
Fig.2.CytologicalanalysisofC.frutescens L.Cz-544-14 ofregenerantplants
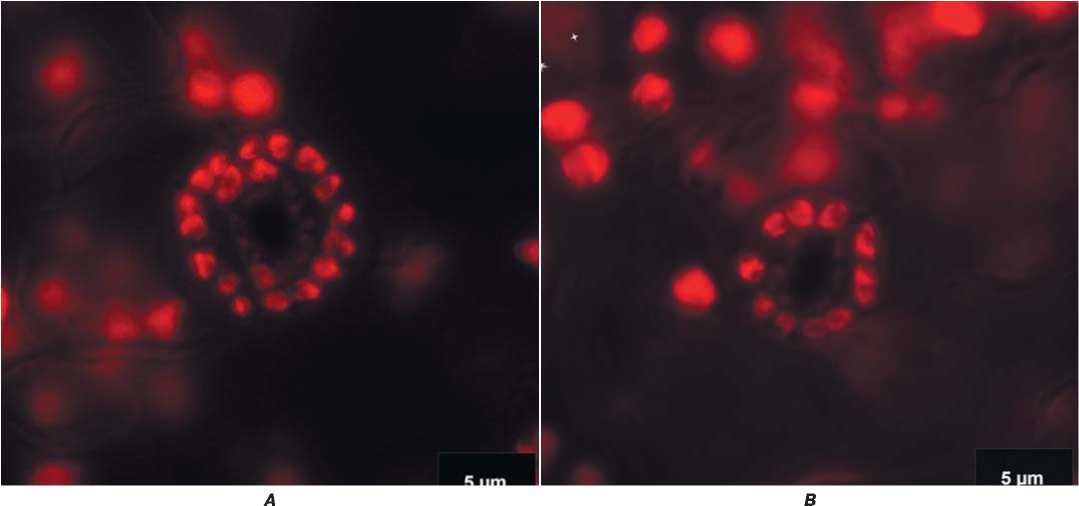
Рис.3.Определение числа хлоропластов в устьичных клетнах листа:А – удвоенное гаплоидное растение, число хлоропластов в 2 замыкающих устьичных клетках 20-22 шт.B –гаплоидное растение, число хлоропластов в 2 замыкающих устьичных клетках 10-12 шт.
Fig.3.Determination ofthe number ofchloroplastsin stomatalcellsofaleaf:A – Double haploid plant, number ofchloroplastsin 2 closing stomatalcells20-22 pcs.B – Haploid plant, number ofchloroplasts in 2 terminalstomatacells10-12
начала культивирования видимые глазом эмбриоиды (фаза развития от глобулярной до сердцевидной) были перенесены для дальнейшего развития на плотную питательную среду.
Линия 1 – растение детерминантного типа, раскидистое, лист темно-зеленый со слабым антоцианом,плоды треугольной формы, пониклые, в технической спелости фиолетовый, в биологической спелости красный.
Линия 2 – растение детерминантного типа, полурас-кидистое, лист темно-зеленый с антоцианом, плод сердцевидной формы, в технической спелости фиолетовый, в биологической спелости оранжевый.
Линия 3 – растение детерминантного типа, раскидистое, лист темно-зеленый с антоцианом, плод округлой формы, в технической спелости фиолетовый, в биологической спелости темно желтый.
Линия 5 – растение детерминантного типа, сильно раскидистое, лист зеленый без антоциана, плод округ- лой формы, в технической спелости сиреневый, в биологической спелости оранжевый.
Линия 6 – растение детерминантного типа,ком-пактное, лист зеленый без антоциана, плод округлой формы,в технической спелости фиолетовый,в биологической спелости оранжевый.
Линия 7 – растение детерминантного типа,ком-пактное, лист зеленый с сильным антоцианом, плод округлой формы,в технической спелости фиолето-вый,в биологической спелости темно-красный.
Наибольший интерес для дальнейшей селекции представляла Dh-1 Линия № 4 (рис. 5). Dh-1 Л-№4 – среднеспелая линия (период от всходов до начала технической спелости плодов составляет 125 дней). Растение кустовое, штамбовое, компактное, высотой 25-30 см. Лист мелкий, фиолетовый. Плоды вверхторчащие, округлые, гладкие, глянце-вые,в технической спелости – фиолетовые,в био-

Линия 1
Линия 2

Линия 3
Линия 5

Линия 6
Линия 7
Рис.4.Гаплоидные растения C.frutescensL.в период плодоношения

Рис.5.C.frutescensL. (Сз-544-14) линия Dh 4
Fig.5.C.frutescensL. (Sz-544-14) line Dh 4
логической спелости – красные. Толщина стенки плода 1,2 мм. Масса плода 8 г.
Отобранная линия C. frutescens L. (Сз-544-14) (Dh 4) была включена в гибридизацию с линией C.annuum L. (Рб-551) которая характеризуется супердетерминантным габитусом, высотой до 20-25 см, с характерными укороченными междоузлиями и цветками «букетного типа» обусловленными геном fa – пучковатость. Лист мелкий, ланцетовидный, зеленый. Цветок белый, плоды конусовидные, вверх торчащие, светло-зеленые в технической спелости, красные в биологической спелости. Длина плода 5,8 см, диаметр 0,5 см, средняя масса 2,0 г. (рис. 6).
В результате гибридизации был получен высокодекоративный гибрид перца острого со следующими характеристиками: растение компактное, низкое. Лист мелкий, тёмно-зелёный, морщинистый. Плоды направлены вверх, букетного типа, конусовидные, короткие, гладкие, глянцевые, окраска в технической спелости фиолетовая, в биологической – красная. Число гнёзд - 3. Масса плода – 8 г, толщина стенки - 1,8-2 мм. Количество плодов до 120

Рис.7.Гибрид перца острого F 1 Рождественский букет
Fig.7.The F1 pepper hybrid Christmas bouquet штук на одном растении, длина плода 3,8 см, диаметр 1,2 см. Плоды имеют приятный вкус и сильный перечный аромат, острота – 5 баллов (по 10 бальной шкале). Урожайность плодов – 1,1-1,2 кг/м2. Данный гибрид получил название F1 Рождественский букет и был включен в Государственный реестр селекционных достижений для использования в качестве горшечной культуры, как для декоративных, так и для пищевых целей (рис. 7).
Следует отметить, что межвидовой гибрид F 1 Рождественский букет характеризуется высокими биохимическими показателями по сравнению с родительскими формами (табл. 2)
Анализ содержания красных и желтых пигментов в плодах свидетельствует о своеобразии количественного содержания каротиноидов каждого вида. Содержание красных и желтых пигментов определяет не только окраску плода, но и ее интенсивность в зависимости от их соотношения. Родительские образцы и гибридная комбинация перца имели красную окраску плодов в фазе биологической спелости, поэтому содержание красных пигментов было преобладающим, однако наибольшее количество отмечено у полученного гибрида F 1 (0,501±0,025). Сумма каротиноидов у созданного гибрида в 1,6-1,8 раза выше, чем у родительских форм. Как известно, среди овощных культур одно из лидирующих мест по содержанию витамина С занимает перец, и его содержание не зависит от окраски плода и видовой принадлежности. Содержание витамина С у межвидового гибрида F 1 Рождественский букет составляет 370±26 мг%, что в 1,2-2,5 раза выше по сравнению с родительскими компонентами.
Заключение
Гибрид перца острого F 1 Рождественский букет был создан в результате гибридизации видовых родительских форм, полученных различными методами (биотехнологическими и классическими). Для ускорения получения выровненной отцовской формы С. frutescens L. была использована технология удвоенных гаплоидов через культуру микроспор. В результате чего получены удвоенные гаплоидные растения,
Таблица 2. Содержание биохимических показателей в межвидовом гибриде и родительских формах Table 2. Content of biochemical parameters in the interspecific hybrid and parental forms
Об авторах:
Мубариз Иса оглы Мамедов – доктор с.-х. наук
Алексей Алексеевич Байков – старший научный сотрудник Анна Алексеевна Матюкина – старший научный сотрудник
Aboutthe authors:
Elena A.Dzhos – Cand. Sci. (Agriculture),
,
Darya V.Shumilina – Cand. Sci. (Biology), Senior Researcher, , Olga N.Pyshnaya – Doc. Sci. (Agriculture),
MubarisI.Mamedov – Doc. Sci. (Agriculture)
Alexey A.Baikov – Senior Researcher
Anna A.Matyukina – Senior Researcher
Список литературы Создание межвидового гибрида Capsicum annuum L. и C. frutescens L. с использованием биотехнологических подходов
- Moscone E.A., Scaldaferro M.A., Grabiele M.A., Cecchini N.M., Sa´nchez G.Y., Jarret R., Davin˜a J.R., Ducasse D.A., Barboza G.E., Ehrendorfer F. The evolution of chili peppers (Capsi-cum-Solanaceae): a cytogenetic perspective. Acta Hort. 2007;(745):137-170. http://dx.doi.org/10.17660/ActaHortic.2007.745.5
- Ibiza V.P., Blanca J., Can˜izares J., Nuez F. Taxyonom and genetic diversity of domesti-cated Capsicum species in the Andean region. Genetic Resources and Crop. 2012;(59):1077-1088. https://doi.org/10.1007/s10722-011-9744-z.
- Carvalho S.I.C., C.F. Ragassi, Faleiro F.G., Buso G.S.C., Bianchetti L.B., Lima M.F., Re-ifschneider F.J.B. and Ribeiro C.S.C. Establishment of Capsicum frutescens core collections based on morphological and molecular descriptors and on virus incidence. Genetics and Molec-ular Research. 19(1):gmr18503:1-19.
- Sudre´ C.P., Gonc¸alves S.A., Rodrigues R., do AmaralJu´nior A.T., Riva-Souza E.M., Bento S.C. Genetic variability in domesticated Capsicum spp. as assessed by morphological and agronomic data in mixed statistical analysis. Genetics Mol Res. 2010;9(1):283-94. https://doi.org/10.4238/vol9-1gmr698
- Henrique Kuhn Massot Padilha, Rosa Lía Barbieri, Crop Science Dept., Capão do Leão. Plant breeding of chili peppers (Capsicum, Solanaceae) – A review. Australian Journal of Basic and Applied Sciences. 2016;10(15):148-154
- Silva S.A.M., Rodrigues R., Goncalves L.S.A., Sudre C.P., Bento C.S., Carmo M.G.F., Medeiros A.M. Resistance in Capsicum spp. to anthracnose affected by different stages of fruit development during pre-and post-harvest. Tropical Plant Pathology. 2014;39(4):335-341. https://doi.org/10.1590/S1982-56762014000400009
- Ilodibia C.V., C.E. Ugwoke T.P. Egboka E.E. Akachukwu U.M. ChukwumaandB.O. Aziagba. Breeding Pepper for Enhanced Food Nutrients. Asian Journal of Crop Science. 2015;7(3):214-218. DOI: 10.3923/ajcs.2015.214.218
- Gémes Juhász A. and Sági Zs. Strategies in pepper (Capsicum annuum L.) hybrid breed-ing. Acta Hortic. 2020;(1282):441-446. https://doi.org/10.17660/ActaHortic.2020.1282.66
- Kuo J.S., Wang Y.Y., Chien N.F., et al. Investigation on the anther culture in vitro of Ni-cotiana tabacum L. and Capsicum annuum L. Acta Bot. Sinica. 1973;(15):43-47.
- George L, Narayanaswamy S. Haploid Capsicum through experimental androgenesis. Protoplasma. 1973;(78):467–470.
- Wang Y.Y., Sun C.S., Wang C.C., et al. The induction of the pollen plantlets of triticale and Capsicum annuum from anther culture. Sci. Sinica. 1973;(16):147-151.
- Kristiansen K., Andersen S.B. Effects of donor plant temperature, photoperiod, and age on anther culture response of Capsicum annuum L. Euphytica. 1993;(67):105-109.
- Mityko´ J., Andra´sfalvy A., Csille´ry G., Fa´ri M. Anther culture response in different genotypes and F1 hybrids of pepper (Capsicum annuum L.). Plant Breed. 1995;(114):78–80. https://doi.org/10.1111/j.1439-0523.1995.tb00764.x
- Rodeva V., Koleva-Gudeva L., Grozeva S., Traikova F. Obtaining of haploids in anther culture of pepper Capsicum annuum L. and their including in the breeding process. Goce Delchev Univ Stip Fac Agric Yearbook. 2007;(7):7–17.
- Dolcet-Sanjuan R., Claveira E., Huerta A. Androgenesis in Capsicum annuum L. effects of carbohydrate and carbon dioxide enrichment. J Am SocHortSci. 1997;(122):468–475. https://doi.org/10.21273/JASHS.122.4.468
- Gyulai G., G´emesn´e J.A., S´agi Z.S., Venczel G., Pint´er P., Krist´of Z., T¨orj´ek O., Heszky L., Bottka S., Kriss J., Zatyk´o L. Doubled haploid development and PCRanalysis of F1 hy-bridderived DH-R2 paprika (Capsicum annuum L.) lines. J PlantPhysiol. 2000;(156):168–174.
- Supena E.D.J., Muswita W., Suharsono S., Custers J.B.M. Evaluation of crucial factors for implementing shedmicrospore culture of Indonesian hot pepper (Capsicum annuum L.) cul-tivars. Sci Hortic (Amsterdam). 2006b;(107):226–232. https://doi.org/10.1016/j.scienta.2005.08.006
- Parra-Vega V., Renau-Morata B., Sifres A., Seguı´-Simarro J.M. Stress treatments and in vitro culture conditions influence microspore embryogenesis and growth of callus from an-ther walls of sweet pepper (Capsicum annuum L.). Plant Cell Tiss Org Cult. 2013;(112):353–360. https://doi.org/10. 1007/s11240-012-0242-6
- Пышная О.Н., Шумилина Д.В., Супрунова Т.П. Получение удвоенных гаплоидных линий перца (Capsicum annuum L.) через культуры пыльников/микроспор in vitro: Методические рекомендации. Москва: Всероссийский научно-исследовательский институт селекции и семеноводства овощных культур Россельхозакадемии, 2012. 36 с. ISBN 9785901695555 [Pyshnaya O.N., Shumilina D.V., Suprunova T.P. Obtaining doubled haploid lines of pepper (Capsicum annuum L.) through in vitro anther/microspore cultures: Guidelines. Moscow, All-Russian Research Institute of Vegetable Breeding and Seed Production, Russian Academy of Agricultural Sciences Publ. 2012. 36 p. (In Russ.)]
- Nitsch J.P., Nitsch C. Haploid plants from pollen grains. Science. 1969;(163):85–85.
- Gamborg O., Eveleigh D. Culture methods and detection of glucanases in suspension cultures of wheat and barley. Canadian Journal of Biochemistry. 1968. https://doi.org/10.1139/o68-063
- Masuda K., Kikuta Y., Okazawa Y. A revision of the medium for somatic embryogenesis in carrot suspension culture. Journal of the Faculty of Agriculture, Hokkaido University. 1981;60(3):183-193.
- Murashige S., Skoog F. A revised medium for rapid growth and bioassays with tobac-co tissue cultures. PhysiolPlant. 1962;(15):473–497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
- Shumilina D., Kornyukhin D., Domblides E., Soldatenko A., Artemyeva A. Effects of Genotype and Culture Conditions on Microspore Embryogenesis and Plant Regeneration in Brassica rapa ssp. rapa L. Plants. 2020; 9(2):278. https://doi.org/10.3390/plants9020278
- Алпатьев А.В. Перцы и баклажаны. М., 1952. 80 с. [Alpatiev A.V. Peppers and au-bergines. Moscow, 1952. 80 p. (In Russ.)]
- Кружилин А.С., Шведская З.М. Помидоры, перцы, баклажаны. Биология и агротехника. М.: Россельхозиздат, 1972. 144 с. [Kruzhilin A.S., Shvedskaya Z.M. Tomatoes, pep-pers and aubergines. Biology and farming techniques. Moscow, Rosselkhozizdat Publ. 1972. 144 p. (In Russ.)]
- Мамедов М.И., Пивоваров В.Ф., Пышная О.Н. Селекция томата, перца и баклажана на адаптивность. Москва: Всероссийский научно-исследовательский институт селекции и семеноводства овощных культур Россельхозакадемии, 2002. 441 с. [Mamedov M.I., Pivovarov V.F., Pyshnaya O.N.. Selection of tomato, pepper and eggplant for adaptability. Moscow, All-Russian Research Institute of Vegetable Breeding and Seed Production, Russian Academy of Agricultural Sciences Publ. 2002. 441 p. (In Russ.)]
- 28.Официальный сайт Госсорткомиссии. Режим доступа: http://gossort.com/22-metodiki-ispytaniy-na-oos.html [Official website of the Gossort Commission. Available from: http://gossort.com/22-metodiki-ispytaniy-na-oos.html. [Accessed 15th July 2021]]
- Доспехов Б.А. Методика полевого опыта. М.: Агропромиздат, 1975. 315 с. [Dospekhov B.A. Methodology for the field experience. Moscow, Agropromizdat. 1975. 315 p. (In Russ.)]
- Lichtenthaler H.K., Buschmann C. Chlorophylls and carotenoids: Measurement and characterisation by UV-VIS. Current Protocols in Food Analytical Chemistry (CPFA), (Supplement 1), F4.3.1 - F 4.3.8 (2001) (John Wiley, New York). DOI: 10.1002/0471142913.faf0403s01
- Hornero-Mendez D., Minguez-Mosquera M.I. Rapid spectrophotometric determination of red and yellow isochromic fractions in paprika and red pepper oleoresins. J. Agric. Food Chem. 2001;(49):3584-3588. DOI: 10.1021/jf010400l


