Создание ортотопических опухолей в молочной железе мышей BALB/C NUDE клетками рака молочной железы человека MCF-7 и ее VDAC-дефицитными производными
Автор: Мндлян Е.Ю., Семушина С.Г., Ржевский Д.И., Новикова Н.И., Калабина Е.А., Комков Д.С., Масленникова А.Ю., Мурашев А.Н., Холмухамедов Э.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Цель исследования - изучить опухолеобразующую активность «диких» клеток mcF-7, несущих полный набор поринов (Vdac1, Vdac2, Vdac3), а также их генетически модифицированных клеток, из которых удалена одна из изоформ (mcF-7 Vdac1 Ko, mcF-7 Vdac2 Ko, mcF-7 Vdac3 Ko). Материал и методы. Исследование направлено на создание животной модели ортотопических опухолей в молочной железе иммунодефицитных мышей BalB/c Nude путем имплантации суспензии клеток рака молочной железы человека (mcF-7) и производных этих клеток, полученных нокаутом одной из выбранных изоформ митохондриальных поринов (Vdac1, Vdac2 или Vdac3). Опухоли создавались путем инъекции в жировую ткань молочной железы мышей BalB/c Nude суспензии клеточных линий либо диких mcF-7 (содержащих все три изоформы поринов, Vdac1, Vdac2 и Vdac3) либо ее Vdac-дефицитных производных «mcF-7 Vdac1 Ko», «mcF-7 Vdac2 Ko» и «mcF-7 Vdac3 Ko» в дозе 4х106 клеток на одну инъекцию. Проведён патоморфологический анализ места имплантации опухолевых клеток, самой опухоли, а также органов брюшной и грудной полости. результаты. Показана возможность успешного создания ортотопических опухолей в жировой ткани иммунодефицитных голых мышей BalB/c Nude эпителиальными клетками рака молочной железы человека «mcF-7 Wt», содержащими полный набор изоформ митохондриальных поринов и ее Vdac-дефицитными производными. Опухолеобразующая активность имплантированных клеток коррелирует с их цитотоксическим действием на внутренние органы животного. По результатам патоморфологического анализа можно сделать вывод о том, что за исключением клеток типа «mcF-7 Vdac1 Ko», которые не образовали опухолей, все остальные имплантированные клеточные культуры «mcF-7 Wt», «mcF-7 Vdac2 Ko» и «mcF-7 Vdac3 Ko» вызывали патологические изменения состояния легких, печени и селезенки, а также наличие других опухолевидных новообразований. заключение. Полученные данные будут использованы для оптимизации объема инъекции и количества клеток, а также для уточнения динамики роста опухолей, пригодного для изучения действия противоопухолевых препаратов на опухолях, образованных клетками рака молочной железы человека (mcF-7) и ее генетически модифицированными Vdac-дефицитными производными.
Клеточная культура mcf-7, митохондриальные порины (vdac1, мыши balb/c nude, ортотопическая опухоль
Короткий адрес: https://sciup.org/140290559
IDR: 140290559 | УДК: 618.19-006.6-091.8]-092.9 | DOI: 10.21294/1814-4861-2022-21-1-72-84
Текст научной статьи Создание ортотопических опухолей в молочной железе мышей BALB/C NUDE клетками рака молочной железы человека MCF-7 и ее VDAC-дефицитными производными
Рак молочной железы остается одной из наиболее актуальных проблем современной онкологии, занимая лидирующее положение среди онкологических заболеваний [1]. Поиск и разработка новых препаратов и протоколов лечения проводятся с широким использованием животных моделей, среди которых наиболее распространенными являются модели иммунодефицитных мышей [2–4]. Удобством этих моделей является особый иммунодефицитный статус этих животных, благодаря чему они не способны отторгать чужеродный биологический материал, что позволяет успешно создавать в них опухоли из человеческих кле- ток или ксенотрансплантатов [5]. Несомненным преимуществом мышиных животных моделей является возможность сравнения опухолеобразующей активности генетически-модифицированных клеточных линий, позволяя, таким образом, создание эффективных доклинических моделей [2, 5, 6]. Дополнительным достоинством животных моделей по сравнению с моделями культуры клеток является то обстоятельство, что опухолевые модели с использованием иммунодефицитных животных представляют клиническую картину более адекватно, чем исследования, выполненные на клеточных культурах [2, 5]. В последние годы резко возрос интерес к роли митохондрий в механизмах таблица 1/table 1
список последовательностей гидовых рнк для митохондриальных поринов list of guide RNa sequences for mitochondrial porins
Целью исследования явилось изучение опухолеобразующей активности «диких» клеток MCF-7, несущих полный набор поринов (VDAC1, VDAC2, VDAC3), а также их генетически модифицированных клеток, из которых удалена одна из изоформ (MCF-7 VDAC1 KO, MCF-7 VDAC2 KO, MCF-7 VDAC3 KO).
Экспериментальная часть
Культура клеток MCF-7
Клеточная линия эпителиальных клеток рака молочной железы человека (MCF-7), экспрессирующих эстрогеновые, прогестероновые и глюкокортикоидные рецепторы, была приобретена из Коллекции культур клеток позвоночных ФГБУ «Институт цитологии» РАН, г. Санкт-Петербург, <>. Клетки инкубировали в инкубаторе для культивирования клеток животных и человека, 5 % CO2/95 %-воздух, 95 % влажности, 37°C, в среде инкубации DMEM (D5648, Sigma USA) с добавлением 10 % фетальной бычьей сыворотки (10500064, Gibco, Germany), гентамицина (2 мл/л, Дальхимфарм) и 1 % смеси пенициллин/ стрептомицин, как описано в работе [18].
Получение VDAC-нокаутированных клеточных производных MCF-7
Нокаут генов митохондриальных поринов (vdac1, vdac2 и vdac3) в клетках рака молочной железы человека был проведен методом SORTS, как описано в работе [19]. Вкратце, с помощью CRISPR/Cas9 осуществляли биаллельный нокин двух коротких маркеров селекции – эпитопных тагов Flag и HA – в ген-мишень, а последовательности гидовых РНК для митохондриальных по-ринов были отобраны с использованием ресурса Массачусетского технологического института (MIT) , представлены в табл. 1.
Для экспрессии эпитопных тагов на поверхности клетки их встраивали в короткую молекулу-носитель CD52 и для нокаута гена-мишени после кодирующей части добавляли короткий терминатор транскрипции. Условия и технические детали получения клеток, модифицированных по выбранным генам (изоформам митохондриальных поринов) в клеточной линии MCF-7, приведены в работах [19–21]. Необходимые клетки-нокауты отбирались с помощью антител к эпитопным тагам методом проточной цитофлуориметрии. Таргетные последовательности гидовой РНК выделены жирным курсивом. Прямой и обратный праймеры отжигались друг на друга и клонировались в плазмиду для экспрессии гидовой РНК pKS-gRNA-BB после обработки рестриктазой Bbs I . Для ПЦР-амплификации донорской ДНК использовали праймеры, приведенные в табл. 2. Красным цветом отмечена замена нуклеотида, инактивирующая эндогенный старт-кодон.
Подготовка клеточных культур
Культуры клеток MCF-7, дикого типа (WT) и VDAC-дефицитные производные этих клеток (VDAC1 KO, VDAC2 KO и VDAC3 KO), высаженные в раздельные чашки Петри, культивировали в течение 4 сут без смены среды инкубации до достижения 80 % конфлюэнтности, как описано в [18]. После трипсинизации и отмывки от трипсина в среде инкубации клетки подсчитывались и переносились в фосфатный буфер для инъекций.
таблица 2/table 2
список праймеров, использованных для ПЦр-амплификации донорской Днк list of primers used for pcR amplification of donor dNa
Праймеры/ Primers
Последовательности/Sequences
5’-VDAC1-in
CAATGCATTTATTCTGGTGATTCTTTTATCATAGCAGAAG T TGGCTGTGCCACCCACGTATGCCGA TCTTGGCAAATCTGCCAGGGATGTCTTCACCACCATGAAGCGCTTCC
3’-VDAC1-in
GCTGACCTACCCAGGTCTCCTAAACAGTTATCGGTAAAGTCTCAAACATGCCAACTCAGTCTGTG AGCTGAAAGGCACCCCCTCTCTGCAACACTCACCACACAAAAAACCAACACAC
5'-VDAC2-in
GGCCCTTTGACCCCAGCTTACCGCACTTCTTGTCCCTCCCGCAGATTCCCCTCTTCCCGCGGCCTC GCC T TGGCGACCCACGGACAGACTTGCGCGCGCCACCATGAAGCGCTTCC
3'-VDAC2-in
GCAGCCGAATTTCCAAGTTCTTGGAAAGATAGGGGGAAACAAACTGGGTTTCTGGTCGACAGGC TTCGACTCTCCGCCGCCCCATCCCGCAGAGATCCACACAAAAAACCAACACAC
5’-VDAC3-in
CACAGGATTAAACAGCAGAAGAACTGTGGGTGAATAAATACTAAATGGTTATTTTTATTCCTTTGC CCTGTTTTTCTTTATAAGAT T TGTGTAACACACCACCATGAAGCGCTTCC
3’-VDAC3-in
CACAGTAGGCATTCAACACTAACCTTTACCCCAAACTGGAAAGTTACAATAGCATACTTACCATAT CCTTTGTTGAAGACATCCTTAGCAGCCTTTCCACACAAAAAACCAACACAC
Животные
В исследовании использованы самки иммунодефицитных мышей BALB/c Nude (SPF Питомник лабораторных животных «Пущино», Россия) в возрасте 20–24 нед. Данная линия мышей является наиболее распространенной при изучении опухолеобразующей активности клеточных линий человека [4, 22, 23]. Животные содержались в стандартных условиях барьерной зоны в соответствии с «Программой по уходу и использованию животных» Лаборатории биологических испытаний ФИБХ РАН (г. Пущино), имеющей аккредитацию AAALAC (Association for Assessment and Accreditation of Laboratory Animal Care). Манипуляции с животными проводили в соответствии с Протоколом-заявкой на животных, рассмотренным и одобренным «Институтской комиссией по контролю за содержанием и использованием лабораторных животных» ФИБХ РАН. Животные были распределены по группам в соответствии с типом культуры клеток (Wild type, VDAC1 KO, VDAC2 KO и VDAC3 KO), и каждая группа содержала по 9 самок мышей BALB/c Nude. До введения опухолевых клеток, а также на протяжении всего эксперимента животные проходили обязательную для создания ортотопических опухолей эстрогенную адаптацию путем наложения на кожу животного пластыря с эстрадиолом для гормонозаместительной терапии Климара® (Bayer Pharmaceuticals, Россия). Пластырь, содержащий 10 мкг активного вещества, накладывали на область холки и спины и закрепляли фиксирующей повязкой вокруг грудной клетки мыши [4, 24, 25]. Эстрогенная адаптация состояла из двух циклов: аппликация 12 дней (пластырь приложен к коже мыши), затем 2 дня перерыва (пластырь снимали), чтобы исключить возможность повреждения кожи. Необходимый уровень эстрогенного фона определяли по наступлению постоянного эструса, который определялся через 24–48 ч после первичного наложения пластыря микроскопией влагалищных мазков [26].
Создание ортотопической опухоли
Для создания ортотопических опухолей в настоящей работе суспензию живых клеток вводили в жировую подушку молочной железы, как описано в работе [6]. Анестезия животных осуществлялась путем внутримышечной инъекции смеси золотил + ксилазин в дозе 20 мг/кг и 5 мг/кг живого веса, соответственно [25]. Наркотизированную мышь фиксировали в положении на спине, делали разрез кожи длиной 3–5 мм на 3–4 мм каудальнее 4-го соска, слегка оттягивая сосок вверх анатомическим пинцетом и аккуратно (без повреждения) небольшую часть жировой подушечки (2–3 мм) вытягивали через полученный разрез. При помощи инсулинового шприца и в соответствии с групповой принадлежностью в жировую ткань мыши инъецировали 50 мкл суспензии 4×106 опухолевых клеток в стерильном физиологическом растворе, после инъекции жировую подушечку отпускали, давая ей возможность самопроизвольно вернуться на место, а операционную рану закрывали швом при помощи атравматической хирургической полиамидной нити Капроаг («Репромед», Россия). Дважды в неделю каждое животное взвешивали, определяли размер образовавшихся опухолевых узлов в 2 проекциях с помощью электронного штангенциркуля и полученные данные использовали для оценки динамики роста опухоли.
Патоморфологический анализ органов
Забор органов (образцы опухоли с окружающими тканями молочной железы, регионарные лимфоузлы, легкие, печень и селезёнка) осуществляли, предварительно проведя процедуру эвтаназии в CO2 камере. В каждой группе образцы брали от трёх животных и анализировали индивидуально. Для патоморфологического исследования органы фиксировали в 10 % нейтральном формалине. Обработку материала проводили по общепринятой методике: последовательное обезвоживание в растворах спиртов возрастающей концентрации последующей обработкой хлороформом и заливка в парафиновые блоки. Парафиновые срезы толщиной 10–15 мкм переносили на стекло и окрашивали гематоксилином и эозином. Светооптическое исследование и микрофотосъемку проводили на микроскопе проходящего света DMLA Leica (Германия), видеокамерой Photometrics Cool SNAP cf (США), используя программное обеспечение «Мекос» (Россия). Для оценки выраженности гистологических изменений в органах и морфологической оценки опухолевых узлов использовалась оценочная шкала Эванса [27].
Результаты и обсуждение
Создание опухолей и динамика роста опухолей
Размеры каждой опухоли в жировой ткани молочной железы мыши измерялись два раза в неделю в 2 проекциях (длина и ширина) с помощью электронного штангенциркуля. Объем опухоли рассчитывали по формуле: V (мм3) = длина (мм) × ширина (мм) × ширина (мм) × ½ [6]. Результаты динамики роста опухоли в каждой группе животных по каждому типу инокулированных клеток представлены на рис. 1 как среднее значение объёма опухоли в каждой группе ± стандартное отклонение.
Изменение размера опухолей в молочной железе мышей имплантированных клетками дикого типа (WT) и клетками, дефицитными по VDAC1 KO, VDAC2 KO и VDAC3 KO, показано на рис. 1. В жировую ткань молочной железы каждого животного инъецировали 50 мкл суспензии клеток, содержащей 4×106 опухолевых клеток в стерильном физиологическом растворе. Показаны средние размеры опухолей ± StDev, полученные по меньшей мере в трех независимых измерениях.
Интенсивнее всего опухоли развивались в группе животных, которым инокулировали суспензию клеток MCF-7 дикого типа (WT). Скорость роста опухоли в этой группе была наибольшей среди всех инокулированных типов клеток и к пятой неделе (завершение опыта) достигала величины 1801 ± 369 мм3 (рис. 1, кривая «WT», n=6). Следующий по интенсивности рост опухолей наблюдался в группе животных, которым опухоли создавались инокуляцией клеток MCF-7, дефицитных по содержанию изоформы VDAC3 (рис. 1, кривая «VDAC3 KO»). Скорость роста опухоли в этой группе животных была ниже той, которая наблюдалась для опухолей, полученных клетками дикого типа, и к пятой неделе после инокуляции суспензии клеток размер опухоли достигал величины 1726 ± 498 мм3 (рис. 1, кривая «VDAC3 KO», n=5). Также к формированию опухоли привела инокуляция клеток MCF-7, дефицитных по митохондриальному по-рину VDAC2 (рис. 1, кривая «VDAC2 KO»), и к пятой неделе после инокуляции клеток средний размер опухоли достигал величины, близкой к группе с диким типом клеток, и был равен 1809 ± 654 мм3 (рис. 1, кривая «VDAC2 KO», n=4). При инокуляции животным клеток MCF-7, дефицитных по митохондриальному порину VDAC1, к пятой неделе после инокуляции опухолей не образовалось (рис. 1, кривая «VDAC1 KO»). Таким образом, из всех четырех типов клеток MCF-7 (WT, VDAC1 KO, VDAC2 KO, VDAC3 KO) только три типа клеток, а именно, дикие клетки MCF-7 (WT), а также две линии «VDAC2» и «VDAC3» дефицитных клеток MCF-7, образовали полноценные твердые опухоли. Сравнение размеров опухолей показало, что дикий тип растет быстрее, чем опухоли из клеток MCF-7 VDAC3 KO и MCF-7 VDAC2 KO (рис. 1, кривые «WT», «VDAC3 KO» и «VDAC2 KO»). Из данных, приведенных на рис. 1, видно, что после 3,5 нед инокуляции клеток, скорости развития образовавшихся опухолей выровнялись, и к моменту проведения патоморфологического анализа животных находились в единой области роста и объема опухолей. У животных, которым были инокулированы клетки MCF-7 VDAC 1 KO, появления и развития опухолей в молочной железе в течение месяца не наблюдалось.
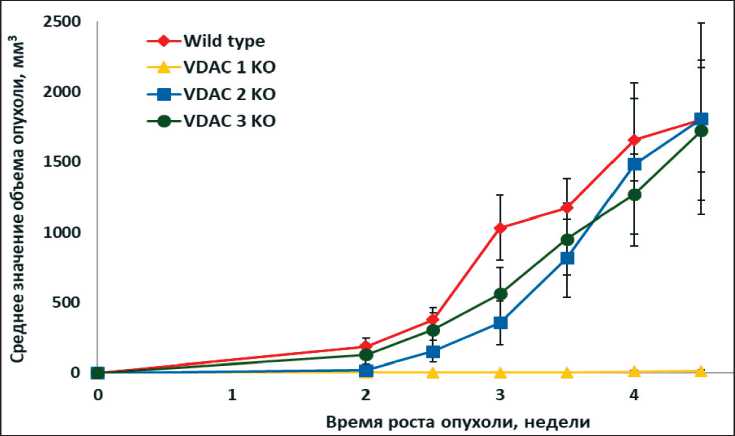
Рис. 1. Графики роста опухолей в группах животных после инокуляции опухолевых клеток MCF-7 и их VDAC-дефицитных производных Fig. 1. Tumor growth curves in groups of animals after inoculation of MCF-7 tumor cells and their VDAC-deficient derivatives
Выживаемость мышей в группах после инокуляции клеточной линии MCF-7 и VDAC-дефицитных производных
Отслеживание динамики выживаемости животных после инокуляции клеток позволяет определить временные интервалы и правильно распределить сроки лечения. Кривые длительности жизни (выживаемости) животных в каждой группе мышей, которым инокулировали клетки линии MCF-7 или ее модифицированные производные (Wild type, VDAC1 KO, VDAC2 KO или VDAC3 KO), показаны на рис. 2. Наибольшая выживаемость животных в первые три недели наблюдалась у мышей, у которых опухоль создавалась дикими клетками MCF-7 (рис. 2, «Wild type»,). Аналогичную картину демонстрировали мыши, в жировую ткань которых были имплантированы клеточные линии, дефицитные по содержанию поринов VDAC1 и VDAC3 (рис. 2, «VDAC1 KO» и «VDAC3 KO»). В этих трех группах за первые 3 нед погибло всего одно животное. Причиной гибели этой мыши могла быть избыточная механическая нагрузка на тело животного, которая создавалась дополнительной фиксирующей повязкой вокруг грудной клетки мыши, необходимой для закрепления эстроген-содержащего пластыря.
Животные в группе с опухолями, образованными клетками, дефицитными по порину 2 («VDAC2 KO»), умирали в течение 2 нед после инокуляции клеток, до формирования опухоли (рис. 2), что может быть также связано с индивидуальными особенностями иммунодефицитных мышей линии BALB/c Nude, а также с гормональной терапией, проходившей на фоне всего эксперимента. Среди всех мышей, инокулированных клеточными линиями, только клетки, дефицитные по порину-1 («VDAC1 KO»), не образовывали опухолей, животные показали устойчивое выживание. Таким образом, полученные данные по переносимости искусственно созданных ортотопических опухолей в молочных железах животных показали, что наименее агрессивными являются опухоли, образованные имплантированными клетками MCF-7, модифицированными по экспрессии митохондриального порина-1 («VDAC1 KO»), и, напротив, клетки дикого типа MCF-7 и ее клеточные производные, дефицитные по содержанию митохондриального порина-2 и/или порина-3 («Wild type», «VDAC2 KO» или «VDAC3 KO»), способны образовывать солидные опухоли.
Патоморфологический анализ органов мышей
После вскрытия было видно, что у животных в каждой группе подкожно-жировой слой истощён. Для гистологии были взяты образцы ткани с опухолью и прилегающими паховыми лимфоузлами. Опухоли в группах «WT», «VDAC2 KO» и «VDAC3 KO» хорошо визуализировались, плотные узлы, которые часто сращены с брюшной стенкой, и в области между маткой и мочевым пузырём обнаруживались опухолевидные новообразования. На момент проведения некропсии у животных в группе мышей с привитыми клетками «VDAC1 KO» со дня инокуляции суспензии опухолевых клеток не наблюдалось никаких внешних изменений и признаков наличия опухоли. При вскрытии животных в молочных железах и/или жировых тканях мышей заметных опухолевидных образований не обнаруживалось, и единственные и наиболее ярко выраженные изменения были обнаружены в яичниках, а при осмотре была зафиксирована гиперплазия яичников, которая могла быть спровоцирована избыточной эстрогеновой стимуляцией и обусловленным этим состоянием гиперэструса у животных.
Анализ состояния тканей легких показал, что все исследованные ткани имели нормальный
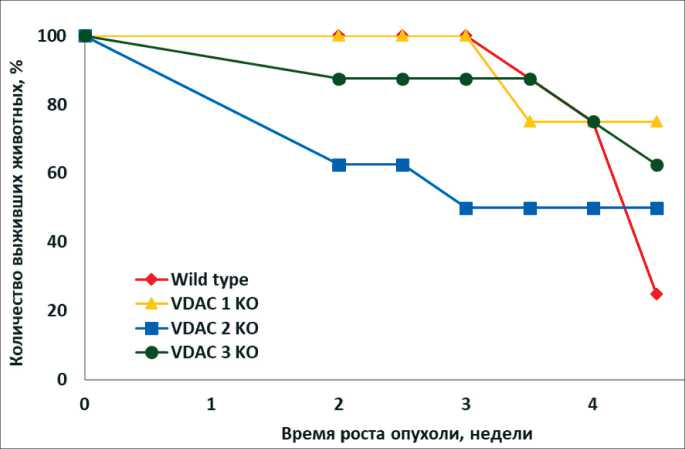
Рис. 2. Выживаемость мышей в группах после инокуляции клеточной линии MCF-7 и VDAC-дефицитных производных в жировую ткань молочной железы Fig. 2. Survival curves of mice in groups after inoculation of the MCF-7 cells and VDAC-deficient derivatives into mammary fad pads
светло-розовый оттенок, без каких-либо признаков метастазирования. Наиболее характерным и общим для всех исследованных тканей легкого было наличие заметных структурных изменений легких, в результате чего они выглядели спавшимися и деформированными со сросшимися отделами. Такие структурные изменения характерны для условий, когда тело животного оказывается сжатым внешними воздействиями, например, могут быть обусловлены ношением жилетов, поддерживающих гормональный пластырь, которые создавали сдавливание грудной клетки, что, как следствие, могло привести к сращению и слипанию отделов легкого [28].
Состояние печени во всех группах животных, контрольных и имплантированных клетками MCF-7, зависело от типа имплантированных клеток. У всех мышей, которым были инокулированы клетки линии «MCF-7 VDAC1 KO», и у которых мы не обнаружили образование сформированного опухолевого узла, печень внешне выглядела здоровой и по цвету, и по форме находилась в норме. В остальных же трех группах животных, в которых развились опухоли из клеточных линий «MCF-7 WT», «MCF-7 VDAC2 KO», «MCF-7 VDAC3 KO», печень отличалась от печени контрольных животных, заметно видоизменена по форме и была серого цвета. В ткани печени у всех животных из этих трех групп были обнаружены очаговые метастатические зоны, различной величины и формы. Наиболее сильные изменения в морфологии печени были обнаружены в группе мышей с имплантированными клетками «MCF-7 VDAC2 KO», и в печени этих животных преобладали отчётливо обнаруживаемые множественные метастатические области по всей поверхности органа.
Результаты осмотра селезенки животных показали, что развитие опухолей у животных привело к значительным морфологическим изменениям в селезёнке. В группе мышей, имплантированных клетками «MCF-7 VDAC1 KO», в которой опухолей не образовалось, селезёнка находилась в норме и никаких ярко выраженных внешних изменений цвета и формы не наблюдалось. Наиболее выраженные различия состояния селезёнки наблюдались в других группах. Так, у тех мышей, которым были имплантированы клеточные линии «MCF-7 WT», «MCF-7 VDAC2 KO» и «MCF-7 VDAC3 KO», селезёнка внешне выглядела обесцвеченной и рыхлой, с сероватым отливом, со множественными белыми и тёмными вкраплениями. У некоторых животных в группе «MCF-7 VDAC2 KO» ткань селезёнки была рыхлой, бесцветной, со множественными темно-красными вкраплениями.
Суммируя результаты внешнего осмотра животных и результаты некропсии (осмотра тканей и внешнего состояния внутренних органов), можно сделать вывод о том, что за исключением клеток типа «MCF-7 VDAC1 KO», которые не образовали опухолей, все остальные имплантированные клеточные культуры «MCF-7 WT», «MCF-7 VDAC2 KO» и «MCF-7 VDAC3 KO» вызывали патологические изменения состояния легких, печени и селезенки. Следует особо отметить наиболее выраженные патологические изменения внешнего вида, состояния ткани, а также образование множественных метастатических узлов в печени и селезёнке у животных, у которых опухоль образовывалась из клеточной линии, дефицитной по митохондриальному порину-2 («MCF-7 VDAC2KO»). Необходимо отметить образование и наличие опухолевидных новообразований в различных частях тела животного, таких как подмышечные лимфатические узлы, мочевой пузырь, а также в тканях, окружающих матку. Однако эти новообразования не носили систематического характера и были выявлены только у некоторых животных.
Гистологический анализ тканей
К 4–5-й нед у всех животных BALB/c Nude, которым были имплантированы/инъецированы суспензии клеточных линий «MCF-7 WT» и ее VDAC-дефицитных производных «MCF-7 VDAC2 KO» и «MCF-7 VDAC3 KO», сформировались подкожные макроскопические опухолевые узлы, которые легко визуализировались при внешнем осмотре гистологических срезов (рис. 3а–в). Большая часть подкожных опухолевых узлов состояла из жизнеспособных опухолевых клеток, и опухолевая ткань была представлена преимущественно округлыми или овальными эпителиоподобными одноядерными или полиплоидными клетками с хорошо выраженными ядрышками (на рис. 3 показано стрелками). Опухолевые клетки имели выраженные признаки плеоморфизма, характерные изменения формы клеток в злокачественных опухолях. На всех срезах опухолевых тканей присутствовало множество клеток с характерными уплотнениями ядерного материала, свидетельствующими о высокой митотической и пролиферативной активности клеток в опухолях (рис. 3). Кроме того, на всех срезах подкожных опухолевых узлов наблюдались участки некротического распада опухолевой ткани, что, скорее всего, связано с недостаточным кровоснабжением опухолевой ткани, обусловленным большими размерами опухоли и высокой плотностью клеток в этих узлах [3, 29–31]. Площадь некротического распада во всех обследуемых опухолевых узлах составляла приблизительно 15–40 % от общей площади, что соответствовало оценкам, составленным по оценочной шкале Эванса степени IIA [32]. Необходимо отметить, что в отличие от клеточных линий «MCF-7 WT» и ее VDAC-дефицитных производных «MCF-7 VDAC2 KO» и «MCF-7 VDAC3 KO», которые образовывали характерные солидные опухоли в жировой ткани мышей, имплантация в молочную железу животных клеточной линии
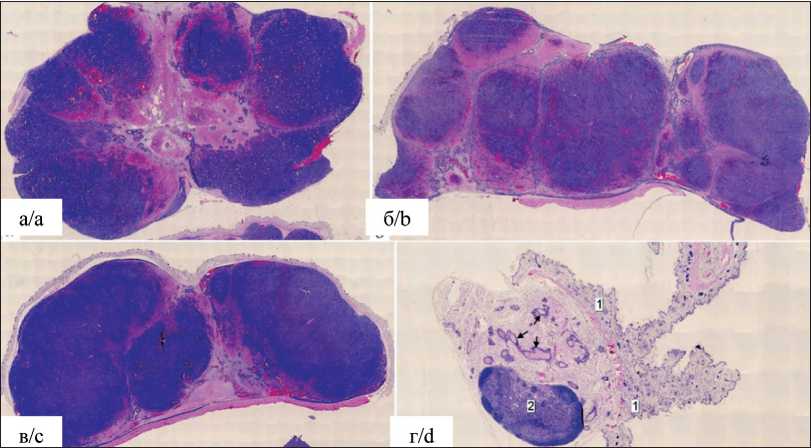
Рис. 3. Микрофото. Обзорный снимок подкожного опухолевого узла у мышей после введения клеточной линии MCF-7 и VDAC KO: а – WT; б – VDAC2 KO; в – VDAC3 KO; г – область после введения клеточной линии VDAC1 KO. Области, окрашенные в розовый цвет, являются зонами некроза. Область введения представлена кожей (1), структурами молочной железы (показаны стрелками) и регионарным лимфоузлом (2) в состоянии нормы. Снимки сделаны с использованием программы «Виртуальный микроскоп» (объектив ×10, окуляр ×10), окраска гематоксилином и эозином
Fig. 3. Microphoto. Imaging of a subcutaneous tumor in mice after injection of MCF-7 and VDAC KO cells: а – WT, b – VDAC2 KO, c – VDAC3 KO, d – area after injection of VDAC1 KO cells. Areas colored pink are areas of necrosis. The injection area is represented by the skin (1), mammary gland structures (shown by arrows) and the regional lymph node (2) in the normal state. The images were taken using the program «Virtual Microscope» (objective ×10, eyepiece ×10), stained with hematoxylin and eosin
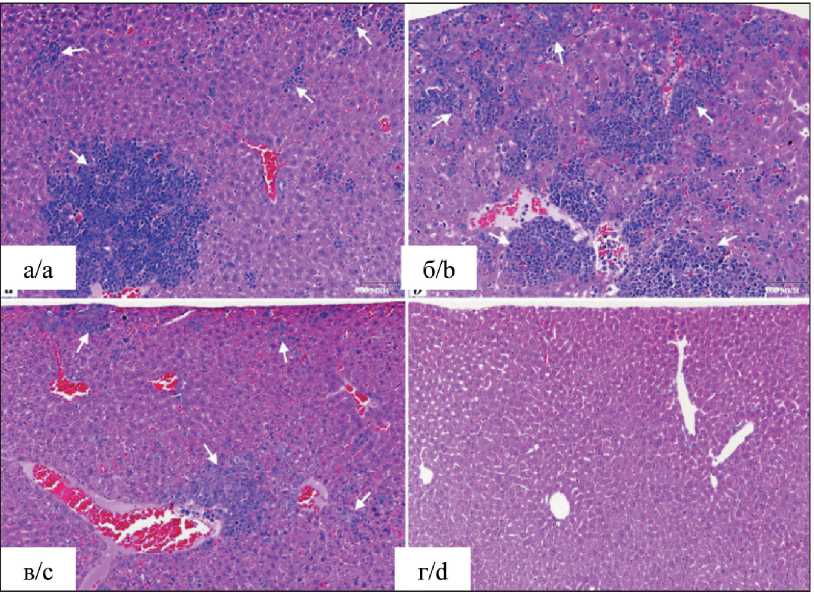
Рис. 4. Микрофото. Гистологические срезы фрагментов печени у мышей после введения клеточной линии MCF-7 и VDAC KO: а – WT; б – VDAC2 KO; в – VDAC3 KO; г – VDAC1 KO; ×100, окраска гематоксилином и эозином.
В печеночной паренхиме отмечены среднеочаговые и многочисленные мелкоочаговые рассеянные клеточные инфильтраты (показаны стрелками) с признаками малигнизации во всех долях печени
Fig. 4. Microphoto. Histological sections of liver fragments from mice after injection of MCF-7 and VDAC KO cells: а – WT; b – VDAC2 KO; c – VDAC3 KO; d – VDAC1 KO; ×100, stained with hematoxylin and eosin.
In the hepatic parenchyma, medium-focal and numerous small-focal scattered cellular infiltrates were noted (shown by arrows) with signs of malignancy in all lobes of the liver
«MCF-7 VDAC1 KO» не вызывала образования пальпируемых ортотопических опухолей, и у этих животных не наблюдалось также образования макроскопических визуализируемых подкожных опухолевых узлов (рис. 3г).
В тканях печени животных из группы мышей, которым имплантировались клеточные линии дикого типа MCF-7 клеток («MCF-7 WT»), при микроскопическом обследовании выявлялись среднеочаговые и многочисленные мелкоочаговые рассеянные клеточные инфильтраты с признаками малигнизации во всех долях печеночной паренхимы (на рис. 4а показано стрелками). В печени у всех мышей с имплантированными «MCF-7 VDAC2 KO» клетками выявлялись клеточные инфильтраты с признаками малигнизации (на рис. 4б показано стрелками).
При этом степень проявления данного морфологического признака изменялась от минимальной до выраженной максимальной. Аналогичные изменения в форме клеточных инфильтратов, с признаками малигнизации обнаруживались также в печени всех мышей, которым были имплантированы клетки линии «MCF-7 VDAC3 KO» (на рис. 4в показано стрелками). Степень проявления данного морфологического признака также может быть разделена на градации от минимальной до выраженной максимальной. Микроскопическое исследование ткани печени у животных с имплантированными клетками «MCF-7 VDAC1 KO» также не выявило в печеночной паренхиме клеточных инфильтратов с признаками малигнизации (рис. 4г). Необходимо отметить, что аналогично подкожным опухолевым структурам в структуре печени не обнаруживалось патологических изменений, и по внешнему виду обе структуры соответствовали норме.
В группе животных, которым имплантировали дикий тип клеток («MCF-7 WT»), в селезенке выявляются обширные клеточные инфильтраты с признаками малигнизации, как определено в работах [33–35], при этом у одного животного из группы красная и белая пульпа селезенки была почти полностью замещена на опухолевую ткань (на рис. 5а показано стрелками).
В селезенке у мышей с «MCF-7 VDAC2 KO» и «MCF-7 VDAC3 KO» типом клеток выявлены обширные клеточные инфильтраты с признаками малигнизации. Степень проявления признака – от умеренной до сильно выраженной [36]. У этих животных красная и белая пульпа селезенки была почти полностью замещена на опухолевую ткань (рис. 5б, в). После введения клеточной линии VDAC1 KO ни у одной мыши в этой группе кле-
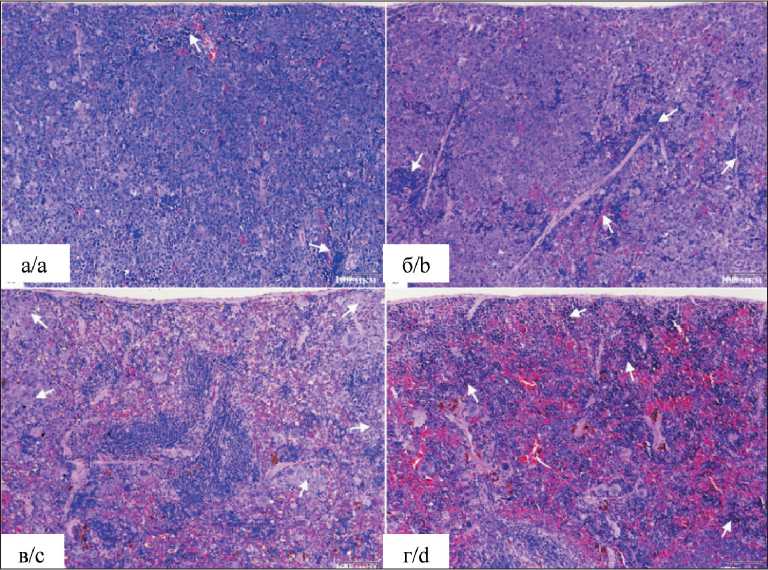
Рис. 5. Микрофото. Гистологические срезы фрагментов селезенки у мышей после введения клеточной линии MCF-7 и VDAC KO: а – WT и б – VDAC2 KO, где небольшие единичные участки сохранившейся селезеночной пульпы показаны стрелками; в – VDAC3 KO, где стрелками отмечены очагово-диффузные клеточные инфильтраты с признаками малигнизации; г – VDAC1 KO, где стрелками показаны некоторые очаги гемопоэза; ×100, окраска гематоксилином и эозином
Fig. 5. Microphoto. Histological sections of spleen fragments from mice after injection of MCF-7 and VDAC KOcells: а – WT and b – VDAC2 KO, where small isolated areas of preserved splenic pulp are shown by arrows; c – VDAC3 KO, where the arrows indicate focal-diffuse cellular infiltrates with signs of malignancy; d – VDAC1 KO, where the arrows show some foci of hematopoiesis; ×100, stained with hematoxylin and eosin
точных инфильтратов с признаками малигнизации в селезенке не выявлено (рис. 5г). В одном случае в этой группы в красной пульпе селезенки отмечен экстрамедуллярный гемопоэз, который характерен для мышей BALB/c Nude. В целом морфологическая структура селезенки соответствовала норме.
Заключение
Таким образом, показана возможность успешного создания ортотопических опухолей в жировой ткани иммунодефицитных голых мышей BALB/c Nude эпителиальными клетками рака молочной железы человека «MCF-7 WT», содержащими полный набор изоформ митохондриальных по-ринов и ее VDAC-дефицитными производными. Формирование опухолей и размеры образующихся опухолей отслеживались в течение 4 нед, после чего были произведены эвтаназия животных и патоморфологический анализ состояния тканей опухоли, региональных лимфатических узлов, легких, печени и селезенки. Ни в одной группе животных не наблюдалось спонтанного рассасывания опухолей, а малые сроки жизни животных указывают на возможность смерти животного от передозировки количества (4 миллиона на инъекцию) инъецированных клеток, которое определяет скорость рота опухоли. Полученные результаты продемонстрировали образование солидных опухолей человеческими клетками с модифицированным набором функциональных белков митохондрий, и возможность определить оптимальный режим и количество клеток в инъекции, достаточное для получения опухолей для
Список литературы Создание ортотопических опухолей в молочной железе мышей BALB/C NUDE клетками рака молочной железы человека MCF-7 и ее VDAC-дефицитными производными
- Momenimovahed Z., Salehiniya H. Epidemiological characteristics of and risk factors for breast cancer in the world. Breast Cancer (Dove Med Press) 2019; 11: 151–64. doi:10.2147/BCTT.S176070.
- Кит О.И., Ващенко Л.Н., Дашкова И.Р., Кутилин Д.С., Максимов А.Ю., Гончарова А.С. Ксеногенные модели рака молочной железы человека в экспериментальных исследованиях. Современные проблемы науки и образования. 2019; (6). [Kit O.I., Vashchenko L.N., Dashkova I.R., Kutilin D.S., Maksimov A.Y., Goncharova A.S. Xenograft models of human breast cancer in experimental studies. Modern Problems of Science and Education. 2019; (6). (in Russian)].
- Koldin I.I., Treshchalina E.M., Sharovskaia I., Dubovaia T.K., Kobliakov V.A. Effect of cell microenvironment on cell functions associated with tumour promotion and progression. Tsitologiia. 2013; 55: 328–32.
- Treshalina H.M. Immunodeficient mice balb/c nude and modeling of various types of tumor growth for preclinical studies. Russian Journal of Biotherapy. 2019; 16: 6–13. doi.org/10.17650/1726-9784-2017-16-3-6-13.
- Holen I., Speirs V., Morrissey B., Blyth K. In vivo models in breast cancer research: progress, challenges and future directions. Disease Models Mechanisms. 2017; 10 (4): 359–71. doi: 10.1242/dmm.028274.
- Tavera-Mendoza L.E., Brown M. A less invasive method for orthotopic injection of breast cancer cells into the mouse mammary gland. Lab Anim. 2017; 51(1): 85–8. doi: 10.1177/0023677216640706.
- Mazure N.M. VDAC in cancer. Biochim Biophys Acta Bioenerg. 2017; 1858(8): 665–73. doi: 10.1016/j.bbabio.2017.03.002.
- Shoshan-Barmatz V., Ben-Hail D. VDAC, a multi-functional mitochondrial protein as a pharmacological target. Mitochondrion. 2012; 12(1): 24–34. doi: 10.1016/j.mito.2011.04.001.
- Shteinfer-Kuzmine A., Amsalem Z., Arif T., Zooravlov A., Shoshan-Barmatz V. Selective induction of cancer cell death by VDAC1-based peptides and their potential use in cancer therapy. Mol Oncol. 2018; 12 (7): 1077–1103. doi: 10.1002/1878-0261.
- Raghavan A., Sheiko T., Graham B.H., Craigen W.J. Voltagedependant anion channels: novel insights into isoform function through genetic models. Biochim Biophys Acta. 2012; 1818(6): 1477–85. doi: 10.1016/j.bbamem.2011.10.019.
- Maldonado E.N., Lemasters J.J. Warburg revisited: regulation of mitochondrial metabolism by voltage-dependent anion channels in cancer cells. J Pharmacol Exp Ther. 2012; 342: 637–41, doi:10.1124/jpet.112.192153.
- Pedersen P.L. Voltage dependent anion channels (VDACs): a brief introduction with a focus on the outer mitochondrial compartment’s roles together with hexokinase-2 in the «Warburg effect» in cancer. J Bioenerg Biomembr. 2008; 40 (3): 123–6. doi: 10.1007/s10863-008-9165-7.
- Yang G., Zhou D., Li J., Wang W., Zhong W., Fan W., Yu M., Cheng H. VDAC1 is regulated by BRD4 and contributes to JQ1 resistance in breast cancer. Oncol Lett. 2019; 18 (3): 2340–7. doi: 10.3892/ol.2019.10534.
- Seo J.H., Chae Y.C., Kossenkov A.V., Lee Y.G., Tang H.Y., Agarwal E., Gabrilovich D.I., Languino L.R., Speicher D.W., Shastrula P.K., Storaci A.M., Ferrero S., Gaudioso G., Caroli M., Tosi D., Giroda M., Vaira V., Rebecca V. W., Herlyn M., Xiao M., Fingerman D., Martorella A., Skordalakes E., Altieri D.C. MFF Regulation of Mitochondrial Cell Death Is a Therapeutic Target in Cancer. Cancer Res. 2019; 79 (24): 6215–26. doi: 10.1158/0008-5472.CAN-19-1982.
- Ralph S.J., Low P., Dong L., Lawen A., Neuzil J. Mitocans: mitochondrial targeted anti-cancer drugs as improved therapies and related patent documents. Recent Pat Anticancer Drug Discov. 2006; 1 (3): 327–46.
- Shoshan-Barmatz V., Krelin Y., Chen Q. VDAC1 as a Player in Mitochondria-Mediated Apoptosis and Target for Modulating Apoptosis. Curr Med Chem. 2017; 24(40): 4435–46. doi: 10.2174/0929867324666170616105200.
- Wu S., Sampson M.J., Decker W.K., Craigen W.J. Each mammalian mitochondrial outer membrane porin protein is dispensable: effects on cellular respiration. Biochim Biophys Acta. 1999; 1452: 68–78. doi:10.1016/s0167-4889(99)00120-2.
- Solovieva M.E., Shatalin Y.V., Solovyev V.V., Sazonov A.V., Kutyshenko V.P., Akatov V.S. Hydroxycobalamin catalyzes the oxidation of diethyldithiocarbamate and increases its cytotoxicity independently of copper ions. Redox Biol. 2019; 20: 28–37. doi:10.1016/j.redox.2018.09.016.
- Zotova A., Pichugin A., Atemasova A., Knyazhanskaya E., Lopatukhina E., Mitkin N., Holmuhamedov E., Gottikh M., Kuprash D., Filatov A., Mazurov D. Isolation of gene-edited cells via knock-in of short glycophosphatidylinositol-anchored epitope tags. Sci Rep. 2019; 9: 3132. doi:10.1038/s41598-019-40219-z.
- Мазуров Д.В. Селекция редактированных клеток методом SORTS. Главная публичная научно-техническая библиотека Сибирского отделения РАН. Новосибирск, 2020; Глава 22. [Mazurov D.V. Selekcija redaktirovannyh kletok metodom SORTS. Glavnaja publichnaja nauchno-tehnicheskaja biblioteka Sibirskogo otdelenija RAS. Novosibirsk, 2020; 22. (in Russian)].
- Tarasevich A., Filatov A., Pichugin A., Mazurov D. Monoclonal antibody profiling of cell surface proteins associated with the viral biofilms on HTLV-1 transformed cells. Acta Virol. 2015; 59: 247–56. doi:10.4149/av_2015_03_247.
- Cheon D.J., Orsulic S. Mouse models of cancer. Ann Rev Pathol. 2011; 6: 95–119, doi:10.1146/annurev.pathol.3.121806.154244.
- Park M.K., Lee C.H., Lee H. Mouse models of breast cancer in preclinical research. Lab Anim Res. 2018; 34: 160–5, doi:10.5625/lar.2018.34.4.160.
- Dall G., Vieusseux J., Unsworth A., Anderson R., Britt K. Low Dose, Low Cost Estradiol Pellets Can Support MCF-7 Tumour Growth in Nude Mice without Bladder Symptoms. J Cancer. 2015; 6: 1331–6. doi:10.7150/jca.10890.
- Кадомцев Д.В. Золетил-ксилазиновый наркоз в экспериментах у крыс. Международный журнал прикладных и фундаментальных исследований 2015; 5: 56–7. [Kadomcev D.V. Zoletyl-xylazine anesthesia in experiments on rats. International Journal of Applied and Basic Research. 2015; 5: 56–7. (in Russian)].
- Владимирская Т.Э., Швед И.А., Криворот С.Г., Веялкина Н.Н., Адамович А.В. Определение фаз эстрального цикла белых крыс по клеточному составу влагалищных мазков. Вести Национальной Академии Наук Белоруссии, Серия Биологическая. 2011; 4: 88–91. [Vladimirskaja T.Je., Shved I.A., Krivorot S.G., Vejalkina N.N., Adamovich A.V. Determination of the phases of the estrous cycle of white rats by the cellular composition of vaginal smears. News of the National Academy of Sciences of Belarus, Biological Series. 2011; 4: 88–91. (in Russian)].
- Miller A.R., Pisters P.W., Lee J.E., Janjan N.A., Abbruzzese J.L., Evans D.B. Preoperative chemoradiation and pancreaticoduodenectomy for adenocarcinoma of the pancreas. Hepatogastroenterology. 1998; 45(21): 624–33.
- Majer J., Kedziora J., Madziala M. A pilot study of mechanical chest compression with the LifeLine ARM device during simulated cardiopulmonary resuscitation. Anaesth Crit Care Pain Med. 2017; 36(4): 249. doi: 10.1016/j.accpm.2017.01.007.
- Jung Y.Y., Hyun C.L., Jin M.-S., Park I.A., Chung Y.R., Shim B., Lee K.H., Ryu H.S. Histomorphological Factors Predicting the Response to Neoadjuvant Chemotherapy in Triple-Negative Breast Cancer. J Breast Cancer. 2016; 19(3): 261–7. doi: 10.4048/jbc.2016.19.3.261.
- Sethi D., Sen R., Parshad S., Khetarpal S., Garg M., Sen J. Histopathologic changes following neoadjuvant chemotherapy in various malignancies. Int J Appl Basic Med Res. 2012; 2(2): 111–6. doi: 10.4103/2229-516X.106353.
- Pokrovskii V.S., Treshchalin M.I., Bodiagin D.A., Treshchalina E.M. Hematological toxicity of some combined chemotherapy schemes involving aranoza. Eksp Klin Farmakol. 2010; 73(5): 36–40.
- Yao L., Xue X., Yu P., Ni Y., Chen F. Evans Blue Dye: A Revisit of Its Applications in Biomedicine. Contrast Media; Molecular Imaging. 2018.
- Зайцев В.Б., Федоровская Н.С., Дьяконов Д.А., Федоровский А.М., Коледаева Е.В., Дорох Л.В., Гамулинская И.Н. Морфофункциональные характеристики селезёнки человека. Вятский медицинский вестник. 2011; 3–6. [Zajcev V.B., Fedorovskaja N.S., D’jakonov D.A., Fedorovskij A.M., Koledaeva E.V., Doroh L.V., Gamulinskaja I.N. Morphofunctional characteristics of the human spleen. Vyatka Medical Bulletin. 2011; 3–6. (in Russian)].
- Кирьянов Н. А., Иванова Г.С., Баженов Е. Л., Башмаков А. Б. Частная патология.Часть 2. Патологическая анатомия. Ижевск, 2018. [Kir’janov N. A., Ivanova G.S., Bazhenov E.L., Bashmakov A.B. Particular pathology. Part 2. Pathological anatomy. Izhevsk, Izhevsk, 2018. (in Russian)].
- Ионкин Д.А., Кармазановский.Г.Г., Степанова Ю.А., Шуракова А.Б., Журенкова Т.В., Щеголев А.И., Дубова Е.А. Редкие злокачественные поражения селезёнки. Малигнизация эпидермоидной кисты и метастазы в селезёнку. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова 2011; 6: 137–143. [Ionkin D.A., Karmazanovskij.G.G., Stepanova Ju.A., Shurakova A.B., Zhurenkova T.V., Shhegolev A.I., Dubova E.A. Rare malignant lesions of the spleen. Malignancy of the epidermoid cyst and metastases to the spleen. Bulletin of the National Medical and Surgical Center. N.I. Pirogov. 2011; 6: 137–143. (in Russian)].


