Создание пациентоподобной модели рака пищевода на иммунодефицитных мышах
Автор: Кит Сергей Олегович, Максимов Роман Алексеевич, Гончарова Анна Сергеевна, Лукбанова Екатерина Алексеевна, Карнаухов Николай Сергеевич, Непомнящая Евгения Марковна, Миндарь Мария Вадимовна, Ткачев Сергей Юрьевич, Колесников Евгений Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.19, 2020 года.
Бесплатный доступ
Введение. Для изучения противоопухолевого действия веществ in vivo требуется создание модели, отражающей основные характеристики заболевания человека. Такому требованию могут отвечать пациентоподобные ксенографты (Patient Derived Xenograft - PDX) на иммунодефицитных мышах. Пациентоподобные модели опухолей считаются наиболее прогрессивными по причине их способности сохранять после имплантации свои первоначальные свойства, характеризующиеся разнообразием на гистологическом и молекулярном уровне. Целью исследования явилось создание PDX-модели рака пищевода человека в шейном отделе пищевода иммунодефицитных мышей. Материал и методы. Для создания PDX-модели рака пищевода человека было использовано 11 самцов иммунодефицитных мышей линии Balb/c Nude массой 19-22 г. Фрагмент опухоли был взят от пациента с диагнозом инфильтративно-язвенного рака - умереннодифференцированной плоскоклеточной карциномы без ороговения. Результаты. В результате имплантации донорского фрагмента опухоли наблюдалось полное приживление материала у 6 (54,5 %) из 11 животных, что согласуется с литературными данными. По результатам морфологических исследований, пациентоподобный ксенографт является плоскоклеточной карциномой, что гистологически соответствует опухоли пациента.
Рак пищевода, пациентоподобная модель, иммунодефицитные мыши, плоскоклеточная карцинома
Короткий адрес: https://sciup.org/140254057
IDR: 140254057 | УДК: 616-006.61:57.089.67]-092.9 | DOI: 10.21294/1814-4861-2020-19-2-70-75
Текст научной статьи Создание пациентоподобной модели рака пищевода на иммунодефицитных мышах
Среди всех онкологических заболеваний рак пищевода (РП) занимает 9-е место в мире и 7-е – в России, при этом смертность достигает 80 % [1, 2]. Причиной служат скрытое течение заболевания на ранних этапах, высокая вероятность развития отделенных метастазов, распространение в структуры средостения [3]. Рак пищевода выявляется зачастую уже на поздних стадиях, в результате чего хирургическое лечение может быть противопоказанным. Частота операционных осложнений может достигать 60 %, из них наиболее грозными являются кровотечения, повреждения внутренних органов и кровеносных сосудов, медиастинит, несостоятельность швов, эмпиема плевры [4]. Наиболее сложно поддается лечению шейный отдел пищевода ввиду близкого расположения жизненно важных органов и калечащего характера операций, поэтому при этой локализации РП наиболее предпочтительным методом является химиолучевая терапия [5].
В клинической практике применяется большое количество химиопрепаратов. Однако современные противоопухолевые препараты имеют ряд недостатков, в том числе узкий диапазон терапевтических доз. Химиопрепараты зачастую обладают тяжелыми побочными эффектами и вместе с этим чрезвычайно дороги. Подсчитано, что расходы на лечение одного пациента могут составлять до нескольких десятков тысяч долларов в месяц [6]. В связи с вышеперечисленным актуальным является поиск новых лекарственных средств, обладающих улучшенными свойствами по сравнению с уже использующимися в онкологии.
В мире проводятся доклинические исследования миллионов веществ с вероятным противоопухолевым действием, и лишь единицы из них внедряются в клиническую практику, пройдя все фазы испытаний в течение более 10 лет. Доклинические исследования каждой новой фармакологической субстанции включают этапы in vitro и in vivo. Для изучения противоопухолевого действия веществ in vivo требуется создание модели, максимально приближенной по своим характеристикам к человеческому заболеванию. Такому требованию могут отвечать ксенографты человеческих опухолей на иммунодефицитных мышах.
Наиболее распространенными моделями для испытания новых веществ являются подкожные ксенографты культур опухолевых клеток. Несмотря на ряд их неоспоримых преимуществ, выявляются и существенные недостатки, такие как отсутствие естественного микроокружения, влияющего на онкогенез, а также однородный состав культуры клеток, что не соответствует реальной клинической картине. В итоге результаты исследований веществ на подкожных ксенографтах культуры клеток рака человека будут в определенной степени искаженными и могут разниться с результатами клинических исследований [7].
Более адекватной считается пациентоподобная модель (Patient Derived Xenograft – PDX), получаемая в результате ксенотрансплантации фрагмента опухоли человека иммунодефицитным мышам. Доклинические исследования на подобных тест-системах проводятся перед началом клинических испытаний фармакологических субстанций. Помимо этого PDX используются для реализации концепции персонализированной медицины, когда терапевтические подходы подбираются с учетом индивидуальных особенностей конкретного пациента, основываясь на результатах предварительных испытаний на PDX-моделях [8].
Целью исследования явилось создание PDX-модели РП человека в шейном отделе пищевода иммунодефицитных мышей как наиболее проблемной зоне для лечения.
Материал и методы
Наркоз мышам делали при помощи ксилазина концентрацией 20 мг/мл и золетила концентрацией 22,57 мг/мл в дозе 1,13 мг на 20 г веса животного. Доступ к шейному отделу пищевода иммуноде-
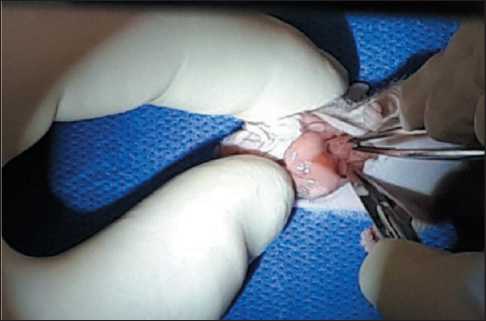
Рис. 1. Повреждение адвентициального и мышечного слоев стенки пищевода
Fig. 1. Damage to adventitial and muscular layers of the esophageal wall
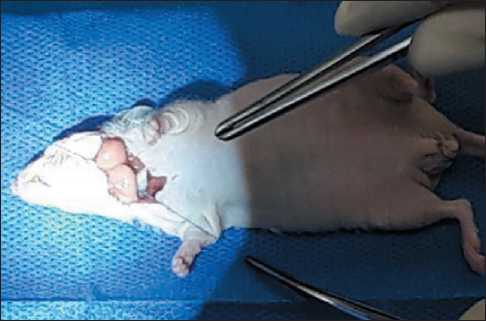
Рис. 2. Подшивание фрагмента опухоли пищевода человека к стенке шейного отдела пищевода иммунодефицитной мыши Balb/c Nude
Fig. 2. Sewing of a fragment of human esophageal tumor to the cervical esophagus wall in an immunodeficient Balb/c Nude mouse
фицитной мыши Balb/c Nude обеспечивали путем рассечения кожи на шее от основания правой ушной раковины вплоть до основания левой ушной раковины. Пищевод вместе с надлежащей трахеей выделяли от окружающих тканей тупым способом. При помощи скальпеля надсекали адвентициальный и мышечный слои стенки пищевода (рис. 1). Фрагмент опухоли пищевода человека подшивали к стенке шейного отдела пищевода в районе произведенного ранее повреждения (рис. 2). Кожный дефект ушивали лигатурой из неабсорбируемого полипропилена толщиной 4–0. Наблюдение за животными проводили в течение 30 сут. Эвтаназию мышей осуществляли в СО2-камере, после чего выполняли некропсию и отбор опухолевого материала для морфологического исследования.
Результаты
Фрагменты опухоли пищевода человека имплантировали 11 самцам мышей линии Balb/c Nude. Спустя 8 дней с момента посадки опухолевого материала у 9 из 11 животных наблюдалась четкая припухлость на вентральной стороне шеи, которая при пальпации имела плотную консистенцию. Еще через 5 дней у трех мышей стали появляться изъязвления в области имплантации опухолевого материала, из которых на следующий день наблюдался выход некротических масс, после чего объем предполагаемых опухолей визуально резко уменьшился. В дальнейшем было продолжено наблюдение за этими животными. По прошествии 7 дней после выхода некротических масс был отмечен рост опухолевой ткани, имеющей плотную консистенцию. В результате некропсии всех животных у 6 мышей были выявлены опухолевые образования беловато-розового цвета с четкими границами и плотной структурой (рис. 3). При морфологическом анализе опухоль идентифицировали как умереннодифференцированную плоскоклеточную карциному пищевода без ороговения, характеризующуюся
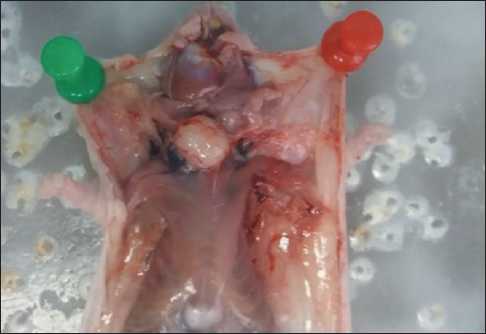
Рис. 3. Некропсия иммунодефицитной мыши Balb/c Nude с развитой опухолью пищевода
Fig. 3. Necropsy of an immunodeficient Balb/c Nude mouse with developed esophageal tumor
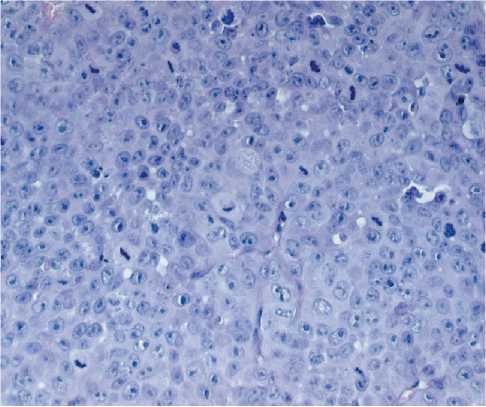
Рис. 4. Микрофото. Плоскоклеточная карцинома у иммунодефицитной мыши Balb/c Nude, ×40
Fig.4. Microphoto. Esophageal adenocarcinoma in an immunodeficient Balb/c Nude mouse, ×40
наличием в отдельных клетках патологических митозов (рис. 4).
Обсуждение
Ортотопические пациентоподобные модели, характеризующиеся гетерогенным клеточным составом и развивающиеся в естественном микроокружении, сохраняют гистологические, генетические и физиологические свойства донорской опухоли [8]. В результате эксперимента была получена PDX-модель рака пищевода человека на иммунодефицитных мышах Balb/c Nude, которая по результатам морфологических исследований гистологически соответствует опухоли пациента, являясь плоскоклеточной карциномой.
В результате имплантации донорского фрагмента опухоли наблюдалось полное приживление материала у 6 из 11 животных, что составило 54,5 %. Это соответствует литературным данным, согласно которым процент успешной имплантации PDX иммунодефицитным мышам может варьировать от 10 до 50 % в зависимости от типа опухоли, сайта имплантации, особенностей пациента.
Пациентоподобные модели рака пищевода, как и другие тест-системы, имеют как преимущества, так и ряд недостатков. Первым необходимым условием для проведения исследований с использованием PDX является доступ исследовательских лабораторий к донорским резицированным опухолям. Существенным недостатком является техническая сложность создания подобной модели, так как это требует наличия у исследователей навыков проведения наркотизации и микрохирургии лабораторных животных. Пациентоподобная модель имеет более низкую скорость роста по сравнению с подкожными ксенографтами опухолевых культур клеток и относительно низкие показатели приживления, что вносит существенные коррективы в планирование исследований [9]. Однако, несмотря на перечисленные недостатки, PDX-модели имеют существенные преимущества, благодаря которым они считаются перспективными в доклинических исследованиях новых фармакологических субстанций, изучении механизмов онкогенеза, тестировании использующихся лекарственных средств для пациентов, проявляющих резистентность к общепринятым схемам терапии.
Заключение
В результате эксперимента были получены пациентоподобные модели плоскоклеточной карциномы человека на иммунодефицитных мышах, сохранившие свои гистологические характеристики. При этом удалось добиться 54,5 % при-живляемости опухолевого материала, что вполне согласуется с литературными данными.
Список литературы Создание пациентоподобной модели рака пищевода на иммунодефицитных мышах
- Арутюнян К.В., Кузнецов И.М., Фёдоров К.С., Тер-Ованесов М.Д, Шостка К.Г., Роман Л.Д., Мушников Н.А. Оценка функциональной операбельности, как предпосылка для профилактики осложнений после операций по поводу рака пищевода. Профилактическая и клиническая медицина. 2017; 1(62): 42-48.
- Скворцов М.Б. Рак пищевода: хирургическое лечение. Сибирский медицинский журнал. 2011; 4: 21-30.
- Ильин И.А., Малькевич В.Т. Отдаленные результаты хирургического лечения рака пищевода при различных типах оперативных вмешательств. Онкологический журнал. 2016; 10(1(37)): 84-92.
- Урсол Г.Н. Способы хирургического лечения рака пищевода. ScienceRise. 2015; 3(4(8)): 19-26.
- Гарин А.М., Базин И.С. Лекарственная терапия опухолей желудочно-кишечного тракта. Эффективная фармакотерапия. 2015; 2: 16-23.
- Имянитов Е.Н., Моисеенко В.М. Применение молекулярно-генетического анализа для выбора противоопухолевой цитостатической терапии. Онкогематология. 2007; 3: 4-8.
- Kelland L.R. "Of mice and men": values and liabilities of the athymic nude mouse model in anticancer drug development. Eur J Cancer. 2004 Apr; 40(6): 827-36. DOI: 10.1016/j.ejca.2003.11.028
- Lee N.P., Chan C.M., Tung L.N., Wang H.K., Law S. Tumor xenograft animal models for esophageal squamous cell carcinoma. J Biomed Sci. 2018 Aug 29; 25(1): 66. DOI: 10.1186/s12929-018-0468-7
- Кит О.И., Колесников Е.Н., Максимов А.Ю., Протасова Т.П., Гончарова А.С., Лукбанова Е.А. Методы создания ортотопических моделей рака пищевода и их применение в доклинических исследованиях. Современные проблемы науки и образования. 2019; 2: 96


