Специализированная офтальмоонкологическая помощь в условиях многопрофильного онкологического диспансера
Автор: Важенин А.В., Панова И.Е., Семенова Л.Е., Ефименко И.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 1 (9), 2004 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14054124
IDR: 14054124
Текст статьи Специализированная офтальмоонкологическая помощь в условиях многопрофильного онкологического диспансера
Традиционно офтальмоонкологическая помощь оказывается больным в общей лечебной глазной сети либо офтальмоонкологических центрах, расположенных на базе глазных научноисследовательских институтов и клиник. Рост онкологической заболеваемости, в том числе и со стороны органа зрения, увеличение частоты распространенных форм онкологической патологии требуют комплексного подхода к диагностике и лечению данной категории пациентов. Выполнение необходимого объема диагностического исследования, оказание многокомпонентного лечения с использованием современных технологий, диспансеризация больных с новообразованиями органа зрения в условиях общей глазной сети представляют определенные сложности [7]. Трудное социально-экономическое положение населения нередко не позволяет выехать за пределы своего региона. Все это послужило основанием для организации в Челябинской области офтальмоонкологической службы на базе областного онкологического учреждения.
Офтальмоонкологический центр областного онкологического диспансера организован приказом главного управления здравоохранения администрации Челябинской области в январе 1999 г. В своем развитии центр постепенно совершенствовался, и на сегодняшний день он представлен глазным консультативным кабинетом, 20-коечным специализированным отделением; в нем работают 3 врача-офтальмоонколога, онколог-отоларинголог, радиолог, химиотерапевт, пластический хирург. Центр органично вплетается в структуру всего диспансера и имеет все возможности для использования различных современных методов диагностики (ультразвуковое исследование, допплерография, компьютерная томография, мор- фологическое исследование) и лечения (лучевая терапия на аппаратах РОКУС–М, Агат, линейные ускорители фирмы «Phillips» SL–20 и SL–50, ней-тронотерапия, брахитерапия).
Частота злокачественных опухолей глаза по отношению ко всему числу злокачественных опухолей составляет, по данным различных авторов, от 3 до 4,3% [2, 6]. Согласно нашим сведениям, по ряду нозологических форм (увеальная меланома в структуре меланомы, базально-клеточный рак периокулярной локализации в структуре базально-клеточного рака кожи) эта цифра возрастает до 11 – 15% .
Основными направлениями работы центра являются совершенствование диагностики оф-тальмоонкологической патологии на основе комплексного применения современных диагностических методов, разработка дифференцированного лечения базально-клеточного рака век, многокомпонентного лечения увеальной меланомы, опухолей орбиты, метастатического поражения органа зрения.
По данным офтальмоонкологического центра, в структуре офтальмоонкологической патологии (по обращаемости) превалируют опухоли придаточного аппарата глаза и конъюнктивы – 55–73%, среди которых наиболее часто диагностируется базально-клеточный и плоскоклеточный раки (32%), доброкачественные эпителиальные новообразования век (37%), невусы (11%), реже – меланомы (1,5 %), гемангиомы (0,5%).
Актуальность проблемы базально-клеточного рака кожи определяется увеличением заболеваемости, трудностями диагностики и выбора тактики лечения [1]. Заболеваемость базальноклеточным раком кожи по обращаемости в г. Челябинске составляет 47,7, в области – 30 больных на 100 000 населения. Наиболее часто опухоль локализуется на голове и шее (81%). Согласно нашим данным, заболеваемость базально-клеточным раком вспомогательного аппарата (веки, параор-битальная область) составляет 4,5 на 100 000 населения (12,5% всех базалиом, локализующихся на голове и шее).
Большой клинический материал позволил нам изучить особенности клинического течения базально-клеточного рака вспомогательного аппарата глаза. Наиболее часто заболевание выявляется у женщин (65%), средний возраст пациентов 65,5±0,8 лет, рецидивирующее течение заболевания наблюдается у 12% больных.
Базально-клеточный рак век преимущественно локализуется в области нижнего века (50,4%), внутреннего угла глазной щели (19,8%), реже – на верхнем веке (10,8), у наружного угла глазной щели (4,7%) и имеет распространенный характер (14,3). Наиболее часто встречаются узелковая (48,2%), разъедающе-язвенная (44,6%), реже – поверхностная (4,7%) и склеродермоподобная (2,5%) формы.
Изучение клинико-морфологических параллелей (с учетом классификации L. Lowe, R. Ra-pini, 1993) позволило нам установить, что при узловой форме (включая пигментый вариант) наиболее часто встречается узловой тип роста, при язвенной – агрессивно-растущий и смешанные, при поверхностной – поверхностный, склеродермоподобной – агрессивно-растущий с выраженным склерозом стромы.
В лечении базально-клеточного рака кожи применяются различные методы: лучевые, хирургические, криовоздействие, системная и локальная химиотерапия. Сложность анатомического строения век и параорбитальной области, особенности клинического течения и разнообразие морфологической картины определяют трудности выбора метода лечения, возможности неизле-ченности процесса и возникновения рецидивов. Нами обоснован и применяется дифференцированный подход к лечению базально-клеточного рака вспомогательного аппарата глаза.
Традиционным методом лечения базальноклеточного рака кожи является близкофокусная рентгенотерапия [4]. До организации работы оф-тальмоонкологического центра 220–300 пациентов с данной патологией получали лучевое лечение в различных отделениях лучевой терапии го- рода и области. Отсутствие консолидации работы офтальмологов и радиологов нередко приводило к необоснованности лечения, неадекватным дозам и методам лучевого воздействия, возникновению постлучевых осложнений и рецидивов. Осложнения лучевой терапии в виде постлучевой окклюзии носо-слезных путей, рубцовых деформаций век, синдрома «сухого глаза» и даже субатрофии глазного яблока имели место у 17% больных, получивших лечение в предыдущие годы, и потребовали дополнительной медикаментозной и хирургической коррекции.
Анализ рецидивов базалиом век после лучевой терапии показал, что они наблюдаются у 13,7% больных (преимущественно женщин), локализуются в труднодоступных зонах – интермаргинальном пространстве (47%), во внутреннем углу глазной щели (36,8%), реже – в области наружного угла глазной щели (10,5%) и на коже нижнего века (5,3%). Клинически у данной группы больных преобладает разъедающе-язвенная форма базально-клеточного рака (63%), статистически достоверно чаще верифицируется аг-рессивно-растущий и смешанные типы роста. Это позволило нам обосновать следующие «относительные» противопоказания к проведению близкофокусной рентгенотерапии: разъедающе-язвенная форма, локализация на интермаргинальном крае, во внутреннем углу глаза, агрессив-но-растущий и смешанные типы роста.
Одним из ведущих методов лечения базально-клеточного рака кожи век является хирургический [9], иссечение опухоли производится под местным, реже – общим обезболиванием, границы опухоли определяются биомикроскопически. Выполнение радикального хирургического вмешательства у офтальмоонкологических больных нередко приводит к возникновению значительных по размеру дефектов тканей и требует реконструктивно-пластического этапа. Трудность выбора восстановительной операции определяется сложностью анатомо-топографического строения органа зрения, стремлением сохранить функции и достигнуть удовлетворительного косметического эффекта. Наличие в офтальмоонко-логическом центре пластического хирурга позволяет обеспечить радикальность операции, выполнить реконструктивно-восстановительное пособие любой категории сложности и получить максимальный эстетический результат. При узло- вых формах образования размерами до 2–3 см, локализующихся в пределах кожи, выполняется иссечение опухоли с одномоментной кожной пластикой (свободным полнослойным лоскутом с противоположного века или транспозиционным лоскутом на питающей ножке).
Наиболее сложной задачей является лечение пациентов с распространенными формами базально-клеточного и плоскоклеточного рака. Обширность поражения с вовлечением в процесс смежных областей, отсутствие отдаленных метастазов определяют целесообразность выполнения расширенных оперативных вмешательств – экзентерации орбиты, удаления век, костных стенок орбиты. Одномоментно выполняется пластика дефектов различными модификациями лоскутов: тарзоконъюнктивальным (с противоположного века ипсилатерального глаза), кожным (лепестковым, ротационным), мышечным (височной мышцей на питающей ножке), в ряде случаев – реваскуляризируемым ТКАМ-лоскутом.
С 2002 года в центре успешно применяется диодлазерная абляция небольших (до 1–1,5 см) узловых или плоскостных форм базально-клеточного рака.
Близкофокусная рентгенотерапия при базально-клеточном раке кожи век проводится при узловых формах опухоли с локализацией на коже верхнего века, наружного угла глаза без вовлечения ребра века. Методика облучения традиционная – аппарат РТА02 при условиях РИК-10, фильтр АСМА-0,5, мощность дозы в воздухе 440, 1–40; разовая доза 2 Гр, СОД до 50-55 Гр.
Внутриглазные новообразования выявлены нами у 20 – 25% больных с опухолями органа зрения, среди них наиболее часто встречается меланома сосудистой оболочки глаза (83%) , реже – гемангиома сосудистой оболочки и радужки (2%), меланома (1%) и миома (2%) радужной оболочки. Невусы хориоидеи диагностированы нами у 12% пациентов с патологией заднего отдела глаза.
Актуальность проблемы внутриглазной меланомы определяется особой агрессивностью и злокачественностью данной опухоли, что представляет угрозу не только для зрения, но и для жизни больного. Сложности лечения обусловлены необходимостью многокомпонентного воздействия, что возможно лишь в условиях онкологической службы. Частота заболеваемости внутриглазной меланомой варьирует от 0,6 до 1,2 на
100 000 населения и имеет тенденцию к росту [3]. По нашим предварительным данным, в Челябинской области частота заболеваемости внутриглазной меланомой (по обращаемости) составляет 0,73 на 100 000 населения. Нами впервые установлена доля внутриглазной меланомы в общей структуре онкологической заболеваемости – 0,21% и в структуре меланомы других локализаций – 14,9%. Согласно нашим данным, заболеваемость внутриглазной меланомой у населения Челябинской области за период 1999 – 2001 гг. в среднем составила 0,73 на 100 000 населения (у мужчин – 0,83, у женщин – 0,67). Нами выявлены статистически достоверные различия в заболеваемости внутриглазной меланомой городских (0,65 ± 0,06) и сельских жителей (1,16 ± 0,14) в среднем за период 1999–2001 гг.
При исследовании распределения больных по возрасту (рис. 1) установлено, что внутриглазная меланома наиболее часто диагностируется в возрастном диапазоне 60–69 лет (38,8%), у 9,8% больных заболевание выявлено в молодом возрасте (19–39 лет), что согласуется с тенденцией к «омолаживанию» внутриглазной меланомы.
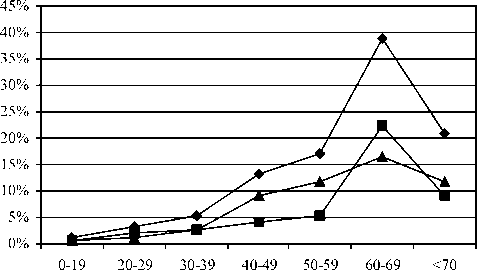
—♦ оба пола —■ мужчины —* женщины
Рис. 1. Распределение больных внутриглазной меланомой по полу и возрасту
Средний возраст пациентов с внутриглазной меланомой составляет 62 ± 4,2 лет. Анализ заболеваемости по полу и возрасту свидетельствует, что наиболее высокие показатели заболеваемости отмечаются у мужчин в возрасте старше 60 лет – до 7,0 на 100 000 населения.
Показатели смертности от внутриглазной меланомы в Челябинской области (при сроках наблюдения до 5 лет) составляют 0,05 на 100 000 населения – 0,02% по отношению ко всем умершим от злокачественных новообразований и 2,71% – от меланомы всех локализаций.
Изучение клиники у 152 больных внутриглазной меланомой позволило выявить, что внутриглазная меланома чаще наблюдается у женщин – 82 (54 %), реже у мужчин – 70 (46 %). Пигментная меланома встречается у 145 больных (95,4%), беспигментная – у 7 (4,6%). У 5 (3,3%) больных внутриглазной меланомой на другом глазу имел место невус хориоидеи и радужной оболочки.
Исследование частоты поражения различных отделов увеального тракта показало, что наиболее часто внутриглазная меланома локализуется в хориоидее (90,1%), реже в области цилиарного тела (3,8%) и радужной оболочке (1,4%), у 4,7% больных при первичном обращении к врачу в увеальном тракте процесс носит распространенный характер.
При исследовании распределения больных по стадиям (рис. 2) обращает внимание, что увеальная меланома преимущественно выявляется в III стадии (56,3%), в I и II стадиях процесса – у 38,1% пациентов. Осложненное течение увеальной меланомы мы диагностировали у 116 из 142 (82%) больных, при этом у большинства пациентов (66%) наблюдалось более одного осложнения.
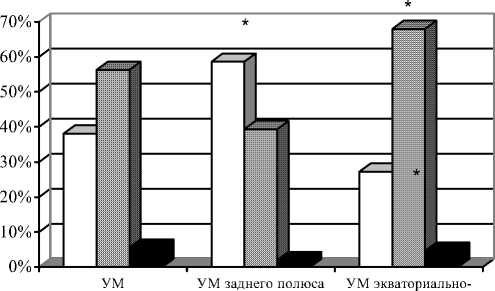
периферической зоны
I-II стадия III стадия IV стадия
Рис. 2. Распределение больных увеальной меланомой (УМ) различных локализаций по стадиям
* Различия между второй и третьей группами статистически достоверны (p<0,05).
Анализ частоты осложнений свидетельствует, что при увеальной меланоме наиболее часто наблюдается отслойка сетчатки (56%), реже диагностируются глаукома (12%), катаракта (12,5%), помутнение стекловидного тела (13%), увеит (5%).
При исследовании гистологических типов строения меланомы нами отмечено преобладание смешанноклеточного (44%) и веретёноклеточного (38%) типов гистологического строения внутриглазной меланомы, эпителиоидный тип наблюдался у 18% больных.
Динамическое наблюдение за больными увеальной меланомой (в том числе получившими лечение в различных лечебных учреждениях) позволило установить особенности клинического течения увеальной меланомы, которое характеризуется возможностью продолженного роста опухоли (11,3%), развитием рецидивов (5%), регионарным (2,8%) и отдалённым метастазированием (2,1%). Летальные исходы в связи с генерализацией процесса отмечены у 2,8% больных при III и IVb стадиях заболевания.
Нами установлены особенности клиники и течения увеальной меланомы различной локализации. Так, увеальная меланома заднего полюса характеризуется ранними сроками обращения больных – в первые 3 мес с момента появления первых жалоб за медицинской помощью обратилось 65,5% больных, наличием низкой остроты зрения при первичном обращении – до 0,1 в 89,3% случаев, развитием различных осложнений – у 72% пациентов. При данной локализации увеальная меланома выявляется достоверно чаще в I–II стадии (58,6%) и достоверно реже – в более поздних III и IV стадих (рис. 2). Средние размеры увеальной меланомы в заднем полюсе по данным УЗИ составляют 11,4 x 6,9 мм.
Увеальная меланома экваториально-периферической зоны глазного дна отличается возможностью бессимптомного начала заболевания, более поздними сроками обращения больных к врачу, 70,4% из них обратилось спустя 3 мес от начала заболевания, более высокой остротой зрения при первичном обращении – 0,2–0,5 и выше (63%), частым развитием (88%) и широким диапазоном осложнений. При данной локализации увеальная меланома преимущественно выявляется в III – 68% (p<0,05) и IV стадиях, средние размеры опухоли составляют 14,9x11,6 мм. Распространённый характер поражения с вовле- чением в процесс двух и более анатомических зон встречается у 7% больных, достоверно чаще наблюдаются рецидивы опухоли (8,3%), регионарное метастазирование (4,7%) и летальность (4,7%).
В зависимости от стадии опухолевого процесса в лечении внутриглазных меланом используются 2 подхода: выполнение радикальных вмешательств – энуклеация глазного яблока, экзентерация орбиты и органосохранные методы: брахитерапия, наружное облучение, блокэксцизии, гипертермия, лазеркоагуляция.
Одним из направлений работы центра является внедрение новых современных технологий в лечение увеальной меланомы, основанных на многофакторном воздействии на опухоль.
Локальное транссклеральное облучение опухоли (брахитерапия) является одним из высокотехнологичных методов в лечении меланом сосудистой оболочки. Приобретение комплекта офтальмоаппликаторов с изотопом 106Ru/Rh, а также наличие в онкологическом диспансере мощной радиологической службы и физико-технического отдела позволило нам внедрить и успешно использовать данный метод лечения.
Оценка показаний к проведению брахитерапии, определение дозы облучения и расчет времени экспозиции осуществляются совместно с радиологом и физиком онкологического учреждения. Доставка офтальмоаппликатора из хранилища, его подшивание выполняются с учетом всех правил радиационной безопасности. Операция (подшивание β-аппликатора) производится под эндотрахеальным наркозом с использованием микрохирургической техники, диафаноско-пии. В послеоперационном периоде больной переводится в радиологическое отделение, где его ежедневно осматривает офтальмолог. При необходимости на месте проводится ультразвуковой контроль соответствия аппликатора основанию опухоли. Удаление аппликатора осуществляется в операционной под местной анестезией, в ряде случаев дополнительно с седатацией.
Нами впервые разработано многокомпонентное лечение внутриглазной меланомы на основе применения радиомодифицирующих препаратов платины в сочетании с брахитерапией. С целью усиления лучевого воздействия на опухоль до операции эписклеральной фиксации офтальмоаппликатора внутривенно вводили 100 мг плати- нола (цисплатина) по следующей схеме: для премедикации с прегидратацией внутримышечно вводили 0,5% р-р сибазона – 2,0 мл, 1% р-р димедрола – 1,0 мл подкожно, эмесет 4 мг внутрь, внутривенно 0,9% р-р хлорида натрия – 400 мл с 16 мг дексаметазона, изотонический р-р хлорида натрия – 400 мл внутривенно; затем внутривенно вводили 100 мг платинола, после чего для постгидратации внутривенно капельно вводили 5% р-р глюкозы – 800 мл. У 92% больных отмечена хорошая переносимость платинола.
Установлено, что в первые 3 мес после брахитерапии с радиомодификацией у большинства больных наблюдается уменьшение проминенции опухоли (61%), отслойки сетчатки по высоте и распространённости (88%), изменение структуры поверхностных слоёв опухоли, рельефа (92%), характера её пигментации (76%); к 6-му мес у всех больных купируются лучевые реакции. Клинические результаты подтверждены данными триплексного сканирования, свидетельствующими, что у большинства больных в сроки до 3 мес наблюдаются уменьшение элевации опухоли на 30– 50 %, изменение её эхоструктуры и акустической плотности опухоли.
Оснащение в 2002 г. офтальмоонкологиче-ского центра диодным офтальмокоагулятором позволило широко внедрить современный высокотехнологичный метод транспупиллярной термотерапии в лечение новообразований сосудистой оболочки (меланом, гемангиом, метастатического поражения). В настоящее время транспупиллярная термотерапия выполнена у 46 больных увеальной меланомой. Предварительный анализ результатов (сроки наблюдения 3–12 мес) свидетельствует о высокой эффективности данной методики в многокомпонентном лечении меланомы сосудистой оболочки.
Энуклеация глазного яблока выполняется при размерах образования, превышающих допустимые для органосохранного лечения, а также клинических признаках распада опухоли. Обязательными условиями для проведения хирургического вмешательства являются эндотрахеальный наркоз и использование микрохирургической техники. Стандартное глазное протезирование осуществляется на 3–5-й день после операции.
Нами разработан комплексный подход к лечению распространённых форм увеальной меланомы (IVа и IVв стадии), который включал вы- полнение хирургического вмешательства в оптимальном объёме (частичная или полная экзентерация орбиты), одномоментный реконструктивно-пластический этап - замещение дефекта орбиты височной мышцей на «питающей ножке» с различными вариантами пластики кожи и слизистой оболочки.
С учётом стандартов лечения больных меланомой и полученных результатов иммунологического исследования (снижение количества CD3, CD4, CD8 лимфоцитов, а также клеток, экспрессирующих маркёры активации HLA-DR) в послеоперационном периоде назначается иммунотерапия реафероном.
Опухоли орбиты среди всех новообразований органа зрения составляют 23–25%, характеризуются значительным полиморфизмом, что можно объяснить присутствием в орбите большого количества различных тканевых структур. Это относится как к первичным новообразованиям, частота которых, по данным литературы, достигает 94,5%, так и к вторичным и метастатическим, которые составляют 5,5% от всех новообразований орбиты [2, 10].
По материалам нашего центра, на долю доброкачественных новообразований орбиты приходится 70%, злокачественных – 10%, вторичных и метастатических – 20%. В структуре доброкачественных опухолей преобладают гемангиомы (40%) и дермоидные кисты (28%), в единичных случаях встречаются фибромы, менингиомы, тератомы. Злокачественные опухоли орбиты представлены злокачественной гемангиоперицитомой, аденокарциномой слезной железы, аденокистозным раком слезной железы, злокачественной фиброзной гистиоцитомой, неходжкинской лимфомой низкой степени злокачественности.
В диагностике новообразований орбиты ведущее место принадлежит таким клиническим симптомам, как диплопия, экзофтальм, нарушение движения глазного яблока, затруднение репозиции, наличие синдрома верхней глазничной щели, определение объемного образования в орбите пальпаторно, диоптрийного симптома.
Алгоритм диагностики новообразований орбит включает последовательное применение ультразвукового исследования на аппаратах Image Point (Hewlett Packerd) и Aloka: серошкального сканирования, доплеровского картирования, импульсно-волновой доплерографии.
Несмотря на высокую информативность данного метода в постановке диагноза опухолей орбиты, подавляющее большинство больных нуждаются в проведении компьютерной томографии орбиты с контрастированием, которая выполняется на спиральном томографе TomoScan-SR-5000 (Phillips) c толщиной скана 1,5–3 мм и шагом томографа 2–3 мм. Данный метод обследования позволяет не только предполагать этиологический диагноз, но и уточнить расположение новообразования в орбите («наружное» или «внутреннее» хирургическое пространство), степень заинтересованности параорбитальных структур. Как правило, диагностика доброкачественных образований орбиты на основании данных УЗИ и КТ не представляет трудностей; при подозрении на злокачественное, вторичное или метастатическое поражение проводится инцизионная хирургическая биопсия, тонкоигольная аспирационная биопсия или прицельная пункционная биопсия. Информативность данных методик варьирует от 58 до 100% [5, 8]. Внедрение в 2002 г. прицельной пункционной биопсии позволило приблизить информативность к 100%.
Лечение опухолей орбиты требует многостороннего подхода, в ряде случаев с участием нейрохирургов, отоларингологов, онкологов, пластических хирургов, химиотерапевтов и радиологов [11]. При доброкачественном характере заболевания выполняется орбитотомия транскутанным или трансконъюнктивальным доступами под эндотрахеальным наркозом.
Комплексный подход к лечению больных со злокачественными новообразованиями орбиты включает оперативное вмешательство с предоперационным и послеоперационным наружным облучением в условиях ООД и нейтронного центра.
В последние десятилетие наблюдается увеличение числа больных с метастатическим поражением органа зрения, что обусловлено ростом онкологической заболеваемости и увеличением продолжительности жизни пациентов, получивших комбинированное лечение по поводу основного заболевания. По нашим данным, внутриглазные метастазы диагностированы у 1,5% офтальмоонкологических больных, а скрининговые офтальмологические исследования у пациентов с раком молочной железы по- зволили выявить метастазы в сосудистую оболочку у 6,6% исследуемых.
Внутриглазные метастазы в сосудистую оболочку и иридоцилиарную зону выявлены нами у больных раком молочной железы (87%), легких и урогенитального тракта; средний возраст пациентов составил 49,5 ± 6,2 лет.
При первичном обращении к офтальмологу больные жалуются на снижение зрения, диплопию, появление «завесы», искажение предметов и наличие пятна на одном или обоих глазах. Острота зрения варьирует от 0,1 до 0,8; исследование полей зрения позволяет выявить центральную, парацентральную скотому, сужение его границ.
Внутриглазные метастазы при раке молочной железы наблюдаются у пациентов, преимущественно в Т 3-4 N 1 M х , реже – во Т 2 N 1 M х стадии основного заболевания. При офтальмоскопическом осмотре в центральных, реже экваториальных отделах сетчатки выявляются слегка проминирующие очаги крупных размеров (4–8 диаметров диска зрительного нерва), с нечеткими границами, желтовато-белого цвета, умеренным количеством отдельных пятнистых скоплений коричневого пигмента по типу «следов рыси», у половины пациентов выявлена вторичная отслойка сетчатки. При ультрасонографическом исследовании, проводимом на офтальмологическом аппарате А–В Scan–835 фирмы «Champhry», в задних отделах глаза визуализируется плюс ткань неоднородной эхоструктуры, с проминенцией от 2 до 5,5 мм, протяженностью 7–16 мм, отслойка сетчатки определяется как пленчатое образование, фиксированное у диска зрительного нерва, неподвижное, отстоящее от хориоидеи на 9–12 мм, распространенное до экваториальных отделов. Наш клинический опыт свидетельствует о необходимости тщательного офтальмологического осмотра у онкологических больных, квалифицированного ультрасонографического исследования при подозрении на внутриглазные метастазы.
Одной из актуальных проблем в офтальмоонкологии является оказание специализированной высокотехнологичной помощи детям с опухолями органа зрения. По предварительным данным, в г. Челябинске и области ежегодно выявляется 3–5 случаев ретинобластомы, единичные случаи злокачественных опухолей орбиты. Возможности онкологического диспансера, тесное взаимодействие в работе с детским гематологическим центром позволяют нам осуществлять квалифицированную помощь детям с офтальмоон-кологической патологией.
Таким образом, создание офтальмоонколо-гического центра на базе областного онкологического диспансера позволяет осуществлять раннюю диагностику первичных и вторичных опухолей органа зрения, проводить многокомпонентное лечение, диспансеризацию данной группы больных, а также оказывать квалифицированную офтальмологическую помощь пациентам с экстраокулярной онкологической патологией.


