Специфичность изменения состава липидов субклеточных мембран Hydrilla verticillata под действием ионов кадмия
Автор: Розенцвет О.А., Нестеров В.Н., Розенцвет В.А.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Прикладная экология
Статья в выпуске: 1-1 т.14, 2012 года.
Бесплатный доступ
Исследовали влияние ионов кадмия на состав липидов хлоропластов, митохондрий и микросом водного растения Hydrilla verticillata. Установлено, что наиболее высокое количество суммарных липидов содержит фракция хлоропластов, а наименьшее - фракция митохондрий. В составе жирных кислот липидов хлоропластов обнаружено более высокое содержание линоленовой кислоты, а в липидах митохондрий и микросом - линолевой кислоты. Мембраны митохондрий и микросом, в отличие от фракции хлоропластов, в большей степени обогащены стеринами. Под действием ионов кадмия снижалось общее количество липидов и изменялся их состав. Во фракции микросом и митохондрий уменьшалось относительное содержание фосфатидилхолина и фосфатидилинозита и увеличивалось содержание фосфатидиоэтаноламина в период 1-3 ч и фосфатидной кислоты к 24 ч экспозиции. В липидах фракции хлоропластов наблюдали разнонаправленные изменения: содержание сульфолипида в период 1-3 ч было достоверно выше, а моно- и дигалактозилдиацилглицеринов- ниже контроля. При более длительной экспозиции (24 ч) относительное содержание гликолипидов увеличивалось по сравнению с контролем. Таким образом, специфичность изменения состава липидов зависела от количества кадмия, содержащегося в клетках растений, времени инкубации и типа внутриклеточного компартмента.
Кадмий, липиды, жирные кислоты
Короткий адрес: https://sciup.org/148200557
IDR: 148200557 | УДК: 628.581.13.577.7.15
Текст научной статьи Специфичность изменения состава липидов субклеточных мембран Hydrilla verticillata под действием ионов кадмия
Среди многочисленных загрязнителей окружающей среды наиболее токсичными для живых организмов, в том числе растений, являются тяжелые металлы (ТМ). Приоритетными металла-ми-токсикантами считают кадмий, ртуть, свинец, мышьяк [3]. Кадмий, хотя и не является необходимым для жизни растений элементом, активно поглощается, легко транспортируется и накапливается во всех органах растения [1]. Поступление кадмия в биосферу происходит путем аэрозольных выбросов и промышленных стоков предприятий, использование химических средств защиты растений в сельском хозяйстве. Конечным резервуаром для многочисленных поллютантов является, как правило, водная среда [2, 3].
Высшие водные растения представляют собой важнейший компонент водных экосистем. Они принимают участие в процессах обмена биогенных элементов и самоочищения воды, способны накапливать и трансформировать органические и неорганические поллютанты. Известно, что одним из видов, способных перераспределять ТМ в водной экосистеме является Hydrilla verticil-lata (L. fil.) Royle [9]. Это водное растение способно извлекать из водной среды токсичные металлы, что указывает на наличие у данного вида определенных механизмов устойчивости [14, 18].
Известно, что особую роль в формировании ответа растительной клетки на действие ТМ играют клеточные мембраны, основой которых яв-
ляются фосфо- (ФЛ) и гликолипиды (ГЛ), а также некоторые нейтральные липиды [12]. Под воздействием факторов окружающей среды происходят изменения в липидном и жирнокислотном составе мембран растений, что отражается на процессах жизнедеятельности, ассоциированных с ними. Метаболизм липидов тесно связан с дыханием, фотосинтезом, стрессовой реакцией и другими физиологическими процессами [8]. В частности, одним из самых ранних проявлений негативного действия кадмия является нарушение целостности мембран, что ведет к разрушению клетки и ее органелл. В то же время устойчивые к действию ТМ растения обладают эффективными механизмами детоксикации и регуляции состояния мембран за счет модуляции липидов [16].
Структурные свойства мембран и их локализация внутри клетки различаются в зависимости от выполняемых функций [4]. Однако специфичность ответа липидов, являющихся структурной основой мембран различных внутриклеточных органелл, исследована недостаточно.
Цель работы состояла в изучении влияния ионов кадмия на состав липидов субклеточных мембран – хлоропластов, митохондрий и микросом – водного погруженного растения H. verticil-lata.
МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проводили на растениях H. verticillata (гидрилла мутовчатая) из сем. Hydrocharitaceae (водокрасовые). Растения выращивали в лабораторных условиях на 5% среде Хогланда-Арнона. Перед началом эксперимента побеги растений разрезали на фрагменты весом 4–5 г и помещали в вегетационные сосуды c отстоянной водопроводной водой объемом 1 л. В опытные варианты добавляли соли Cd(NO3)2 в концентрации 100 мкМ. Данная концентрация выбрана, исходя из ранее исследованных концентрационных и временных зависимостей влияния ТМ на липидный, белковый и пигментный метаболизм водных растений [10]. Растения инкубировали при температуре 20оС в условиях освещенности 1400 ± 200 лк при 10 часовом световом дне. По истечении заданного времени (1, 3 и 24 ч) растения промывали в проточной воде, гомогенизировали в охлажденной среде выделения (0,5 М сахарозы, 50 мМ трис-НС1, 5 мМ ЭДТА, 5 мкМ β-меркаптоэтанола, рН 7.8) и фильтровали через 3 слоя марли. Гомогенат центрифугировали 10 мин. при 500 g для получения фракции хлоропластов. Супернатант центрифугировали 15 мин. при 15 000 g с получением в осадке митохондриальной фракции. Из супернатанта осаждали общую микросомальную фракцию при 80 000 g 1 ч. Осадки мембран ресуспендировали в среде, включающей 0,5 М сахарозы, 5 мМ трис-НСl, рН 7,2. Мембранные липиды извлекали из разделенных фракций.
Липиды трижды экстрагировали смесью хлороформа и метанола (1:2, по объему) [13]. Объединенные экстракты отмывали от нелипидных примесей, растворитель отгоняли на роторновакуумном испарителе.
Липиды очищали методом ТСХ с использованием различных систем растворителей [10]. Количество ФЛ проводили по содержанию неорганического фосфора [19], ГЛ и стеринов (СТ) анализировали на денситометре «ДенСкан-04» (Россия).
Жирные кислоты анализировали в виде их метиловых эфиров на хроматографе «Кристалл 5000.1» («Хроматэк», Россия) с использованием капиллярной колонки длиной 105 м и диаметром 0,25 мм («RESTEK», США) в изотермическом режиме [10]. Температура колонки - 180о, испарителя и детектора - 260о. Скорость тока газа-носителя (гелий) - 2 мл/мин.
Количество кадмия в тканях H. verticillata определяли на атомно-абсорбционном спектрометре МГА-915 («ЛЮМЭКС», Россия) после мокрого озоления растительного материала [5].
В таблицах и рисунках приведены средние арифметические значения измеряемых величин из трех независимых биологических повторностей и их стандартные ошибки. Достоверность различий оценивали на основании t-критерия Стьюдента при доверительном интервале P ≤ 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Экспозиция растений в среде содержащей нитрат кадмия не вызывала видимых признаков повреждения растений. Содержание кадмия в тканях H. verticillata повышалось с 1,2 до 8,5 мг/г сухой массы в зависимости от времени экспозиции (рис. 1).
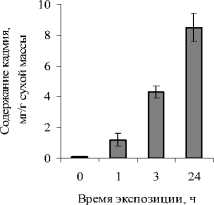
Рис. 1. Содержание кадмия в тканях H. verticillata
Для анализа влияния кадмия на мембраны H. verticillata из тканей растений были выделены фракции, обогащенные хлоропластами, митохондриями и микросомами. Количество суммарных липидов уменьшалось в ряду: хлоропласты > микросомы > митохондрии. По мере накопления кадмия в клетках растений содержание липидов в субклеточных фракциях снижалось для хлоропластов на 20-60%, а для микросом и митохондрий на 16-30% (рис. 2). В то же время в микросомах наблюдали некоторое увеличение количества липидов через 3 ч экспозиции растений.
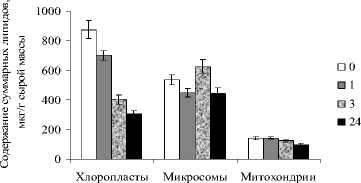
Рис. 2. Влияние кадмия на содержание суммарных липидов субклеточных мембран H. verticillat: продолжительность инкубации – 0 (контроль), 1, 3 и 24 ч.
Анализ состава жирных кислот суммарных липидов в каждой из фракций показал, что главными кислотами являются С 16:0 (18–27%), С 18:3n3 (29–52%), С 18:2n6 (11–18%) (табл. 1). В хлоропластах наблюдалось более высокое содержание линоленовой (52%) кислоты, а в митохондриях – линолевой кислоты (18%). Митохондрии и микросомы имели приблизительно одинаковый индекс ненасыщенности ацильных цепей липидов – 1,4 и 1,3 соответственно.
Под действием нитрата кадмия в липидах хлоропластов через 1 ч экспозиции увеличивалось содержание насыщенных жирных кислот. Так, в хлоропластах контрольных вариантов соотношение С 18:3 /С 16:0 составляло 2,9. Под действием кадмия это соотношение снижалось и через 24 ч экспозиции становилось равным 1,0. Для ЖК липидов микросом и митохондрий было отмечено небольшое изменение соотношения кислот С 18:2n6 и С 18:3n3 , в то время как содержание кислоты С 16:0 оставалось примерно на одном уровне.
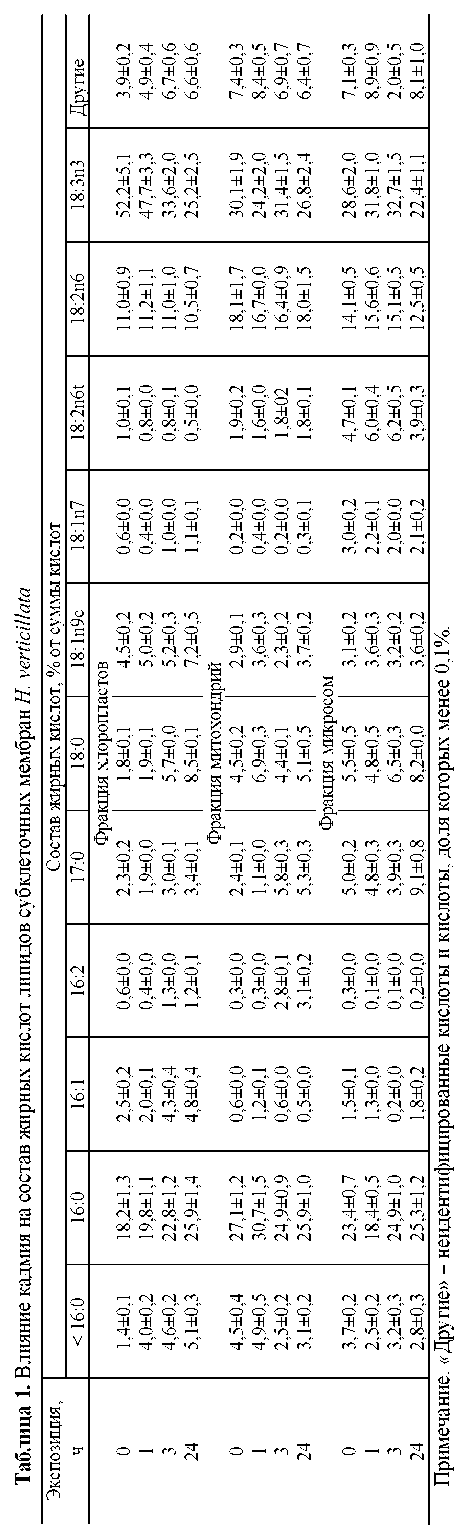
Таблица 2. Влияние кадмия на состав липидов субклеточных мембран H. verticillate
|
Липиды |
Состав липидов, % от суммы |
|||
|
0 |
1 |
3 |
24 |
|
|
МГДГ |
38,4±3,0 |
Фракция хл< 43,7±4,1 |
ропластов 31,2±2,8 |
49,1±3,8 |
|
ДГДГ |
16,1±1,5 |
20,4±1,7 |
16,4±1,6 |
19,7±1,8 |
|
СХДГ |
3,4±0,3 |
4,3±0,3 |
4,5±0,1 |
2,0±0,2 |
|
ФГ |
19,5±1,0 |
18,8±0,6 |
22,3±1,1 |
12,8±1,1 |
|
ФХ |
9,3±0,3 |
6,9±0,4 |
11,2±1,0 |
5,9±0,6 |
|
ФЭ |
5,1±0,6 |
1,7±0,1 |
5,2±0,5 |
3,9±0,3 |
|
ФИ |
3,2±0,2 |
2,7±0,2 |
4,0±0,3 |
1,0±0,0 |
|
ФК |
2,2±0,2 |
0 |
1,5±0,0 |
2,3±0,0 |
|
ДФГ |
0,7±0,0 |
0,6±0,0 |
0,7±0,0 |
0,3±0,0 |
|
СТ |
2,1±0,4 |
0,9±0,1 |
3,0±0,1 |
3,0±0,1 |
|
МГДГ |
23,1±2,2 |
Фракция ми 29,4±3,0 |
тохондрий 30,9±3,0 |
30,0±3,0 |
|
ДГДГ |
14,7±1,4 |
16,8±1,3 |
19,0±1,2 |
18,0±1,8 |
|
ФГ |
4,2±0,0 |
2,1±0,0 |
2,4±0,0 |
3,0±0,0 |
|
ФХ |
23,1±2,3 |
27,3±2,5 |
14,3±0,0 |
18,0±2,9 |
|
ФЭ |
16,8±0,8 |
14,7±2,0 |
11,9±0,8 |
9,0±0,0 |
|
ФИ |
1,4±0,0 |
0,7±0,0 |
0,8±0,0 |
1,0±0,0 |
|
ФК |
4,2±0,0 |
0,7±0,0 |
3,2±0,0 |
12,0±0,1 |
|
ДФГ |
2,1±0,0 |
0 |
0,8±0,0 |
0 |
|
СТ |
10,4±0,5 |
8,3±0,7 |
16,7±0,8 |
9,0±1,0 |
|
МГДГ |
17,9±1,8 |
Фракция м 21,3±1,2 |
икросом 15,8±1,4 |
20,9±1,2 |
|
ДГДГ |
10,6±1,0 |
9,3±0,9 |
10,1±0,9 |
7,4±0,7 |
|
ФГ |
9,5±0,7 |
4,7±0,3 |
10,9±1,1 |
2,9±0,0 |
|
ФХ |
24,6±2,0 |
23,3±2,0 |
20,6±2,0 |
19,5±1,0 |
|
ФЭ |
22,4±0,8 |
28,1±2,4 |
27,8±2,5 |
23,5±2,1 |
|
ФИ |
2,6±0,1 |
0 |
0,3±0,0 |
0 |
|
ФК |
3,6±0,2 |
4,0±0,1 |
4,6±0,5 |
11,7±1,1 |
|
ДФГ |
0,4±0,0 |
0 |
0,8±0,1 |
0 |
|
СТ |
8,4±0,7 |
9,3±0,4 |
9,1±0,9 |
14,1±0,6 |
Примечание: 0 - отсутствие кадмия в среде выращивания; 1, 3, 24 ч - продолжительность воздействия кадмия.
Изменения в относительном содержании индивидуальных классов липидов соответствующих фракций, вызванных действием кадмия, представлены в табл. 2. Фракция микросом обычно включает элементы мембран плазма-леммы, эндоплазматического ретикулума, тонопласта, аппарата Гольджи и др. [4]. Из данных табл. 2 можно видеть, что в составе липидов этой фракции главными были фосфатидилхолин (ФХ) и фосфатидилэтаноламин (ФЭ) (39% и 36% от суммы фосфолипидов соответственно). Кроме них в составе липидов присутствовали фосфатидилглицерин (ФГ), фосфатидилинозит (ФИ), фосфатидная кислота (ФК) и примерно 30% ГЛ. Под действием ионов кадмия постепенно снижалось относительное содержание ФХ и ФИ. При этом относительное содержание ФЭ увеличивалось в период 1-3 ч инкубации, но уменьшалось через 24 ч. На фоне снижения содержания ФХ и ФЭ происходило 3-кратное увеличение содержания ФК после 24 ч экспозиции растений в среде, содержащей кадмий. Кроме того под действием кадмия была обнаружена тенденция к увеличению содержания СТ 8% до 14%.
Как и следовало ожидать, главными липидами хлоропластов были моногалактозилдиацилг-лицерин (МГДГ), дигалактозилдиацилглицерин (ДГДГ), сульфохиновозилдиацилглицерин (СХДГ) и ФГ (табл. 2) [17]. Их содержание составляло 77% от суммы липидов. Среди фосфолипидов хлоропластов доминировал ФГ (49% от суммы фосфолипидов). В липидах микросом и хлоропластов наблюдали разнонаправленные изменения. Например, содержание СХДГ в период 1-3 ч инкубации было достоверно выше контроля, а через 24 ч содержание данного липида уменьшалось и становилось ниже контрольных значений. В изменении относительного содержания МГДГ и ДГДГ не выявлено отчетливых тенденций.
В поведении фосфолипидов хлоропластов обнаруживалась аналогичная картина: относительный вклад ФГ, ФХ, ФЭ и ФИ после 1 ч экспозиции снижался, через 3 ч – увеличивался и вновь снижался к 24 ч. Все эти изменения происходили на фоне постепенного увеличения содержания кадмия в клетках растений.
Преобладающим классом липидов митохондрий также как и микросом были ФХ и ФЭ. Их содержание составляло 5% и 36% соответственно от суммы фосфолипидов. В отличие от мембранных структур хлоропластов, мембраны митохондрий и микросом в большей степени были обогащены СТ (10% и 8% от общего содержания липидов соответственно). Особенностью изменения состава липидов митохондрий было 3-кратное повышение содержания ФК после 24 ч инкубации (табл. 2). Относительное содержание ФЭ в липидах митохондрий снижалось при воздействии кадмия с 17% до 9% по сравнению с контролем. Максимальные значения относительного содержания СТ во фракции митохондрий зафиксированы через 3 ч.
Таким образом, специфичность изменения состава липидов в значительной степени зависели от типа внутриклеточного компартмента и времени инкубации H. verticillata в среде, содержащей кадмий.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в ходе исследования данные показали, что водное растение H. verticillata проявляет устойчивость к действию кадмия, которая, по-видимому, связана со структурнофункциональными свойствами мембран и их локализацией внутри клетки. Это отчетливо видно по изменению суммарных липидов под действием ионов кадмия в отдельных фракциях, соответствующих различным клеточным ком-партментам (рис. 2). Наибольший негативный эффект ионы кадмия оказывали на липиды хлоропластов. Количество липидов в мембранах микросом и митохондрий снижалось не более чем на 16-30%, а во фракции микросом после 3 ч инкубации даже увеличивалось. Полученные данные свидетельствуют, что липиды хлоропластов наиболее подвержены адаптивному изменению при воздействии ионов кадмия, в отличие от липидов микросом и митохондрий. Можно предположить, что разные концентрации кадмия, накапливаемого в клетках растений, вызывали неоднозначное влияние на метаболизм ГЛ и ФЛ.
Известно, что ФЛ являются главными липидами плазмалеммы и других непластидных эндомембран и одними из первых реагируют на изменения в среде обитания [7, 12, 15]. Действие ионов кадмия на H. verticillata приводило к освобождению ФК, которая, выступая в роли вторичного посредника способна передавать сигнальный импульс и вызывать в конечном итоге экспрессию защитных генов [11]. Повышение содержания ФК происходит при активации фосфолипаз, субстратом для которых служат ФХ, ФЭ, ФГ. По результатам наших экспериментов можно предположить, что увеличение относительного содержания ФК во фракции микросом (табл. 2) свидетельствует об участии этих структурных липидов в регуляции состояния мембран. Кроме того, ФК может выступать не только в качестве вторичного мессенджера в передаче сигнала, но и участвовать в процессе синтеза липидов de novo и тем самым влиять на физическое состояние мембран [20]. Следует подчеркнуть, что изменение функциональной активности клеточных мембран при воздействии на них ионов металлов отражает совокупность как процессов деградации биомолекул, так и процессов, направленных, на регуляцию клеточного метаболизма [9]. Увеличение количества ФЛ в микросомах и МГДГ, и ФГ в хлоропластах, свидетельствуют о возможной компенсаторной активации синтеза липидов в то время, когда концентрация накопленного кадмия не превышала 4,3 мг/г сухой массы (табл. 2). При более высоком накоплении кадмия в клетках растений, приводило к снижению содержания суммарных (рис. 2) и индивидуальных классов липидов (табл. 2), что, по-видимому, отражает преобладание процессов катаболизма в метаболизме липидов.
Известно, что одним из способов регулирования физического состояния мембран является увеличение относительного содержания СТ, которые встраиваются в мембраны и регулируют физическое состояние бислоя [6]. При инкубации H. verticillata в среде, содержащей кадмий, было также обнаружено существенное увеличение относительного содержания СТ в микросомах и митохондриях (на 27-40% по сравнению с контролем) (табл. 2).
Помимо изменения уровня СТ и соотношения ФЛ, регуляция физического состояния мембран и их проницаемости контролируется уровнем ненасыщенности жирных кислот липидов [16]. В проведенных экспериментах было зафиксировано повышение уровня насыщенных кислот (пальмитиновой С16:0 и стеариновой С18:0) в хлоропластах за счет снижения относительного содержания линоленовой кислоты С18:3n3. В митохондриях и микросомах состав жирных кислот менялся менее значительно, чем в хлоропластах. Уровень кислоты С18:3n3 снижался не более чем на 20% и только после 24 ч инкубации (табл. 1). По-видимому, данный механизм контроля целостности мембраны, и как следствие ее проницаемости, в наших экспериментах реализуется только на мембранах хлоропластов.
Таким образом, изменения состава липидов и степени ненасыщенности их жирных кислот являются специфическими для различных субклеточных мембранных систем. Регуляция состояния мембран хлоропластов при воздействии кадмия происходит с помощью изменения состава жирных кислот (насыщен-ные/ненасыщенные) и ГЛ; микросом и митохондрий – возрастанием содержания СТ снижением относительного содержания ФХ и увеличением ФК.
Список литературы Специфичность изменения состава липидов субклеточных мембран Hydrilla verticillata под действием ионов кадмия
- Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л.: Агропромиздат, 1987. 232 с.
- Брагинский Л.П. Принципы классификации и некоторые механизмы структурно-функциональных перестроек пресноводных экосистем в условиях антропогенного пресса//Гидробиологический журнал. 1998. Т. 34. № 6. С. 72-93.
- Будников Г.К. Тяжелые металлы в экологическом мониторинге водных систем//Соросовский образовательный журнал. 1998. № 5. С. 23-29.
- Геннис Р. Биомембраны: молекулярная структура и функции. М.: Мир, 1997. 624 с.
- Голубкина Н.А. Флуорометрический метод определения селена//Журн. аналит. химии. 1995. Т. 50. С. 492-497.
- Иванова А.Б., Гордон Л.Х., Лыгин А.В. Роль структурных липидов в регуляции ионного транспорта растительных клеток//Цитология. 1997. Т. 39. № 4/5. С. 285-293.
- Ипатова В.И. Адаптация водных растений к стрессовым абиотическим факторам среды. М.: Графиконпринт, 2005. 224 с.
- Кириченко К.А., Побежимова Т.П., Соколова Н.А., Столбикова А.В., Дударева Л.В., Войников В.К. Жирнокислотный состав общих липидов высших водных растений из реки ангары//Химия растительного сырья. 2011. № 2. С. 97-102.
- Микроэлементы в окружающей среде: биогеохимия, биотехнология и биоремедиация/Под ред. М.Н.В. Прасада, К.С. Саджвана, Р. Найду. М.: ФИЗМАТЛИТ, 2009. 816 с.
- Розенцвет О.А., Мурзаева С.В., Гущина И.А. Роль мембранных липидов в устойчивости Potamogeton perfoliatus L. к избытку кадмия в воде//Изв. РАН. Сер. биол. 2004. Т. 6. С. 232-239.
- Тарчевкий И.А. Сигнальные системы клеток растений. М.: Наука, 2002. 294 с.
- Чиркова Т.В. Физиологические основы устойчивости растений. С-Петербург: издательство С-Петербургского Университета, 2002. 244 с.
- Bligh E.G., Dyer W.J. A Rapid Method of Total Lipid Extraction and Purification//Can. J. Biochem. Physiol. 1959. V. 37. P. 911-917.
- Gupta M., Sinha, S., Chandra P. Copper-induced Toxicity in Aquatic Macrophyte Hydrilla verticillata: Effect of pH//Ecotoxicology. 1996. V. 5. P. 23-33.
- Hall J.L. Cellular mechanisms for heavy metal detoxification and tolerance//J. Exp. Bot. 2002. V. 53. № 366. P. 1-11.
- Rama Devi S., Prasad M.N.V. Heavy metal stress in plants. From molecules to ecosystems. Berlin: Springer, 1999. P. 99-117.
- Siegenthaler P.-A. Murata N. Lipids in Photosynthesis: Structure, Function and Genetics. Dordrecht: Kluwer Acad. Publ., 1998. P. 321.
- Sinha S., Pandey K. Nickel Induced Toxicity Effects and Bioaccumulation in the Submerged Plant Hydrilla verticillata (L.F.) Royle under Repeated Metal Exposure//Bull. Environ. Contamin. and Toxicol. 2003. V. 71. P. 1175-1183.
- Vaskovsky V.E., Latyshev N.A. Modified Jungnickel's Reagent for Detecting Phospholipids and Other Phosphorus Compounds on Thin-layer Chromatograms//J. Chromatogr. 1975. V. 115. P. 246-249.
- Wang X., Devaiah Sh.P., Zhang W., Welti, R. Signaling Functions of Phosphatidic Acid//Prog. Lipid Res. 2006. V. 45. P. 250-278.


