Спектральное проявление взаимодействия гидроксильных групп фенолов-антиаксидантов с растворителями
Автор: Русских Ирина Владимировна, Писарева Светлана Ивановна, Рябова Наталья Викторовна
Журнал: Science for Education Today @sciforedu
Рубрика: Биологические, химические, медицинские науки
Статья в выпуске: 5 (15), 2013 года.
Бесплатный доступ
В статье исследованы спектрально-структурные характеристики пространственно-затрудненных фенолов в хлорсодержащих и ароматических растворителях методом ИК-спектроскопии. Цель работы – исследование спектральных проявлений водородных связей гидроксильных групп пространственно-затрудненных фенолов с хлорсодержащими и ароматическими углеводородами. Известно, что в фенолах экранирование объемными заместителями не позволяет гидроксильным группам образовывать межмолекулярные водородные связи. Именно этим обусловлен выбор таких структур в качестве присадок, ингибирующих окисление углеводородов. Тем не менее, введение пространственно-затрудненных фенолов в углеводородную систему может повлиять на установившийся порядок межмолекулярных взаимодействий и изменить спектральные характеристики фенолов. В работе было обнаружено, что при равных концентрациях фенолов полосы поглощения растворов в диапазоне 3700-3200 см -1 отличаются по интенсивности и по положению максимумов в зависимости от полярности и типа растворителя. Изменения спектральных характеристик обусловлены межмолекулярными взаимодействиями гидроксильных групп фенолов с растворителями.
Пространственно-затрудненные фенолы, хлорсодержащие и ароматические растворители, межмолекулярные и внутримолекулярные взаимодействия, ик-спектроскопия, водородные связи
Короткий адрес: https://sciup.org/147137492
IDR: 147137492 | УДК: 543.42
Текст научной статьи Спектральное проявление взаимодействия гидроксильных групп фенолов-антиаксидантов с растворителями
Электронный журнал «Вестник Новосибирского государственного педагогического университета» 5(15) 2013 ISSN 2226-3365
Введение.
Наиболее распространенными ингибиторами, применяемыми для предотвращения окисления различных углеводородных систем – моторных топлив, смазочных масел, пищевых продуктов, полимерных материалов и покрытий, являются соединения класса пространственно-затрудненных фенолов (ПЗФ) [1]. Известно, что в фенолах экранирование объемными заместителями не позволяет гидроксильным группам образовывать межмолекулярные водородные связи [2]. Именно этим обусловлен выбор таких структур в качестве присадок, ингибирующих окисление углеводородов. Тем не менее, введение ПЗФ в углеводородную систему может повлиять на установившийся порядок межмолекулярных взаимодействий и изменить спектральные характеристики фенолов. В работе [3] методом ИК спектроскопии изучено влияние химической природы растворителя на образование межмолекулярных водородных связей с нефтяными фенолами.
Цель работы – исследование спектральных проявлений водородных связей гидроксильных групп ПЗФ с хлорсодержащими и ароматическими углеводородами.
Объекты и методы исследования.
В качестве объектов исследования выбраны 2,6-ди- трет -бутил-4-метил-фенол
(ионол) – соединение, в котором содержится одна реакционноспособная гидроксильная группа, экранированная с двух сторон трет -бутильными заместителями, и 2,2’-метилен- бис -(4-метил-6- трет -бутил-фенол) (БФ) – соединение, в котором содержатся две реакционноспособные гидроксильные группы, экранированные с двух сторон трет -бутильными заместителями.
ИК cпектры поглощения растворов ПЗФ регистрировали на ИК-Фурье спектрометре Nicolet 5700 (разрешение 4 см-1, число сканов пробы 64) в диапазоне 3700-3200 см-1, в кюветах из NaCl c толщиной поглощающего слоя 0,216 мм. В работе использовали две группы растворителей: хлорсодержащие (четыреххлористый углерод (CCl 4 ), хлороформ (CHCl 3 ), хлористый метилен (CH 2 Cl 2 )) и ароматические углеводороды (бензол, толуол, кумол). Растворители подвергали очистке по общепринятым методикам [4]. Концентрации используемых в работе фенолов составили 0,18·10-3 моль.
Результаты и их обсуждение.
Характеристика ИК полос поглощения гидроксильных групп растворов ионола и БФ в хлорсодержащих и ароматических растворителях приведена в таблицах 1, 2.
Таблица 1.
Характеристика ИК полос поглощения гидроксильных групп растворов ионола.
|
Растворитель |
ν, см 1 |
Оптическая плотность ИК поглощения ОН (своб.) |
|
Четырёххлористый углерод (CCl 4 ) |
3649 |
0,34 |
|
Хлороформ (CHCl 3 ) |
3643 |
0,29 |
|
Хлористый метилен (СН 2 Cl 2 ) |
3638 |
0,24 |
|
Бензол (C 6 H 6 ) |
3637 |
0,23 |
|
Толуол (C 7 H 8 ) |
3637 |
0,23 |
|
Кумол (C 9 H 12 ) |
3643 |
0,19 |
|
Примечание: ν – частота максимума полосы поглощения в ИК спектрах растворов ионола в области валентных колебаний ОН-группы |
||
Все права защищены

Таблица 2.
Характеристика ИК полос поглощения гидроксильных групп растворов БФ.
|
Растворитель |
ν, см 1 |
Оптическая плотность в областях спектра ИК поглощения |
|||
|
ОН (своб.) |
ОН… π связь |
ОН (внутримол.) |
ОН (межмол.) |
||
|
Четырёххлористый углерод (CCl 4 ) |
3631, 3508, 3440 |
0,32 |
- |
0,69 |
0,31 |
|
Хлороформ (CHCl 3 ) |
3622, 3508, 3438 |
0,46 |
- |
0,33 |
0,38 |
|
Хлористый метилен (СН 2 Cl 2 ) |
3620, 3508, 3435 |
0,60 |
- |
0,42 |
0,54 |
|
Бензол (C 6 H 6 ) |
3612, 3573, 3504, 3427 |
0,39 |
0,26 |
0,59 |
0,44 |
|
Толуол (C 7 H 8 ) |
3612, 3573, 3504, 3437 |
0,35 |
0,29 |
0,58 |
0,40 |
|
Кумол (C 9 H 12 ) |
3610, 3573, 3504, 3437 |
0,31 |
0,27 |
0,63 |
0,39 |
Примечание: ν – частота максимума полос поглощения в ИК спектрах растворов БФ в области валентных колебаний ОН-группы
5(15) 2013
ISSN 2226-3365
Фрагменты ИК спектров растворов ПЗФ в четыреххлористом углероде, хлороформе, бензоле, представленные на рисунках 1, 2 демонстрируют различные виды водородной связи, о чем свидетельствуют полосы поглощения в этой области: 3649-3637 см-1 для ионола, 3631-3612, 3573, 3508-3504,
3440-3427 см-1
концентрациях
для БФ. При равных фенолов во всех растворителях полосы поглощения растворов как для ионола, так и для БФ, отличаются по интенсивности и по положению максимумов полос поглощения в зависимости от полярности и типа растворителя [5].
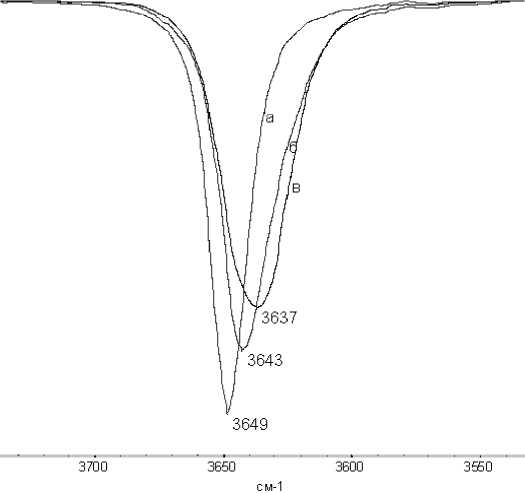
Рисунок 1.
Фрагменты ИК спектров Растворов ионола в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Все права защищены

5(15) 2013
ISSN 2226-3365
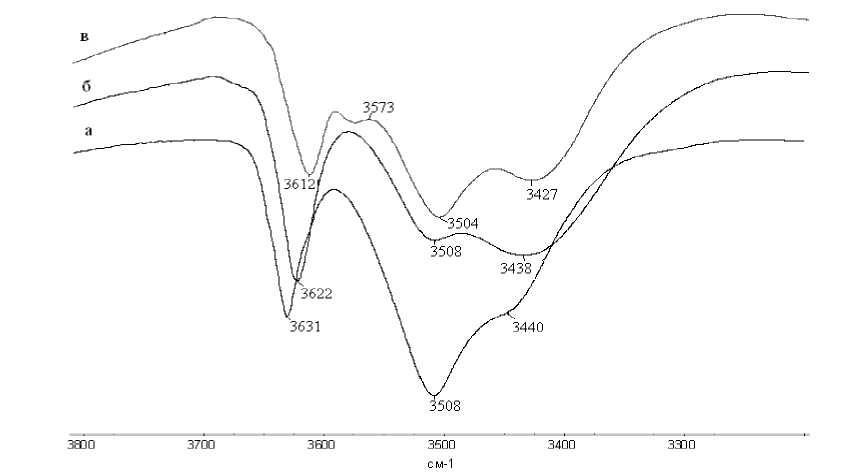
Рисунок 2.
Фрагменты ИК спектров растворов БФ в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
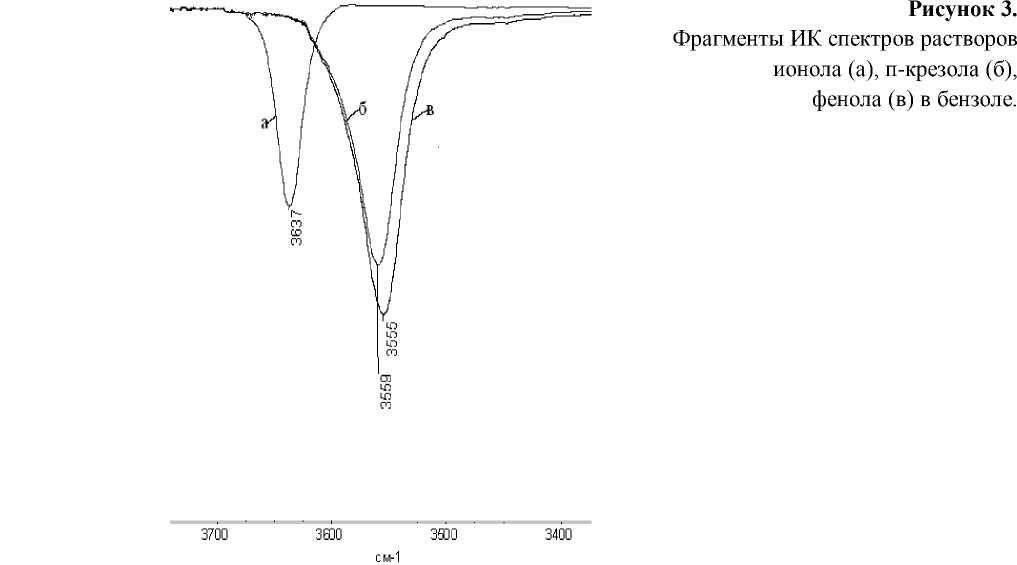
ИК спектры ионола во всех растворителях содержат одну полосу поглощения, соответствующую валентным колебаниям свободной гидроксильной группы (рис. 1, таблица 1), отличающуюся формой. Самая узкая и интенсивная полоса наблюдается в ИК спектре раствора ионола в CCl4, так как CCl4, имеющий дипольный момент, равный 0 [4], не образует межмолекулярных связей с ионолом, являясь инертной средой (рис. 1, а). Хлороформ и хлористый метилен с дипольными моментами 1,87 D (для CHCl3), 1,6 D (для CH2Cl2) [4] являются активными полярными растворителями, кислые протоны которых взаимодействуют с гидроксильными группами ионола, что проявляется на спектре в виде более широкой полосы меньшей интенсивности, смещенной в область низких частот (рис. 1, б). Наиболее широкая и менее интенсивная, еще больше смещенная в длинноволновую область, полоса поглощения, наблюдаемая на рисунке 1, в, является спектральным проявлением межмолекуляр- ного взаимодействия гидроксильных протонов ионола с π-электронной системой ароматических углеводородов (OH…π взаимодействие). В таблице 1 представлены результаты влияния заместителей в ароматических кольцах растворителей на интенсивность и положение максимумов полос поглощения гидроксильной группы ионола. Для бензола и толуола эти значения равны, а для кумола наблюдается уширение и сдвиг полосы поглощения в высокочастотную область, что обусловлено пространственным эффектом метильных групп изопропилбензола. Влияние метильных групп в ароматических кольцах фенолов (на примере фенола, п-крезола, ионола) на межмолекулярное взаимодействие гидроксильных групп с π-электронной системой бензола представлено на рисунке 3. Как следует из рисунка, для п-крезола и фенола наблюдается существенное увеличение интенсивности и сдвиг полосы поглощения в область низких частот, что свидетельствует о более прочном OH…π взаимодействии.
Все права защищены

5(15) 2013 ISSN 2226-3365
ИК спектр раствора БФ в CCl4 содержит узкую полосу поглощения свободной гидроксильной группы в области 3631 см-1. Полоса поглощения 3508 см-1, более интенсивная, чем при 3631 см-1, свидетельствует о том, что большую долю водородной связи БФ в растворе CCl4 составляет внутримолекулярная водородная связь между двумя гидроксильными группами. Положение максимума этой полосы не зависит от полярности растворителя (таблица 2). Полоса поглощения, смещенная в область низких частот - 3440 см-1, характеризует валентные колебания гидроксильных групп в межмолекулярной водородной связи, так как при межмолекулярном взаимодействии влияние пространственного фактора меньше (больше степеней свободы во взаимном расположении двух молекул БФ относительно друг друга и связь О…Н прочнее). Положение максимума полосы межмолекулярной водородной связи зависит от полярности растворителя (таблица 2) [4].
Так, в инертном растворителе CCl 4 , полоса 3440 см-1 проявляется только в виде плеча на полосе 3508 см-1 (рис. 2, а).
ИК спектры растворов БФ в CHCl3 и CH2Cl2 содержат узкие интенсивные полосы поглощения гидроксильной группы при 3622 и 3620 см-1, соответственно (рис. 2 б, таблица 2). Увеличение интенсивности и сдвиг максимума полос поглощения гидроксильных групп в область низких частот, по сравнению с CCl4 (3631 см-1), с повышением полярности растворителя объясняется взаимодействием их с кислыми протонами CHCl3 и CH2Cl2. В этих растворах также присутствуют полосы поглощения в области 3508 см-1, которые характеризуют внутримолекулярную водородную связь между гидроксильными группами. Увеличение интенсивности полос при 3438 и 3435 см-1, отвечающих за межмолекулярную водородную связь гидроксильных групп БФ, а также стабильность максимума полос поглощения внутримолекулярной водородной связи вполне соответствуют
Все права защищены

5(15) 2013
ISSN 2226-3365
классическим представлениям о том, что увеличение полярности растворителя усиливает интенсивность процесса образования межмолекулярных водородных связей [5, 6].
В ИК спектрах БФ в ароматических растворителях наряду с вышеуказанными полосами поглощения появляется новая полоса 3573 см-1 меньшей интенсивности, которая является спектральным проявлением межмолекулярного взаимодействия гидроксильных протонов БФ с π-электронной системой ароматических углеводородов (OH…π взаимодействие) (рис. 2, в, таблица 2). Теоретически эта связь должна усиливаться с увеличением подвижности р-электронов в ряду: C 6 H 6 < C 7 H 8 < C 9 H 12 [5], однако влияние пространственного эффекта в изопропилбензоле меняет вышеуказанный теоретический ряд: C 6 H 6 < C 9 H 12 < C 7 H 8 , что подтверждается значениями оптических плотностей полос поглощения (таблица 2).
Заключение.
Анализ спектральных характеристик растворов пространственно-затрудненных фенолов показал, что на проявление межмолекулярных взаимодействий влияет тип и полярность растворителя. Так, CCl4 не способствует образованию межмолекулярных водородных связей в растворах фенолов, являясь инертной средой. С повышением полярности хлорсодержащих растворителей наблюдается увеличение интенсивности и сдвиг максимума полос поглощения гидроксильных групп в область низких частот, что объясняется межмолекулярным взаимодействием их с кислыми протонами CHCl3 и CH2Cl2. В растворах ароматических углеводородов обнаружено межмолекулярное взаимодействие гидроксильных протонов фенолов с π-электронной системой ароматических углеводородов. В полярных хлорсодержащих и ароматических растворителях БФ содержит смесь соединений с внутримолекулярной (3504 см-1) и межмолекулярной (3573, 3427 см-1) водородных связей, находящихся в лабильном динамическом равновесии.
Список литературы Спектральное проявление взаимодействия гидроксильных групп фенолов-антиаксидантов с растворителями
- Рогинский В. А. Фенольные антиоксиданты. Реакционная способность и эффективность. -М.: Наука, 1988. -247 с.
- Четкина Л. А., Соболев А. Н., Бельский В. К., Заводник В. Е., Арзаманова И. Г.,Гурвич Я. А., Старикова О. Ф. Строение фенольных стабилизаторов полимеров. VIII. Структура кристаллов моноакрилата 2,2’-метилен-бис-(4-метил-6-трет-бутил-фенола)//Журнал структурной химии. -1991. -Т. 32. -№ 5. -С. 162-164.
- Писарева С. И., Русских И. В. Влияние природы растворителя на образование ассоциатов с внутри-и межмолекулярными водородными связями в растворах нефти//Нефтехимия. -2012. -Т. 52. -№ 3. -С. 191-195.
- Гордон А., Форд Р. Спутник химика. -М.: Мир, 1976. -541 с.
- Беллами Л. Новые данные по ИК-спектрам сложных молекул/пер. с англ. В. М. Акимова, Э. Г. Тетерина//под ред. Ю. А. Пентина. -М.: Мир, 1971. -318 с.
- Наканиси К. Инфракрасные спектры и строение органических соединений/пер. с англ. Н. Б. Куплетской и Л. М. Эпштейн//под ред. А. А. Мальцева. -М.: Мир, 1965. -21 с.


