Спектральные линзы для выделения кровеносных сосудов на коже
Автор: Хамза Мохаммед Мохей, Бланк Вероника Александровна, Подлипнов Владимир Владимирович, Досколович Леонид Леонидович, Скиданов Роман Васильевич, Фан Б.
Журнал: Компьютерная оптика @computer-optics
Рубрика: Дифракционная оптика, оптические технологии
Статья в выпуске: 6 т.46, 2022 года.
Бесплатный доступ
Представлен лабораторный макет для визуализации кровеносных сосудов на коже человека. Для выделения кровеносных сосудов на коже используется дифракционный оптический элемент нового типа - спектральная линза. Показано, что визуализация кровеносных сосудов наиболее эффективна в виде получения индексного изображения по длинам волн 735 нм и 835 нм по формуле, аналогичной формуле расчета индекса NDVI. В работе также используется прикладное программное обеспечение, которое предназначено для решения задач спектрального анализа.
Гиперспектрометр, гиперкуб, спектральный анализ, кровеносные сосуды на коже, спектральная дифракционная линза
Короткий адрес: https://sciup.org/140296237
IDR: 140296237 | DOI: 10.18287/2412-6179-CO-1155
Текст научной статьи Спектральные линзы для выделения кровеносных сосудов на коже
Выделение картины структуры кровеносных сосудов на коже человека является важной практической задачей. Важность решения этой задачи связана с тем, что невозможность точного определения положения сосуда приводит к тому, что 25–50% пациентам требуются многократные попытки введения иглы [1]. Особенно плохо ситуация складывается для детей младше 2 лет. В этом случае с первой попытки получается ввести иглу только 38,9% против 53,5% у взрослых [2]. В результате этого существенно увеличивается и время процедуры, в среднем до 11 минут.
Проблема настолько серьезна, что для ускорения и облегчения проведения процедуры в ряде случаев используется такой сложный метод, как ультразвуковая визуализация в состоянии седации или глубокой седации [3]. Таким образом, визуализация кровеносных сосудов на коже оптическими методами является актуальной проблемой в настоящее время.
Искусственная визуализация кровеносных сосудов осуществлялась с помощью специальной подсветки мощным источником белого света [4]. Однако, как отмечено в [4], метод ограничивается детьми, т.к. даже мощной подсветки недостаточно для плотных тканей у взрослых людей, к тому же метод признан небезопасным для всех участков тела, кроме конечностей, поскольку мощность примерно в 200 Вт концентрируется на относительно небольшом участке тела с помощью волновода. Есть целый ряд работ, в которых используется специальная подсветка в ближнем инфракрасном диапазоне [5– 10]. Но в этих исследованиях так и не получен однозначный результат относительно наиболее эффективной длины волны. Так, в [5] описан метод выделения сосудов на изображении за счет использования специальной узкополосной подсветки с использованием лазерного диода с длиной волны 830 нм, однако в этой работе вместо кожи использован ее модельный объект, что вызывает некоторые сомнения в практической применимости результатов. В [6, 7] утверждается, что контрастное изображение кровеносных сосудов можно получить при использовании инфракрасного излучения из всего спектра, доступного камерам с обычными кремниевыми светочувствительными матрицами от 720 нм до 1100 нм. В работе [8] наилучший результат получен для длины волны 850 нм. В работе [9] получен близкий, но все же отличающийся результат – 880 нм. В работе [10] используется широкодиапазонная подсветка от 760 до 960 нм. Такая несогласованность результатов, очевидно, связана с широким разбросом параметров человеческой кожи, и поэтому существует множество методов выделения кровеносных сосудов на основе инфракрасной подсветки. Анализ публикаций последних лет [11 – 14] показывает, что большинство исследователей руководствуются критерием видимости кровеносных сосудов без объективных числовых параметров, что затрудняет сравнение методов. На это также указывает и обзор коммерчески доступных приборов [15], где демонстрируются рабочие изображения в виде бинарного результата цифровой обработки. Значитель- ное количество объективных числовых параметров присутствует только в [14]. Но данная публикация посвящена методам идентификации по кровеносной системе, где главными параметрами являются ошибки первого и второго рода, поэтому не годятся для сравнения.
Целью данного исследования является оценка возможности использования индексного подхода [16], который обычно используется в сельскохозяйственных приложениях, для визуализации кровеносных сосудов. В качестве индексной формулы используется формула, аналогичная расчетам индекса NDVI, но для длин волн 735 и 835 нм. Для выделения узких спектральных полос в работе использован дифракционный оптический элемент нового типа – спектральная линза, формирующая в +1 и –1 порядках изображения для длин волн 835 и 735 нм соответственно. Метод расчета таких элементов представлен в [17, 18]. Ранее в [19] уже было продемонстрировано получение индексного изображения водного индекса (water band index) на основе использования подобной спектральной линзы.
-
1. Метод поиска длин волн, на которых наблюдается наилучшая видимость сосудов, и изготовление спектральной дифракционной линзы для этих длин волн
Способ расчета спектральных дифракционных линз (СДЛ) был подробно описан в [3], поэтому в рамках данной работы мы не будем подробно его описывать. Длины волн для расчета индексного изображения были определены методом полного перебора. Часть метода описана в [20]. В этом методе осуществляется расчет по всем сочетаниям спектральных каналов полноформатного гиперспектрального изображения, а затем по получившемуся набору индексных изображений определяются длины волн, при использовании которых в индексном изображении наиболее ярко отображается целевой объект. Этот метод довольно затратный по времени, поскольку, например, при 250 спектральных каналах, получаемых гиперспектрометром, получается 250×249=62250 индексных изображений, которые чаще всего приходится просматривать в ручном режиме. Такой поиск был проведен для гиперспектрального изображения руки снятого на гиперспектрометре.
Для этого вычислялось индексное изображение по формуле, похожей на формулу вычисления индекса NDVI:
I ( X , y ) = I d x , y ) - I X 2 ( x , y ) , I x , ( x , y ) + I X 2 ( x , y )
где I (x, y) – индексное изображение, I λ1 (x, y) – изображение на длине волны λ 1 , I λ2 (x, y) – изображение на длине волны λ 2 .
На основе этого поиска были определены две длины волны λ1 = 735 нм и λ2 =835 нм, которые давали наибо- лее контрастное изображение сосудов в сформированном индексном изображении.
Спектральная дифракционная линза для выделения сосудов на коже была изготовлена методом прямой лазерной записи на станции лазерной записи CLWS-2014 по фоторезисту ФП-3535, который был предварительно нанесен на кварцевую подложку методом центрифугирования толщиной 6 мкм. При этом высота формируемого микрорельефа составила около 4 мкм. Для удобства изготовления диаметр линзы был ограничен диаметром 12 мм, фокусное расстояние f =70 мм было выбрано из соображения удобства при проведении экспериментальных исследований. На рис. 1 а показано изображение микрорельефа СДЛ для разделения длин волн 735 нм и 835 нм, которое было получено в оптическом микроскопе. Спектральная ширина линии по спаду e 2 составляет 20 нм.
На рис. 1 б представлено изображение участка микрорельефа, где хорошо видна в том числе и тонкая структура СДЛ. На рис. 1 в представлена профилограмма, полученная по линии симметрии линзы в профилометре Tencor.
Тонкая структура СДЛ видна как высокочастотная составляющая профилограммы на рис. 1 в . На рис. 1 б эта тонкая структура заметна на границах зон.
2. Экспериментальные исследования СДЛ
Для исследования использовалось предплечье здорового 35-летнего испытуемого. Предплечье было освещено при помощи галогеновой лампы 1, затем отраженный световой поток попадал на линзу 3. При помощи линзы 3 формировалось изображение объекта 2 в плоскости щелевой диафрагмы 4 шириной 80 мкм, после чего СДЛ 5 формировала спектральное изображение на светочувствительной матрице камеры Basler acA 1920-40um. Основной принцип пользовательской оптической системы визуализации показан на рис. 2, где ключевым элементом для получения необходимых гиперспектральных изображений была камера на основе изготовленной СДЛ со спектральным диапазоном светочувствительного сенсора 400– 1000 нм Basler acA 1920-40um. Оптическая установка была закреплена во время сканирования на расстоянии 1 м от исследуемого образца на специальной поворотной платформе. Поскольку жесткое крепление предплечья затруднительно, в эксперименте постарались максимально убыстрить процесс сканирования за счет использования мощной подсветки (мощность галогеновой лампы составила 1500 Вт). Лампа устанавливалась на расстоянии около 80 см от предплечья, максимально близко от оптической оси экспериментальной установки, угол расходимости используемой лампы составлял около 60°, таким образом, энергетическая освещенность поверхности кожи составляла около 800 Вт/м2. Эта освещенность примерно соответствует естественной освещенности в безоблачный день. Ширина спектральной линии позволяет оценить энергети- ческую освещенность на рабочих длинах волн: так, на диапазон от 725 нм до 745 нм приходится 1,04% от полной мощности лампы, на диапазон от 825 нм до
845 нм приходится 1,23 % от полной мощности лампы.
а)
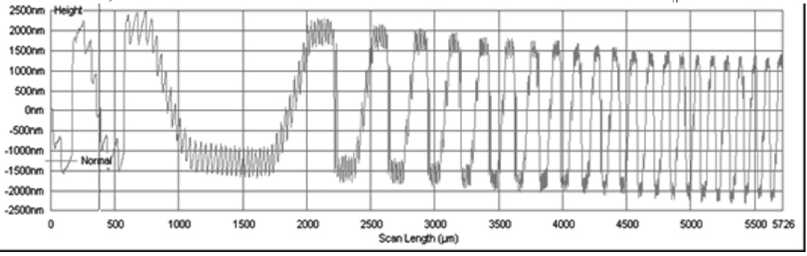
Рис. 1. Фазовая функция СДЛ (735 нм, 835 нм) (а), внешний вид центрального участка СДЛ (735 нм, 835 нм) с тонкой структурой под оптическим микроскопом (б), профилограмма СДЛ (735 нм, 835 нм), полученная вдоль линии симметрии линзы в профилометре Tencor (в)
в)

б)
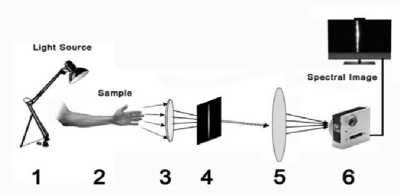
Рис. 2. Оптическая схема эксперимента:
1 – источник освещения, 2 – объект, 3 – линза, 4 – щелевая диафрагма, 5 – СДЛ, 6 – камера Basler acA 1920-40um
За счет относительно небольшого расстояния до объекта расстояние между СДЛ и плоскостью регистрации составило 80 мм, где располагалась светочувствительная матрица камеры. На светочувствительной матрице регистрировались два порядка в –1 для длины волны 735 нм, в +1 для длины волны 835 нм.
После регистрации собиралось два изображения для длин волн 735 и 835 нм соответственно (рис. 3 а и рис. 3 б ). После этого вычислялось индексное изображение по формуле (1).
На рис. 3 в представлено получившееся индексное изображение. На рис. 3 г – индексное изображение, подвергнутое нелинейной обработке для более контрастной видимости кровеносных сосудов, в ходе которой в сечении изображения по столбцам осуществлялось увеличение контраста до максимально возможного. На рис. 3 д представлено изображение предплечья, снятое на ту же самую камеру при той же подсветке штатным объективом.
Как видно из рис. 3г , индексное изображение позволяет получить намного более контрастное изобра-
Таким образом, энергетическая освещенность в этих диапазонах составляет 8 Вт/м2 и 10 Вт/м2 соответственно, что достаточно для регистрации изображений каме- рой Basler acA 1920-40um.

жение кровеносных сосудов на коже, чем изображение, снятое через штатный объектив. Также это изображение контрастнее любого из исходных узкополосных изображений, что подтверждает работоспособность использования исследуемой спектральной линзы для визуализации кровеносных сосудов. Для точного определения среднего по изображению контраста была использована специальная программа, которая по анализу всех возможных сечений изображения определяет среднее значение контраста по формуле.
NM
-
(K = XX K j , (2)
=1 j =1
где N – количество пикселов в столбце изображения, M – количество детектируемых темных полос, Kij определяется по формуле к = iI
ijmax I ij min ijmax ij min
где Iij max – максимальное значение интенсивности в полосе, Iij min – минимальное значение интенсивности в полосе. Для изображения на рис. 3а среднее значение контраста по области руки составило 0,058, для изображения на рис. 3б среднее значение контраста по области руки составило 0,061, для изображения на рис. 3в среднее значение контраста по области руки составило 0,114, для изображения на рис. 3г среднее значение контраста по области руки составило 0,163. Таким образом, объективно использование индексного изображения, рассчитанного по формуле (1), позволяет практически в два раза повысить контраст на изображении кровеносных сосудов руки по сравнению с изображением, полученным при узкополосной подсветке, а при последующей обработке довести это преимущество до трехкратного. К сожалению, не представляется возможным сравнение с предшествующими работами, перечисленными в обзоре, поскольку в перечисленных работах контраст изображений кровеносных сосудов не вычислялся.
д)
а)
б)
в)
г)
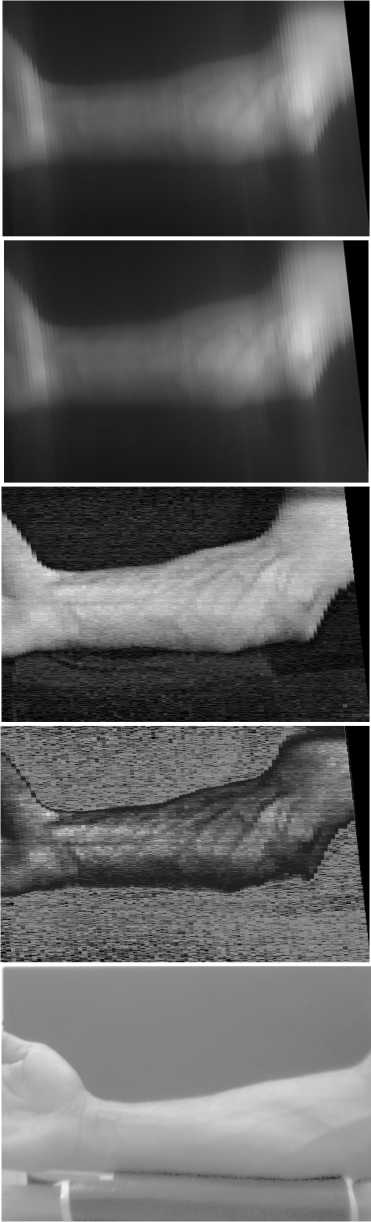
Рис. 3. Изображения руки на длинах волн 735 нм (а)
и 835 нм (б), индексное изображение (в), обработанное индексное изображение (г), изображение предплечья, снятое на ту же самую камеру при той же подсветке штатным объективом (д)
Заключение
Продемонстрированный в статье лабораторный макет для формирования двух изображений в узких спектральных диапазонах дает хорошую альтернативу узкополосному освещению для визуализации кровеносных сосудов кожи человека. Проведенный эксперимент по получению индексного изображения сосудов кожи человека показал, что сформированное индексное изображение имеет средний контраст, почти вдвое превышающий контраст изображений, полученных при узкополосной подсветке. Использование дополнительной обработки позволяет получить изображение уже втрое более контрастное. Особенно важно, что индексное изображение получено без использования сложного и дорогого гиперспектрометра. А использованный для получения индексного изображения лабораторный макет на основе спектральной линзы, который можно называть сенсором спектрального индекса, является существенно более простой альтернативой. Более того, отсутствие специальной узкополосной подсветки на основе светодиодов позволяет говорить о более простом решении по сравнению с существующими коммерчески доступными приборами. Конечно, необходимость сканирования является недостатком предложенного метода, но этот недостаток не столь существенен при использовании полученной информации в системах дополненной реальности.
Работа выполнена при поддержке гранта РНФ № 20-69-47110.
Список литературы Спектральные линзы для выделения кровеносных сосудов на коже
- Frey A. Success rates for peripheral i.v. insertion in a children's hospital. Financial implications. J Infus Nurs 1998; 21(3): 160-165.
- Reigart JR, Chamberlain KH, Eldridge D, O'Brien ES, Freeland KD, Larsen P, Hartzog TH. Peripheral intravenous access in pediatric inpatients. Clin Pediatr 2012; 51(5): 468-472. DOI: 10.1177/0009922811435164.
- Munshey F, Parra DA, McDonnell C, Matava C. Ultrasound guided techniques for peripheral intravenous placement in children with difficult venous access. Pae-diatr Anaesth 2020; 30(2): 108-115. DOI: 10.1111/pan.13780.
- Atalay H, Erbay H, Tomatir E, Serin S, Oner O. The use of transillumination for peripheral venous access in paediatric anaesthesia. Eur J Anaesthesiol 2005: 22(4): 317-318. DOI: 10.1017/s026502150524053x.
- Bachir W, Abo Dargham F. Feasibility of 830 nm laser imaging for vein localization in dark skin tissue-mimicking phantoms. Phys Eng Sci Med 2022: 45(1): 135-142. DOI: 10.1007/s13246-021-01096-x.
- Lin X, Zhuang B, Su X, Zhou Y. Measurement and matching of human vein pattern characteristics. Journal of Tsinghua University 2003: 43(2): 164-167.
- Zhang J-Y, Sun M-H. Study on algorithm for skeleton features extraction of hand vein image. J Comput Appl 2007: 27(1): 152-154.
- Wang K, Zhang Y, Yuan Z, Zhuang D. Hand vein recognition based on multi supplemental features of multi-classifier fusion decision. 2006 International Conference on Mechatronics and Automation 2006: 1790-1795. DOI: 10.1109/ICMA.2006.257486.
- Li W, Yuan W. Imaging quality analysis on palm vein under different wavelengths near-IR. Computer Engineering and Applications 2011; 47(30): 15-18.
- Zharov V, Ferguson S, Eidt J, Howard P, Fink L, Waner M. Infrared imaging of subcutaneous veins. Lasers Surg Med 2004; 34(1): 56-61. DOI: 10.1002/lsm.10248.
- Madrid Garcia A, Horche PR. Light source optimizing in a biphotonic vein finder device: Experimental and theoretical analysis. Results Phys 2018; 11: 975-983. DOI: 10.1016/j.rinp.2018.10.033.
- Pan C-T, Francisco MD, Yen C-K, Wang S-Y, Shiue Y-L. Vein pattern locating technology for cannulation: a review of the low-cost vein finder prototypes utilizing near infrared (NIR) light to improve peripheral subcutaneous vein selection for phlebotomy. Sensors 2019; 19(16): 3573. DOI: 10.3390/s19163573.
- Ayoub Y, Serhal S, Farhat B, Ali A, Amatoury A, Nasser H, Ali MA. Diagnostic superficial vein scanner. 2018 Int Conf on Computer and Applications (ICCA) 2018: 321325. DOI: 10.1109/COMAPP.2018.8460229.
- Uhl A, ed. Handbook of vascular biometrics. Springer; 2020.
- 8 best devices for finding veins. Source: (https://evercare.ru/news/8-luchshikh-ustroystv-dlya-poiska-ven).
- Spectral Indices. Source: (http://www.exelisvis.com/docs/SpectralIndices.html).
- Soifer VA, ed. Methods for computer design of diffractive optical elements. New York: John Willey & Sons Inc; 2002. ISBN: 978-0-471-09533-0.
- Skidanov RV, Doskolovich LL, Ganchevskaya SV, Blank VA, Podlipnov VV, Kazanskiy NL. Experiment with a dif-fractive lens with a fixed focus position at several given wavelengths. Computer Optics 2020; 44(1): 22-28. DOI: 10.18287/2412-6179-C0-646.
- Blank V, Skidanov R, Doskolovich L, Kazanskiy N. Spectral diffractive lenses for measuring a modified red edge simple ratio index and a water band index. Sensors 2021; 21(22): 7694. DOI: 10.3390/s21227694.
- Firsov NA, Podlipnov VV, Ivliev NA, Nikolaev PP, Mashkov SV, Ishkin PA, Skidanov RV, Nikonorov AV. Neural network-aided classification of hyperspectral vegetation images with a training sample generated using an adaptive vegetation index. Computer Optics 2021; 45(6): 887-896. DOI: 10.18287/2412-6179-C0-1038.


