Способ конхопластики при синдроме пустого носа
Автор: Заргарян Б. М., Литвинов С. Д.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 4 (58), 2022 года.
Бесплатный доступ
Целью исследования является воссоздание резецированной нижней носовой раковины. Разработан и внедрен новый способ, в котором впервые применен спредер-имплантат в виде сендвич-композита, представляющий собой комбинацию из перфорированной пластинки костного цемента «Hi-Fatigue Bone Cement» необходимого размера, покрытой с одной или обеих сторон биокомпозитным материалом «ЛитАр». В результате выполнения работы удалось установить, что «сендвич-имплантат» способствует репарации хрящевой и костной части, а также слизистой оболочки нижней носовой раковины, стимулирует неоангиогенез и обеспечивает постоянство объема раковины в долгосрочной перспективе.
Синдром пустого носа, сендвич-имплантат, биокомпозит «литар», костный цемент, конхопластика, репаративная регенерация
Короткий адрес: https://sciup.org/143179119
IDR: 143179119 | УДК: 616.284-002 | DOI: 10.20340/vmi-rvz.2022.4.MORPH.2
Текст научной статьи Способ конхопластики при синдроме пустого носа
УДК 616.284-002
Cite as: Zargaryan B.M., Litvinov S.D. The conchoplasty method in empty nose syndrome. Bulletin of the Medical Institute “REAVIZ”.
Rehabilitation, Doctor and Health. 2022;12(4):48-55.

Синдром пустого носа (ENS) – симптомоком-плекс, включающий парадоксальную носовую обструкцию и возникающий вследствие тотальной или парциальной резекции носовых раковин, а также и незначительных процедур, таких как подслизистое прижигание, подслизистая резекция, лазерная терапия и криохирургия, если они выполняются агрессивно, т.е. после любой операции на носовых раковинах [1]. Начало этого состояния возникает с интервалом в месяцы или годы после проведенной процедуры.
По мнению K.S. Myrthe, конхотомия лишает нос одного из его важных органов, и для этой тех- нологии нет места в современной функциональной хирургии носа. До сих пор неизвестно, какой объем ткани носовых раковин можно удалить или повредить, не вызвав ENS [2].
Теоретически слизистая оболочка полости носа обладает автономной нервной системой, которая регулируется за счет касательного напряжения воздушного потока в полости носа и местных вазоактивных медиаторов. Рецепторные окончания слизистой оболочки являются специализированными нервными клетками – холодовыми терморецепторами (TRPM8), расположенными в окончаниях тройничного нерва и участвующими в ощущении проходимости носа. Холодовые рецепторы резко повышают частоту импульсации в ответ на охлаждение и снижают ее, когда температура увеличивается. Таким образом, если охлаждение слизистой оболочки не может стимулировать такие рецепторы, мозг ощущает недостаток воздушного потока и создает ощущение заложенности и затрудненного дыхания. Поэтому основной жалобой пациентов при ENS является парадоксальная заложенность носа – ощущение затруднения носового дыхания при наличии широких носовых проходов [3].
Следует иметь в виду, что при удалении или разрушении рецепторов, расположенных на медиальной и верхней поверхностях нижней носовой раковины, у пациентов возникает ощущение недостаточности носового дыхания. Скорость воздушной струи имеет пределы нормы, индивидуальные для каждого субъекта. Она зависит, в основном, от размеров носовых ходов и объема носовых раковин. При слишком широких носовых ходах скорость становится минимальной. В этом случае уменьшается динамическое и статическое давление воздуха на рецепторный аппарат слизистой оболочки носа. Снижение функциональной активности рефлексогенных зон полости носа фактически выключает ее активирующее действие на ЦНС. В результате этого снижается функциональная активность многих эндоназальных структур. В итоге наносится ущерб основной функции носа – воздухопроводной, осуществляемой функциональным аэродинамическим комплексом [4].
Являясь периферическим отделом ЦНС, рецепторы слизистой оболочки носа «сообщают» ей о всех происходящих в ней процессах, связанных с носовым дыханием, и получают соответственно «команды», поддерживающие физиологичность носового дыхания. Процесс нейросенсорной передачи выглядит следующим образом: поток вдыхаемого воздуха вызывает испарение влаги с поверхности слизистой оболочки полости носа, задержку жидкости фосфолипидами мембран и поверхностное охлаждение. Данный процесс активирует TRPM8 (преобразует механическую энергию в биохимический и электрофизиологический сигналы) за счет деполяризации мембран нейронов, которые связаны с дыхательным центром ствола мозга, передающих информацию в респираторный центр головного мозга, что приводит к расслаблению дыхательной мускулатуры [5]. Вды- хаемый воздух стимулирует рецепторы растяжения бронхов, передавая сигнал о насыщении легких кислородом в центральную нервную систему посредством назопульмонарного рефлекса. При ENS возникает дисбаланс между импульсацией от холодовых терморецепторов TRPM8 полости носа и рецепторами растяжения бронхиол.
Патогенез заболевания необходимо рассмотреть с позиции аэродинамики воздушного потока и нейросенсорной передачи в полости носа. ENS может быть результатом потери физиологических функций носа (увлажнение, нагревание и очищение вдыхаемого воздуха) из-за уменьшения площади слизистой оболочки. Необходимо обратить внимание на то, что в литературе приводятся противоречивые взгляды на патогенез ENS. Так, по мнению Zhao K. и соавт., охлаждение является более важным фактором при ENS, чем температура воздуха или носовое сопротивление [6]. В то же время, Di M.Y. и соавт. считают, что изменения в аэродинамике играют центральную роль в ENS [7]. Исторически ENS ассоциировалась с уменьшением размера носовых раковин. Новые данные предполагают, что нарушение функции тройничного нерва также может играть определенную роль в патофизиологии заболевания [8]. Нет сомнений в том, что патогенез заболевания связан с дефицитом слизистой оболочки, изменением аэродинамики полости носа и нарушением чувствительной иннервации.
В качестве предоперационной подготовки и оценки проведенного хирургического лечения используют как субъективные (шкала SNOT-25, хлопковаый тест), так и объективные (вычислительная гидродинамика – CFD, риноманометрия, акустическая ринометрия, КТ придаточных пазух носа, эндовидеоскопия) методы исследования. Большое значение придается измерению носовой чувствительностм тройничного нерва с помощью порогов обнаружения латерализации ментола (LDT) с использованием устройства латерализации [9]. Этот тест использует тот факт, что обонятельная система не может определить источник стимуляции, в то время как система тройничного нерва может. К сожалению, этот способ еще не нашел свое применение в рутинных исследованиях в области ринологии.
При планировании предстоящего хирургического лечения проводят ватный (хлопковый) тест (cotton test) (рис. 1), представляющий собой про- цедуру, которая используется не только в качестве диагностического инструмента, но и для предоперационной оценки для выбора возможного местоположения и количества имплантата, необходимого для уменьшения объема носовой полости [10]. Однако, полезность хлопкового теста еще предстоит подтвердить [11, 12].
Консервативное лечение существенно не отличается от лечения атрофического ринита и направлено на гигиену носа и увлажнение слизистой оболочки носа. Все безоперационные методы лечения улучшают кровообращение в носу и помогают сохранить оставшуюся слизистую оболочку носа, но они не восстановливают утраченные функции носа и нормальные ощущения в носу.
В ситуации, когда часть внутриносовых структур отсутствует, одним из способов решения проблемы является хирургическое сужение полости носа. Отметим сразу, что не все пациенты могут извлечь пользу из хирургического вмешательства. Применяемые в настоящее время имплантаты не воссоздают первоначальную структуру носа и аэродинамику и, следовательно, могут обеспечить лишь ограниченное улучшение для пациента. К сожалению, по статистике, около 20 % пациентов, подвергнутых операциям на перегородке носа и нижней носовой раковине, не удовлетворены результатом. В хирургии ENS правильное расположение имплантата играет ключевую роль. Наиболее физиологичным местом для имплантата считается латеральная стенка полости носа, где располагается нижняя носовая раковина. Подслизистая имплантация различных материалов уменьшает симптомы заболевания, однако аргументов в пользу конкретного материала для имплантации пока нет.
Цель эндоназальной хирургии ENS – с помощью аутотрансплантатов или имплантатов воссоздать форму удаленных носовых раковин и уменьшить объем носовой полости и, таким образом, восстановить некоторые функции полости носа за счет увеличения сопротивления воздушному потоку, уменьшения воздушного потока для увеличения влажности воздуха и отклонения воздушного потока от операционного поля в сторону здоровой или неоперированной стороны [10]. Следовательно, идея хирургического лечения ENS состоит в том, чтобы восстановить носовое сопротивление и аэродинамику, а также увеличить площадь поверхности слизистой оболочки носа.
Доступны различные материалы, включая аутологичные (кости, хрящи и жир) и экзогенные: гидроксиапатит [13], тефлон, пластипор [1, 3]. Перегородочный хрящ – наиболее распространенный материал, используемый в ринологических трансплантатах. При процедуре также можно использовать конхальный и реберный хрящи [14]. Разработаны операции по формированию нижней носовой раковины из слизистой оболочки носа с использованием аутохрящевой пластинки или костного минерала «Geistlich Bio-Oss Collagen» [15, 16]. Экспериментальным путем было установлено, что материалом для имплантации могут быть: бесклеточный дермальный матрикс («ADM»), гидроксиапатит, костный цемент, а также аутотрансплантат (ушной, перегородочный и реберный хрящ). «ADM» можно использовать в наноразмерной форме (например, «Acell») и вводить в носовые раковины пациентов с менее объемным дефицитом ткани.
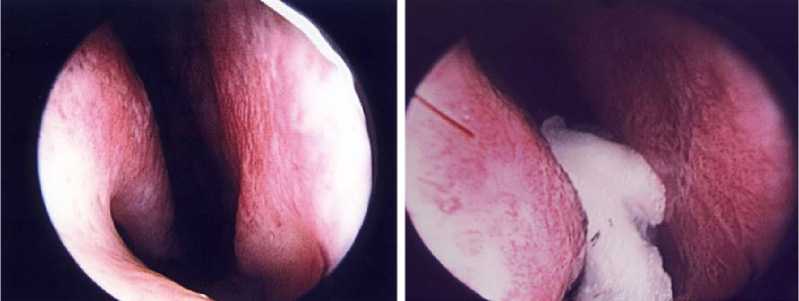
Рисунок 1. Хлопковый тест
Figure 1. Cotton test
Считаем целесообразным обратить внимание на некоторые отрицательные стороны применяемых в настоящее время имплантатов.
Продолжительность положительного эффекта от данных методов лечения пока что неизвестна. Например, относительно жировых трансплантатов, процент рассасывания жировой ткани и продолжительность этого процесса в носовой раковине не изучены. Пациентам с тотальными резекциями нижней носовой раковины могут не принести пользу жировые трансплантаты (невозможно создать адекватный объем носовых раковин), в отличие от обычных трансплантатов. Инъекции геля гиалуроновой кислоты в область носовых раковин, а также в перегородку носа, могут дать временное облегчение в течение нескольких месяцев, но их нужно повторять каждые шесть месяцев.
Описаны технологии инъекционного введения измельченного реберного хряща, которые, однако, характеризуются повышенной резорбцией хрящевой крошки и непредсказуемостью результата [17]. Gill A.S. и соавт. считают, что в настоящее время недостаточно данных, чтобы полностью поддержать использование инъекционных имплантатов для увеличения объема носовых раковин [18]. Отдельного внимания заслуживают данные о том, что клинический опыт применения аутотрансплантатов в разных областях хирургии показывает высокую степень его резорбции в послеоперационном периоде, наличие дополнительной травмы в месте забора, увеличения времени операции и недостаточное количество материала, в связи с чем целесообразно применять биоматериалы, которые не рассасываются с течением времени.
Существенным недостатком хряща перегородки носа является то, что объем хрящевой ткани ограничен, зачастую недостаточен или полностью отсутствует после предыдущей операции. Применение костных имплантатов ограничено их жесткой структурой и склонностью к резорбции [17]. В качестве недостатков применения «alloderm», по мнению Тарасова Н.В. и соавт., можно отметить следующее: быстрое лизирова-ние имплантата; «alloderm» не обладает в достаточной степени прочностью структуры и не сохраняет объем в течение длительного времени; есть риск развития вторичной инфекции; применяемый имплантат часто отторгается [16]. Недостатками дермы считается неспособность обеспечить структурную поддержку и высокая скорость резорбции. По разным данным, объем ткани уменьшается на 30–50 % в течение года.
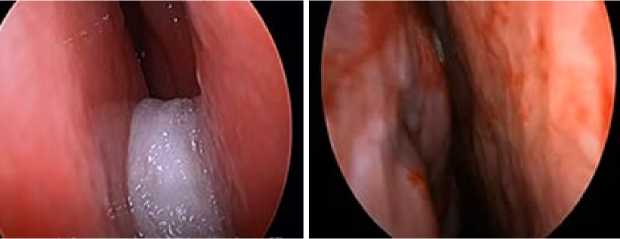
В связи с вышеизложенным нами впервые применен спредер-имплантат в виде сендвич-композита, представляющий собой комбинацию из перфорированной пластинки костного цемента «Hi-Fatigue Bone Cement» необходимого размера, покрытой с одной или обеих сторон материалом «ЛитАр» (рис. 2).
После помещения пластинки костного цемента в горячую воду на 0,5 ч, она становится пластичной и при остывании принимает ту форму, которую ей придали. Это позволяет придавать заготовкам имплантата необходимую форму и размер.
Суть предложенного способа конхопластики заключается в следующем: под местной инфиль-рационной анестезией (Sol. Ultracaini 4 % 1 капсула) в переднем отделе культи нижней носовой раковины производится вертикальный разрез длиной 0,5 см до кости, через который распатор-отсосом отслаивается слизистая оболочка с надкостницей с латеральной стенки полости носа в проекции переднего конца резецированной раковины и создается небольшой «карман» длиной от 2 до 3 см. После введения в него соответствующего размера пластинки «спредер-имплантата», обработанного тонким слоем латексного тканевого клея «ЛТК», раковина слегка прижимается к латеральной стенке полости носа введенным в нижний носовой ход небольшим тампоном на 10–15 мин. В завершении операции, после удаления тампона, производится обработка краев разреза клеем «ЛТК» (рис. 3).
В настоящее время известно, что процессы регенерации в слизистой оболочке и костной ткани ННР развиваются медленно, образование здесь полноценной ткани происходит не ранее чем через год. Тканевые волокна распространяются по поверхности имплантата и прорастают через его перфорационные отверстия, что придает дополнительную прочность реконструированной нижней носовой раковине. В то же время применение костного цемента «Hi-Fatigue Bone Cement» способствует восстановлению костной ткани путем постепенного замещения цемента грануляционной, а затем соединительной тканью уже на ранних сроках (7–14 дней). Через 3–5 месяцев после конхопластики участок резецированной костной ткани ННР замещается грубоволокнистой костью, которая на многих участках трансформируется в пластинчатую с развитой системой гаверсовых каналов. Следовательно, биокомпозит «ЛитАр» ускоряет репарацию тканей нижней носовой раковины примерно в 2 раза.

А В
Рисунок 2. Сендвич-имплантат: А – заготовка спредер-имплантата; В – двустороннее покрытие биокомпозитом «ЛитАр»
Figure 2. Sandwich-implant: A – spreader-implant blank; B – double-sided coating with "LitAr" biocomposite
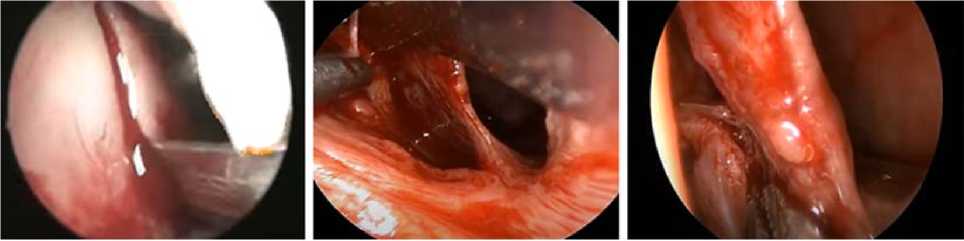
А В С
D E
Рисунок 3. Метод формирования ННР: А – разрез слизистой оболочки с надкостницей; В – создание «кармана»; С – введение спредер-имплантата; D – тампонада; Е – неораковина
Figure 3. The method of MNR formation: A – incision of the mucosa with periosteum; B – creation of a "pocket"; C – insertion of the spreader-implant; D – tamponade; E – neocutaneous
Особенности «ЛитАр» обусловливают способность материала регенерировать остатки резецированной нижней носовой раковины в пределах ее нормальной топографии, активизируя для этого имеющиеся в организме стволовые клетки, а также обеспечивать ангиогенез в зоне его введения в области дефекта за счет своей пористости, что, по-видимому, способствует нормализации функции реснитчатого эпителия [19].
При ENS слизистая оболочка носа, особенно ее латеральной стенки, атрофически изменена. Поэтому после имплантации под нее костного цемента, хряща и других материалов происходит локальное увеличение отдельных участков латеральной стенки носа или перегородки носа в виде выпуклостей. При носовом дыхании это приводит к функциональной перегрузке данных областей воздушным потоком, что еще больше способству-– 52 – ет дальнейшему прогрессированию атрофического процесса в послеоперационном периоде. Принимая во внимание вышеперечисленное, нет сомнения в том, что при ENS необходимо имплантировать материал, способствующий не только восстановлению объема резецированной нижней носовой раковины, но и репарации слизистой оболочки носа с ее рецепторным аппаратом. После конхотомии физиологической регенерации нижней носовой раковины не происходит, и на месте резекцированной нижней носовой раковины образуется рубцовая ткань, т.е. происходит метаплазия и развитие атрофических процессов в слизистой оболочке и, как следствие, нарушение ее функций. При применении спредер-имплантата восстановление функциональной деятельности нижней носовой раковины объясняются, по-видимому, не только воздействием биокомпозит-ного материала «ЛитАр» на костную ткань раковины и сосуды пещеристых венозных сплетений, но и на нервные структуры слизистой оболочки. Это можно объяснить тем, что слизистая оболочка носа обладает автономной нервной системой, расположенной в подслизистом слое нижней носовой раковины в виде двух вегетативных сплетений и регулируемой за счет касательного напряжения воздушного потока в полости носа и местных вазоактивных медиаторов [20]. Имеются основания предполагать, что они, наряду с чувствительными нервными окончаниями, также являются датчиками афферентной импульсации для вегетативных и эндокринных центров, регулирующих барьерную функцию.
Мы не можем согласиться с мнением Косякова С.Я. и соавт., что полноценное восстановление нижней носовой раковины на сегодняшний день невозможно, т.к. хирургические методы лечения не способны регенерировать нервные окончания слизистой оболочки носа [21]. После резекции слишком большой части носовой раковины ее невозможно восстановить, вырастить или заменить. В организме человека нет донорских участков с подобной тканью, т.к. носовые раковины и слизистая оболочка носа уникальны. В связи с этим считаем нужным отметить некоторые особенности материала «ЛитАр». Известно, что время биодеградации композита составляет 15–20 дней. Далее, в области введения материала образуется мягкотканиевая структура (соединительная ткань), которая далее оссифицируется только в том слу- чае в тот тип костной ткани (плоская кость черепа, трубчатая кость с кортикальным и губчатым слоем), который должен находится в месте дефекта в случае нормальной анатомической топографии. Запуск регенераторного механизма с помощью имплантата осуществлялся не только у костных тканей или хряща (перегородка носа), а также тканей паренхиматозных органов (легкое, печень, почка) и инфарктного участка миокарда с восстановлением последнего без рубца. Показана возможность композита «ЛитАр», не содержащего в своем составе никакой клеточной массы, индуцировать ангиогенез [19].
Подводя итоги рассмотрения предложенного способа конхопластики, следует отметить, что он обеспечивает надежную фиксацию спредер-имплантата к мукопериосту в нужном положении, что способствует стабильности неораковины, снижает риск ее смещения в послеоперационном периоде, позволяет отказаться от передней тампонады полости носа в раннем послеоперационном периоде, тем самым исключая источник мощной патологической импульсации и психотравмирующий фактор. Кроме того, «сендвич-имплантат» способствует репарации хрящевой и костной части, а также слизистой оболочки нижней носовой раковины, стимулирует неоангиогенез и обеспечивает постоянство объема раковины в долгосрочной перспективе.
При необходимости существует возможность установить спредер-имплантаты сразу в разные ключевые стратегические места полости носа – дно, перегородка носа и латеральная стенка. Это позволяет устанавливать небольшого размера спредер-имплантаты, т.к. слизистая оболочка носа атрофична и может при установке испытывать сильное натяжение и рваться.
Все ринохирурги производят имплантацию разнообразных материалов с одной целью – воссоздать резецированную нижнюю носовую раковину. В то же время, они мало обращают должное внимание на атрофичную слизистую оболочку, которой покрывают имплантаты. В результате резкого падения кровообращения в атрофически измененной слизистой оболочке нижней носовой раковины с холодовыми рецепторами не может полноценно регенерировать. Как известно, исходом процесса атрофии является истощение компенсаторных механизмов слизистой оболочки, что выражается уменьшением пролиферативной и метаболической активности эпителия, изменением его дифференцировки с переходом в плоскоклеточную метаплазию. Снижение метаболических процессов в эндотелии капилляров приводит к перваскулярному склерозу, что изменяет микроокружение базальных клеток покровного эпителия. В то же время известно, что «ЛитАр» усиливает регенерацию эпителия и базальных клеток, т.е. стволовых, стимулируя именно их.
После конхотомии физиологической регенерации нижней носовой раковины не происходит и на месте резекцированной ее части образуется рубцовая ткань, т.е. происходит метаплазия и развитие атрофических процессов в слизистой оболочке и, как следствие, нарушение ее функций. При применении спредер-имплантата восстановление функциональной деятельности нижней носовой раковины объясняются, по-видимому, не только воздействием биокомпозитного материала «ЛитАр» на сосуды пещеристых венозных сплетений, но и на нервные структуры слизистой оболочки, так как в подслизистом слое нижней носовой раковины располагаются два выраженных вегетативных сплетения [20].
Определенную роль в стойком нарушении сенсорной иннервации может играть нарушение нормального процесса заживления слизистой оболочки в послеоперационном периоде. Как известно, нижняя носовая раковина являются областью продукции нейронального ростового фактора, медиатора, отвечающего за рост, репарацию и образование аксональных связей периферических окончаний чувствительных нейронов. Анализируя сказанное, можно предположить, что вероятность развития ENS возрастает с увеличением объема удаленной ткани раковины. В то же время, нет сомнений в том, что больше шансов на регенерацию имеется при ее парциальной резекции.
Мнения расходятся относительно продолжительности сроков уменьшения или исчезновения неврологических осложнений, которые варьируют от нескольких месяцев до года [20]. Самочувствие пациентов улучшалось после операции в среднем на 29-е сутки. Важно, чтобы долгосрочные исследования клинических исходов проводились после периода наблюдения в 48 месяцев [12].
Таким образом, данные литературы показывают, что вопрос о сроках восстановления функциональных показателей слизистой оболочки носа при различных видах хирургических вмешательств до настоящего времени остается до конца не изученным и требует дальнейших исследований.
Нам кажется более перспективным развитие научного направления по регенерации тканей путем введения некоего вещества, стимулирующего клеточную деятельность организма. Разработанный материал (имплантат) «ЛитАр» без привлечения (или культивирования) клеток (в режиме in vitro) благодаря своему химическому составу стимулирут клеточную деятельность самого организма, то есть запускает регенераторный механизм, апеллируя к малодифференцированным клеткам самого организма-хозяина [22–24].
Опыт использования в качестве материала для замещения удаленной нижней носовой раковины нового пластического композитного материала – спредер-имплантата – требует дальнейшего изучения. Однако первые положительные результаты его применения позволяют рекомендовать этот материал для использования в качестве метода выбора.
Список литературы Способ конхопластики при синдроме пустого носа
- Houser S.M. Surgical treatment for empty nose syndrome. Arch. Otolaryngol. Head Neck Surg. 2007;133:858-863.
- Myrthe K.S. Hot and Egbert H. Huzing. Treatment of pathology of the lower nasal conch: review and critical evaluation of various techniques. Rhinology. 2000;38:157-166.
- Chhabra N., Houser S.M. The Diagnosis and Management of Empty Nose Syndrome. Otolaryngol. Clin. North Am. 2009;42(2):311-330.
- Бабияк В.И., Говорун М.И., Накатис Я.А. Оториноларингология. М., 2009. Т. 1. 832 с. [Babiyak V.I., Govorun M.I., Nakatis Y.A. Otorhinolaryngology. Moscow, 2009. Т. 1. 832 p. (In Russ)].
- Baraniuk J.N. Subjective nasal fullness and objective congestion. Proc Am Thorac Soc. 2011 ;8:62-69.
- Zhao K., Blaker K., Luo Y., Bryant B. Jiang J. Perceiving nasal patency through mucosal cooling rather than air temperature or nasal resistance. PloS One. Oct. 2011:6.
- Di M.Y., Jiang Z., Gao Z.Q., Li Z., An Y.R., Lv W. Numerical simulation of airflow fields in two typical nasal structures of empty nose syndrome: a computational fluid dynamics study. PLoS One. 2013;8(12):18.
- Kim D-Y, Hong H.R., Choi E.W., et al. Efficacy and safety of autologous stromal vascular fraction in the treatment of empty nose syndrome. Clin. Exp. Otorhinolaryngol. 2018;11(4):281-287.
- Konstantinidis I., Tsakiropoulou E, Chatziavramidis A, Ikonomidis C, Markou K. Intranasal trigeminal function in patients with empty nose syndrome. Laryngoscope. 217;127(6):1263-1267.
- Houser S.M. Empty nose syndrome associated with middle turbinate resection. Otolaryngol Head Neck Surg. 2006;135:972-973.
- Leong S. The Clinical Efficacy of Surgical Interventions for Empty Nose Syndrome: 2015;5:1-6.
- Leong S. The clinical efficacy of surgical interventions for empty nose syndrome: A Systematic review. 125(7):1557-1562.
- Rice D.H. Rebuilding the inferior turbinate with hydroxyapatite cement. Ear Nose Throat J. 2000;79:276-277.
- Jung J.H, Baguindali M.A., Park J.T., et al. Costal cartilage is a superior implant material than Conchal cartilage in the treatment of empty nose syndrome. Otolaryngol Head Neck Surg. 2013;149(3):500-505.
- Тарасова Н.В., Князькин Д.Г., Тарасов С.Ю. Метод формирования нижней носовой раковины при синдроме пустого носа. Российская ринология. 2013;21(2):11 -95. [Tarasova N.V., Knyazkin D.G., Tarasov S.Yu. Method of lower nasal shell formation in empty nose syndrome. Russian rhinology. 2013;21(2):11 -95. (In Russ)].
- Тарасова Н.В., Князькин Д.Г., Тарасов С.Ю. Способ сужения полости носа при частичном или полном отсутствии нижних носовых раковин у больных синдромом пустого носа. Патент RU2546450C. 2015. R [Tarasova N.V., Knyazkin D.G., Tarasov S.Yu. Method of nasal cavity narrowing in partial or complete absence of lower nasal cavities in patients with empty nose syndrome. PatentRU2546450C . 2015. R (In Russ)].
- Айрапетян А. Д. Повторная ринопластика в эстетической хирургии лица: дис. ... д-ра мед. наук. Ереван, 2017. 245 с. [Ay-rapetyan A. D. D. Repeated rhinoplasty in aesthetic facial surgery: Ph. D. in medical sciences. Yerevan, 2017. 245 p. (In Russ)].
- Gill A.S., Said M, Tollefson T.T., Steele T.O. Update on empty nose syndrome. Curr Opin Otolaryngol Head Neck Surg. 2019;27(4):237-242.
- Марков И.И., Литвинов С.Д., Марков А.И. Имплантационный материал «ЛитАр» индуцирует ангиогенез. Морфологические ведомости. 2003;1-2:74-76. [Markov I.I., Litvinov S.D., Markov A.I. LitAr implantation material induces angiogenesis. Morphological Bulletin. 2003;1 -2:74-76. (In Russ)].
- Хем А., Кормак Д. Гистология. М., 1983. Т. 4. 245 с. [Hem A., Cormack D. Histology. Moscow, 1983. Т. 4. 245 p. (In Russ)].
- Косяков С.Я., Кирдеева А.И. Синдром пустого носа (обзор литературы). Российская ринология. 2015;2:62-67. [Kosyakov S.Y., Kirdeeva A.I. Empty nose syndrome (review of literature). Russian rhinology. 2015;2:62-67. (In Russ)].
- Литвинов С.Д., Краснов А.Ф., Куликов А.Н. Применение композита «ЛитАр» в случае замедленной консолидации перелома и ложного сустава. Бюллетень ВСНЦ СО РАМН. 2006;5(51):122-127. [Litvinov S.D., Krasnov A.F., Kulikov A.N. Application of "LitAr" composite in case of delayed consolidation of fracture and false joint.Bulletin of All-Russian Scientific Center of the Russian Academy of Medical Sciences. 2006;5(51):122-127. (In Russ)].
- Литвинов С.Д., Марков И.И. Стволовые клетки и материал «ЛитАр» II Международный конгресс ассоциации ревмоортопе-дов. Тезисы докладов конгресса (г. Москва, 21-22 сентября 2018 г.). М., 2018:89-91. [Litvinov S.D., Markov I.I. Stem cells and the material "LitAr" II International Congress of the Rheumoorthopedic Association. Theses of the congress reports (Moscow, September 21-22, 2018). Moscow, 2018:89-91. (In Russ)].
- Литвинов С.Д., Марков И.И., Попов В.С., Иващенко А.В. Наноразмерный цитоактивный материал «ЛитАр» и межпозвонковая дисковая грыжа. Вестник медицинского института «РЕАВИЗ». 2019;6(42):157-169. [Litvinov S.D., Markov I.I., Popov V.S., Ivashchenko A.V. Nanoscale cytoactive material "LitAr" and intervertebral disc hernia. Bulletin of the Reavis Medical Institute. 2019;6(42):157-169. (In Russ)].
- Kuan E.C., Suh J.D., Wang M.B. Empty Nose Syndrome. Curr. Allergy Asthma Rep. 2015;15(1):493.


