Способ обнаружения антител класса IgA к деамидированным пептидам глиадина у пациентов с IgA-нефропатией
Автор: Манцаева М.Е., Корабельников Д.И., Борисов А.Г.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.20, 2025 года.
Бесплатный доступ
Обоснование: IgA-нефропатия (IgA-H) – одна из ведущих причин развития терминальной почечной недостаточности, требующей проведения заместительной почечной терапии. Этиопатогенез болезни до конца не изучен. По результатам некоторых исследований предполагается связь с заболеваниями и состояниями, которые сопровождаются воспалением и повышенной проницаемостью кишечной стенки. Ряд исследований указывает на высокую распространенность определённых антител (АТ) в крови, специфичных и чувствительных для целиакии, у больных IgA-H. Предполагается, что эти АТ класса IgA влияют на активность и риски прогрессирования гломерулярного заболевания. Цель: разработать прогностическую модель для определения вероятности обнаружения АТ ДПГ IgA в сыворотке крови у пациентов с IgA-H. Методы: в исследовании приняло участие 105 пациентов в возрасте от 18 до 64 лет (мужчины – 92 (87,6%), женщины – 13 (12,4%)) с морфологически подтвержденной IgA-Н. Медиана длительности заболевания до проведения нефробиопсии составила 17 [6–48] месяцев. Результаты: на основании полученных при комплексном обследовании данных методом бинарной логистической регрессии построена прогностическая модель определения вероятности обнаружения АТ ДПГ IgA в сыворотке крови у пациентов с IgA-H в зависимости от протеинурии, систолического артериального давления и общего IgA. Полученная регрессионная модель имеет высокую статистическую значимость (площадь под ROC-кривой составила 0,860; 95% ДИ: 0,744–0,976; p<0,001). Чувствительность и специфичность модели составили 82,4% и 83,1%, соответственно. Заключение: разработанная прогностическая модель может снизить стоимость диагностики при отборе пациентов для тестирования на АТ; улучшить оценку рисков прогрессирования IgA-Н и создать новые возможности для персонифицированного клинического подхода и оптимизации лечебных стратегий, что, в свою очередь, может привести к улучшению почечных исходов для пациентов с IgA-H.
IgA-нефропатия, хронический гломерулонефрит, целиакия, антитела к деамидированным пептидам глиадина, прогностическая модель
Короткий адрес: https://sciup.org/140310624
IDR: 140310624 | DOI: 10.25881/20728255_2025_20_3_96
Текст научной статьи Способ обнаружения антител класса IgA к деамидированным пептидам глиадина у пациентов с IgA-нефропатией
Обоснование
Иммуноглобулин A-нефропатия (IgA-H) – хроническая гломерулярная болезнь, связанная с воспалительным поражением почечных клубочков, опосредованным депозицией иммунных комплексов, содержащих аберрантный секреторный иммуноглобулин А и приводящая к развитию необратимых фибропластических изменений органа.
IgA-H является одной из ведущих причин терминальной почечной недостаточности, требующей проведения дорогостоящей заместительной почечной терапии [1; 2].
Этиопатогенез болезни остается недостаточно изученным. Существование потенциальной патогенетической энтероренальной оси позволяет предполагать, что развитие IgA-Н может быть ассоциировано с заболева-

ниями или состояниями, которые сопровождаются клинически очевидным или субклиническим воспалением с повышенной проницаемостью стенки кишечника и активацией MALT-системы кишечника [3–6].
В свете ранее проведенных исследований особое внимание следует уделять значению пищевых антигенов, в частности глютену, способных изменять иммунный ответ слизистой оболочки тонкой кишки и приводить к выработке специфических антител (АТ) [7–10]. Так, согласно экспериментальным данным пероральная иммунизация глиадином (фракция белка клейковины некоторых злаковых растений) способна приводить к отложению IgA в мезангии клубочков [8; 11].
Ассоциация IgA-H и целиакии (ЦК), где основным этиологическим фактором развития болезни является глютен, а также эффективность аглютеновой диеты у некоторых больных IgA-H [12; 13], вызывает необходимость уточнить значение специфических АТ, характерных для ЦК, у пациентов с IgA-H.
Принимая во внимание результаты ряда ранее проведенных исследований о распространенности АТ, характерных для ЦК [14–19], а также собственные данные о распространенности АТ класса IgA к деамидированным пептидам глиадина (АТ ДПГ IgA) среди больных IgA-H [20] и высокую активность гломерулярной болезни в данной группе больных мы предполагаем, что определенные целиакийные АТ могут служить дополнительным предиктором ускоренного прогрессирования заболевания и прогнозирования почечных исходов. Поскольку стандартные протоколы диагностики и лечения IgA-H не включают в себя скрининговое определение целиакийных АТ, возникает необходимость создания специального инструмента для выявления пациентов, нуждающихся в данном скрининге.
Цель
Разработать прогностическую модель для определения вероятности обнаружения АТ ДПГ IgA в сыворотке крови у пациентов с IgA-H.
Методы
Дизайн исследования
В одноцентровом проспективном сравнительном когортном контролируемом исследовании приняло участие 105 пациентов в возрасте от 18 до 64 лет.
Критерии соответствия
Критерии включения пациентов в исследование : пациенты обоего пола старше 18 лет; морфологически подтвержденная IgA-H; подписанное информированное согласие пациента на участие в исследовании.
Критерии невключения пациентов в исследование: CКФ по CKD-EPI <15 мл/мин/1,73 м2; атипичные формы IgA-H; пациенты на заместительной почечной терапии (программный гемодиализ, перитонеальный диализ, трансплантация почки); наличие у пациента тяжелых соматиче- ских заболеваний в стадии декомпенсации или обострения, онкологических и психических заболеваний; отсутствие подписанного больным информированного согласия.
Критерии исключения : положительный тест на беременность и период лактации; отказ пациента от дальнейшего участия в исследовании.
Условия проведения
Исследование проводилось среди пациентов, которые находились на обследовании и лечении в нефрологическом отделении Главного военного клинического госпиталя имени академика Н.Н. Бурденко Минобороны России (ГВКГ).
Продолжительность исследования
Исследование проводилось в период с сентября 2020 г. по апрель 2025 г.
Описание медицинского вмешательства
Всем пациентам проведено комплексное клиническое обследование. Выполнены клинический анализ крови и мочи, биохимический и иммунологический анализы крови, расчёт скорости клубочковой фильтрации по формуле CKD-EPI для оценки функционального состояния почек, определение суточной экскреции белка с мочой, измерение артериального давления (АД) стандартным методом и ультразвуковое исследование почек.
Антитела IgA к тканевой трансглютаминазе (АТ ТТГ IgA) и АТ ДПГ IgA определены в венозной крови иммуноферментным методом с применением набора реагентов Euroimmun и Orgentec (Германия). Антитела к эндомизию (АЭМ IgA) определены методом непрямой иммунофлюоресценции с применением набора реагентов Euroimmun (Германия).
Диагноз IgA-Н был установлен на основании прижизненной нефробиопсии с морфологическим исследованием почечной ткани методами световой микроскопии и иммунофлюоресцентного исследования.
Части серопозитивных пациентов (n = 12) выполнена фиброгастродуоденоскопия с биопсией из залукович-ного отдела двенадцатиперстной кишки с последующим морфологическим исследованием слизистой оболочки тонкой кишки.
Анализ в подгруппах
На основании полученных результатов обследования были сформированы две группы: в основную группу I (n = 20) вошли больные IgA-H с выявленными АТ ДПГ IgA, в контрольную группу II (n = 85) – пациенты с IgA-H, серонегативные по АТ ДПГ IgA, АТ ТТГ IgA и АЭМ IgA.
Этическая экспертиза
Исследование проводилось с одобрения независимого этического комитета при ГВКГ и независимого этического комитета при АНО ДПО «Московский медико-социальный институт им. Ф.П. Гааза» при соблюдении

действующего законодательства РФ и в соответствии с этическими принципами, принятыми Всемирной медицинской ассоциацией (Хельсинкская декларация).
Статистический анализ
Статистический анализ полученных данных проведен с использованием программы StatTech v. 4.8.0 (ООО «Статтех», Россия). Рассчитывали медиану (Me) с межквартильным размахом [Q1–Q3], среднее со стандартным отклонением (M±SD) и 95% доверительным интервалом (ДИ). Построение прогностической модели вероятности определенного исхода выполнялось при помощи метода логистической регрессии. Мерой определенности, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент детерминации R2 Найджелкерка (Nagelkerke). Для оценки диагностической значимости количественных признаков при прогнозировании определенного исхода, применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке cut-off определялось по наивысшему значению индекса Юдена (Youden’s index). Различия считались статистически значимыми при p<0,05.
Результаты
Объекты (участники) исследования
Средний возраст больных составил 35,48±9,68 лет. Медиана возраста дебюта IgA-H 30 [24–36] лет. Средний возраст на момент нефробиопсии 33,19±8,46 лет. Медиана длительности заболевания до проведения нефробиопсии составила 17 [6–48] месяцев. Распределение по полу: мужчины – 92 (87,6%), женщины – 13 (12,4%). 94 (89,5%) пациента получали нефропротективную терапию блокаторами ренин-ангиотензин-альдостероновой системы в максимально переносимых дозировках. Из них 80 (76,2%) больным терапия проводилась в течение более 3 месяцев. У 13 (12,4%) пациентов в анамнезе был шестимесячный курс лечения глюкокортикостероидами.
Основные результаты исследования
С целью определения вероятности обнаружения АТ IgA к ДПГ у пациентов с IgA-H нами была разработана прогностическая модель методом бинарной логистической регрессии в зависимости от протеинурии (ПУ, г/л), систолического артериального давления (САД, мм рт. ст.) и общего иммуноглобулина A (IgA, г/л). Число наблюдений составило 105. Наблюдаемая зависимость описывается следующим уравнением:
P = 1 / (1 + e-z) x 100% z = -13,396 + 1,020XПУ + 0,813XIgA + 0,055XСАД (1)
где: P – оценка вероятности обнаружения АТ IgA к ДПГ (%), z – значение логистической функции, XПУ – протеинурия (г/л), XIgA – IgA (г/л), XСАД – систолическое артериальное давление (мм рт. ст.).
Табл. 1. Характеристики связи предикторов модели с вероятностью выявления АТ IgA к ДПГ
|
Предикторы |
Unadjusted |
Adjusted |
||
|
COR; 95% ДИ |
p |
AOR; 95% ДИ |
p |
|
|
Протеинурия, г/л |
3,618; 1,562–8,373 |
0,003* |
2,774; 1,111–6,931 |
0,029* |
|
IgA, г/л |
2,344; 1,366–4,023 |
0,002* |
2,255; 1,271–3,999 |
0,005* |
|
САД, мм рт. ст. |
1,058; 1,016–1,102 |
0,007* |
1,057; 1,005–1,112 |
0,030* |
САД, мм рт. ст. - Н^
Протеинурия, г/л - = -----------------------■-----------------------
IgA, г/л - i ---------------------------------------
—i-------------------------------------1-----------------1-----------
1 3 5
ОШ; 95% ДИ
Рис. 1. Оценки отношения шансов с 95% ДИ для изучаемых предикторов.
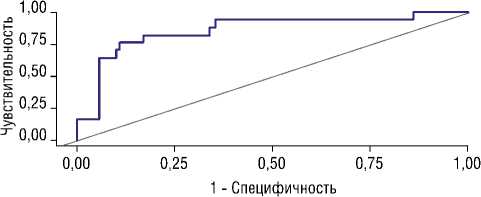
Рис. 2. ROC-кривая, характеризующая зависимость вероятности выявления АТ IgA к ДПГ от значения логистической функции P.
Полученная регрессионная модель с точки зрения соответствия прогнозируемых значений наблюдаемым при включении предикторов по сравнению с моделью без предикторов является статистически значимой (p <0,001). Псевдо-R2 Найджелкерка составил 40,3%.
Так, при увеличении ПУ на 1 г/л шансы выявления АТ IgA к ДПГ увеличивались в 2,774 раза. При увеличении IgA на 1 г/л шансы выявления АТ IgA к ДПГ увеличивались в 2,255 раза. При увеличении САД на 1 мм рт. ст. шансы выявления АТ IgA к ДПГ увеличивались в 1,057 раза.
Характеристики связи каждого из предикторов с шансами выявления АТ IgA к ДПГ представлены в таблице 1.
На рис. 1 сопоставлены значения скорректированного отношения шансов с 95% ДИ для изучаемых факторов, вошедших в модель (1).
При оценке дискриминационной способности регрессионной модели с помощью ROC-анализа была получена следующая кривая (Рис. 2).
Площадь под ROC-кривой составила 0,860; 95% ДИ: 0,744–0,976, p<0,001). Полученная модель была статистически значимой (p<0,001).
Пороговое значение оценок вероятности P в точке cut-off, которому соответствовало наивысшее значение
индекса Юдена (Youden’s index), составило 19,5%. Наличие АТ IgA к ДПГ прогнозировалось при значении оценок вероятности P выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 82,4% и 83,1%, соответственно.
Обсуждение
Резюме основного результата исследования
Скорректированная прогностическая модель, обладающая высокой чувствительностью и специфичностью, подтверждает возможность использования АТ IgA ДПГ в качестве дополнительного предиктора для оценки рисков прогрессирования IgA-H. С помощью данного инструмента появится возможность проводит целенаправленный отбор больных IgA-H для тестирования на предмет выявления АТ IgA ДПГ.
Обсуждение основного результата исследования
Основываясь на данных мировой литературы, факт выявления специфических АТ, характерных для ЦК у пациентов с IgA-H, позволил сформулировать гипотезу о связи IgA-H и ЦК. На уровне отдельных клинических наблюдений подтверждается вышеуказанная ассоциация, при этом назначение аглютеновой диеты положительно влияет на течение гломерулярного заболевания [21–23].
Авторы других исследований отметили высокую распространенность специфических целиакийных АТ среди пациентов с IgA-H без указания на морфологически подтвержденную глютеновую энтеропатию [14-20].
Общепринятого объяснения этому феномену не дано до сих пор. Рассматривая патогенез IgA-H с позиций энтероренальной оси, Coppo R. c соавт. отметили, что ключевую роль в образовании «патогенного» IgA играет усиленный иммунный ответ слизистых оболочек кишечника под воздействием различных антигенов, включая пищевые, такие как глютен.
Важным аспектом является роль MALT-системы кишечника, поскольку нарушение иммунологической толерантности, возникающее вследствие повреждения кишечного барьера и увеличенной абсорбции пищевых антигенов, может приводить к усилению иммунного ответа, субклиническому воспалению кишечника и избыточному синтезу галактозодефицитного IgA (Gd-IgA1). Gd-IgA1 откладывается в мезангии почечных клубочков, образуя депозиты, которые формируют характерную морфологическую картину IgA-H [3].
В экспериментальных условиях Papista K. c соавт. продемонстрировали, что глиадин участвует в образовании нефротоксичного циркулирующего комплекса IgA1-sCD89 не только за счёт взаимодействия с IgA1, но и посредством связывания с sCD89 (растворимая форма рецептора IgA). Исключение глютена из рациона приводило к снижению экспрессии CD71 (рецептор к трансферрину) и тканевой трансглутаминазы 2, уменьшению уровня мезангиального IgA1 и степени выраженности гематурии, а также к отсутствию иммунных комплексов IgA1-sCD89 в сыворотке крови и мезангии почек. Авторы отметили, что тяжесть и клиническая картина IgA-H зависели от прямого связывания глиадина с CD89. Кроме того, глютен вызывал увеличение секреции IgA1 в кишечнике, что способствовало воспалению и атрофии ворсинок слизистой оболочки тонкого кишечника. При этом уровень АТ к глиадину в крови коррелировал с выраженностью ПУ [11].
Использование антиглиадиновых АТ (АГА) в качестве дополнительного прогностического предиктора для пациентов с IgA-H впервые предложили Ots M. с соавт. В своём исследовании авторы отметили, что уровень АГА коррелировал с продолжительностью заболевания, возрастом и уровнем артериального давления. В группе АГА концентрация креатинина крови была выше, а СКФ, соответственно, ниже. Морфологические изменения в пределах площади нефробиоптата статистически значимо не отличались в группах, однако у пациентов с АГА выраженность интерстициального фиброза была выше и коррелировала с уровнем артериального давления и суточной ПУ [17].
Для отбора пациентов с IgA-H – возможных носителей АТ IgA ДПГ для тестирования нами ранее была разработаны прогностическая модель и программа для ЭВМ на ее основе, которая позволяет эффективно отбирать больных для скрининга на наличие АТ IgA ДПГ [24]. При продолжении исследования с увеличением количества пациентов мы скорректировали прогностическую модель на основании дополнительных данных.
Ограничения исследования
Исследование, выполненное на базе одного центра и относительно небольшой размер выборки, могут ограничивать воспроизводимость результатов в других условиях и возможности экстраполяции результатов на более крупные когорты. Разница в размерах групп (n = 20 vs n = 85) может снижать статистическую мощность сравнения.
Заключение
Разработанная прогностическую модель определения вероятности обнаружения АТ ДПГ IgA в сыворотке крови у пациентов с IgA-H, обладающая высокой чувствительностью и специфичностью, может снизить стоимость диагностических мероприятий при отборе пациентов для тестирования на АТ; улучшить оценку рисков прогрессирования IgA-Н и создать новые возможности для персонифицированного клинического подхода и оптимизации лечебных стратегий, что, в свою очередь, может привести к улучшению почечных исходов для пациентов с IgA-H.


