Способность искусственных антигенных конструкций, содержащих эпитопы белков, ассоциированных с меланомой, стимулировать цитотоксическую активность мононуклеарных клеток периферической крови в отношении клеток меланомы
Автор: Боробова Елена Александровна, Антонец Денис Викторович, Старостина Екатерина Владимировна, Карпенко Лариса Ивановна, Жеравин Александр Александрович, Ильичев Александр Алексеевич, Бажан Сергей Иванович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Цель исследования - оценить способность ДНК-конструкций pMEL-TCI и pMEL-A0201, кодирующих искусственные полиэпитопные антигены меланомы, стимулировать противоопухолевый ответ в системе индукции Т-клеточного ответа ex vivo. материал и методы. Изучение цитотоксической активности проводилось в системе индукции Т-клеточного ответа ex vivo с использованием мононуклеарных клеток (МНК) периферической крови HLA-A*02:01 позитивных доноров. Цитотоксическую активность оценивали двумя методами: 1) по способности МНК, стимули-рованных дендритными клетками, трансфицированными плазмидами pMEL-TCI и pMEL-A0201, вызывать лизис клеток меланомы человека линии Mel Is, а также 2) по уровню их гранзим-продуцирующей активности. В качестве положительного контроля использовалась рекомбинантная плазмида, кодирующая полноразмерный антиген клеток меланомы MART-1. Результаты. Полученные результаты показали, что дендритные клетки HLA-A*02:01+ доноров, трансфицированные плазмидными конструкциями pMel-A0201 и pMel-TCI, стимулировали цитотоксическую актив-ность аутологичных МНК в отношении клеток меланомы Mel Is. Как по эффективности индукции цитотоксического ответа, так и по уровню стимуляции продукции гранзима B аллелеспецифическая конструкция достоверно пре-взошла конструкцию, кодирующую полноразмерный белок MART1. заключение. ДНК-вакцинные конструкции, кодирующие искусственные полипептиды, составленные из эпитопов опухолевых антигенов, способны стимулиро-вать противоопухолевый цитотоксический ответ. Данный подход может послужить основой для разработки новых способов иммунотерапии онкологических заболеваний.
Меланома, днк-вакцинные конструкции, т-клеточные эпитопы, полиэпитопные антигены, цитотоксические т-лимфоциты, меланома кожи, иммуногены, цитотоксическая активность, иммунный ответ
Короткий адрес: https://sciup.org/140254240
IDR: 140254240 | УДК: 616-006.81-091.811:615.155 | DOI: 10.21294/1814-4861-2019-18-1-43-49
Текст научной статьи Способность искусственных антигенных конструкций, содержащих эпитопы белков, ассоциированных с меланомой, стимулировать цитотоксическую активность мононуклеарных клеток периферической крови в отношении клеток меланомы
Меланома является наиболее опасным злокаче‑ ственным новообразованием кожи [1]. В послед‑ нее десятилетие отмечается стремительный рост заболеваемости меланомой кожи (МК) по всему миру, при этом пока не существует универсального метода терапии этой опухоли. Стандартные методы лечения меланомы позволяют добиться опреде‑ ленных результатов, но не приводят к увеличению выживаемости больных. Высокая смертность и низкая эффективность лечения диктуют необходи‑ мость разработки новых методов лечения МК.
Известно, что клетки меланомы обладают вы‑ сокой иммуногенностью. Описан ряд белковых антигенов, специфичных для меланомы и неко‑ торых других форм злокачественных опухолей, отсутствующих (или практически отсутствующих) на нормальных клетках организма человека. Среди них можно выделить такие антигены, как Melan‑A/ MART‑1, gp100, тирозиназа, MAGE‑3 и NY‑ESO‑1 [2–4]. Это обстоятельство дает возможность раз‑ работки стратегии иммунотерапии меланомы, основанной на применении терапевтических вак‑ цин, создаваемых с использованием достижений современной иммунологии, биоинформатики и клеточных технологий. Весьма привлекательной в этом плане представляется ДНК‑вакцинация, индуцирующая активацию цитотоксических CD8+ Т‑лимфоцитов – главных эффекторных клеток противоопухолевого иммунного ответа [5].
Ранее с использованием программного обе‑ спечения TEpredict и PolyCTLDesigner [6, 7] был проведен теоретический дизайн последователь‑ ностей двух искусственных Т‑клеточных имму‑ ногенов (MEL‑A0201 и MEL‑TCI), содержащих как цитотоксические (CD8+ CTL), так и хелперные (CD4+ Th) Т‑клеточные эпитопы 6 меланомных антигенов (NY‑ESO‑1, MART1, MAGE‑A1, MAGE‑ A11, MAGE‑A3 и MAGE‑C1) [8]. Иммуноген MEL‑TCI содержит эпитопы, рестриктированные наиболее распространенными аллельными вариан‑ тами молекул HLA I класса, тогда как конструкция MEL‑A0201 является аллель‑специфической, в которую включены эпитопы, рестриктированные молекулами HLA‑A*02:01. Искусственные гены, кодирующие целевые иммуногены, спроектирова‑ ны с использованием программного обеспечения GeneDesigner [9]. Для увеличения экспрессии целевых генов использовались кодоны высокоэк‑ спрессируемых генов человека. Спроектированные гены были синтезированы (Evrogen LLC, Russia) и клонированы в составе плазмиды pcDNA3.1, являющейся эукариотическим экспрессионным вектором. В качестве положительного контроля использовалась рекомбинантная плазмида, коди‑ рующая полноразмерный антиген клеток мелано‑ мы MART1. Экспрессия целевых генов в составе ДНК‑вакцинных конструкций была подтверждена с помощью трех методов: ОТ‑ПЦР, иммуноблот‑ тинга и внутриклеточного окрашивания продукта экспрессии специфическими моноклональными антителами (МКА) 29F2 к маркерному эпитопу белка p24 ВИЧ‑1 [8].
Цель исследования заключалась в оценке способности искусственных полиэпитопных иммуногенов, сконструированных нами ранее, индуцировать противоопухолевый ответ в системе индукции Т‑клеточного ответа ex vivo .
Материал и методы
Получение миелоидных дендритных клеток
Образцы крови здоровых доноров были по‑ лучены в ФГБУ «НМИЦ им. Е.Н. Мешалкина». Протокол исследования № 4 от 29.04.2016 был рассмотрен и одобрен на заседании этического комитета центра. Работу проводили с соблюдением принципов добровольности и конфиденциальности в соответствии с Основами законодательства РФ об охране здоровья граждан.
Мононуклеарные клетки периферической крови (МНК) HLA‑A*02:01 позитивных доноров выделяли из лейкомассы в градиенте плотности с использованием Lymphocyte separation medium (MP BIOMEDICALS, США). Клетки интерфазного кольца собирали, дважды отмывали, инкубировали в среде RPMI‑1640 2 ч в атмосфере, содержащей 5 % СО2 при 37 °С. Прилипшую фракцию культи‑ вировали в 48‑луночном планшете (Greiner bio‑one, Германия) в концентрации 1 млн/мл, в объеме 0,5 мл полной среды RPMI‑1640 в присутствии 100 нг/мл rhGM‑CSF и 20 нг/мл rhIL‑4 в течение 4 сут для по‑ лучения незрелых дендритных клеток (ДК). Далее проводилась процедура магнитной трансфекции на стадии незрелых ДК согласно инструкции производителя (PromoKine, USA). Для индукции созревания к культуре трансфицированных ДК добавляли коктейль цитокинов: rhTNF‑α (50 нг/ мл), poli I:C (20 мкг/мл), IFN гамма (20 нг/мл), IFN альфа (20 нг/мл), ИЛ‑1 β (25 нг/мл) и инкуби‑ ровали в течение 24 ч. Для оценки фенотипа ДК были использованы соответствующие меченные флюорохромами моноклональные антитела anti‑ CD14‑FITC, anti‑CD83‑PE, anti‑CD86‑PerCP‑Cy5.5, anti‑HLA‑DR‑FITC, anti‑CD11C‑PE с последую‑ щим анализом на проточном цитофлуориметре FACS CALIBUR (BD, США). Клетки в количестве 0,3×106инкубировали с антителами в течение
20 мин при комнатной температуре в темноте, за‑ тем отмывали PBS, содержащим 0,02 % ЭДТА и 1 % азида натрия, и фиксировали в растворе с 0,1 % параформальдегида. Уровень экспрессии маркеров на поверхности полученных ДК составил более 80 % для CD80/CD86/CD11c/CD80.
Стимуляция МНК в совместной культуре с ДК
Зрелые дендритные клетки, трансфицирован‑ ные плазмидами pMEL‑TCI, pMEL‑A0201, pcDNA‑ MART1, pcDNA3.1, подвергались совместному культивированию с неприлипшей фракцией МНК в течение 48 ч (в соотношении ДК:МНК = 1:10) в среде RPMI‑1640 с содержанием 10 % FBS при 37 °С, 5 % СО2. Полученные активированные клетки использовались для оценки цитотоксиче‑ ской активности и уровня продукции гранзима B цитотоксическими Т‑лимфоцитами.
Изучение гранзим-продуцирующей активности цитотоксических Т-лимфоцитов
Уровень гранзим‑продуцирующей активности цитотоксических Т‑лимфоцитов в совместной культуре МНК и ДК, трансфицированных целе‑ выми плазмидами, оценивался с помощью метода проточной цитофлюориметрии. К суспензии МНК с дендритными клетками (2 сут культуре) в сте‑ рильных условиях добавляли по 1 мкл на 1×106 клеток ингибитора транспорта белков BD GolgiS‑ top согласно инструкции производителя набора Cytofix/Cytoperm™ Plus Fixation/Permeabilization Kit (BD), инкубировали 4–6 ч в атмосфере 5 % СО2 при 37 ºС. Стимуляция МНК осуществлялась смесью синтетических пептидов, содержащих Т‑клеточные эпитопы, входящие в состав целевых таблица
Синтетические пептиды, выбранные для стимуляции предшественников ctl в совместной культуре МНк и Дк, трансфицированных плазмидами pMel-tci, pMel-a0201 и pcdna-Mart1
Пептиды pMEL‑TCI EADPTGHSY SVLEVFEGR YRAREPVTK
YEDYFPEIF EHSAYGEPR ESRLLEFYL LTAADHRQL IRLTAADHR RRRNGYRAL HLLLRKYRV YRALMDKSL MPREDAHFI
ALMDKSLHV pMEL‑A0201 IMPKAGLLI CILESLFRA YIFATCLGL
FLWGPRALA LMWITQCFL HLLLRKYRV ALMDKSLHV
pcDNA‑MART1 RRRNGYRAL YRALMDKSL ALMDKSLHV GYPKKGHGH DKSLHVGTQ PAYEKLSAE
GYRALMDKS RNGYRALMD
полиэпитопных иммуногенов MEL‑A0201 и MEL‑ TCI и белка MART‑1 (таблица). Каждый пептид до‑ бавлялся в количестве 10 мкг/мл на 1×106 клеток.
В качестве контроля для оценки неспеци‑ фической cтимуляции использовали форбол‑ 12‑миристат‑13‑ацетат (PMA) (30 нг/мл) c иономицином (Io) (1 мкг/мл). Стимуляцию в этом случае проводили в течение 4–6 ч с добавлением BD GolgiStop. После инкубации клеток с ингиби‑ тором транспорта белков BD GolgiStop проводили окрашивание следующими моноклональными антителами: CD4/CD8/CD3/GR B (BD Biosciences, USA). Клетки с моноклональными антителами инкубировали 30 мин при 4 ºС. Далее клетки про‑ мывали и проводили анализ уровня продукции гранзима В эффекторными Т‑лимфоцитами на проточном цитофлуориметре BD FACSCalibur. Подсчет гранзим B продуцирующих CD8+ клеток проводился среди пула CD8+ клеток.
Оценка цитотоксической активности
Анализ цитотоксической активности аутоло‑ гичных МНК, генерируемых в системе индукции Т‑клеточного ответа ex vivo , проводился путем измерения содержания фермента лактатдегидро‑ геназы (ЛДГ), высвобождаемого из поврежденных клеток‑мишеней, в качестве которых исполь‑ зовались опухолевые клетки меланомы линии Mel Is (Российский онкологический научный центр им. Н.Н. Блохина, г. Москва). Измерения проводились согласно инструкции производителя набора CytoTox 96® Non‑Radioactive Cytotoxicity Assay (Promega). В лунки 96‑луночного планшета вносились клетки меланомы Mel Is в количестве 2×105 см2. Клетки культивировались в среде RPMI‑ 1640 с содержанием 10 % FBS при 37 °С в 5 % СО2 в течение ночи. Через 16 ч в культуру опухолевых клеток вносили смесь ДК с аутологичными МНК. Соотношение эффекторных клеток и клеток ми‑ шеней составляло 10:1. Планшет с клетками инку‑ бировался в течение 16–18 ч, после чего измеряли уровень ЛДГ в культуральной среде.
Статистический анализ
Статистическое сравнение результатов, полу‑ ченных с использованием различных конструкций, проводили с помощью парного однонаправленного теста Стьюдента с поправкой на множественное тестирование по методу Бенжамини – Хохберга (FDR). Проверку гомоскедастичности проводили с помощью критерия Бартлетта. Во всех случаях критический уровень значимости был принят рав‑ ным 5 % (0,05). Анализ результатов и построение графиков выполняли на персональном компью‑ тере с использованием свободной программной среды для статистического анализа R [9]. Данные в тексте представлены в виде среднего и ошибки среднего.
Результаты
Исследование цитотоксической активности активированных эффекторных клеток по отношению к клеткам-мишеням
Поскольку основным механизмом элиминации опухолевых клеток является их непосредственный лизис, то мы провели исследование цитототокси‑ ческой активности эффекторных клеток, сформи‑ рованных в совместной культуре МНК и зрелых ДК, нагруженных плазмидами pMEL‑TCI, pMEL‑ A0201, pcDNA‑MART1, pcDNA3.1 [8]. В качестве мишени использовали клетки меланомы человека линии Mel Is, экспрессирующие на своей поверх‑ ности антиген MART‑1. Оценка цитотоксической активности эффекторных клеток проводилась колориметрическим методом, позволяющим про‑ вести количественное определение содержания лактат‑дегидрогеназы – цитозольного фермента, выделяющегося из лизированных клеток (см. раз‑ дел «Материал и методы»).
Результаты исследования цитотоксической ак‑ тивности МНК, стимулированной под влиянием различных иммуногенных конструкций, пред‑ ставлены на рис. 1. Статистический анализ полу‑ ченных результатов показал, что цитотоксическая активность МНК, стимулированных дендритными клетками, трансфицированными конструкциями pcDNA‑MART1 (9,47 ± 1,31), pMel‑TCI (17,3 ± 0,67) и pMel‑A0201 (20,03 ± 3,13), значимо превос‑ ходит цитотоксический ответ, наблюдавшийся в совместной культуре МНК и ДК, трансфицирован‑ ных векторной плазмидой pcDNA3.1 (5,32 ± 1,28) (p≤0,05). Кроме того, цитотоксический ответ, индуцированный целевыми конструкциями pMel‑ A0201 и pMel‑TCI, достоверно превзошел цито‑ токсический ответ, индуцированный плазмидой pcDNA‑MART1, кодирующей полноразмерный бе‑ лок MART‑1 (p=0,035). При этом различий между цитотоксическим ответом, индуцированным пре‑ паратами pMel‑A0201 и pMel‑TCI, не наблюдалось (p=0,26).
Цитотоксические лимфоциты могут лизировать опухолевые клетки с помощью гранзима B, кото‑ рый является сериновой протеазой и накапливается в секреторных гранулах цитотоксических лимфо‑ цитов и натуральных киллеров. Для подтвержде‑ ния предположения о том, что лизис опухолевых клеток в нашем случае может осуществляться гранзимом В, мы определяли содержание клеток, экспрессирующих внутриклеточный гранзим B в культуре МНК здоровых доноров после совмест‑ ного культивирования с ДК, трансфицированными препаратами целевых ДНК‑вакцинных конструк‑ ций, по сравнению с совместными культурами МНК и ДК, трансфицированными контрольными плазмидами. Содержание клеток, имеющих в цитоплазме гранулы гранзима B, определяли с помощью метода внутриклеточного окрашивания цитокинов (ISC).
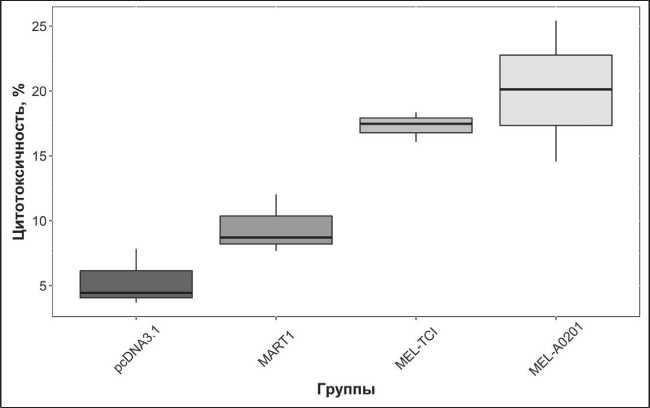
Рис. 1. Результаты исследования цитотоксического ответа МНК условно-здоровых доноров, стимулированного при совместном культивировании с аутологичными ДК, трансфицированными различными иммуногенными конструкциями, против линии клеток меланомы человека Mel Is (n=3).
Примечания: pcDNA3.1 – совместная культура МНК и ДК, трансфицированных контрольной плазмидой; MART-1 – совместная культура МНК и ДК, трансфицированных плазмидой pcDNA-MART1, кодирующей полноразмерный белок MART-1; Mel-A0201 – совместная культура МНК и ДК, трансфицированных плазмидой pMel-A0201; Mel-TCI – совместная культура МНК и ДК, трансфицированных плазмидой pMel-TCI
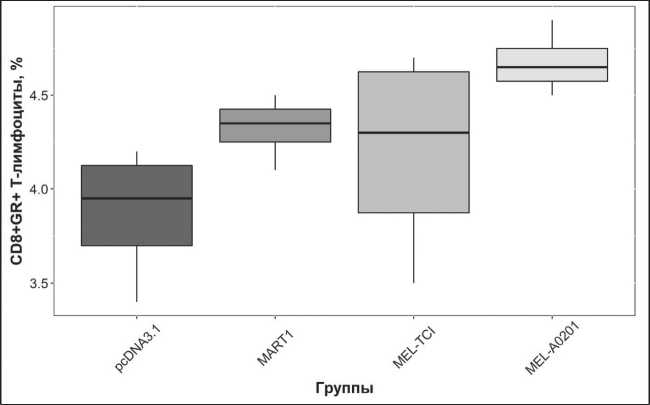
Рис. 2. Результаты исследования количества CD8+ Т-лимфоцитов, продуцирующих гранзим B, в совместной культуре МНК условно-здоровых доноров с помощью метода ICS (n=4).
Примечания: pcDNA3.1 – совместная культура МНК и ДК, трансфицированных контрольной плазмидой; MART-1 – совместная культура МНК и ДК, трансфицированных плазмидой pcDNA-MART1, кодирующей полноразмерный белок MART-1; Mel-A0201 – совместная культура МНК и ДК, трансфицированных плазмидой pMel-A0201; Mel-TCI – совместная культура МНК и ДК, трансфицированных плазмидой pMel-TCI
Результаты определения количества СD8+ клеток, продуцирующих гранзим В, полученные в опытных и контрольных образцах, представлены как процент от общего количества СD8+ лимфо‑ цитов в пробе, значение которого оценивалось на основе анализа данных проточной цитометрии (рис. 2). Среди МНК, стимулированных препа‑ ратом pMel‑A0201, обнаруживается в среднем 4,67 % (± 0,09) CD8+ гранзим‑положительных CD8+ Т‑лимфоцитов; среди МНК, культивиро‑ ванных с ДК, трансфицированными плазмидой pcDNA3,1 – 3,88 ± 0,18; среди МНК, стимулиро‑ ванных ДК, трансфицированными конструкцией pMel‑TCI – 4,2 ± 0,28; и 4,33±0,09 – среди МНК, стимулированных ДК, трансфицированными pcDNA‑MART1. Статистический анализ резуль‑ татов, представленных на рис. 2, показал, что в культурах МНК с ДК, трансфицированными pMel‑ A0201, относительное количество CD8+ гранзим‑ положительных CD8+ Т‑лимфоцитов значимо превосходит результат, полученный в культурах МНК с ДК, трансфицированными pcDNA‑MART1 и pcDNA3.1 (p=0,018). Отличия между остальными культурами были недостоверными.
Обсуждение
Учитывая существующие в настоящее время проблемы в создании терапевтических вакцин против онкологических заболеваний, эта задача требует новых подходов. За последнее десятилетие был предложен ряд стратегий, учитывающих со‑ временные знания о противоопухолевом иммуни‑ тете. Один из подходов к созданию эффективных и безопасных вакцин нового поколения основан на дизайне мозаичных полиэпитопных антигенов на основе широкого спектра протективных В‑ и/или Т‑клеточных детерминант [10–16]. В частности, данный подход включает создание искусственных полиэпитопных конструкций, оптимизированных для повышения эффективности процессинга и включающих большое количество консервативных Т‑клеточных эпитопов, взаимодействующих с широким спектром аллельных вариантов молекул MHC. В данной работе исследовалась способность ранее созданных ДНК‑вакцинных конструкций pMel‑A0201 и pMel‑TCI индуцировать противоопу‑ холевый иммунный ответ, который оценивался по способности МНК вызывать лизис клеток мела‑ номы Mel Is в системе индукции Т‑клеточного от‑ вета ex vivo. Полученные результаты показали, что дендритные клетки HLA‑A*02:01+ доноров, транс‑ фицированные ДНК‑вакцинными конструкциями pMel‑A0201 и pMel‑TCI, стимулировали у аутоло‑ гичных МНК развитие цитотоксической активно‑ сти в отношении клеток меланомы Mel Is . Причем как по эффективности индукции цитотоксического ответа, так и по уровню продукции гранзима В аллелеспецифическая конструкция достоверно превзошла ДНК‑вакцинную конструкцию, коди‑ рующую полноразмерный белок MART1.
Список литературы Способность искусственных антигенных конструкций, содержащих эпитопы белков, ассоциированных с меланомой, стимулировать цитотоксическую активность мононуклеарных клеток периферической крови в отношении клеток меланомы
- Siegel R.L., Miller K.D., Jemal A. Cancer Statistics, 2018. CA Cancer J Clin. 2018 Jan; 68 (1): 7-30. DOI: 10.3322/caac.21442
- Halama N., Zoernig I., Jaeger D. Advanced malignant melanoma: immunologic and multimodal therapeutic strategies. J Oncol. 2010; 2010: 689893. DOI: 10.1155/2010/689893
- Pandolfi F., Cianci R., Lolli S., Dunn I.S., Newton E.E., Haggerty T.J., Boyle L.A., Kurnick J.T. Strategies to overcome obstacles to successful immunotherapy of melanoma. Int J Immunopathol Pharmacol. 2008 Jul-Sep; 21 (3): 493-500.
- Parmiani G. Melanoma antigens and their recognition by T cells. Keio J Med. 2001 Jun; 50 (2): 86-90.
- Denapoli P.M., Zanetti B.F., dos Santos A.A., de Moraes J.Z., Han S.W. Preventive DNA vaccination against CEA-expressing tumors with anti-idiotypic scFv6. C4 DNA in CEA-expressing transgenic mice. Cancer Immunol Immunother. 2017 Mar; 66 (3): 333-342. DOI: 10.1007/s00262-016-1940-4


