Способы синтеза соединений фосфора R4PX, где Х - электроотрицательная группа
Автор: Шарутин В.В., Механошина Е.С., Сахаутдинова М.Э., Байгильдина Д.Р., Мородецких М.О., Сажин О.А., Якшимбаев А.А., Журавлева С.А., Безгодова А.Р., Сычева С.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
На основе анализа литературы, опубликованной с начала XXI века до настоящего времени, систематизированы и описаны методы получения соединений фосфора общей формулы R4PX (X - электроотрицательная группа). Настоящая работа является продолжением классических исследований в области химии органических соединений фосфора в лаборатории химии элементоорганических соединений Южно-Уральского государственного университета. Основное внимание уделено методам синтеза производных тетраорганилфосфония, основанных на реакциях перераспределения радикалов и реакциях замещения, по которым синтезирован бромид тетрафенилфосфора и ряд аренсульфонатов алкилтрифенилфосфония соответственно. Показано, что единственным продуктом взаимодействия дибромида трифенилфосфора с пентафенилфосфором в растворе бензола (1 ч, 25 °С) является бромид тетрафенилфосфония, выделенный из реакционной смеси с выходом 92 %. По реакции замещения из бромида тетрафенилфосфония и бензолсульфоновой кислоты в воде получен гидрат бензолсульфоната тетрафенилфосфония [Ph4P][OSO2Ph] ∙ H2O (1) с выходом 90 %. По аналогичной схеме с выходом до 92 % получен ряд аренсульфонатов алкилтрифенилфосфония: [Ph3PC3H5-cyclo][OSO2Naft-1] (2), [Ph3PCH2СN][OSO2Mez)] (3), [Ph3PCH2СN] [OSO2C6H3Сl2-2,5] ∙ ½MeOH (4), [Ph3PCH2OH] [OSO2C6H3Сl2-2,5] ∙ H2O (5), [Ph3PEt] [OSO2C6H3(NO2)2-2,4] (6), [Ph3P(СH2)2OH][OSO2C6H3(NO2)2-2,4] (7), [Ph3P(С6H11-cyclo)] [OSO2C6H3(NO2)2-2,4] (8). Строение комплексов доказано методами ИК-спектроскопии и рентгеноструктурного анализа (РСА). По данным РСА кристаллы комплексов 2-5 имеют ионную структуру и состоят из катионов тетраорганилфосфония и аренсульфонатных анионов.
Бромид тетрафенилфосфония, бензолсульфонат тетрафенилфосфония, аренсульфонат алкилтрифенилфосфония, синтез, реакция, перераспределения лигандов, замещения
Короткий адрес: https://sciup.org/147243274
IDR: 147243274 | УДК: 546 | DOI: 10.14529/chem240106
Текст научной статьи Способы синтеза соединений фосфора R4PX, где Х - электроотрицательная группа
Одними из наиболее изученных арильных соединений элементов пятой группы Ar 5 E (E = P, As, Sb, Bi) являются их фенильные производные. Известно, что пентафенилфосфор, который Г. Виттиг получил в 1953 году, являлся базовым реагентом для синтеза новых производных фосфора общей формулы Ph 4 PX по реакции деарилирования пентафенилфосфора неорганическими кислотами, такими, например, как гексахлорплатиновая кислота [1].
2 Ph 5 P + H 2 PtCl6 ---► [Ph 4 P] 2 [PtCl 6 ] + 2 PhH
В работе [2] описан синтез алкоксидов и феноксида тетрафенилфосфора из пентафенилфос-фора и гидроксилсодержащих соединений и была отмечена возможность использования первых в органическом синтезе для синтеза простых эфиров, когда, например, из бензилокситетрафенил-фосфора и трифенилсиланола с практически количественным выходом был получен бензиловый эфир трифенилсиланола.
Ph 4 POCH 2 Ph + HOSiPh3 —► Ph 3 PO + PhH + Ph 3 SiOCH 2 Ph
Весьма интересна реакция пентафенилфосфора с углекислым газом, когда из реакционной смеси было выделено гетероциклическое соединение - 5-оксо-2,2,2-трифенилбенз-[c]-1,2-оксафосфолан, строение которого быдо доказано методом рентгеноструктурного анализа (РСА) [3, 4].
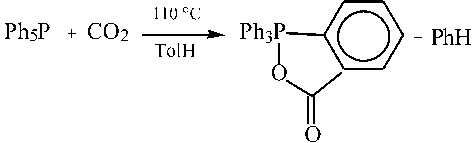
Известно, что пентафенилфосфор при действии карбоновых кислот превращается в карбоксилаты тетрафенилфосфора [5, 6].
PhH
Ph 5 P + RCOOH Ph 4 PO(O)CR + PhH
R = C 6 H 4 (OH-2), C 6 H 4 (COOH-2), Me, CCl 3 , Ph, CH=CHPh, CH 2 CH 2 COOH, CH=CHCOOH, CH 2 COOH, C 6 H 4 (NO 2 -2)
Взаимодействие избытка пентафенилфосфора с тетрафторфталевой кислотой протекает с участием двух карбоксильных групп с образованием тетрафторфталата бис (тетрафенилфосфония) [7].
2 Ph 5 P + C 6 F 4 (COOH) 2 [Ph 4 P] 2 +[С 6 F 4 (COO) 2 ]2– + 2 PhH
По аналогичной схеме пентафенилфосфор реагирует с фталевой кислотой.
Взаимодействием пентафенилфосфора с 2,6-дигидроксибензойной и янтарной кислотами (мольное соотношение 2:1 и 1:1) в растворе ароматического углеводорода (бензол или толуол, запаянная ампула, 0,5 часа, 60 °С) синтезированы карбоксилаты тетрафенилфосфония в форме сольватов с растворителем [Ph4P]+[OC(O)C 6 H 3 (OH)2-2,6] -- PhH и [Ph4P] + 2[O2CCH2CH2CO2]2 -- TolH [8]. По данным РСА, кристаллы карбоксилатов тетрафенилфосфония сформированы из тетраэдрических катионов тетрафенилфосфония и карбоксилатных анионов.
Особый интерес к изучению особенностей строения аддуктов карбоксилатов тетрафенил-фосфора связан с тем, что они ранее были описаны в литературе. Аддукт бензоата тетрафенил-фосфора с бензойной кислотой был получен взаимодействием пентафенилфосфора с бензойной кислотой в мольном соотношении 1:2 в бензоле [9]. Кристаллы бледно-желтого цвета с т. пл. 129 ° С хорошо растворимы в ароматических углеводородах и полярных растворителях.
Взаимодействием пентафенилфосфора с 2-сульфобензойной кислотой в бензоле получен с выходом 90 % (2-карбокси)бензолсульфонат тетрафенилфосфония [Ph4P] + [OSO2C6H4(COOH-2)] - , который был также синтезирован из хлорида тетрафенилфосфония и 2-сульфобензойной кислоты в воде с выходом 89 % [10].
Реакция пентафенилфосфора с оксидом серы SO 2 (стеклянная ампула, 24 ° С, 1 ч) c последующей перекристаллизацией целевого продукта из воды приводила к получению тиобензол-сульфоната тетрафенилфосфония [Ph4P] + [PhSO2S] - , который был охарактеризован методами рентгеноструктурного анализа и ИК-спектроскопии [11]. Представляет собой бесцветные кристаллы с т. пл. 164 ° С, растворимые в аренах и полярных растворителях.
Показано, что пентафенилфосфор реагирует с аренсульфоновыми кислотами (мольное соотношение 1:1) в бензоле с образованием аренсульфонатов тетрафенилфосфония, представляющих собой бесцветные кристаллические вещества, хорошо растворимые в полярных органических растворителях и воде [5, 12 - 14]:
PhH
Ph 5 P + HOSO 2 Ar Ph 4 POSO 2 Ar + PhH
Ar = C 6 H 5 , C 6 H 4 Me-4, C 6 H 3 (COOH-3)(ОН-4), C 6 H 3 (NO 2 ) 2 -2,4
Бензолсульфонат тетрафенилфосфония был также получен внедрением оксида серы(VI) по связи P–C в пентафенилфосфоре [5]:
PhH
Ph 5 P + SO 3 Ph 4 POSO 2 Ph
По данным РСА, аренсульфонаты тетраорганилфосфония являются ионными соединениями с малоискаженными катионами тетраорганилфосфония.
В работах [15 - 19] был описан синтез ряда аренсульфонатов тетраорганилфосфония из галогенидов тетраорганилфосфония и аренсульфоновых кислот. Достоинствами данного одностадийного способа являются мягкие условия проведения эксперимента и высокие выходы комплексов, однако получение производных тетраорганилфосфония, содержащих функциональные группы в органических радикалах при атоме фосфора, ранее не изучалось, как и соли тетраорганилфосфония с анионами сложного строения.
В настоящей работе представлен синтез бромида тетрафенилфосфония и новых аренсульфо-натов алкилтрифенилфосфония: [Ph 3 PC 3 H 5 -cyclo][OSO 2 Naft-1], [Ph 3 PCH 2 СN][OSO 2 Mez)],
[Ph 3 PCH 2 СN][OSO 2 C 6 H 3 Сl 2 -2,5]∙½MeOH, [Ph 3 PCH 2 OH][OSO 2 C 6 H 3 Сl 2 -2,5]∙H 2 O, [Ph 3 PEt][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4], [Ph 3 PСН 2 СН 2 OH] [OSO 2 C 6 H 3 (NO 2 ) 2 -2,4], [Ph 3 PС 6 Н 11 - цикло ] [OSO 2 C 6 H 3 (NO 2 ) 2 -2,4].
Экспериментальная часть
Реакция сольвата пентафенилфосфора с бензолом с дибромидом трифенилфосфора. Смесь 110 мг (0,24 ммоль) сольвата пентафенилфосфора с бензолом [5] и 100 мг (0,24 ммоль) дибромида трифенилфосфора [20] в 10 мл бензола перемешивали при 20 °С 1 ч, удаляли растворитель. Остаток перекристаллизовывали из воды. Получили 93 мг (92 %) бесцветных кристаллов бромида тетрафенилфосфония c t пл = 295 °С ( t пл = 294 - 296 °С [21]).
Реакция бромида тетрафенилфосфония с бензолсульфоновой кислотой. К раствору 79 мг (0,50 ммоль) бензолсульфоновой кислоты в 10 мл воды прибавляли 210 мг (0,50 ммоль) бромида тетрафенилфосфония и перемешивали при 20 °С 1 ч. Остаток перекристаллизовывали из воды. Получили 223 мг (90 %) бесцветных кристаллов гидрата бензолсульфоната тетрафенилфосфония Ph 4 POSO 2 Ph ∙ H 2 O ( 1 ) c t пл = 175 °С (лит. данные t пл = 174 - 176 °С [5]).
Аналогично получали неизвестные ранее аренсульфонаты алкилтрифенилфосфония, которые перекристаллизовывали из воды или метилового спирта.
1-Нафталинсульфонат циклопропилтрифенилфосфония [Ph 3 PC 3 H 5 - cyclo ][OSO 2 Naft-1] ( 2 ) ( t пл = 156 °С, 91 %). ИК-спектр ( ν , см–1): 3011, 1587, 1504, 1485, 1437, 1340, 1317, 1301, 1213, 1190, 1072, 1045, 997, 814, 787, 754, 723, 694, 685, 661, 611, 563, 527, 496, 459. Найдено, %: С 72,85; Н 5,64. C 31 H 27 O 3 PS. Вычислено, %: С 72,87; Н 5,29.
Мезитиленсульфонат цианометилтрифенилфосфония [Ph 3 PCH 2 CN][OSO 2 C 6 H 2 Me 3 -2,4,6] ( 3 ) ( t пл = 199 °С, 91 %). ИК-спектр ( ν , см–1): 3059, 3021, 2884, 2845, 2768, 2251, 1605, 1587, 1566, 1472, 1439, 1339, 1315, 1254, 1213, 1192, 1161, 1114, 1013, 957, 932, 914, 758, 746, 719, 687, 677, 581, 550, 530, 496, 463, 432. Найдено, %: С 69,28; Н 5,68. C 29 H 28 NO 3 PS. Вычислено, %: С 69,38; Н 5,54.
Сольват 2,5-дихлорбензолсульфонат цианометилтрифенилфосфония с метиловым спиртом [Ph 3 PCH 2 СN][OSO 2 C 6 H 3 Сl 2 -2,5] ∙ ½MeOH ( 4 ) ( t пл = 182 °С, 91 %). ИК-спектр ( ν , см–1): 3071, 2876, 2849, 2766, 2251, 1587, 1483, 1439, 1373, 1342, 1242, 1211, 1150, 1113, 1096, 1061, 1016, 995, 905, 853, 827, 746, 717, 687, 617, 588, 552, 534, 519, 505, 493, 459, 434. Найдено, %: С 58,30; Н 5,81. C 53 H 44 Cl 4 N 2 O 7 P 2 S 2 . Вычислено, %: С 58,42; Н 4,04.
Гидрат 2,5-дихлорбензолсульфонат оксиметилтрифенилфосфония [Ph 3 PCH 2 OH][OSO 2 C 6 H 3 Сl 2 -2,5] ∙ H 2 O ( 5 ) ( t разл = 112 °С, 91 %). ИК-спектр ( ν , см–1): 3568, 3256, 1567, 1437, 1373, 1244, 1200, 1472, 1117, 1063, 1016, 997, 891, 752, 739, 719, 683, 619, 590, 532, 496, 486, 457, 413. Найдено, %: С 56,39; Н 4,27. C 50 H 44 Cl 4 O 9 P 2 S 2 . Вычислено, %: С 56,78; Н 4,16.
2,4-Динитробензолсульфонат этилтрифенилфосфония [Ph 3 PEt][OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] (6) ( t разл = 112 °С, 93 %). ИК-спектр ( ν , см–1): 3011, 1587, 1485, 1437, 1340, 1317, 1302, 1213, 1113, 1072, 1045, 997, 814, 787, 754, 723, 695, 685, 662, 611, 563, 527, 496, 459, 428. Найдено, %: С 69,28; Н 5,68. C 29 H 28 NO 3 PS. Вычислено, %: С 69,38; Н 5,54.
2,4-Динитробензолсульфонат оксиэтилтрифенилфосфония [Ph 3 P(СH 2 ) 2 OH] [OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] (7) ( t разл = 142 °С, 93 %). ИК-спектр ( ν , см–1): 3551, 3092, 3048, 3019, 2907, 1549, 1528, 1487, 1439, 1371, 1352, 1240, 1163, 1134, 1113, 1067, 1026, 993,943, 918, 849, 837, 816, 748, 733, 721, 692, 665, 633, 556, 505, 473, 419. Найдено, %: С 56,12; Н 4,36. C 26 H 23 N 2 O 8 PS. Вычислено, %: С 56,32; Н 4,15.
2,4-Динитробензолсульфонат циклогексилтрифенилфосфония [Ph 3 P(С 6 H 11 - cyclo )] [OSO 2 C 6 H 3 (NO 2 ) 2 -2,4] (8) ( t пл = 208 °С, 93 %). ИК-спектр ( ν , см–1): 3094, 3063, 3032, 2938, 2897, 2860, 1601, 1587, 1543, 1526, 1485, 1452, 1437, 1350, 1250, 1229, 1167, 1111, 1065, 1028, 997, 918, 891, 851, 833, 746, 719, 698, 664, 637, 615, 544, 521, 469, 417. Найдено, %: С 60,68; Н 4,97. C 30 H 29 N 2 O 7 PS. Вычислено, %: С 60,81; Н 4,90.
ИК-спектры соединений записывали на ИК-спектрометре Shimadzu IR Affinity-1S в таблетке KBr в области 4000–400 см–1.
Элементный анализ на С, Н проведен на анализаторе Carlo-Erba 1106. Температуры плавления измерены на синхронном термоанализаторе Netzsch 449C Jupiter.
Рентгеноструктурный анализ (РСА) соединений 2 - 5 проводили на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 K. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINT-Plus. Все расчеты по определению и уточнению структур 2 - 5 выполнены с помощью программ SHELXL/PC и OLEX2 [22‒24]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Кристаллографические данные и результаты уточнения структур приведены в таблице.
Кристаллографические данные, параметры эксперимента и уточнения структур 2 - 5
|
Параметр |
2 |
3 |
4 |
5 |
|
Формула |
C 62 H 54 O 6 P 2 S 2 |
C 29 H 28 NO 3 PS |
C 53 H 44 Cl 4 N 2 O 7 P 2 S 2 |
C 50 H 44 Cl 4 O 9 P 2 S 2 |
|
М |
1021,11 |
501,55 |
1088,76 |
1056,71 |
|
Сингония |
Ромбическая |
Моноклинная |
Триклинная |
Моноклинная |
|
Пр. группа |
P ca21 |
P 2 1 / c |
P -1 |
P 2 1 / n |
|
a , Å |
18,215(11) |
13,033(18) |
12,229(8) |
9,120(5) |
|
b, Å |
21,189(12) |
14,544(12) |
12,839(7) |
12,936(8) |
|
c, Å |
13,330(8) |
13,941(13) |
18,008(10) |
21,094(13) |
|
α, град. |
90,00 |
90,00 |
84,38(2) |
90,00 |
|
β, град. |
90,00 |
101,30(4) |
75,73(4) |
83,74(3) |
|
γ, град. |
90,00 |
90,00 |
77,65(2) |
90,00 |
|
V , Å3 |
5145(5) |
2591(5) |
2674(3) |
2489(3) |
|
Z |
4 |
4 |
2 |
4 |
|
ρ (выч.), г/см3 |
1,318 |
1,286 |
1,352 |
1,410 |
|
µ , мм–1 |
0,220 |
0,218 |
0,411 |
0,441 |
|
F (000) |
2144,0 |
1056,0 |
1124,0 |
1092,0 |
|
Размер кристалла, мм |
0,37×0,34×0,09 |
0,47×0,19×0,17 |
0,41× 0,37× 0,24 |
0,65× 0,29 × 0,19 |
|
Область сбора данных по 2 θ , град. |
5,74–56,66 |
5,54‒58,88 |
6,46–56,64 |
5,78‒57 |
|
Интервалы индексов отражений |
–24 ≤ h ≤ 24, –28 ≤ k ≤ 28, –17 ≤ l ≤ 17 |
–18 ≤ h ≤ 18, –19 ≤ k ≤ 19, –19 ≤ l ≤ 19 |
–16 ≤ h ≤ 16, –17 ≤ k ≤ 17, –23 ≤ l ≤ 23 |
–12 ≤ h ≤ 10, –17 ≤ k ≤ 17, –28 ≤ l ≤ 28 |
|
Измерено отражений |
94209 |
109265 |
98644 |
56284 |
|
Независимых отражений |
12754 |
7027 |
13253 |
6307 |
|
R int |
0,1669 |
0,0444 |
0,0460 |
0,0503 |
|
Переменных уточнения |
649 |
319 |
648 |
323 |
|
GOOF |
1,016 |
1,051 |
1,015 |
1,034 |
|
R -факторы по F 2 > 2 σ ( F 2) |
R 1 = 0,0759, wR 2 = 0,1639 |
R 1 = 0,0408, wR 2 = 0,1047 |
R 1 = 0,0480, wR 2 = 0,1159 |
R 1 = 0,0476, wR 2 = 0,1156 |
|
R -факторы по всем отражениям |
R 1 = 0,1524, wR 2 = 0,1982 |
R 1 = 0,0548, wR 2 = 0,1139 |
R 1 = 0,0769, wR 2 = 0,1325 |
R 1 = 0,0702, wR 2 = 0,1289 |
|
Остаточная электронная плотность (max/min), e/A3 |
0,72/–0,35 |
0,22/–0,51 |
0,45/–0,41 |
0,51/–0,47 |
Полные таблицы координат атомов, длин связей и валентных углов для структур депонированы в Кембриджском банке структурных данных (№ 2171555 (2), № 2177559 (3), № 2182137 (4), № 2219901 (5); ; .
Обсуждение результатов
Известно, что эффективным способом получения ониевых соединений сурьмы Ar4SbX является метод, основанный на реакции перераспределения радикалов [25-31], неизвестной ранее для производных фосфора. Мы предположили, что протекание подобных реакций перераспределения лигандов может наблюдаться и для пентафенилфосфора, который является аналогом пентафе-нилсурьмы. Действительно, мы впервые нашли, что взаимодействие сольвата пентафенилфосфо- ра (Ph5P ∙ ½ PhH) с дибромидом трифенилфосфора в бензоле (24 °С, 1 ч) приводит к образованию бромида тетрафенилфосфония с выходом 92 %.
PhH
Ph 5 P∙½PhH + Ph 3 PBr2 ---► 2 Ph 4 PBr
Найдено, что полученный бромид тетрафенилфосфония реагирует с бензолсульфоновой кислотой в бензоле с образованием бензолсульфоната тетрафенилфосфония [Ph 4 P][OSO 2 Ph] ( 1 ), выделенного из реакционной смеси с выходом 90 %.
H 2 О
Ph 4 PBr + HOSO 2 Ph —* [Ph 4 P] [OSO 2 Ph] ( 1 )
Показано, что по аналогичной схеме реагируют аренсульфоновые кислоты с галогенидами алкилтрифенилфосфония:
H 2 О
[Ph 3 PR]Br + HOSO 2 Ar —► [Ph 3 PR][OSO 2 Ar]
R = цикло -С 3 Н 5 , Ar = 1-Naft ( 2 ); R = СН 2 CN, Ar = Mez ( 3 ); R = СН 2 CN, Ar = C 6 H 3 Cl 2 -2,5 ( 4 ); R = СН 2 OH, Ar = C 6 H 3 Cl 2 -2,5 ( 5 ); R = Et, Ar = C 6 H 3 (NO 2 ) 2 -2,4 ( 6 ); R = СН 2 СН 2 OH, Ar = C 6 H 3 (NO 2 ) 2 -2,4 ( 7 ); R = цикло -С 6 Н 11 , Ar = C 6 H 3 (NO 2 ) 2 -2,4 ( 8 )
Полученные соединения представляют собой бесцветные кристаллические вещества, хорошо растворимые в полярных органических растворителях и аренах, а при нагревании и в воде.
Строение комплексов 2 ‒ 8 доказано методом ИК-спектроскопии. В ИК-спектрах комплексов присутствуют характерные полосы поглощения высокой интенсивности при 1223‒1192 см-1 и средней интенсивности при 1049‒1032 см-1, которые отвечают асимметричным и симметричным валентным колебаниям сульфонатной группы SO3. Высокоинтенсивные полосы поглощения в области 696‒689 см–1 соответствуют валентным колебаниям связи S‒O. Также содержатся характерные полосы валентных колебаний углеродного скелета ароматических фрагментов при 1603‒1483 см–1. Валентным колебаниям связей CAr—H принадлежат полосы при 3088‒3028 см–1; плоскостным деформационным колебаниям этих же связей ‒ полосы при 1165‒1031 см–1, внепло-скостным деформационным колебаниям – при 910‒849 см–1. Валентным колебаниям связей C Ar ‒S и C Ar ‒P отвечают интенсивные полосы в области 600‒597 см‒1 и 760‒716 см–1 соответственно [32]. Неплоским деформационным колебаниям связей C‒H ароматических фрагментов принадлежат полосы при 995‒906 см–1 [33]. Синглет средней интенсивности при 2251 см–1 в ИК-спектрах 2 и 3 подтверждает присутствие цианогруппы в катионах комплексов. Узкий синглет при 3568 см–1 и широкая полоса при 3256 см–1 в ИК-спектре комплекса 4 свидетельствуют о наличии гидроксильной группы в катионе и сольватных молекул воды в кристалле соответственно.
По данным рентгеноструктурного анализа, кристаллы соединений 2 ‒ 5 образованы тетраэдрическими катионами алкилтрифенилфосфония и аренсульфонатными анионами с четырехкоор-динироваными атомами серы (рис. 1‒4).
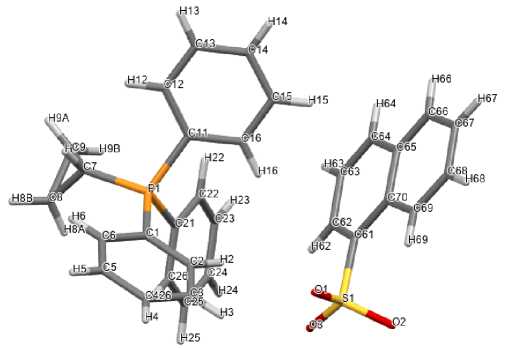
Рис. 1. Общий вид одной пары ионов 1-нафталинсульфоната циклопропилтрифенилфосфония (2)
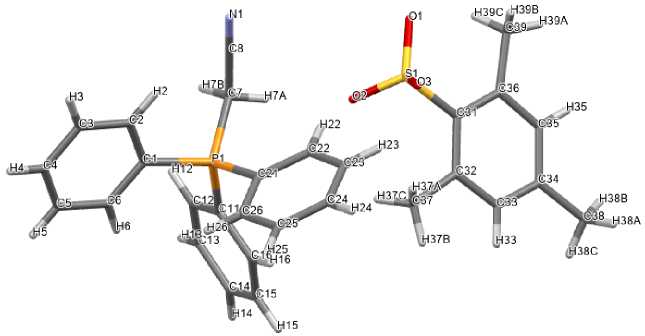
Рис. 2. Общий вид мезитиленсульфоната цианометилтрифенилфосфония (3)
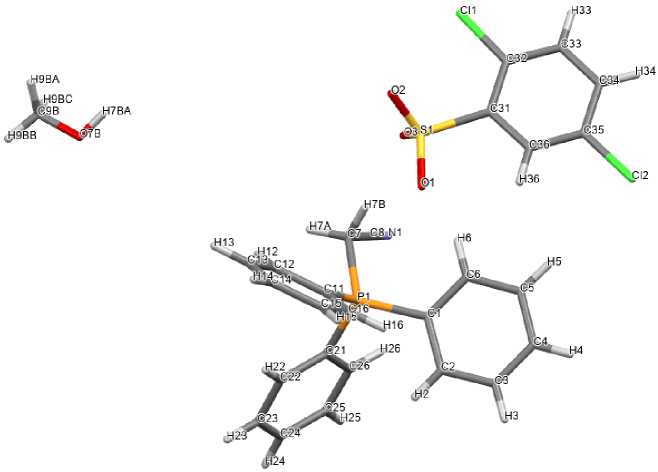
Рис. 3. Общий вид одной пары ионов сольвата 2,5-дихлорбензолсульфоната (4) цианометилтрифенилфосфония с метанолом
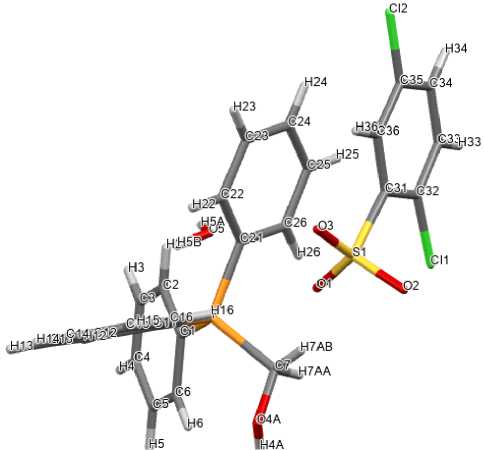
Рис. 4. Общий вид гидрата 2,5-дихлорбензолсульфоната оксиметилтрифенилфосфония (5)
Катионы алкилтрифенилфосфония в 2 ‒ 5 имеют незначительно искаженную тетраэдрическую конфигурацию. Длины связей Р-С принимают значения 1,761(5)-1,837(2) Å [1,761(5)-1,796(5) Å ( 2 ); 1,786(2)–1,798(2) Å ( 3 ); 1,781(2)–1,820(3) Å ( 4 ), 1,789(2)–1,837(2) Å ( 5 )], что сопоставимо с суммой ковалентных радиусов атомов-партнеров (1,83 Å) [34]. Валентные углы СРС изменяются в интервалах: 107,9(2)°-110,4(2)° ( 2 ); 105,76(8)°-111,34(8)° ( 3 ); 106,10(12)°-111,38(11)° ( 4 ); 108,28(10)°-110,66(9)° ( 5 ).
В сульфонатных анионах комплексов 2 ‒ 5 расстояния S-C близки между собой и принимают значения 1,777(5)-1,799(2) Å. Связи S‒О в 2 , 3 , 4 и 5 близки между собой [1,399(4)‒1,469(4) Å, 1,4421(15)‒1,4556(17) Å, 1,4349(19)‒1,448(2) Å и 1,418(2)‒1,442(2) Å соответственно], что указывает на равномерное распределение электронной плотности в SO 3 ‒ группах. Валентные углы OSC (104,6(2)°-108,96(10)°) меньше, чем углы OSO (110,24(10)°-117,1(3)°). В кристалле гидрата 5 [Ph 3 PCH 2 OH][OSO 2 C 6 H 3 Сl 2 -2,5]∙H 2 O молекулы воды посредством межмолекулярных водородных связей объединяют два сульфонатных аниона в димер (рис. 5).
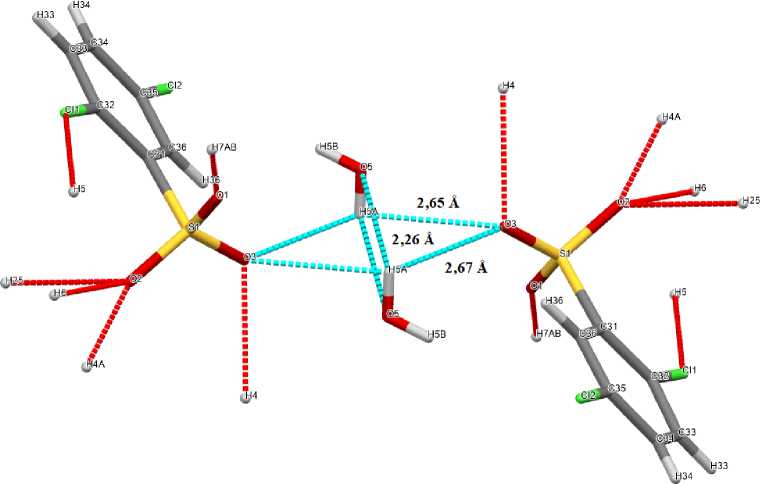
Рис. 5. Общий вид связанных между собой водородными связями
2,5-дихлорбензолсульфонатных анионов в кристалле 5
Заключение
Таким образом, взаимодействие пентафенилфосфора с дибромидом трифенилфосфора приводит к образованию бромида тетрафенилфосфония, продуктом реакции которого с бензолсульфоновой кислотой является гидрат бензолсульфоната тетрафенилфосфония. Подобные реакции бромида алкилтрифенилфосфония с аренсульфоновыми кислотами протекают аналогично с образованием аренсульфонатов алкилтрифенилфосфония.
Список литературы Способы синтеза соединений фосфора R4PX, где Х - электроотрицательная группа
- Зыкова А.Р. // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 1. С. 31. DOI: 10.14529/еЬет210103.
- Razuvaev G.A., Osanova, Brilkina T.G. et al. // J. Organomet. №ет. 1975. V. 99, № 1. Р. 93.
- Шарутин В.В., Бычков В.Т., Лебедев В.А. // Журн. общ. химии. 1986. Т. 56, № 2. С. 325.
- Шарутин В.В. // Журн. общ. химии. 1988. Т. 58, № 10. С. 2305.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. // Журн. общ. химии. 2009. Т. 79, № 1. С. 80. DOI: 10.1134^1070363209010125.
- Шарутин В.В., Шарутина О.К., Рыбакова А.В. и др. // Журн. общ. химии. 2018. Т. 88, № 8. С. 1308. DOI: 10.1134^0044460X18080139.
- Шарутин В.В., Шарутина О.К., Рыбакова А.В., Губанова Ю.О. // Журн. общ. химии. 2018, Т. 88, № 8. С. 1308. DOI: 10.1134^0044460X18080139.
- Шарутина О.К., Губанова Ю.О., Рыбакова А.В. // Вестник ЮУрГУ. Серия «Химия». 2019. Т. 11, № 1. С. 68. DOI: 10.14529/chem190108
- Рыбакова А.В. // Вестник ЮУрГУ. Серия «Химия». 2020. Т. 12, № 3. С. 88. DOI: 10.14529/chem200304.
- Ефремов А.Н., Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 3. С. 34. DOI: 10.14529/chem220304.
- Шарутин В.В. // Вестник ЮУрГУ. Серия «Химия». 2021. Т. 13, № 4. С. 55. DOI: 10.14529/chem210403.
- Шарутин В.В., Мукушева Н., Уржумова А.В. // Вестник ЮУрГУ. Серия «Химия». 2018. Т. 10, № 2. С. 48. DOI: 10.14529/chem180206.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К., Бояркина Е.А. // Журн. общ. химии. 2009. Т. 79. С. 80.
- Шарутин В.В., Шарутина О.К., Губанова Ю.О. // Известия высших учебных заведений. Серия «Химия и химическая технология» 2019. Т. 62, № 2. С. 4. DOI: 10.6060/ivkkt.20196202.5823.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14, № 2. С. 41. DOI: 10.14529/chem220205.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. общей химии. 2022. Т. 92, № 6. С. 885. DOI: 10.31857/S0044460X22060087.
- Шарутин В.В., Шарутина О.К., Механошина Е.С. // Журн. структ. химии. 2022. Т. 63, № 10. С. 99532. DOI: 10.26902/JSC_id99532.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 1. С. 31. DOI: 10.14529/chem230103.
- Механошина Е.С. // Вестник ЮУрГУ. Серия «Химия». 2023. Т. 15, № 2. С. 55. DOI: 10.14529/chem230204.
- Godfrey S.M., McAuliffe C.A., Mushtaq I., PritchardR.G., Sheffield J.M. // J. Chem. Soc., Dal-ton Trans. 1998. P. 3815. DOI: 10.1039/A807241H.
- Пурдела Д., Вылчану Р. Химия органических соединений фосфора. 1972.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 1996. Т. 66, № 10. С. 1755. EDN: BLATEE.
- Шарутин В.В., Шарутина О.К., Панова Л.П., Бельский В.К. // Коорд. химия. 1997. Т. 23, № 7.С. 513.
- Шарутин В.В., Шарутина О.К., Пакусина А.П., Бельский В.К. // Журн. общ. химии. 1997. Т. 67, № 9. С. 1536. EDN: PFLFSA.
- Шарутин В.В., Сенчурин В.С., Шарутина О.К. и др. // Журн. общ. химии. 2009. Т. 79, № 10. С. 1636.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н., Артемьева Е.В. // Журн. неорган. химии. 2020. Т. 65, № 4. С. 482. DOI: 10.31857/S0044457X20040170.
- Шарутин В.В., Шарутина О.К., Сенчурин В.С. // Журн. неорган. химии. 2013. Т. 58, № 11. С. 1454. DOI: 10.1134/S0036023613110181.
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. M.: МГУ, 2012. 54 с.
- Васильев А.В., Гриненко Е.В., Щукин А.О. и др. Инфракрасная спектроскопия органических и природных соединений: учебное пособие.СПб.: СПбФТУ, 2007. 29 с.
- Бацанов С.С. Атомные радиусы элементов. // Журн. неорг. химии. 1991. Т. 36, № 12. С. 3015.


