Сравнение эффективности и безопасности терапии регорафенибом и реинтродукции химиотерапии при метастатическом раке толстой кишки - результаты ретроспективного многоцентрового исследования
Автор: Кузьмина Е.С., Федянин М.Ю., Решетов И.В., Покатаев И.А., Галкин В.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Цель исследования - сравнить эффективность различных вариантов системной терапии метастатического рака толстой кишки в 3-й и последующих линиях лечения. материал и методы. Проведено ретроспективное многоцентровое исследование. Собраны данные 2 российских клиник. В качестве основного критерия эффективности рассматривали общую выживаемость (ОВ). Дополнительный критерий - выживаемость без прогрессирования (ВБП). Проведены одно- и многофакторный анализы влияния различных признаков на ВБП. Для выполнения задачи по оценке эффективности регорафениба и повторного назначения ранее эффективных препаратов необходимо было доказать эквивалентность 6-месячной общей выживаемости при повторном назначении химиотерапии и таргетной терапии в 3-й линии и при назначении регорафениба, при условии, что границы эквивалентности будут находиться в диапазоне 0,8-1,25. При вероятности ошибки первого рода 0,05, мощности исследования 80 % в исследование необходимо включить суммарно 178 пациентов (по 89 человек в каждой группе). Результаты. В базе идентифицированы 215 пациентов с морфологически подтвержденным метастатическим раком толстой кишки (мРТК), получившие две или более линии противоопухолевой лекарственной терапии с 2010 по 2021 г. Было отобрано 132 пациента, которым проводилась терапия регорафенибом в анамнезе, и 83 пациента, у которых в качестве 3-й линии была проведена повторно ранее применявшаяся схема химиотерапии. Медиана ОВ в группах реинтродукции и регорафениба не отличалась (отношение рисков (ОР) 1,01; 95 % ДИ 0,7-1,45; p=0,920); 6-месячная ОВ составила 74 и 70 % соответственно. Выживаемость без прогрессирования была значимо выше в группе реинтродукции (ОР 1,94; 95 % ДИ 1,3-2,7; p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак толстой кишки, регорафениб, химиотерапия, ретроспективное исследование
Короткий адрес: https://sciup.org/140301245
IDR: 140301245 | УДК: 616.345-006.6-08:615.28 | DOI: 10.21294/1814-4861-2023-22-4-34-43
Текст научной статьи Сравнение эффективности и безопасности терапии регорафенибом и реинтродукции химиотерапии при метастатическом раке толстой кишки - результаты ретроспективного многоцентрового исследования
Долгое время стандарт терапии 3-й линии метастатического колоректального рака (мКРР) отсутствовал. Сравнительно недавно в клинической практике появился мультикиназный ингибитор ре-горафениб, продемонстрировавший преимущество по общей выживаемости у больных мКРР после прогрессирования на оксалиплатине, иринотекане, антиангиогенных препаратах и EGFR-ингибиторах (при диком типе RAS) по сравнению с плацебо. В группе регорафениба медиана ОВ составила 6,4 мес, в группе плацебо – 5,0 мес (ОР 0,77; р=0,005).
Нежелательные явления, связанные с лечением, наблюдались у 465 (93 %) пациентов, получавших регорафениб, и у 154 (61 %) пациентов, получавших плацебо [1].
В настоящее время назначение регорафениба в 3-й линии лечения является стандартным подходом. Однако его скромная эффективность и значимая токсичность делают актуальным поиск новых терапевтических опций. В связи с этим во многих странах рассматривается возможность повторного назначения ранее эффективных схем лечения [2, 3]. Данный подход в представленной статье мы будем называть реинтродукцией. При этом результаты сравнения реинтродукции с регорафенибом мало представлены в литературе.
Цель исследования ‒ сравнить эффективность и токсичность регорафниба и реинтродукции у пациентов с метастатическим раком толстой кишки, спрогрессировавших после двух линий химиотерапии, а также выявить факторы, негативно влияющие на результаты лечения регорафенибом.
Материал и методы
Нами проведено многоцентровое ретроспективное исследование, в ходе которого изучены данные из первичной медицинской документации пациентов с мРТК, получавших лечение на базе 2 российских клиник (n=215): ГБУЗ «Городская клиническая онкологическая больница №1» ДЗМ, г. Москва (n=125), ГБУЗ «Салехардская окружная клиническая больница», г. Салехард (n=90), с 2010 по 2021 г. Задачи исследования ‒ сравнить показатели ОВ и ВБП у больных метастатическим раком толстой кишки в 3-й линии лечения на терапии регорафенибом и реинтродукцией ранее эффективных схем; оценить факторы прогноза при терапии регорафенибом в отношении ВБП; оценить токсичность лечения с точки зрения частоты и степени нежелательных явлений в группах реинтродукции и регорафениба. В исследование включались пациенты, соответствующие следующим критериям: получавшие терапию регорафенибом или реинтродукцию ранее эффективных схем лечения в 3-й линии терапии мКРР; имевшие прогрессирование опухолевого процесса после применения фторпиримидинов, оксалиплатина, иринотекана; в первичной медицинской документации представлены данные по основным прогностическим факторам.
Нами проанализированы такие факторы прогноза, как возраст, пол, соматический статус по шкале ECOG, показатели оценки первичной опухоли (T), регионарных лимфатических узлов (N), отдаленных метастазов (M), мутационный статус генов RAS, BRAF, MSI, локализация и количество метастатических локусов, наличие в анамнезе адъювантной химиотерапии, удаление первичного опухолевого очага, хирургическое лечение метастазов, линия терапии регорафенибом, редукция дозы регорафениба, стартовая доза регорафениба, перерыв в лечении регорафенибом.
Для выполнения задачи по оценке эффективности регорафениба и повторного назначения ранее эффективных препаратов необходимо было доказать эквивалентность 6-месячной общей выживаемости при повторном назначении химиотерапии и таргетной терапии в 3-й линии и при назначении регорафениба, при условии, что границы эквивалентности будут находиться в диапазоне 0,8–1,25. При вероятности ошибки первого рода 0,05, мощности исследования 80 % в исследование необходимо включить суммарно 178 пациентов (по 89 пациентов в группе, с учетом потери данных 10 % пациентов). Для расчета выживаемости мы применяли метод Каплана‒Майера. В зависимости от статистической ситуации сравнение групп больных по выживаемости проводилось с помощью лог-ранк-теста, теста Breslow‒Wilcoxon, Tarone‒Ware или с помощью Cox анализа. Для сравнения малых групп использовался χ2-Пирсона. Для переменных, отражающих различные признаки, применялись методы описательной статистики. В случае изучения выживаемости многофакторный анализ выполнялся с помощью пошагового регрессионного анализа Cox или биноминального регрессионного анализа, если речь шла об определенном событии. В многофакторный анализ включались признаки, которые по результатам однофакторного анализа показали тенденцию во влиянии на показатели выживаемости без прогрессирования (p < 0,20). Однофакторный анализ проводился в отношении следующих признаков: пол, возраст, показатели T, N, M, локализация первичной опухоли, мутационный статус генов RAS, MSI, наличие адъювантной химиотерапии в анамнезе, схема адъювантной химиотерапии, удаление первичного очага в анамнезе, муцинозная аденокарцинома, компонент перстневидноклеточного рака в опухоли, степень дифференцировки опухоли (G), хирургическое лечение метастазов, линия назначения регорафе-ниба, метастазы в печени, метастазы в легких, по брюшине, в забрюшинные лимфоузлы, лимфоузлы средостения, кости, селезенку, яичники, головной мозг, асцит, плеврит, локальный рецидив, число органов, пораженных метастазами, соматический статус по шкале ECOG. Статистический анализ произведен с помощью программ статистического пакета SPSS (IBM SPPS Statistics v. 20).
Результаты
Мы провели ретроспективный анализ базы данных пациентов с мРТК. В базе были идентифицированы 215 пациентов с морфологически подтвержденным метастатическим раком толстой кишки, получившие две или более линии противоопухолевой лекарственной терапии. Было отобрано 83 пациента, которым не проводилась терапия регорафенибом в анамнезе, а в качестве 3-й и последующих линий были повторно проведены ранее применявшиеся схемы химиотерапии. В сравниваемых группах не выявлено значимых различий по основным прогностическим признакам (табл. 1). Однако в группе регорафениба большее число пациентов имели метастазы по брюшине, метахронные метастазы и мутацию в гене BRAF. В группе реинтродукции большее число пациентов имели изначально метастатический процесс, неизвестный статус MSI. Количество проведенных линий лечения было больше в группе регорафе-ниба. Наиболее часто регорафениб был назначен в 3-й линии.
При медиане наблюдения 30,4 мес не отмечено различий в общей выживаемости в исследуемых группах. Медиана общей выживаемости составила 10 мес (95 % ДИ 8,6–11,3) в группе реинтродукции и 9 мес в группе регорафениба (95 % ДИ 7–10,9) (ОР 1,01; 95 % ДИ 0,7–1,45; p=0,920) (рис. 1.), 6-месячная ОВ – 74 и 70 % соответственно. Выживаемость без прогрессирования была значимо выше в группе реинтродукции. Медиана выживаемости без прогрессирования составила 3 мес
(95 % ДИ 2,7–3,2) в группе регорафениба и 6 мес (95 % ДИ 3,8–8,1) в группе реинтродукции (ОР 1,94; 95 % ДИ 1,3–2,7; p<0,001) (рис. 2).
Учитывая наличие расхождения между группами по некоторых характеристикам, был проведен однофакторный (табл. 2), а затем и многофакторный анализ (табл. 3) признаков в отношении выживаемости без прогрессирования. Значимым фактором, негативно влияющим на ВБП, являлся высокий показатель соматического статуса ECOG (ОР 1,4; 95 % ДИ 1,1–1,9; p=0,004). Факторами, ассоциированными с улучшением выживаемости без прогрессирования, были размеры первичной опухоли – показатель Т (ОР 0,7; 95 % ДИ 0,5–0,9; p=0,016), сторона локализации первичной опухоли – левосторонняя локализация (ОР 0,6; 95 % ДИ 0,4–0,9; p=0,026). В рамках многофакторного анализа реинтродукция ранее проведенных схем лечения сохранила свое независимое позитивное влияние на ВБП (ОР 1,9; 95 % ДИ 1,2–2,8; p<0,001).
В нашем исследовании токсичность на 3-й линии ХТ развилась у 117 (54,4 %) из 215 пациентов,
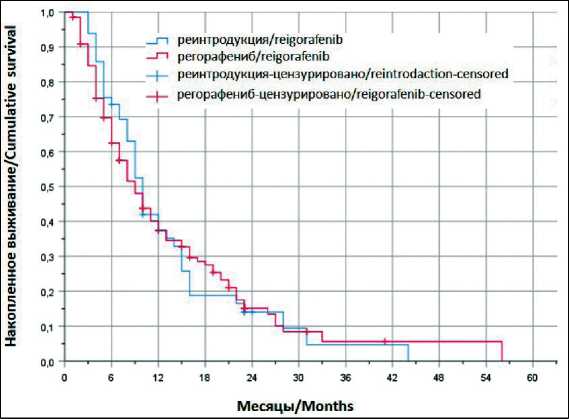
Рис. 1. Общая выживаемость
Fig. 1. Оverall survival
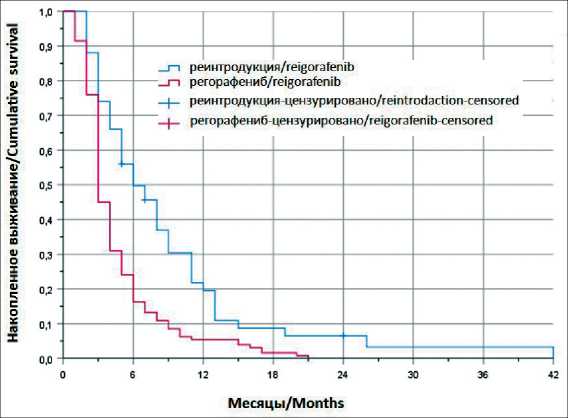
Рис. 2. Выживаемость без прогрессирования Fig. 2. Progression-free survival
|
Характеристика пациентов (n=215) Patient`s characteristics (n=215) |
Таблица 1/Table 1 |
||
|
Повторное назначение ранее |
|||
|
Показатель/Parameter |
эффективной химиотерапии/ Rechallenge of previously effective |
Регорафениб/ Regorafenib |
hkРр |
|
chemotherapy (n=83) |
|||
|
Пол/Gender |
|||
|
Женский/Female |
29 (34,9 %) |
62 (47,0 %) |
0,082 |
|
Мужской/Male |
54 (65,0 %) |
70 (53,0 %) |
|
|
Показатель T/T stage |
|||
|
2 |
3 (3,6 %) |
12 (14,4 %) |
|
|
3 |
38 (45,7 %) |
55 (41,6 %) |
0,300 |
|
4 |
42 (50,6 %) |
65 (49,2 %) |
|
|
Показатель N/N stage |
|||
|
0 |
30 (36,1 %) |
44 (33,3 %) |
|
|
1 |
36 (43,3 %) |
54 (40,9 %) |
0,674 |
|
2 |
17 (20,4 %) |
34 (25,7 %) |
|
|
Показатель M/M stage |
|||
|
0 |
28 (33,7 %) |
71 (53,7 %) |
0,004 |
|
1 |
55 (66,2 %) |
61 (46,2 %) |
|
|
Локализация/Localization |
|||
|
Правосторонняя/Right-sided |
12 (14,4 %) |
30 (22,7 %) |
0,137 |
|
Левосторонняя/Left-sided |
71 (85,5 %) |
102 (77,2 %) |
|
|
Удаление первичной опухоли/Primary tumor removed |
|||
|
Не выполнялось/Not implemented |
17 (20,4 %) |
17 (12,8 %) |
0,137 |
|
Выполнялось/Implemented |
66 (79,5 %) |
115 (87,1 %) |
|
|
Гистотип опухоли/Tumor histotype |
|||
|
Муцинозная карцинома/Mucinous adenocarcinoma |
10 (12,0 %) |
12 (9,0 %) |
0,486 |
|
0 |
0 (0,0 %) |
1 (0,7 %) |
|
|
Степень 1 |
8 (9,6 %) |
30 (22,7 %) |
0,029 |
|
дифференцировки G/ |
72 (86,0 %) |
91 (68,9 %) |
|
|
eoeeo 3 |
3 (3,6 %) |
10 (7,5 %) |
|
|
Компонент перстневидноклеточного рака/ Component of cricoid cell carcinoma |
1 (1,2 %) |
2 (1,5 %) |
0,850 |
|
wtKRAS |
50 (60,2 %) |
71 (53,7 %) |
|
|
mKRAS mKRAS |
20 (24,0 %) |
47 (35,6 %) |
0,119* |
|
Не исследовался/No data |
13 (15,6 %) |
14 (10,6 %) |
|
|
wtNRAS |
67 (80,7 %) |
110 (83,3 %) |
|
|
mNRAS mNRAS |
3 (3,6 %) |
8 (6,0 %) |
0,418* |
|
Не исследовался/No data |
13 (15,6 %) |
14 (10,6 %) |
|
|
wtBRAF |
35 (42,1 %) |
102 (77,2 %) |
|
|
mBRAF mBRAF |
2 (2,4 %) |
4 (3,03 %) |
0,670* |
|
Не исследовался/No data |
46 (55,4 %) |
26 (19,6 %) |
|
|
MSI-high |
0 (0,0 %) |
3 (2,2 %) |
|
|
MSI MSS |
21 (25,3 %) |
73 (55,3 %) |
0,355* |
|
Не исследовался/No data |
62 (74,6 %) |
56 (42,4 %) |
|
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
19 (22,8 %) |
51 (38,6 %) |
0,016 |
|
Количество органов, 1 |
50 (60,2 %) |
69 (58,0 %) |
|
|
пораженных метастазами 2 на 1-й линии/ |
22 (26,5 %) |
43 (66,2 %) |
0,709 |
|
Number of organs affected 3 |
9 (10,8 %) |
17 (65,4 %) |
|
|
by metastases on 1 line 4 |
2 (4,8 %) |
3 (52,2 %) |
|
|
Метастазы в печени/Liver metastases |
39 (46,9 %) |
96 (72,7 %) |
0,426 |
|
Метастазы в легких/Lung metastases |
31 (37,3 %) |
78 (59,0 %) |
0,690 |
|
Метастазы по брюшине/Peritoneal metastases |
12 (14,4 %) |
53 (40,1 %) |
0,043 |
|
Метастазы в забрюшинные лимфоузлы/ Retroperitoneal lymph node metastases |
13 (15,6 %) |
38 (28,7 %) |
0,721 |
Окончание таблицы 1/End of Table 1
|
Метастазы в лимфоузлы средостения/ Mediastinal lymph node metastases |
4 (4,8 %) |
8 (6,0 %) |
0,632 |
|
Метастазы в кости/Bone metastases |
9 (10,8 %) |
21 (15,9 %) |
0,724 |
|
Метастазы в селезенку/Spleen metastases |
3 (3,6 %) |
1 (0,7 %) |
0,031 |
|
Метастазы в яичники/Ovaries metastases |
3 (3,6 %) |
10 (7,5 %) |
0,724 |
|
Метастазы в головной мозг/Brain metastases |
1 (1,2 %) |
5 (3,7 %) |
0,550 |
|
Асцит/Ascites |
2 (2,4 %) |
8 (6,0 %) |
0,590 |
|
Плеврит/Pleuritis |
1 (1,2 %) |
2 (1,5 %) |
0,815 |
|
Локальный рецидив/Local relapse |
5 (6,0 %) |
15 (11,3 %) |
0,801 |
|
Статус по шкале |
ECOG/ECOG performance status |
||
|
0 |
8 (9,6 %) |
18 (13,6 %) |
|
|
1 |
32 (38,5 %) |
92 (69,6 %) |
0,779 |
|
2 |
9 (10,8 %) |
20 (15,5 %) |
|
|
Количество проведенных линий лечения/Number of treatment lines performed |
|||
|
2 |
31 (37,3 %) |
1 (0,7 %) |
|
|
3 |
31 (37,3 %) |
63 (47,7 %) |
|
|
4 |
10 (12,0 %) |
34 (25,7 %) |
<0,001 |
|
5 |
9 (10,8 %) |
32 (24,2 %) |
|
|
6 |
2 (2,4 %) |
2 (1,5 %) |
|
Примечание: * – из анализа были исключены пациенты с неизвестным мутационным статусом.
Note: * – patients with unknown mutational status were excluded from the analysis.
в группе регорафениба она наблюдалась значимо чаще – 67,4 % (89/132) vs 33,7 % (28/83) в группе с повторным назначением ранее эффективных схем (р<0,001) (табл. 4). Значимо чаще в группе рего-рафениба встречались астения – 42 (30,3 %) vs 2 (2,4 %) (p<0,001), артериальная гипертензия – 26 (18,8 %) vs 0 (p<0,001), ладонно-подошвенный синдром – 19 (14,4 %) vs 2 (2,4 %) (p=0,002). В группе реинтродукции чаще наблюдалась неврологическая токсичность – 12 (14,5 %) vs 6 (4,6 %) (p=0,001). Наиболее частыми нежелательными явлениями III–IV степени в группе регорафениба были артериальная гипертензия – 9 (5,9 %) vs 0, диарея – 8 (3,8 %) vs 4 (2,4 %), ладонно-подошвенный
синдром – 4 (3,0 %) vs 0. Значимые различия по частоте серьезных нежелательных явлений между группами были только для артериальной гипертензии (рис. 3).
Обсуждение
Рандомизированные исследования показали преимущество регорафениба в выживаемости по сравнению с плацебо. В нашем исследовании при сравнении регорафениба с реинтродукцией ранее эффективных схем химиотерапии не выявлено отличий в общей выживаемости. Медиана общей выживаемости в группе регорафениба была больше в нашем исследовании в отличие от рандомизирован-
Астения реинтр/Asthenia reintr.
Гипертония per/Hypertension reg.
Неврологическая реинтр/Nervous system disorders...
ЛПС рег/PPE-syndrom reg.
Нейтропения реинтр/Neutropenia reintr Диарея per/Diarrhea reg.
Кожная реинтр/Skin disorders reintr.
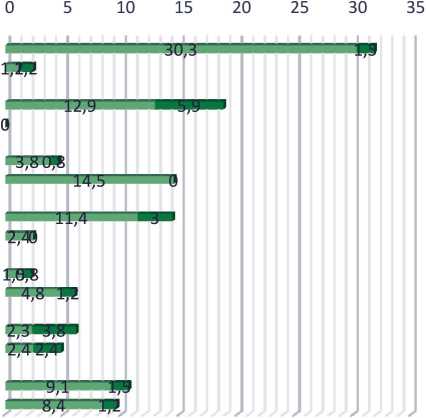
■ l-ll степени/grade l-ll ■ lll-IV степени/grade lll-IV
Рис. 3. Частота наиболее выраженной токсичности Fig. 3. Frequency of the most pronounced toxicity
Таблица 2/Table 2
Результаты однофакторного анализа влияния признаков на выживаемость без прогрессирования Factors affecting progression-free survival (univariate analysis)
|
Фактор. Factor |
p |
Отношение рисков/ Hazard ratio |
95 % ДИ для отношения рисков/ 95 % CI Нижняя граница/ Верхняя граница/ |
|
|
Lower limit |
Upper limit |
|||
|
Пол/Gender |
0,774 |
0,9 |
0,709 |
1,292 |
|
Возраст/Age |
0,413 |
0,9 |
0,978 |
1,009 |
|
Показатель T/T stage |
0,052 |
0,7 |
0,626 |
1,002 |
|
Показатель N/N stage |
0,465 |
1,0 |
0,879 |
1,326 |
|
Показатель М/M stage |
0,518 |
1,1 |
0,816 |
1,495 |
|
Локализация/Localization |
0,072 |
0,7 |
0,495 |
1,030 |
|
mKRAS |
0,821 |
1,0 |
0,953 |
1,062 |
|
mNRAS |
0,969 |
1,0 |
0,948 |
1,057 |
|
mBRAF |
0,809 |
0,9 |
0,958 |
1,034 |
|
MSI-high |
0,702 |
1,0 |
0,966 |
1,052 |
|
HER2neu |
0,658 |
0,9 |
0,928 |
1,048 |
|
Удаление первичного очага/Primary tumor removed |
0,118 |
0,7 |
0,436 |
1,098 |
|
Муцинозная аденокарцинома/ Mucinous adenocarcinoma |
0,083 |
1,5 |
0,942 |
2,626 |
|
Степень дифференцировки опухоли G/ Grade of differentiation G |
0,552 |
0,9 |
0,634 |
1,275 |
|
Компонент перстневидно-клеточного рака в опухоли/ Component of cricoid cell carcinoma |
0,391 |
1,8 |
0,454 |
7,515 |
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
0,286 |
0,8 |
0,618 |
1,153 |
|
Схема адъювантной химиотерапии/ Adjuvant chemotherapy regimen |
0,698 |
1,0 |
0,883 |
1,205 |
|
Хирургия метастазов/Surgery for metastasis |
0,116 |
0,7 |
0,546 |
1,069 |
|
Линия назначения регорафениба/ Regorafenib treatment line |
0,334 |
1,1 |
0,895 |
1,386 |
|
Метастазы в печени/Liver metastases |
0,084 |
1,4 |
0,959 |
1,957 |
|
Метастазы в легких/Lung metastases |
0,122 |
0,7 |
0,577 |
1,067 |
|
Метастазы по брюшине/Peritoneal metastases |
0,910 |
0,9 |
0,717 |
1,345 |
|
Метастазы в забрюшинные лимфоузлы/ Retroperitoneal lymph node metastases |
0,285 |
1,2 |
0,859 |
1,679 |
|
Метастазы в лимфоузлы средостения/ Mediastinal lymph node metastases |
0,510 |
0,8 |
0,453 |
1,483 |
|
Метастазы в кости/Bone metastases |
0,389 |
1,1 |
0,796 |
1,795 |
|
Метастазы в селезенку/Spleen metastases |
0,285 |
0,6 |
0,215 |
1,572 |
|
Метастазы в яичники/Ovaries metastases |
0,304 |
1,3 |
0,763 |
2,383 |
|
Метастазы в головной мозг/Brain metastases |
0,954 |
0,9 |
0,399 |
2,376 |
|
Асцит/Ascites |
0,216 |
1,5 |
0,789 |
2,852 |
|
Плеврит/Pleuritis |
0,483 |
0,6 |
0,211 |
2,087 |
|
Локальный рецидив/Local relapse |
0,654 |
1,1 |
0,697 |
1,776 |
|
Число органов, пораженных метастазами/ Number of organs affected by metastasis |
0,773 |
1,0 |
0,894 |
1,163 |
|
Статус по шкале ECOG/ECOG performance status |
0,004 |
1,4 |
1,133 |
1,912 |
Таблица 3/Table 3
Результаты многофакторного анализа влияния признаков на выживаемость без прогрессирования Factors affecting progression-free survival (multivariate analysis)
|
Фактор/Factor |
p |
Отношение рисков/ Hazard ratio |
95 % ДИ для отношения рисков/ 95 % CI |
|
|
Нижняя граница/ Lower limit |
Верхняя граница/ Upper limit |
|||
|
Реинтродукция/Rechallenge of chemotherapy |
<0,001 |
1,9 |
1,346 |
2,839 |
|
Показатель T/T stage |
0,016 |
0,7 |
0,554 |
0,941 |
|
Сторона локализации первичной опухоли/Localization |
0,026 |
0,6 |
0,431 |
0,948 |
|
Удаление первичного очага/Primary tumor removed |
0,110 |
0,6 |
0,405 |
1,096 |
|
Муцинозная аденокарцинома/Mucinous adenocarcinoma |
0,349 |
1,3 |
0,748 |
2,276 |
|
Хирургия метастазов/Surgery for metastasis |
0,349 |
0,8 |
0,566 |
1,222 |
|
Метастазы в печени/Liver metastases |
0,124 |
1,3 |
0,919 |
2,029 |
|
Метастазы в легких/Lung metastases |
0,289 |
0,8 |
0,613 |
1,157 |
|
Статус по шкале ECOG/ECOG performance status |
0,003 |
1,5 |
1,161 |
2,051 |
Таблица 4/Table 4
|
Осложнения/Complications |
Повторное назначение ранее эффективных схем (n=83)/ Rechallenge of previously effective chemotherapy (n=83) |
Регорафениб (n=132)/ Regorafenib (n=132) |
р |
|
Кожная токсичность/Skin disorders |
|||
|
I–II степени/I–II grade |
7 (8,4 %) |
12 (9,1 %) |
0,539 |
|
III–IV степени/III–IV grade |
1 (1,2 %) |
2 (1,5 %) |
0,669 |
|
Всех степеней/All grade |
8 (9,6 %) |
14 (10,6 %) |
0,507 |
|
Диарея/Diarrhea |
|||
|
I–II степени/I–II grade |
2 (2,4 %) |
3 (2,3 %) |
0,641 |
|
III–IV степени/III–IV grade |
2 (2,4 %) |
5 (3,8 %) |
0,449 |
|
Всех степеней/All grade |
4 (4,8 %) |
8 (6,1 %) |
0,477 |
|
Нейтропения/Neutropenia |
|||
|
I–II степени/I–II grade |
4 (4,8 %) |
2 (1,5 %) |
0,157 |
|
III–IV степени/III–IV grade |
1 (1,2 %) |
1 (0,8 %) |
0,624 |
|
Всех степеней/All grade |
5 (6,0 %) |
3 (2,3 %) |
0,148 |
|
Тромбоцитопения/Thrombocytopenia |
|||
|
I–II степени/I–II grade |
0 (0 %) |
2 (1,5 %) |
0,376 |
|
III–IV степени/III–IV grade |
0 (0 %) |
0 (0 %) |
1 |
|
Всех степеней/All grade |
0 (0 %) |
2 (1,5 %) |
0,376 |
|
Ладонно-подошвенный синдром/Palmar-plantar erythrodysesthesia syndrome |
|||
|
I–II степени/I–II grade |
2 (2,4 %) |
15 (11,4 %) |
0,013 |
|
III–IV степени/III–IV grade |
0 (0 %) |
4 (3,0 %) |
0,140 |
|
Всех степеней/All grade |
2 (2,4 %) |
19 (14,4 %) |
0,002 |
|
Неврологическая токсичность/Nervous system disorders |
|||
|
I–II степени/I–II grade |
12 (14,5 %) |
5 (3,8 %) |
0,006 |
|
III–IV степени/III–IV grade |
0 (0 %) |
1 (0,8 %) |
0,614 |
|
Всех степеней/All grade |
12 (14,5 %) |
6 (4,6 %) |
0,012 |
|
Гепатотоксичность/Hepatic failure |
|||
|
I–II степени/I–II grade |
0 (0 %) |
2 (1,5 %) |
0,376 |
|
III–IV степени/III–IV grade |
0 (0 %) |
1 (0,8 %) |
0,614 |
|
Всех степеней/All grade |
0 (0 %) |
3 (2,3 %) |
0,229 |
|
Артериальная гипертензия/Arterial hypertension |
|||
|
I–II степени/I–II grade |
0 (0 %) |
17 (12,9 %) |
<0,001 |
|
III–IV степени/III–IV grade |
0 (0 %) |
9 (5,9 %) |
0,011 |
|
Всех степеней/All grade |
0 (0 %) |
26 (18,8 %) |
<0,001 |
|
Анемия/Anemia |
|||
|
I–II степени/I–II grade |
2 (2,4 %) |
4 (3,0 %) |
0,574 |
|
III–IV степени/III–IV grade |
0 (0 %) |
4 (3,0 %) |
0,140 |
|
Всех степеней/All grade |
2 (2,4 %) |
8 (6,0 %) |
0,185 |
|
Тошнота/Nausea |
|||
|
I–II степени/I–II grade |
1 (1,2 %) |
6 (4,6 %) |
0,173 |
|
III–IV степени/III–IV grade |
0 (0 %) |
0 (0 %) |
1 |
|
Всех степеней/All grade |
1 (1,2 %) |
6 (4,6 %) |
0,173 |
Окончание таблицы 4/End of Table 4
|
Астения/Asthenia |
|||
|
I–II степени/I–II grade |
1 (1,2 %) |
40 (30,3 %) |
<0,001 |
|
III–IV степени/III–IV grade |
1 (1,2 %) |
2 (1,5 %) |
0,669 |
|
Всех степеней/All grade |
2 (2,4 %) |
42 (31,8 %) |
<0,001 |
|
Стоматит/Stomatitis |
|||
|
I–II степени/I–II grade |
0 (0 %) |
3 (2,3 %) |
0,229 |
|
III–IV степени/III–IV grade |
0 (0 %) |
0 (0 %) |
1 |
|
Всех степеней/All grade |
0 (0 %) |
3 (2,3 %) |
0,229 |
Список литературы Сравнение эффективности и безопасности терапии регорафенибом и реинтродукции химиотерапии при метастатическом раке толстой кишки - результаты ретроспективного многоцентрового исследования
- Grothey A., Van Cutsem E., Sobrero A., Siena S., Falcone A., Ychou M., Humblet Y., Bouché O., Mineur L., Barone C., Adenis A., Tabernero J., Yoshino T., Lenz H.J., Goldberg R.M., Sargent D.J., Cihon F., Cupit L., Wagner A., Laurent D.; CORRECT Study Group. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013; 381(9863): 303-12.
- van Cutsem E., Martinelli E., Cascinu S., Sobrero A., Banzi M., Seitz J.F., Barone C., Ychou M., Peeters M., Brenner B., Hofheinz R.D., Maiello E., André T., Spallanzani A., Garcia-Carbonero R., Arriaga Y.E., Verma U., Grothey A., Kappeler C., Miriyala A., Kalmus J., Falcone A., Zaniboni A. Regorafenib for Patients with Metastatic Colorectal Cancer Who Progressed After Standard Therapy: Results of the Large, Single-Arm, Open-Label Phase IIIb CONSIGN Study. Oncologist. 2019; 24(2): 185-92.
- Lai E., Puzzoni M., Ziranu P., Cremolini C., Lonardi S., Banzi M., Mariani S., Liscia N., Cinieri S., Dettori M., Mencoboni M., Nappo F., Piacentini G., Labianca R., Zucchelli G., Boccaccino A., Conca V., Pusceddu V., Zaniboni A., Scartozzi M.; GISCAD (Gruppo Italiano per lo Studio dei Carcinomi dell'Apparato Digerente, Italian Group for the Study of Gastrointestinal Tumors). Long Term Survival With Regorafenib: REALITY (Real Life in Italy) Trial - A GISCAD Study. Clin Colorectal Cancer. 2021; 20(4): 253-62.
- Li J., Qin S., Xu R., Yau T.C., Ma B., Pan H., Xu J., Bai Y., Chi Y., Wang L., Yeh K.H., Bi F., Cheng Y., Le A.T., Lin J.K., Liu T., Ma D., Kappeler C., Kalmus J., Kim T.W.; CONCUR Investigators. Regorafenib plus best supportive care versus placebo plus best supportive care in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2015; 16(6): 619-29.
- Calegari M.A., Zurlo I.V., Stefano B.D., Camarda F., Dio C.D., Garufi G., Cassano A., Barone C.A., Bria E., Basso M., Orlandi A. FOLFOX rechallenge versus regorafenib in patients with metastatic colorectal cancer refractory to standard chemotherapy: A retrospective analysis. J Clin Oncol. 2019; 37(4s): 669.
- Köstek O., Hacıoğlu M.B., Sakin A., Demir T., Sarı M., Ozkul O., Araz M., Doğan A.F., Demircan N.C., Uzunoğlu S., Çiçin İ., Erdoğan B. Regorafenib or rechallenge chemotherapy: which is more effective in the third-line treatment of metastatic colorectal cancer? Cancer Chemother Pharmacol. 2019; 83(1): 115-22.


