Сравнение эффективности интраоперационной лучевой терапии и дистанционной лучевой терапии у пациенток с ранним раком молочной железы
Автор: Манихас А.Г., Гор Л.А., Топузов Э.Э., Морозова А.В., Калинин И.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.23, 2024 года.
Бесплатный доступ
Введение. Рак молочной железы (РМЖ) является ведущей онкологической патологией у женского населения. Комплексное лечение РМЖ включает в себя хирургическое вмешательство, лекарственное лечение и лучевую терапию. Роль лучевой терапии в лечении злокачественных опухолей молочной железы продолжает изучаться. В настоящее время происходит деэскалация лучевой терапии с учетом использования интраоперационной лучевой терапии (ИОЛТ) и адъювантной эндокринной терапии. Цель исследования - сравнить эффективность интраоперационной лучевой терапии и дистанционной лучевой терапии при лечении раннего рака молочной железы. Материал и методы. В условиях 1-го онкологического (онкомаммологического) отделения СПб ГБУЗ «Городской клинический онкологический диспансер» проведено ретроспективное исследование пациенток с ранним РМЖ. В исследование включено 559 пациенток. Основную группу составили 273 больных, которым выполнена органосохраняющая операция (ОСО) с интраоперационной лучевой терапией и биопсией сигнального лимфоузла (БСЛУ). В группу контроля вошло 286 пациенток, которым выполнена ОСО с биопсией сигнального лимфоузла и последующей дистанционной лучевой терапией (ДЛТ).
Рак молочной железы, интраоперационная лучевая терапия, дистанционная лучевая терапия, рецидив рака молочной железы, косметические результаты, отдаленная выживаемость
Короткий адрес: https://sciup.org/140303745
IDR: 140303745 | УДК: 618.19-006.6-08:615.849.1 | DOI: 10.21294/1814-4861-2024-23-1-36-44
Текст научной статьи Сравнение эффективности интраоперационной лучевой терапии и дистанционной лучевой терапии у пациенток с ранним раком молочной железы
COMPARISON OF THE EFFECTIVENESS OF INTRAOPERATIVE RADIOTHERAPY WITH EXTERNAL BEAM RADIOTHERAPY IN PATIENTS WITH EARLY BREAST CANCER
A.G. Manikhas1,2, L.A. Gor2, E.E. Topuzov1,3, A.V. Morozova2, I.V. Kalinin4
1 City Clinical Oncology Center
3/5, 2nd Berezovaya Alley, Saint Petersburg, 197022, Russia
-
2A.M. Granov Russian Scientific Center for Radiology
and Surgical Technologies of the Ministry of Health of Russia
-
70, Leningradskaya St., pos. Pesochny, Saint Petersburg, 197758, Russia
-
3I .I. Mechnikov North-Western State Medical University of the Ministry of Health of Russia
-
41, Kirochnaya St., Saint Petersburg, 191015, Russia
-
4City Center of Treatment of Multiple Sclerosis and Other Autoimmune Diseases, City Clinical Hospital № 31
-
3, Dynamo Ave., Saint Petersburg, 197110, Russia
Background. Breast cancer is the most common cancer in women. The main treatment for breast cancer includes surgery, chemotherapy, radiation therapy, and hormone therapy. The role of radiation therapy in the management of breast cancer continues to evolve. Radiation therapy is currently being de-escalated to include the use of intraoperative radiotherapy (IORT) and adjuvant endocrine therapy. Purpose of the study: to compare the efficacy of IORT with that of external beam radiotherapy (EBRT) in the treatment of early breast cancer. Material and Methods. A retrospective study of 559 patients with early breast cancer was conducted in Clinical Oncology Center of Saint Petersburg. The main treatment group included 273 patients who underwent breast-conserving surgery with IORT and sentinel lymph node biopsy. The control group included 286 patients who underwent breast-conserving surgery with sentinel lymph node biopsy and EBRT. Results. For all patients, the median follow-up time was 59.1 months (interquartile range: 43.7 to 80.7), the minimum follow-up period was 0.6 months, and the maximum follow-up period was 110.4 months. Recurrence occurred in 18 (6.6 %) patients of the main group and in 8 (2.8 %) patients of the control group. A statistically significant association of biological subtype with survival outcomes was found (p=0.02). The hazard ratio for Luminal B of 1.88 (95 % CI 1.02, 3.46) corresponded to a 65 % chance of an earlier onset of a negative outcome. The hazard ratio for triple-negative breast cancer of 3.01 (95 % CI 1.53, 5.95) corresponded to a 75 % chance of an earlier negative outcome. In the main treatment group, 11 (4 %) patients developed disease progression, and 2 of them died of multiple organ failure. In the control group, disease progression was observed in 18 (6.3 %) patients, 6 of whom died. However, the analysis of overall survival using the Kaplan–Meier curve showed a statistically non-significant log-rank p-value (0.73). The 3-year survival rates were 100 % (100 – 100) in the treatment group and 98.2 % (96.7 – 99.8) in the control group. The 5-yaer survival rates were 99.3 % (97.9 – 100) in the treatment group and 97.8 % (96.2 – 99.6) in the control group. These results showed advantage of IORT over EBRT. Conclusions. Intraoperative radiotherapy is a safe and effective alternative to external beam radiotherapy for early breast cancer.
Рак молочной железы (РМЖ) – наиболее частая онкологическая патология у женского населения. За 2021 г. абсолютное число впервые в жизни установленных РМЖ в России достигало 69 714 и занимало лидирующую позицию среди всех впервые выявленных злокачественных новооб- разований [1]. При комплексном лечении раннего рака молочной железы, которое включает в себя хирургическое вмешательство, лекарственное лечение и лучевую терапию, общая выживаемость достигает 92 % [2]. Роль лучевой терапии в лечении РМЖ продолжает изучаться. В настоящее время при РМЖ ранних стадий гипофракциони-рованное облучение всей молочной железы после органосохраняющей операции (ОСО) является стандартом лечения, основанным на данных рандомизированных исследований, показывающих длительную безрецидивную выживаемость и минимальную общую токсичность [3]. Достижения в этой области биологии, генетики опухолей и их чувствительности к лучевой терапии могут помочь выявить пациенток, в отношении которых возможно уменьшение дозировки лучевой терапии или безопасное ее исключение. С внедрением в практику интраоперационной лучевой терапии (ИОЛТ) и адъювантной эндокринной терапии появилась возможность безопасной деэскалации лучевого лечения раннего РМЖ [4, 5].
Эффективность интраоперационной лучевой терапии доказана в ряде крупных рандомизированных исследований [6–10]. Одно из них – TARGIT-A, которое подтвердило, что при четких критериях отбора пациенток для ИОЛТ не было обнаружено статистически значимых различий для безреци-дивной и общей выживаемости, при медиане 8,6 года [6, 7].
Согласно рекомендациям Российского общества онкомаммологов от 2023 г. и рекомендациям National Comprehensive Cancer Network (NCCN), версия 1.2022, у больных РМЖ с низким риском локального рецидива возможно рассмотреть проведение ускоренного частичного облучения молочной железы (APBI) при соблюдении определенных критериев, но не рекомендуется APBI с использованием интраоперационной ЛТ электронами или низкоэнергетическими фотонами в рутинной практике [11].
На наш взгляд, методика интраоперационной лучевой терапии недооценена в рутинной практике и требует дальнейших исследований с четкими критериями отбора и сравнения данной методики для отдельных биологических подтипов рака молочной железы.
Цель исследования – сравнить эффективность интраоперационной лучевой терапии и дистанционной лучевой терапии при лечении раннего рака молочной железы.
Материал и методы
На базе ГБУЗ ГКОД г. Санкт-Петербурга проведено ретроспективное исследование (2012– 2019 гг.). Дизайн исследования представлен на рис. 1. Подробные критерии включения и предоперационные обследования были описаны ранее [10].
Первым этапом у всех пациенток выполнялась секторальная резекция с определением сторожевых лимфатических узлов. Биопсия сигнального лимфоузла проводилась с использованием радиоизотопного метода, с применением гамма-датчика – Gamma Finder. В Российской Федерации для биопсии сиг-
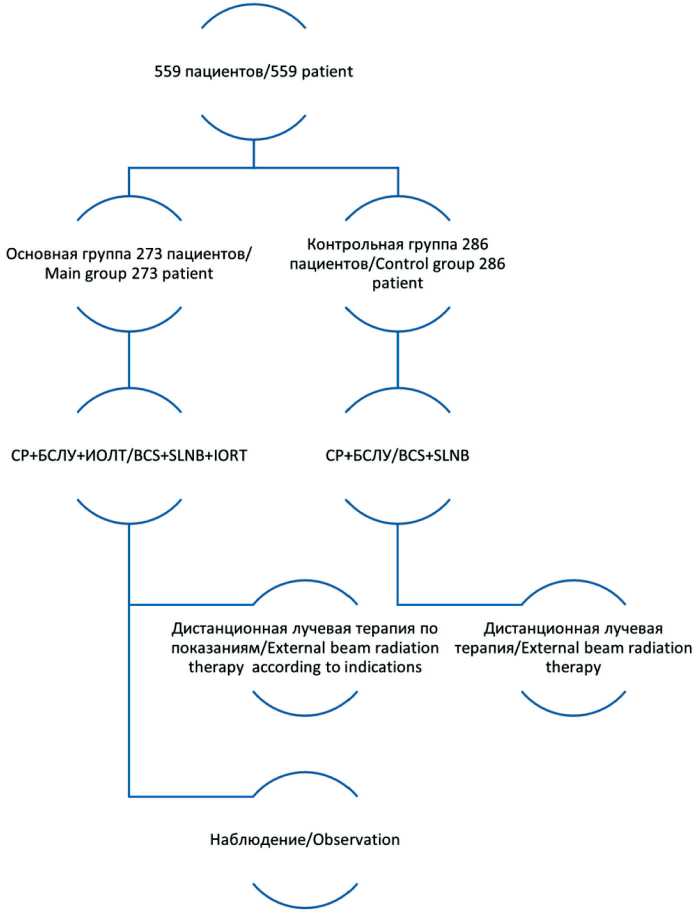
Рис. 1. Дизайн исследования.
Примечание: рисунок выполнен авторами Fig. 1. Study design. Note: created by the authors нальных лимфатических узлов зарегистрирована методика с применением радиоактивных коллоидных частиц [12]. За 2 ч до оперативного вмешательства в 4 точки перитуморозно вводился препарат Технефит 99mTc для радионавигации. Далее с помощью портативного гамма-детектора Gamma Finder II выявлялась проекция сигнальных лимфатических узлов. Под контролем гамма-детектора острым и тупым путем выделялись последовательно от 1 до 4 сигнальных лимфатических узлов, которые отправлялись на срочное гистологическое исследование. После удаления опухоли и сигнальных лимфоузлов выполнялся сеанс интраоперационной лучевой терапии. Интраоперационное облучение молочной железы осуществлялось с использованием мобильного линейного ускорителя INTRABEAM. Для облучения ложа опухоли применялись сферические аппликаторы размерами от 1,5 до 5,0 см в зависимости от объема удаляемых тканей (рис. 2). Для предотвращения лучевых повреждений неизмененных тканей края раны отводились лигатурами (рис. 3). Итоговый вид операционного поля после удаления основного препарата и установки аппарата INTRABEAM представлен на рис. 4. Время облучения составляло от 19 до 40 мин и зависело от размера аппликатора. Дальнейшее лечение назначалось согласно рекомендациям Министерства здравоохранения РФ.
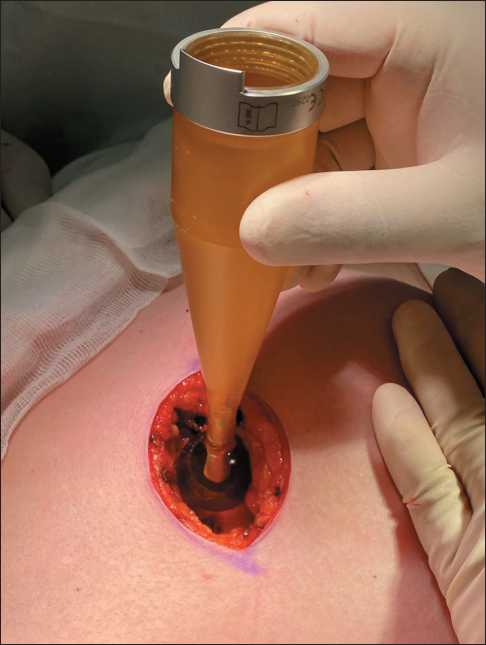
Рис. 2. Подбор сферического аппликатора. Примечание: рисунок выполнен авторами Fig. 2. Selection of spherical applicator.
Note: created by the authors
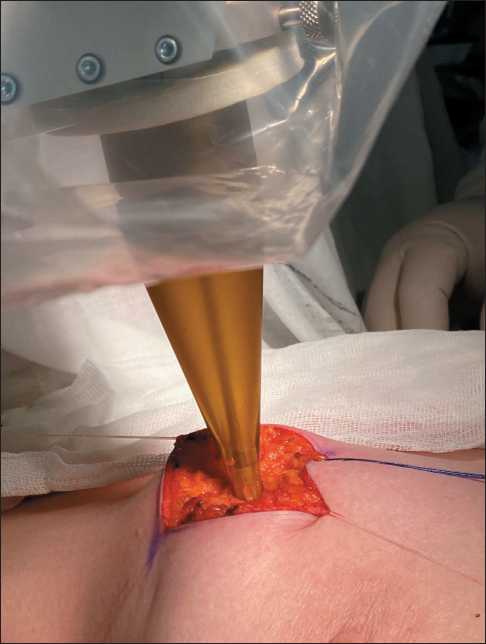
Рис. 3. Отведение краев раны лигатурами.
Примечание: рисунок выполнен авторами Fig. 3. Retraction of wound edges with ligatures.
Note: created by the authors
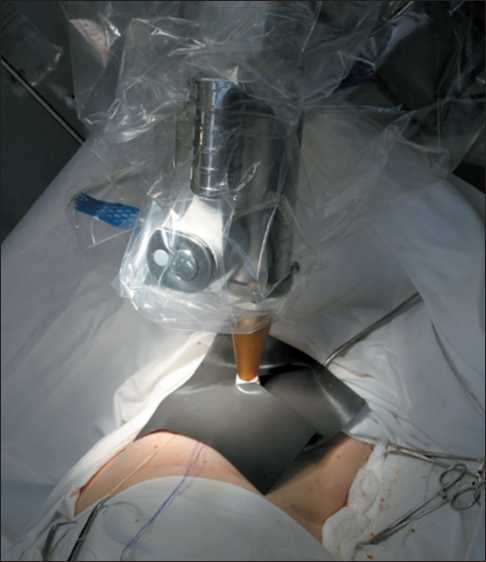
Рис. 4. Итоговый вид операционного поля. Примечание: рисунок выполнен авторами Fig. 4. Final view of the surgical field. Note: created by the authors
Статистический анализ производился с использованием языка программирования R (версия 4.2.2). Оценка нормальности распределения данных выполнялась при помощи критерия Шапиро– Уилка. С учетом характера распределения для количественных данных рассчитывались медиана и интерквартильный размах. Для анализа выживаемости использовался метод Каплана–Майера, определение статистически значимых различий между кривыми выполнялось при помощи лог-рангового критерия; 3- и 5-летняя выживаемость представлена в процентах с указанием 95 % доверительного интервала. Для оценки отношения рисков была построена модель пропорциональных рисков Кокса. Для всех произведенных тестов различия считались статистически значимыми при р<0,05.
Результаты
В основной группе средний возраст пациенток составил 62 года, (интерквартильный размах – от 54 до 69 лет), в группе контроля – 59 лет (интерквартильный размах – от 50 до 66 лет). Минимальный возраст – 30 лет, максимальный возраст – 88 лет, при сравнении двух групп исследования была выявлена статистически значимая разница (р<0,001). Средняя длительность госпитализации
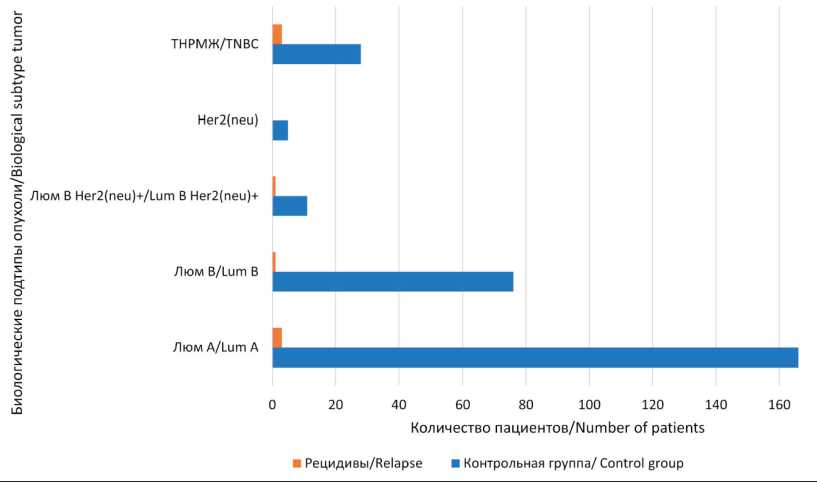
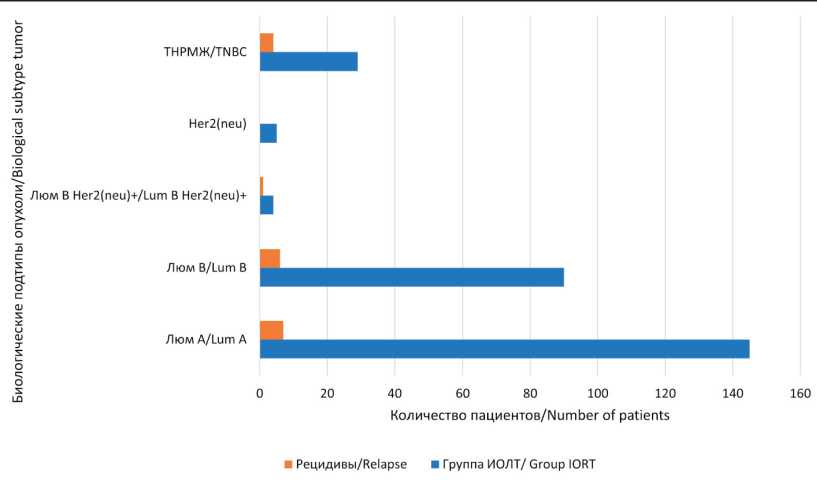
Рис. 5. Распределение пациенток по биологическим подтипам опухоли в группе контроля. Примечание: рисунок выполнен авторами
-
Fig. 5. Distribution of patients by biological subtypes of tumor in the control group. Note: created by the authors
Рис. 6. Распределение пациенток по биологическим подтипам опухоли в основной группе. Примечание: рисунок выполнен авторами
-
Fig. 6. Distribution of patients by biological subtypes of tumor in the main group.
Note: created by the authors в основной группе составила – 3 дня, в группе контроля – 4 дня (p-value 0,03).
Для всех пациенток, включенных в исследование, медиана наблюдения составила 59,1 мес (интерквартильный размах – от 43,7 до 80,7), минимальный срок наблюдения – 0,6 мес, максимальный срок – 110,4 мес. За период наблюдения в основной группе выявлено 18 (6,6 %), в группе контроля – 8 (2,8 %) пациенток с рецидивом заболевания. Распределение больных по биологическим подтипам РМЖ и частоте рецидивов в сравниваемых группах представлено на рис. 5 и 6.
Для анализа рисков рецидива, прогрессирования или смерти от заболевания в разных по иммуногистохимическому типу опухоли группах мы использовали модель пропорциональных рисков Кокса (любой негативный исход). Выявлено значимое влияние ИГХ-подтипа на исход (p=0,02). Отношение рисков для люминального В подтипа 1,88 (95 % ДИ 1,02, 3,46) соответствует 65 % вероятности более раннего наступления негативного исхода. Отношение рисков для трижды негативного рака молочной железы 3,01 (95 % ДИ 1,53, 5,95) соответствует 75 % вероятности более раннего наступления негативного исхода
(рис. 7). Другие переменные (Grade, получение гормональной, лучевой, химиотерапии, таргетной терапии, длительность госпитализации) не оказали значимого влияния на исход. При оценке степени дифференцировки опухоли установлено, что высокая степень дифференцировки (G1) выявлена у 115 (20 %) пациенток, умеренная степень дифференцировки (G2) – у 367 (66 %), низкая степень дифференцировки (G3) – у 77 (14 %) больных.
Прогрессирование заболевания в основной группе отмечено у 11 (4 %) пациенток, две из которых умерли от полиорганной недостаточности, в группе контроля – у 18 (6,3 %) пациенток, шесть из которых впоследствии умерли. Прогрессирование заболевания чаще наблюдалось у больных РМЖ в группе контроля, однако при статистическом анализе общей выживаемости с помощью кривой Каплана–Майера лог-ранговое p-value (0,73) указывает на статистически незначимый результат (рис. 8). Также отмечены летальные исходы, не связанные с основным заболеванием, в основной группе они наблюдались в 2 (0,7 %) случаях, в группа контроля – в 1 (0,3 %) случае. При оценке всех рецидивов заболевания с использованием кривой Каплана–Майера лог-ранговое p-value (0,33) ука-
Отношение рисков Risk ratio
|
Люминальный Lum A Подтипы по ИГХ (N=311) Базовый Biological sybtypes уровень |
1 |
1 |
p-value |
|||||
|
Люминальный В Lum В 1.88 (N=166) (1.02- 3.5) |
--1 |
0.044 |
||||||
|
Люминальный В Her2(neu 0.88 (N=15) (0.12- 6.5) |
)+ |
0.897 |
||||||
|
Her2(neu)+ 3.34 (N=10) (0.78-14.3) |
104 |
|||||||
|
ТНРМЖ TNBC 3.01 (N=57) (1.53- 6.0) |
0. |
001 |
||||||
Количество событий: 58; Лог-ранговое p-value: 0,02'
AIC: 652,14; Concordance index: 0,59
Number of events: 58
5 10 20
0.1 0.2 0.5 1
Рис. 7. Отношение рисков более раннего наступления негативного исхода.
Примечание: рисунок выполнен авторами Fig. 7. Risk ratio of an earlier onset of negative outcome.
Note: created by the authors
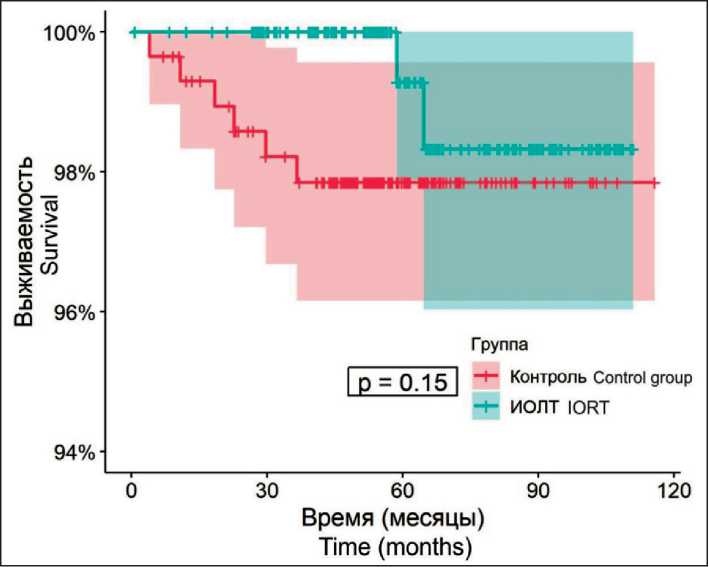
Рис. 8. Оценка прогрессирований заболевания с использованием кривой Каплана–Майера.
Примечание: рисунок выполнен авторами
Fig. 8. Assessment of disease progression using the Kaplan– Meier curve. Note: created by the authors
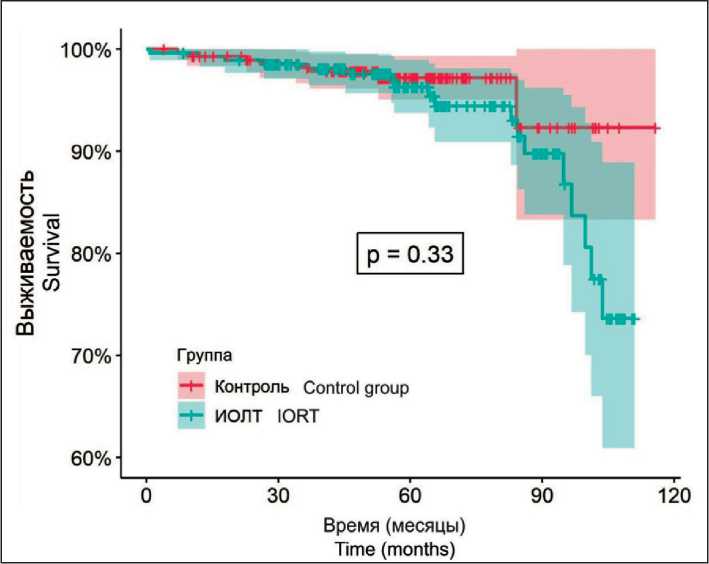
Рис. 9. Оценка рецидивов заболевания с использованием кривой Каплана–Майера.
Примечание: рисунок выполнен авторами
Fig. 9. Assessment of disease relapse using the Kaplan–Meier curve. Note: created by the authors
зывает на статистически незначимый результат при оценке безрецидивной выживаемости (рис. 9).
При оценке послеоперационных осложнений в основной и контрольной группах отмечалось формирование сером, требующих эвакуации, частота которых не была значимой и не влияла на длительность послеоперационного периода. В среднем длительность послеоперационного наблюдения в основной группе составила 15 дней, в группе контроля – 14 дней (p-value 0,14). Косметические результаты оценивались с помощью самооценки по 4-балльной Гарвардской косметической шкале [13]. В основной группе превосходные косметические результаты отмечены у 142 (52 %), хоро- шие – у 115 (42 %), удовлетворительные – у 14 (5,3 %), плохие – у 2 (0,7 %) пациенток. В группе контроля превосходные косметические результаты отмечены у 123 (43 %), хорошие – у 109 (38 %), удовлетворительные – у 29 (10 %), плохие – у 25 (9 %) пациенток.
В послеоперационном периоде все пациентки получали адъювантное лечение: антиэстрогенную терапию (АЭТ) в основной группе – 229, в группе контроля – 259 больных; химиотерапию в основной группе – 54, в группе контроля – 47; дистанционную лучевую терапию в основной группе – 55, в группе контроля – 275 пациенток.
Обсуждение
При анализе полученных результатов обращают на себя внимание значимые различия в возрасте пациенток, включенных в исследование. В основной группе возраст пациенток был больше, чем в группе контроля. Возможно, при включении пациенток в основную группу мы учитывали сопутствующую сердечно-сосудистую и дыхательную патологию, которая чаще встречается в более старшей группе пациенток с учетом низкой перспективы дальнейшего выполнения дистанционной лучевой терапии. Также стоит отметить, что не было значимой разницы в длительности госпитализации и послеоперационного наблюдения, что свидетельствует о схожем течении послеоперационного периода в сравниваемых группах. При оценке косметических результатов была значительная разница по удовлетворенности внешним видом у пациенток в основной и контрольной группе. Это можно объяснить возникновением лучевых дерматитов, постлучевым отеком молочной железы и верхней конечности, гиперпигментацией кожи, часто встречающихся при дистанционной лучевой терапии [14] в отличие от ИОЛТ [6]. Безусловно, важным результатом исследования является значимое влияние ИГХ-подтипа на исход заболевания (p=0,02). Люминальный В и трижды негативный подтипы РМЖ значимо чаще приводили к негативному исходу, такому как рецидив, прогрессирование или смерть, что сопоставимо с результатами крупных исследований [15–19]. В дальнейшем при использовании данной методики стоит тщательнее отбирать пациентов, в том числе учитывая ИГХ-подтип опухоли. При анализе общей выживаемости установлено, что показатели 3- и 5-летней выживаемости в основной группе лечения составили 100 % (100 – 100) и 99,3 % (97,9 – 100) соответственно, в контрольной группе – 98,2 % (96,7 – 99,8) и 97,8 % (96,2 – 99,6) (95 % ДИ), что показывает преимущество ИОЛТ по сравнению с дистанционной лучевой терапией.
Список литературы Сравнение эффективности интраоперационной лучевой терапии и дистанционной лучевой терапии у пациенток с ранним раком молочной железы
- Zlokachestvennye novoobrazovaniya v Rossii v 2021 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2022. 252 s.
- Merabishvili V.M. Sostoyanie onkologicheskoi pomoshchi v Rossii: rak molochnoi zhelezy sredi muzhskogo naseleniya, rasprostranennost' i vyzhivaemost' bol'nykh (populyatsionnoe issledovanie na urovne federal'nogo okruga). Voprosy onkologii. 2022; 68(3): 303-12.
- Kunkler I. The role of adjuvant radiotherapy in the management of breast cancer. Breast Surgery. WB Saunders. 2014; 242-57.
- Shah C., Vicini F., Shaitelman S.F., Hepel J., Keisch M., Arthur D., Khan A.J., Kuske R., Patel R., Wazer D.E. The American Brachytherapy Society consensus statement for accelerated partial-breast irradiation. Brachytherapy. 2018; 17(1): 154-70. https://doi.org/10.1016/j.brachy.2017.09.004.
- Hughes K.S., Schnaper L.A., Bellon J.R., Cirrincione C.T., Berry D.A., McCormick B., Muss H.B., Smith B.L., Hudis C.A., Winer E.P., Wood W.C. Lumpectomy plus tamoxifen with or without irradiation in women age 70 years or older with early breast cancer: long-term follow-up of CALGB 9343. J Clin Oncol. 2013; 31(19): 2382-7. https://doi.org/10.1200/JCO.2012.45.2615.
- Vaidya J.S., Bulsara M., Baum M., Wenz F., Massarut S., Pigorsch S., Alvarado M., Douek M., Saunders C., Flyger H.L., Eiermann W., Brew-Graves C., Williams N.R., Potyka I., Roberts N., Bernstein M., Brown D., Sperk E., Laws S., Sütterlin M., Corica T., Lundgren S., Holmes D., Vinante L., Bozza F., Pazos M., Le Blanc-Onfroy M., Gruber G., Polkowski W., Dedes K.J., Niewald M., Blohmer J., McCready D., Hoefer R., Kelemen P., Petralia G., Falzon M., Joseph D.J., Tobias J.S. Long term survival and local control outcomes from single dose targeted intraoperative radiotherapy during lumpectomy (TARGIT-IORT) for early breast cancer: TARGIT-A randomised clinical trial. BMJ. 2020. BMJ. 2020 Aug 19; 370: m2836. https://doi.org/10.1136/bmj.m2836.
- Vaidya J.S., Wenz F., Bulsara M., Tobias J.S., Joseph D.J., Keshtgar M., Flyger H.L., Massarut S., Alvarado M., Saunders C., Eiermann W., Metaxas M., Sperk E., Sütterlin M., Brown D., Esserman L., Roncadin M., Thompson A., Dewar J.A., Holtveg H.M., Pigorsch S., Falzon M., Harris E., Matthews A., Brew-Graves C., Potyka I., Corica T., Williams N.R., Baum M.; TARGIT trialists’ group. Risk-adapted targeted intraoperative radiotherapy versus whole-breast radiotherapy for breast cancer: 5-year results for local control and overall survival from the TARGIT-A randomised trial. Lancet. 2014; 383(9917): 603-13. https://doi.org/10.1016/S0140-6736(13)61950-9. Erratum in: Lancet. 2014; 383(9917): 602.
- Chumachenko I.S., Murashko R.A., Keshabyan A.A., Krivorot'ko P.V., Novikov S.N. Rezul'taty organosokhranyayushchego lecheniya raka molochnoi zhelezy s primeneniem intraoperatsionnoi luchevoi terapii. Opukholi zhenskoi reproduktivnoi sistemy. 2021; 17(3): 16-23. https://doi.org/10.17650/1994-4098-2021-17-3-16-23.
- Alaichiev N.A., Usynin E.A., Kondakova I.V., Sereda E.E., Frolova I.G., Doroshenko A.V., Garbukov E.Yu., Startseva Zh.A. Kombinirovannoe lechenie operabel'nogo raka molochnoi zhelezy s ispol'zovaniem intraoperatsionnoi luchevoi terapii. Sibirskii onkologicheskii zhurnal. 2023; 22(1): 119-27. https://doi.org/10.21294/1814-4861-2023-22-1-119-127.
- Manikhas A.G., Gor L.A., Topuzov E.E., Oganesyan A.S., Fedorova O.I., Kalinin I.V. Opyt primeneniya intraoperatsionnoi luchevoi terapii u patsientok s rannim rakom molochnoi zhelezy. Opukholi zhenskoi reproduktivnoi sistemy. 2022; 18(2): 14-20. https://doi.org/10.17650/1994-4098-2022-18-2-14-20.
- Zolotoi standart profilaktiki, diagnostiki, lecheniya i reabilitatsii bol'nykh RMZh. M., 2023.
- Krivorot'ko P.V., Dashyan G.A., Shinkarev S.A., Zernov K.Yu., Petrovskii S.G., Manikhas A.G., Novikov S.N. Rekomendatsii ROOM po biopsii signal'nykh limfouzlov. Klinicheskie rekomendatsii ROOM 2018 g. po diagnostike i lecheniyu raka molochnoi zhelezy. M., 2018. S. 227-33.
- Harris J.R., Levene M.B., Svensson G., Hellman S. Analysis of cosmetic results following primary radiation therapy for stages I and II carcinoma of the breast. Int J Radiat Oncol Biol Phys. 1979; 5(2): 257-61. https://doi.org/10.1016/0360-3016(79)90729-6.
- Bazyka D.A., Litvinenko O.O., Bugaytsov S.G., Shakhrai G.F. Skin and subcutaneous adipose tissue damage after radiation therapy in breast cancer patients. Probl Radiac Med Radiobiol. 2021; 26: 18-35. https://doi.org/10.33145/2304-8336-2021-26-18-35.
- Shim H.J., Kim S.H., Kang B.J., Choi B.G., Kim H.S., Cha E.S., Song B.J. Breast cancer recurrence according to molecular subtype. Asian Pac J Cancer Prev. 2014; 15(14): 5539-44. https://doi.org/10.7314/apjcp.2014.15.14.5539.
- Kim R.G., Kim E.K., Kim H.A., Koh J.S., Kim M.S., Kim K.I., Lee J.I., Moon N.M., Ko E., Noh W.C. Prognostic significance of molecular subtype in T1N0M0 breast cancer: Korean experience. Eur J Surg Oncol. 2011; 37(7): 629-34. https://doi.org/10.1016/j.ejso.2011.04.014.
- Vaidya J.S., Bulsara M., Baum M., Wenz F., Massarut S., Pigorsch S., Alvarado M., Douek M., Saunders C., Flyger H., Eiermann W., Brew-Graves C., Williams N.R., Potyka I., Roberts N., Bernstein M., Brown D., Sperk E., Laws S., Sütterlin M., Corica T., Lundgren S., Holmes D., Vinante L., Bozza F., Pazos M., Blanc-Onfroy M.L., Gruber G., Polkowski W., Dedes K.J., Niewald M., Blohmer J., McReady D., Hoefer R., Kelemen P., Petralia G., Falzon M., Joseph D., Tobias J.S. New clinical and biological insights from the international TARGIT-A randomised trial of targeted intraoperative radiotherapy during lumpectomy for breast cancer. Br J Cancer. 2021; 125(3): 380-9. https://doi.org/10.1038/s41416-021-01440-8.
- Manikhas A.G., Oganesyan A.S., Skvortsov V.A., Chikrizov S.I., Li L.A., Babeshkin R.N., Grinev I.A., Fedorova O.I., Manikhas G.M. Sovremennye aspekty intraoperatsionnoi luchevoi terapii v lechenii raka molochnoi zhelezy. Ural'skii meditsinskii zhurnal. 2014; 2(116): 23-8.
- Manikhas A.G., Grinev I.A., Oganesyan A.S., Chikrizov S.I. Organosokhranyayushchee lechenie raka molochnoi zhelezy s intraoperatsionnoi luchevoi terapiei. Vrach-aspirant. 2016; 77(4): 15-22.
- Vaidya J.S., Bulsara M., Wenz F., Sperk E., Massarut S., Alvarado M., Williams N.R., Brew-Graves C., Bernstein M., Holmes D., Vinante L., Pigorsch S., Lundgren S., Uhl V., Joseph D., Tobias J.S.; TARGIT-A authors. The TARGIT-A Randomized Trial: TARGIT-IORT Versus Whole Breast Radiation Therapy: Long-Term Local Control and Survival. Int J Radiat Oncol Biol Phys. 2023; 115(1): 77-82. https://doi.org/10.1016/j.ijrobp.2022.08.029.


