Сравнение кинетических свойств различных циклодекстринглюканотрансфераз
Автор: Федорова Полина Юрьевна, Гильванова Елена Альбертовна, Усанов Николай Глебович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Приводятся данные, указывающие на факт высокой частоты встречаемости способности к образованию циклодекстринов среди бактерий рода Paenibacillus (Ash et al. 1994 emend. Behrendt et al. 2010). Проведено сравнение физико-химических и каталитических свойств циклодекстринглюканотрансфераз четырех штаммов, выделенных из почвы тремя различными методами и охарактеризованных филогенетически в качестве представителей P.macerans, P.ehimensis, P.illinoisensis и P.campinasensis.
Циклодекстрины, цд, циклодекстринглюанотрансфераза, цгтаза
Короткий адрес: https://sciup.org/148205560
IDR: 148205560 | УДК: 577.151.64
Текст научной статьи Сравнение кинетических свойств различных циклодекстринглюканотрансфераз
Циклодекстринглюканотрансфераза (ЦГТаза, КФ 2.4.1.19) – фермент, катализирующий реакции межмолекулярного трансгликозилирования, в своей сумме приводящие к деполимеризации крахмала и образованию циклодекстринов (ЦД) – нередуцирующих макроциклических олигосахаридов, широко используемых в пищевой промышленности, фармацевтике, косметике, органическом синтезе [1].
Наиболее распространены и известны, альфа-( a ), бета-( β ) и гамма-( γ ) ЦД, молекулы которых состоят из 6, 7 и 8 остатков D-глюкопиранозы, связанных a -1→4-D связями. При действии ЦГТазы на крахмал в реакционной смеси одновременно образуются и накапливаются все три гомолога, ингибирующие действие фермента.
В зависимости от того, какой продукт доминирует в продуктах конверсии, различают ( a )-, ( β )- и ( γ )-ЦГТазы, природа которых в свою очередь зависит от генетическо-видовых особенностей штамма-продуцента.
Не смотря на об илие публикаций о выделении новых бактерий, способных к синтезу ЦГТаз, накопленный материал зачастую оторван от современных таксономических описаний, названия изолятов бактерий не соответствуют действительности, а сами публикации фактически лишены смысла. Филогенетически изучены лишь единичные штаммы аэробных спорообразующих бактерий, таких как Paenibacillus macerans [2], P.illinoisensis [10], P.graminis [19], P.stellifer [17], P. campinasensis [20], Bacillus agaradhaerens [14]. Единичные продуценты позиционированы на физиологобиохимическом уровне на уровне родов Klebsiella [9].
Несмотря на перечисленные факты, даже в последних обзорах [16, 18], посвященных сравнительному описанию продуцентов ЦД, в качестве основной родовой группы продолжает фигурировать род Bacillus, Cohn 1872.
Практически не имеется работ, в которых бы в рамках одной лаборатории проводилось сравнение свойств нескольких ЦГТаз бактерий различных видовых групп, прошедших филогенетическую идентификацию. Целью настоящего исследования является восполнение пробелов в данной тематике.
МАТЕРИАЛ И МЕТОДЫ
В работе использовали лиофильно высушенные препараты циклодекстринглюканотрансфераз продуцентов из коллекции лаборатории прикладной микробиологии Института биологии УНЦ РАН: Paenibacillus ehimensis ВКМB-2680D (IB-739), P.illinoisensis IB-1087, P.campinasensis IB-417, P.macerans IB-14 (IB-1053).
Выращивание бактерий Paenibacillus ehimensis осуществляли в 250 мл качалочных колбах содержащих 50 мл среды, при скорости 180 об/мин при 37÷390С в течение 68÷72 ч, на среде, содержащей (в граммах): крахмал – 10,0; пептон – 4,0; дрожжевой экстракт – 5,0; КH 2 PO 4 – 1,0; СaСО 3 – 1,0; дистиллированную воду до 1000 мл, при стартовых рН 7,0-7,2.
Наработку ЦГТазы P.illinoisensis IB-1087 проводили в вышеописанных условиях на среде K1, содержащей (в граммах): крахмал – 10,0; пептон – 5,0; дрожжевой экстракт – 5,0; КH 2 PO 4 – 2,0; Na 2 HPO 4 – 2,0; дистиллированную воду до 1000 мл, при стартовых рН 7,2^7,4.
Наработку ЦГТазы P.campinasensis IB-417 проводили на среде К1 с добавлением 0,8÷1,0% Na2CO3, при стартовых рН 9,2^9,8.
Наработку препарата ЦГТазы P.macerans IB-I4 проводили на среде, содержащей (в граммах): крахмал – 10,0; пептон – 3,0; дрожжевой экстракт – 3,0; кукурузный экстракт – 3,0; (NH 4 ) 2 SO 4 – 0,2; CaCO 3 – 1,0; дистиллированную воду до 1000 мл, при стартовых рН 7,4^7,8.
ЦГТазную активность растворов и препаратов измеряли фенолфталеиновым методом [3], используя для разбавления фермента 50 мМ ацетатный буфер рН 6,0÷6,1, содержащий 10 мМ CaCl 2 . За 1 единицу активности принимали количество ЦГТазы, катализирующее образование 1 мкМ в -ЦД в течение 1 мин при 40 0 С.
Для выделения ЦГТазы из культуральной жидкости бактериальные клетки отделяли центрифугированием при 6000 мин-1 в течение 30 мин, фильтрат культуральной жидкости концентрировали методом ультрафильтрации на полых волокнах ВПУ-50. Для получения сухого не очищенного препарата концентрат подвергали лиофильной сушке в аппарате «ИНЕЙ-6».
Аналитическое определение специфичности ЦГТаз осуществляли следующим методом. Пробы (5 мл) реакционной смеси, состоящей из клейсте-ризованного картофельного крахмала в 50 мМ ацетатном буфере (рН 6,0), ЦГТазы и 10 мМ CaCl 2 , помещали в биологический термостат и выдерживали при 400С в течение 24 часов. По истечении указанного интервала времени, из пробирок извлекали по 900 мкл образцов, которые помещали в 2,0 мл пробирки Эппендорф. В каждую из проб вносили по 90 мкл 10%-ного раствора ксилозы, игравшей роль внутреннего стандарта. После завершения указанных манипуляций в пробирки дозировали по 990 мкл ацетонитрила ОСЧ для хроматографии и отделяли образовавшийся осадок крахмала центрифугированием при 8000 мин-1 в течение 10 минут. Порции супернатанта, соответствующие условиям реакции, анализировали с помощью ВЭЖХ на колонке «SEPARON-NH 2 »-5мкм (3х150 мм), используя в качестве элюента смесь ацетонитрил – вода в объемном соотношении 63:37. Подачу растворителя осуществляли насосом НРР-5001 со скоростью 0,7 мл/мин, а в качестве детектора использовали рефрактометр RIDK-102. Регистрацию и оцифровку аналогового сигнала, последующую обработку хроматограмм проводили с помощью программно-вычислительного комплекса «Мультихром 1.59». Калибровку прибора осуществляли методом внутреннего стандарта, используя индивидуальные ЦД производства «Wacker Chemie» (США).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для получения ферментных препаратов использованы культуры из коллекции лаборатории прикладной микробиологии Института биологии УНЦ РАН Paenibacillus illinoisensis (IB-1087), P.ehimensis ВКМ B-2680D (IB-739), P.macerans (IB-1053), P.campinasensis (IB-417). Три первых штамма были выделены из почвы с помощью аэробной и анаэробной накопительной среды на основе растворов 0,5% β -циклодекстрина [4, 5]. Алкалотоле-рантный штамм P.campinasensis IB-417 обнаружен в процессе скрининга продуцентов щелочных бактериальных целлюлаз на щелочной элективной среде, содержавшей в своем составе 0,5% КМЦ-Na и 1% Na 2 CO 3 (рН=10,0÷11,0).
Способность к синтезу ЦД, была обнаружена лишь после выполнения 16S рРНК анализа и обнаружения близкого сходства прочитанной последовательности гена с таковыми, описанными ранее бразильскими авторами у культур P.campinasensis
JCM11200 (№ NCBI=AB073187) и P.campinasensis BL11 (DQ232773) [7-8; 20].
Для наработки образцов ферментов использовали среды и режимы культивирования, приведенные в материалах и методах.
Препараты подвергали частичной очистке пере-осаждением, высаливанием, хроматографическими и абсорбционными методами.
Используя стандартные процедуры, исследовали физико-химические свойства выделенных белков, их молекулярную массу.
Результаты описаний ЦГТаз 4-х видов бактерий, выделенных в нашей лаборатории и охарактеризованных филогенетическими методами, сведены в таблице.
Суммируя полученные результаты, можно указать на тот факт, что описания ЦГТаз P.macerans IB-1053 и P.campinasensis IB-417, P.illinoisensis IB-1087 были близки к описанным ранее для культур тех же видов.
Весьма важной характеристикой ЦГТаз является их специфичность в отношении спектра ЦД, накапливающихся в продуктах конверсии крахмала [1]. По преобладающему продукту реакции дают название ЦГТазе, указывая что она, например, относится к β -типу. По доминантному продукту реакции принято разделять циклизующие ферменты на a -[11], β -[8] и γ -ЦГТазы [12; 13].
Вместе с тем, в расчет не берется тот факт, что само соотношение [ a -ЦД]:[ β -ЦД]:[ γ -ЦД] в продуктах реакции динамично меняется во времени, и зачастую, весьма существенно. Например для a -ЦГТаз P.macerans описаны серьезные вариации соотношения a -ЦД: β -ЦД: γ -ЦД, возникающие в течение реакции, равно как и при вариациях стартового соотношения субстрат/фермент (E/S).
Учитывая, что условия выбора режима реакции зависит, как от воли автора исследования, так и от использованных им методов измерения циклизующей активности, сравнение ЦГТаз, кинетические свойства которых были исследованы в разных лабораториях зачастую не возможно.
В этой связи для изучения кинетических особенностей ЦГТаз, имевшихся в нашем распоряжении, был применен собственный подход, основанный на определении безразмерных коэффициентов, являющихся отношениями молярных концентраций KU α =[ β -ЦД]/[ a -ЦД] и KU γ =[ β -ЦД]/[ γ -ЦД] в продуктах суточной конверсии крахмала.
Измерения велись в широком диапазоне стартового соотношения (E/S), а в качестве единицы характеризующей количество ЦГТазы, была использована ее активность в мкКат, измеренная фенолфталеиновым методом.
На рис. представлены результаты сравнения каталитических свойств четырех штаммов циклодекстриногенных бактерий относящихся к роду Paeni-bacillus .
Таблица. Сравнение свойств ЦГТаз четырех видов бактерий рода Paenibacillus
|
Источник ЦГТазы |
S* |
ММ** |
pH о пт |
рН стаб. |
т „ опт. |
τ τ 50% *** |
pI |
16S рРНК NCBI |
|
|
А |
P.illinoisensis IB-1087 |
β - |
68 |
7,0 |
5-9 |
55 |
19 мин |
5.1 |
FN422001.1 |
|
Б |
P.macerans IB-1053 |
a - |
70 |
5,5 |
7-9,5 |
55 |
6,2 мин |
4.9 |
AM406669.1 |
|
В |
P.ehimensis IB-739 |
β - |
75 |
6,0 |
5,5-8,2 |
40 |
5,3 мин |
Н.д |
FN582329.1 |
|
Г |
P.campinasensis IB-417 |
β - |
82 |
7,0 |
6-10 |
60 |
3 часа 15 мин |
Н.д |
FN429977.1 |
Прим.: S* – специфичность (дозировка 10 ед/г крахмала, 40оС, 1 ч); ММ** – молекулярная масса; τ 50% *** – время экспозиции образца ЦГТазы при 550С, вызывающее 50% снижение его активности при рН 6,0 без субстрата
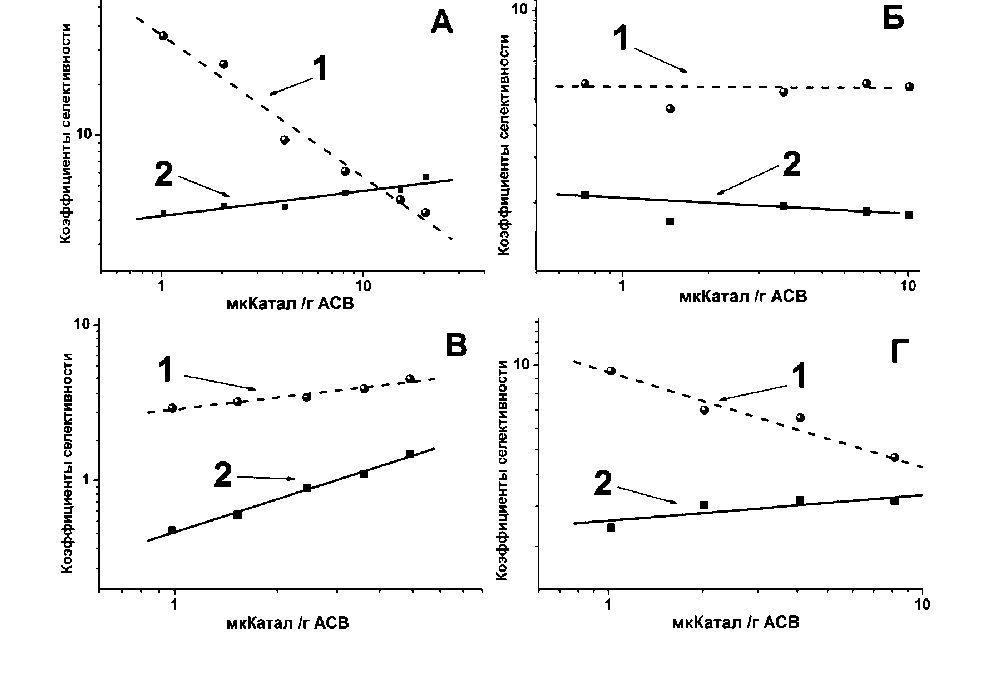
Рис. Зависимость выхода циклодекстринов от концентрации ЦГТаз, выделенных из бактерий различных видов в течение 24 ч трансформации 2,75% крахмала: А – Paenibacillus campinasensis IB-417; Б – Р.ehimensis IB-739; В – P.macerans IB-I4; Г – P.illinoisensis IB-1087. Кривые (1) и (2) обозначают величины безразмерных коэффициентов равных молярным отношениям [ β -ЦД]/[ a -ЦД] и [ β -ЦД]/ [ γ -ЦД] в продуктах реакции соответственно
Обнаружено, что во всех 4-х случаях зависимость молярных соотношений KUα=[β-ЦД]/[a-ЦД] и KUγ=[β-ЦД]/[γ-ЦД] от величины (E/S) в двойных логарифмических координатах вырождаются в линейные (рис.1). Полученная информация позволяет подробно описывать и сравнивать динамику накопления различных форм ЦД, а также ее зависимость от дозы внесенного фермента для разных типов ЦГТаз. Например, при использовании β-ЦГТазы алкалотолерантной P.campinasensis (А), накопление β-ЦД относительно a-ЦД падает с увеличением относительной дозировки фермента и этот процесс сопровождается ростом отношения KUα, из чего следует, что удельный выход γ-ЦД также снижается по мере продолжения реакции. Схожими кинетическими особенностями обладает бета-ЦГТаза P.illinoisensis (Г). Оба фермента, на ранних стадиях реакции (что адекватно низким удельным дозировкам ЦГТаз) катализируют преимущественное образование длинноцепочечных β-ЦД и γ-ЦД, которые по мере накопления начинают изомеризоваться в a-ЦД (6 глюкозных остатков). ЦГТаза P.macerans (В) катализирует трансформацию крахмала иным образом: сначала в среде накапливается a-ЦД, который по мере увеличения (E/S) трансформируется в β-ЦД. Каталитическая «ретрансформация» a- и γ-ЦД в β- форму, по мере нарастания их концентраций в ходе реакции явля- ется типичной и хорошо известной особенностью ферментов данного типа [15]. Бактерии вида P.ehimensis секретируют ЦГТазу широкой специфичности (Б), инициирующую превращение крахмала до смесей, пригодных для одновременного синтеза одновременно трех циклических декстринов. Для этого фермента характерно образование относительно постоянных соотношений a-, β- и γ-ЦД, мало зависящих от дозы внесенной ЦГТазы. ЦГТаза P.campinasensis в первые моменты реакции отличается ярко выраженной β-специфичностью, (А) но по мере трансформации субстрата в среде накапливается значительное количество a-формы. Оптимальными для трансформации крахмала в ЦД для всех четырех типов ЦГТаз можно считать их удельные дозировки на уровне 8÷10 мкКат/1г субстрата.
Таким образом, 4 культуры бактерий, секретирующие ЦГТазу и выделенные 3-мя различными методами, с использованием бета-ЦД и КМЦ-Na в качестве субстрата накопительных сред, принадлежат к роду Paenibacillus. ЦГТазы P.illinoisensis IB-1087; P.macerans IB-1053; P.campinasensis IB-417 по своим физико-химическим свойствам близки к описанным в литературе. Описание ЦГТазы P.ehimensis IB-739 (ВКМ B-2680D) выполнено впервые. Также впервые обнаружено, что при действии ЦГТаз на крахмал зависимость отношений [ β -ЦД]/[ a -ЦД] и [ β -ЦД]/[ γ -ЦД] от величины (E/S) в двойных логарифмических координатах вырождаются в линейную.
Николай Глебович Усанов, один из авторов, скоропостижно скончался при подготовке статьи к публикации.
Список литературы Сравнение кинетических свойств различных циклодекстринглюканотрансфераз
- Абелян В.А. и др. Сравнительная характеристика циклодекстрингликозилтрансфераз различных групп микроорганизмов//Биохимия. 1992. Т. 57. № 3. С. 430-437.
- Абелян В.А., Афян К.Б., Манукян Л.С. Новые циклодекстринглюканотрансферазы, продуцируемые Bacillus macerans//Прикладная биохимия и микробиология. 2000. Т. 36. № 4. С. 395-401.
- Усанов Н.Г. и др. Усовершенствованный метод фотометрического определения активности циклодекстринглюканотрансферазы//Прикладная биохимия и микробиология. 2007. Т. 43. № 1. С. 118-124.
- Усанов Н.Г., Логинов О.Н., Мелентьев А.И. Синтез циклодекстринглюканотрансфераз микроорганизмами, утилизирующими циклодекстрины в качестве единственного источника углерода//Докл. АН СССР. 1989. Т. 310. № 6. С. 1489-1492.
- А.с. 1703681 СССР. Способ выделения бактерий Bacillus macerans из почвы/Усанов Н.Г. и др. Опубл. 1991.
- Abelyan V.H. Cyclodextrines: Production and uses. Kuala Lumpur, 2005. 511 p.
- Alves-Prado H.F., Gomes E., Da Silva R. Evaluation of solid and submerged fermentations for the production of cyclodextrin glycosyltransferase by Paenibacillus campinasensis H69-3 and characterization of crude enzyme//Appl. Biochem. Biotechnol. 2006. V. 129. № 1. Р. 234-246.
- Alves-Prado H. F., Gomes E., Da Silva R. Purification and characterization of a cyclomaltodextrin glucanotransferase from Paenibacillus campinasensis strain H69-3//Appl. Biochem. Biotechnol. 2007. V. 137. Р. 41-55.
- Binder F., Huber O., Bock A. Cyclodextrin-glycosyltransferase from Klebsiella pneumoniae M5a1: Cloning, nucleotide sequence and expression//Gene Lehrstuhl fur Mikrobiologie. 1986. V. 47. № 3. Р. 269-277.
- Doukyu N., Kuwahara H., Aono R. Isolation of Paenibacillus illinoisensis that produces cyclodextrin glucanotransferase resistant to organic solvents//Biosci., Biotechnol. Biochem. 2003. V. 67. № 2. Р. 334-340.
- Gawande B., Patkar A. Alpha-cyclodextrin production using cyclodextrin glycosyltransferase from Klebsiella pneumoniae AS-22//Starch/Staerke. 2001. V. 53. № 2. Р. 75-83.
- Hirano K. et al. Molecular cloning and characterization of a novel gamma-CGTase from alkalophilic Bacillus sp.//Appl. Microbiol. Biotechnol. 2006. V. 70. № 2. Р. 193-201.
- Kato T., Horikoshi K. A new gamma-cyclodextrin forming enzyme produced by Bacillus subtilis No.313//Starch Sci. 1986. V. 33. № 2. Р. 137-143.
- Martins R.F., Hatti-Kaul R. A new cyclodextrin glycosyltransferase from an alkaliphilic Bacillus agaradhaerens isolate: Purification and characterisation//Enzyme and Microbial Technology. 2002. V. 30. № 1. Р. 116-124.
- Patrick Lee K.C., Tao B.Y A kinetic study of cyclodextrin glycosyltransferase: Substrate and product inhibitions//Biotechnol. Appl. Biochem. 1995. V. 21. № 1. Р. 111-121.
- Sivaramakrishnan S. и др. a-Amylases from microbial sources-An overview on recent developments//Food Technol. Biotechnol. 2006. V. 44. № 2. Р. 173-184.
- Suominen I. и др. Paenibacillus stellifer sp. nov., a cyclodextrinproducing species isolated from paperboard//Intern. J. System. Evolution. Microbiology. 2003. V. 53. № 5. Р. 1369-1374.
- Tonkova A. Bacterial cyclodextrin glucanotransferase//Enzyme and Microbial Technology. 1998. V. 22. № 8. Р. 678-686.
- Vollu R.E. et al. Cyclodextrin production and genetic characterization of cyclodextrin glucanotranferase of Paenibacillus graminis//Biotechnol. Lett. 2008. V. 30. № 5. Р. 929-935.
- Yoon J.H. et al. Paenibacillus campinasensis sp. nov., a cyclodextrin-producing bacterium isolated in Brazil//Intern. J. System. Bacteriology. 1998. V. 48. №. 3. Р. 833-837.


