Сравнение методов оценки жизнеспособности бактерий Escherichia coli при действии ципрофлоксацина
Автор: Петерс М.А., Музыка Н.Г., Октябрьский О.Н., Смирнова Г.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2015 года.
Бесплатный доступ
Проведено сравнение различных методов оценки жизнеспособности бактерий E. coli, обработанных фторхинолоном ципрофлоксацином. Показано отсутствие полной корреляции между результатами, полученными в тестах по определению удельной скорости роста, способности к образованию колоний и поддержанию мембранного потенциала (Д\|/), а также в тесте «live-dead». В частности, только 0.04% клеток в популяции сохраняли способность к образованию колоний через 2 ч. экспозиции к 0.3 мкг/мл ципрофлоксацина, в то время как доля «живых» клеток в тесте «live/dead» составляла 83% от их общего числа. При обработке 3 мкг/мл ципрофлоксацина способность к образованию колоний демонстрировали 0.13% клеток, тогда как в этих же условиях в тесте «live/dead» практически все клетки имели интактные мембраны и не окрашивались пропидиум иодидом. В отличие от колониеобразующей способности и теста «live/dead», в тесте с DiBAC 4(3) наблюдалась прямая зависимость числа флуоресцирующих (деполяризованных) клеток от концентрации ци-профлоксацина. Через 2 ч. инкубации доля клеток, утративших мембранный потенциал, составляла 30% в случае обработки 0.3 мкг/мл ципрофлоксацина и 70% - при обработке 3 мкг/мл этого антибиотика. За 2.5 ч. экспозиции экспрессия sulA(sfiA)::lacZ возрастала в 12 раз при действии 0.3 мкг/мл ципрофлоксацина и в 3 раза при обработке клеток 3 мкг/мл этого антибиотика. Обнаружена обратная зависимость между уровнем экспрессии гена sulA, принадлежащего SOS-регулону, и количеством колониеобразующих единиц (КОЕ).
Ципрофлоксацин, "live-dead" тест, мембранный потенциал (д\|/), membrane potential (д\|/), sos-ответ
Короткий адрес: https://sciup.org/147204740
IDR: 147204740 | УДК: 579.22
Текст научной статьи Сравнение методов оценки жизнеспособности бактерий Escherichia coli при действии ципрофлоксацина
Ципрофлоксацин является высокоэффективным и широко используемым антибиотиком. входящим в группу фторхинолонов. Эти антибиотики ингибируют синтез ДНК путем взаимодействия с бак териальными топоизомеразами - ДНК-гиразой и топоизомеразой IV. Топоизомеразы играют важную роль в процессе репликации, релаксируя свсрхспирализованныс молекулы ДНК посрсдст-
(С Петерс М. А., Музыка Н. Г, Октябрьский О Н., Смирнова Г В , 2015
вом внесения одно- или двуцепочечных разрывов с последующим их восстановлением (лигированием). Хинолоны быстро связываются с комплексом ДНК-фермент, препятствуя восстановлению разрывов в молекуле ДНК, что приводит к фрагментации хромосом и, в конечном итоге, к гибели клеток [Drlica Ct al-, 2008J. Экспозиция к ципрофлок-сацину, как и к другим агентам, повреждающим ДНК, индуцирует SOS-ответ, контролирующий репарацию ДНК и филаментацию клеток [Friedberg. Walker. Siede, 1995]. Ципрофлоксацин оказывает бактерицидный эффект как в аэробных, так и в анаэробных условиях. Предполагается, что в аэробных условиях в механизм бактерицидного действия хинолонов вовлечены активные формы кислорода (АФК): супероксид, перекись водорода и гидроксильные радикалы, продуцируемые с участием дыхательной цепи [Wang et al., 2010].
Традиционным способом определения степени бактерицидного эффекта различных антибактериальных препаратов является подсчёт числа видимых колоний (КОЕ) после высева соответствующих разведений бактериальных культур на агари-зованные среды. Вместе с тем в последние годы все шире используются более быстрые методы определения жизнеспособности бактерий, основанные на использовании флуоресцентных проб, которые позволяют осуществлять мониторинг жизненно важных биологических параметров отдельных клеток. К числу таких параметров относятся проницаемость мембран и способность поддерживать мембранный потенциал. Использование двух флуоресцентных красителей ДНК. SYTO9 и пропид иум иодида (PI), в «live-dead» тесте позволяет дифференцировать бактерии с интактной и повреждённой цитоплазматической мембраной [Вегпеу et al., 2007]. SYTO9, дающий зелёную флуоресценцию, проникает во все клетки и служит для подсчета их общего количества, в то время как красный флуоресцентный краситель PI входит только в клетки с повреждёнными цитоплазматическими мембранами или нарушенным механизмом откачки этого красителя. Следует отмеппь, однако, что если клетки с повреждённой мембраной можно рассматривать как «мёртвые», то обратное утверждение (интактные клетки активны) не всегда справедливо [Berney et aL, 2007].
Широко используемой пробой на мембранный потенциал является флуорохром бис-(1,3-дибутил-барбитуровая кислота) триметиноксонол DiBAC4(3) [Wickens et at, 2000]. Отрицательно заряженный DiBAC4(3) не может проникать в активные клетки, несущие изнутри отрицательный заряд. Поэтому' клетки, окрашенные DiBAC4(3), можно рассматривать как утратившие мембранный потенциал (деполяризованные). Было показано наличие тесной корреляции между числом КОЕ при определении стандартным методом и количеством поляризованных клеток в тесте с DiBAC4(3) [Jcpras ct al.. 1995]. Однако следует иметь в виду, что изменения мембранного потенциала могут со провождать различные физиологические перестройки в клетках и отражать переключения их метаболической активности.
Целью настоящей работы является сравнение различных методов оценки жизнеспособности бактерий Е. coli при действии ципрофлоксацина и изучение связи между жизнеспособностью бактерий и индукцией SOS-ответа и антиоксидантных генов.
Материалы и методы исследования
Штаммы бактерий и условия культивирования. В качестве объекта исследований использовали штамм Е. coli BW25113 \(oraD-draB^1. MticZ47^1(/.rrnB-3\ Х-, rph- 1, i\(rhaD-rhaB)56^ hsdR514, полученный из E. coli Genetic Stock Center (CGSC). Штаммы NM3001 и NM3011, несущие слияния промоторов л/«/4 и suLA(sftA) генов со структурным геном lacZ, кодирующим f-галактозидазу, были сконструированы путем трансдукции фагом PI слияний sodA::locZ и sulA(sfc4)::lacZ из Е. coli DM4000 (дар проф. М. Volkert) и QC772 (дар проф D. Touati) в BW25113. Штамм NM3021, несущий транскрипционное генное слияние kotG::lacZt был получен путем трансформации клеток Е. coli BW25113 плазмидой рКТ 1033 [TaoetaL 1989].
Бактерии выращивали на минимальной среде М9 (Na2HPO4 • 12Н2О -15.13 г/л; КН2РО4 - 3 г/л; NH4C1 - 1 г/л; NaCl - 0.5 г/л; MgSO4*7H2O - 0.246 г/л; СаС12 - 0.011 г/л) с добавлением 0.15% глюкозы. За ростом следили путем измерения оптической плотности при длине волны 600 нм (OD^). Клетки ИЗ НОЧНОЙ культуры после центрифугирования переносили в 2 50-мл колбы со 50 мл свежей среды (начальная OD^o^O. 1) и культивировали на шейкере (150 об/мин) при 37°С до OD^^O.4. При достижении ЭТОЙ ПЛОТНОСТИ в культуру ВНОСИЛИ ципрофлоксацин в концентрациях 0 (контроль). 0.3 и 3 мкг/мл и далее выращивали в присутствии антибиотика б течение 2.5 ч.
Удельную скорость роста культуры (ц) рассчитывали по формуле
= 1поЬ^(М-1пОР^^ ?
L-Z1 где 006оо(Г2) и ОВб<|0(6) - оптическая плотность культуры, измеренная при длине волны 600 нм, во время Ь и Л.
Колониеобразующую способность определяли в образцах, отобранных с интервалом в 30 мин. из контрольной культуры и культур, обработанных ципрофлоксацином. После отмывания и приготовления серии разведений в 0.9%-ном растворе NaCl клетки смешивали с расплавленным при 4 2 °C мягким (0.8%) LB-агаром и выливали на чашки Пет- ри, содержащие твёрдый LB-агар (1.5%). Количество образовавшихся колоний (КОЕ) подсчитывали через 24 ч. инкубации в термостате при 37 °C.
В тесте «live-dead» образцы культуры (0.5 мл) отмывали и ресуспендировали в 0.5 мл 0.9%-ном растворе NaCL обрабатывали SYTO9 (10 мкМ) и пропидиум иодилом (PI, 5 мкМ) и в течение 15 мин выдерживали в темноте при комнатной температуре. Каплю (10 мкл) этой суспензии помещали на предметное стекло с 1%-ной агарозой, накрывали покровным стеклом и подсчитывали количество флуоресцирующих клеток при помощи микроскопа Leica DM2 ООО. Для детекции флуоресценции SYTO9 использовали систему’ фильтров 13 (возбуждение 450-490 нм. эмиссия > 515 нм, дихроичное зеркало 510 нм), для детекции флуоресценции PI применялась система фильтров N2.1 (возбуждение 515-560 нм. эмиссиям 590 нм. дихроичное зеркало 580 нм).
Изменения мембранного потенциала исследовали по методу [Wickens et at, 2000]. Для этого бактериальную культуру (180 мкл) смешивали с 20 мкл раствора DiBAQ(3) с концентрацией 100 мкг/мл и выдерживали в темноте при 37°С в течение 10 мин. Затем 10 мкл образца наносили на предметное стекло с 1 %-ной агарозой и исследовали с помощью флуоресцентного микроскопа Leica DM2000 (фильтр-система 13). Общее количество клеток подсчитывали в проходящем свете. Для каждого образца анализировали не менее 800 клеток. Эксперименты проводили 3-6 раз в различные дни.
Активность Р-галактозидазы определяли по методу’ Миллера [Miller. 1972] в штаммах Е* сой NM302L NM3001 и NM3011, несущих генные слияния katG;:lacZ, sodA:;lacZ и suL4(sfiA)::ktcZ. соответственно.
Статистическу ю обр аботку экспери мен-тал ьных данных осуществляли с помощью пакета программ Microsoft Excell и Statistica 6.0, вычисляя среднее значение, стандартную ошибку и доверительный интервал. Каждый результат показан как среднее значение из не менее трех независимых экспериментов ± стандартная ошибка среднего.
Результаты и их обсуждение
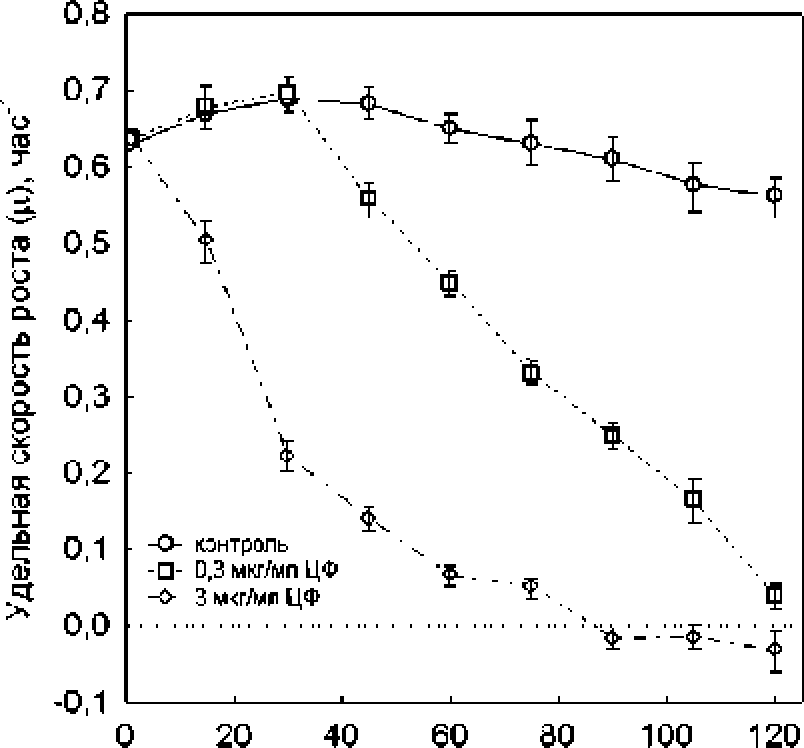
В контрольных культурах удельная скорость роста (ц) была близка к максимальному’ значению на протяжении всего эксперимента и в среднем составляла 0.63 ± 0.02 ч/1 (рис. 1). Добавление ципрофлоксацина сопровождалось торможением роста. которое было более выражено при высокой концентрации антибиотика. В случае обработки 0.3 мкг/мл ципрофлоксацина ц начинала постепенно снижаться через 30 мин. после добавления антибиотика, и через 2 ч. экспозиции скорость роста падала в 16 раз до 0.04 ч.'1. Более высокая доза ципрофлоксацина (3 мкг/мл) вызывала резкое ингибирование роста, и через 80 мин. экспозиции значение ц было близким к нулю.
Время, мин
Рис. L Изменение удельной скорости роста (ц) при действии ципрофлоксацина на бактерии Е* сой BW25113
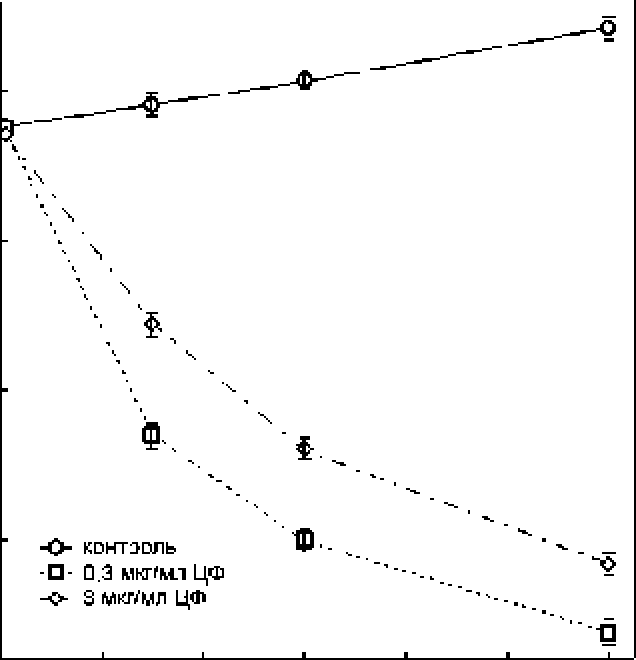
Интересно, что количество КОЕ при разных дозах ципрофлоксацина изменялось противоположным образом по сравнению с удельной скоростью роста: низкая доза антибиотика оказывала в 3 раза более сильный ингибирующий эффект на способность к образованию колоний, чем высокая доза (рис. 2).
0 20 40 60 80 100 120
Время, мин
Рис. 2, Способность бактерий Е. coli BW25113. обработанных ципрофлоксацином, к образованию колоний на агаризованной среде
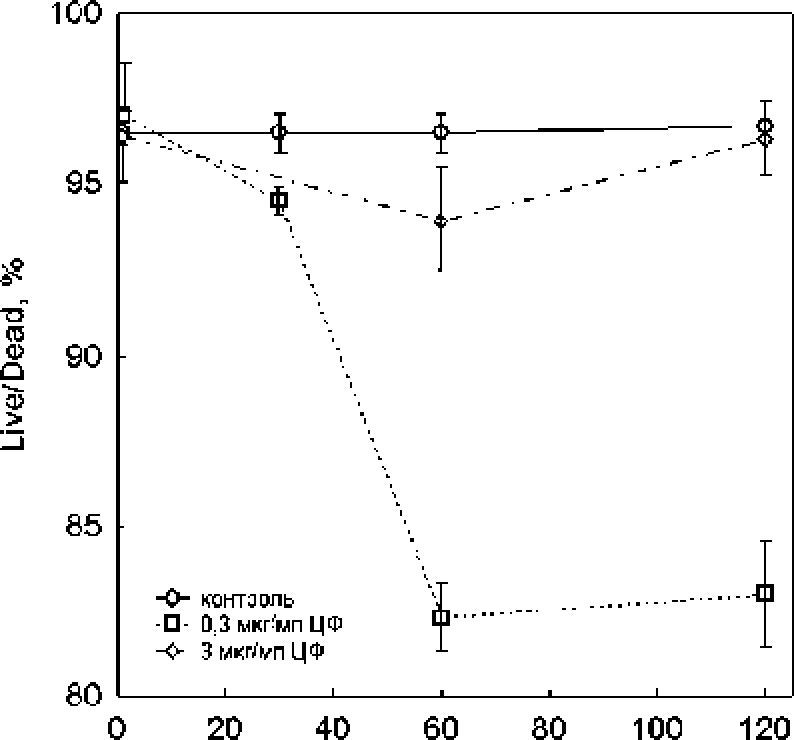
Подобный эффект наблюдался и в тесте «Изе/dead», где бактерицидное действие низкой концентрации ципрофлоксацина было выше, чем высокой (рис. 3). Следует отметить, что, несмотря на определенное соответствие результатов, полеченных в тестах с определением КОЕ и «live/dead», между ними наблюдалась и существенная разница. В частности, только 0.04% клеток в популяции сохраняли способность к образованию колоний через 2 ч. экспозиции к 0.3 мкг/мл ципрофлоксацина, в то время как доля «живых» клеток в тесте «live/dead» составляла 83% от их общего числа. При обработке 3 мкг/мл ципрофлоксацина способность к образованию колоний демонстрировали 0.13% клеток, тогда как в этих же условиях в тесте «live/dead» практически все клетки имели интактные мембраны и не окрашивались пропидиум иодидом. В отличие от колониеобразующей способности и теста «live/dead», в тесте с DiBAC4(3) наблюдалась прямая зависимость числа флуоресцирующих (деполяризованных) клеток от концентрации ципрофлоксацина (рис. 4). Через 2 Ч. инкубации ДОЛЯ клеток, утративших мембранный потенциал, составляла 30% в случае обработки 0.3 мкг/мл ципрофлоксацина и 70% - при обработке 3 мкг/мл этого антибиотика.
Время, мин
Рис. 3, Процент жизнеспособных клеток Е coli BW25 НЗв тесте «live/dead»
Таким образом, определение жизнеспособности бактерий различными методами не дает однозначных результатов. Это может быть связано с тем, что оцениваются разные физиологические параметры клеток. Полеченные данные свидетельствуют о том, что довольно длительное время в течение инкубации с антибиотиком продолжается накопление биомассы, и значительная доля клеток в популяции сохраняет интактные мембраны и поддерживает мембранный потенциал, то есть остаётся метаболически активной. Вместе с тем количество КОЕ начинает снижаться практически сразу после добавления ципрофлоксацина, что может объясняться накоплением повреждений ДНК, препятствующих образованию колоний.
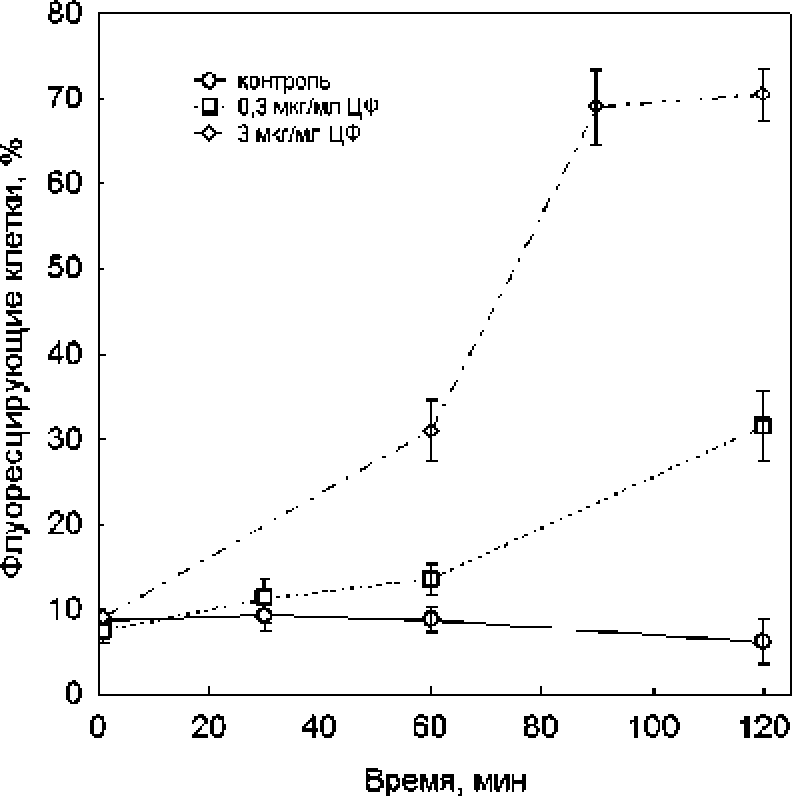
Рис. 4, Доля клеток Е. coll BW25113, окрашенных DiBAC^(3) (утративших мембранный потенциал), от общего числа клеток
Повреждение ДНК различными агентами, в том числе хинолонами, вызывает индукцию SOS-ответа [Piddock, Wise, 1987]. Ген stdA(sfiA) является частью SOS-регул она и кодирует белок Sul А, который взаимодействует с подобным тубулину белком FtsZ. ответственным за процесс деления. Белок Sul А ингибирует активность FtsZ, что приводит к фи ламентации клеток [Trusca et al., 1998]. Мы использовали генное слияние sidA(sjiA)::iacZ для мониторинга SOS-ответа при обработке клеток Е. сой разными концентрациями ципрофлоксацина. Добавление ципрофлоксацина вызывало быструю индукцию активности [S-га лактозидазьк которая была более выражена при низкой дозе антибиотика (рис. 5). За 2.5 ч. экспозиции экспрессия sulA(sfiA)::lacZ возрастала в 12 раз при действии 0.3 мкг/мл ципрофлоксацина и в 3 раза - при обработке клеток 3 мкг/мл этого антибиотика. Полученные результаты могут свидетельствовать о более сильном повреждении ДНК в клетках, сохраняющих высокую скорость роста и поддерживающих нормальный мембранный потенциал при обработке низкой дозой ципрофлоксацина.
Поскольку в аэробных условиях в механизм бактерицидного действия хинолонов могут быть вовлечены активные формы кислорода [Wang et al., 2010], мы проследили за изменениями экспрессии генов kolG и sodA, кодирующих каталазу7 HPI и Мп-супероксиддисмутазу, соответственно. Ген krtfG принадлежит к ретулону, который индуцируется в ответ на пероксидный стресс и контролируется транскрипционным фактором OxyR [Imlay, 2008]. Экспрессия гена sod А повышается в условиях супероксидного стресса под контролем двух-компонентной регуляторной системы SoxRS [Imlay, 2008]. Добавление ципрофлоксацина ингибировало экспрессию обоих генов, причем степень ингибирования повышалась с увеличением концентрации антибиотика (не показано). Снижение индукции антиоксидантных генов может указывать на отсутствие классического окислительного стрес-
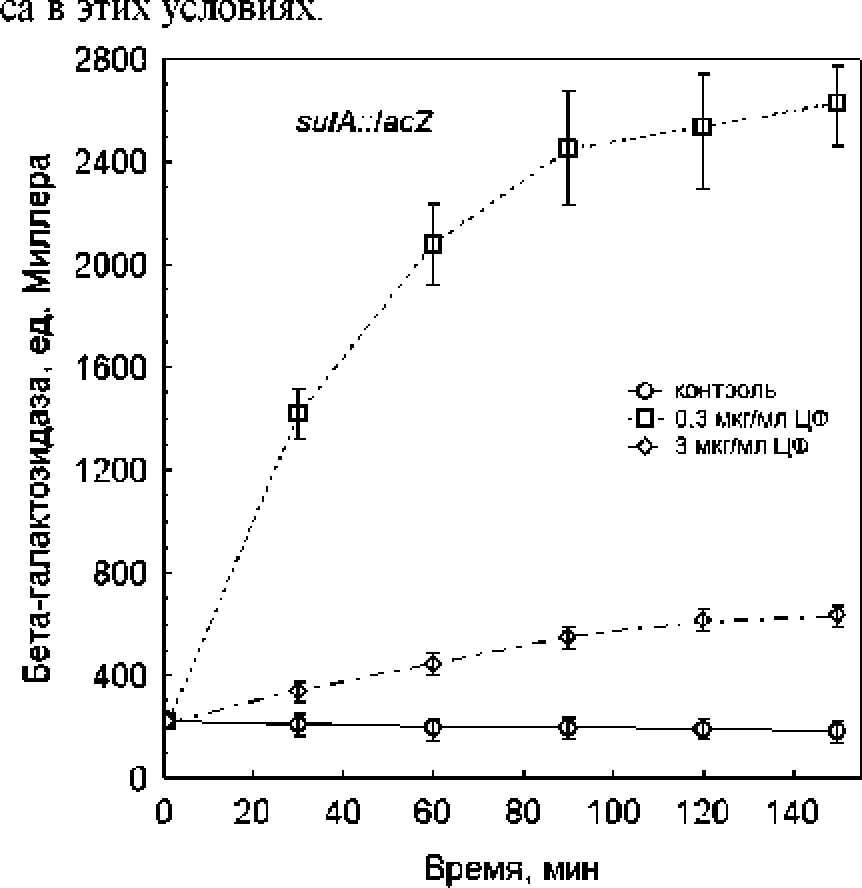
Рис. 5. Изменение экспрессии гена suiA при действии ципрофлоксацина на бактерии
Е. сой NM3011
Парадоксальный эффект. при котором высокие дозы хинолонов обладают меньшей бактерицидной активностью (определяемой по КОЕ), чем низкие, известен уже давно [Lewin, Morrissey, Smith, 1991]. Было показано, что бактерицидное действие хинолонов имеет двухфазный характер: при дозах выше МИК (минимальная ингибирующая концентрация) летальное действие антибиотика возрастает до концентрации, которую называют оптимальной бактерицидной концентрацией (ОБК); при дальнейшем повышении дозы антибиотика его бактерицидная активность падает. Такой двухфазный характер бактерицидной активности хинолонов может быть связан с ингибированием синтеза РНК при концентрациях, превышающих оптимальную бактерицидную концентрацию [Lewinh Morrissey, Smith, 1991], Предполагается, что при концентрациях, превышающих ОБК, ингибирование ДНК-гиразы релаксирует супсрскручснную хромосомную ДНК до такой степени, что она больше не может служить матрицей при транскрипции. Синтез РНК. белка и деление клеток являются обязательными условиями максимальной бактерицидной активности хинолонов [Lewin, Morrissey, Smith, 1991].
В наших экспериментах степень ингибирования колониеобразующей активности при действии ципрофлоксацина прямо коррелировала со значением удельной скорости роста культуры и способностью клеток поддерживать мембранный потенциал в течение периода экспозиции с антибиотиком. Удельная скорость роста является интегральным показа телем метаболической активности клеток. Установлено, что значение ц обратно пропорционально внутриклеточной концентра ции гуанозинтетра -фосфата (ppGpp), который регулирует многие метаболические процессы и ответ клеток на различные стрессовые воздействия, в том числе путем торможения синтеза рибосомальной и транспортной РНК (ppGpp) [Potrykus et al. 2011]. Следовательно, сохранение высокой скорости роста и, соответственно, низкого уровня ppGpp в период экспозиции к ципрофлоксацину должно повышать эффективность бактерицидного действия антибиотика. Бактерии с пониженной метаболической активностью проявляют большую устойчивость к действию ципрофлоксацина.
Заключение
Сравнение различных методов оценки жизнеспособности бактерий Е. сой. обработанных ципрофлоксацином, показало, что результаты, полученные каждым из этих методов, отличаются друг от друга в зависимости от того, что принимается в качество критерия жизнеспособности. Определение удельной скорости роста и способности поддерживать мембранный потенциал позволило установить, что после добавления ципрофлоксацина бактерии длительное время сохраняют метаболическую активность, которая снижается пропорционально концентрации антибиотика. В то же время согласно тесту7 «live-dead», большая часть клеток популяции имела интактные мембраны, что препятствует входу пропид ну м иодида. Вместе с тем количество КОЕ начинало снижаться практически сразу после внесения ципрофлоксацина и имело обратную зависимость от концентрации антибиотика, что хорошо коррелирует со степенью индукции SOS-ответа. Таким образом, использование только одного из методов определения жизнеспособность бактерий при обработке антибиотиками не может дать полной характеристики состояния культуры. С нашей точки зрения, сочетание традиционных методов измерения OD&io- скорости роста и подсчета КОЕ с определением способности клеток поддерживать мембранный потенциал является наиболее предпочтительным, поскольку дает информацию как о метаболической активности клеток, так и об их способности к дальнейшему размножению.
Работа поддержана грантом РФФИ-Урал №13-04-96039 и грантом по программе «Молекулярная и клеточная биология» Российской академии наук.
Список литературы Сравнение методов оценки жизнеспособности бактерий Escherichia coli при действии ципрофлоксацина
- Berney M. et al. Assessment and interpretation of bacterial viability by using the LIVE/DEAD backlight kit in combination with flow cytometry//Appl. Environ. Microbiol. 2007. Vol. 73. P. 3283-3290.
- Drlica K. et al. Quinolone-mediated bacterial death//Antimicrob. Agents Chemother. 2008. Vol. 52. P. 385-392
- Friedberg E.C., Walker G.C., Siede W. DNA repair and mutagenesis. Washington: ASM Press, 1995. P. 407-464
- Imlay J.A. Cellular defenses against superoxide and hydrogen peroxide//Annu. Rev. Biochem. 2008. Vol. 77. P. 755-776
- Jepras R.I. et al. Development of a robust flow cy-tometric assay for determining numbers of viable bacteria//Appl. Environ. Microbiol. 1995. Vol. 61. P. 2696-2701
- Lewin C.S., Morrissey I., Smith J.T. The mode of action of quinolones: the paradox in activity of low and high concentrations and activity in the anaerobic environment//Eur. J. Clin. Microbiol. Infect. Dis. 1991. Vol. 10. P. 240-248
- Miller J.H. Experiments in molecular genetics. Cold Spring Harbor, New York: Cold Spring Harbor Laboratory Press. 1972
- Piddock L.J.V., Wise R. Induction of the SOS response in Escherichia coli by 4-quinolone antimicrobial agents//FEMS Microbiol. Lett. 1987. Vol. 41. P. 289-294
- Potrykus K. et al. ppGpp is the major source of growth rate control in E. coli//Environ. Micro-biol. 2011. Vol. 13. P. 563-575
- Tao K. et al. Molecular cloning and nucleotide sequencing of oxyR, the positive regulatory gene of a regulon for an adaptive response to oxidative stress in Escherichia coli: homologies between OxyR protein and a family of bacterial activator proteins//Mol. Gen. Genet. 1989. Vol. 218. P. 371-376
- Trusca D. et al. Bacterial SOS checkpoint protein SulA inhibits polymerization of purified FtsZ cell division protein//J. Bacteriol. 1998. Vol. 180. P. 3946-3953
- Wang X. et al. Contribution of reactive oxygen species to pathways of quinolone-mediated bacterial cell death//J. Antimicrob. Chemother. 2010. Vol. 65. P. 520-524
- Wickens H.J. et al. Flow cytometric investigation of filamentation, membrane patency and membrane potential in Escherichia coli following ciproflox-acin exposure//Antimicrob. Agents Chemother. 2000. Vol. 44. P. 682-687


