Сравнение методов определения микробной биомассы для оценки биологических свойств почвы
Автор: Савостьянова Анна, Семиколенных Андрей
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Землепользование
Статья в выпуске: 1-8 т.14, 2012 года.
Бесплатный доступ
Для определения биомассы микроорганизмов помимо прямого микроскопического учета применяются различные косвенные химические методы, такие как: субстрат индуцированное дыхание, фумигация парами хлороформа и последующая экстракция, гидролиз флюоресцеин диацетата и другие. В настоящей работе произведено сравнение данных получаемых разными методами при анализе стандартных образцов с известными характеристиками. Установлено, что все методы имеют свои ограничения и позволяют определить не более 15-80% от истинной биомассы, причем бактерии выделяются более полно, а микроскопические грибы в меньшей степени.
Субстрат индуцированное дыхание, фумигация, флюоресцеин диацетат, микробная биомасса, бактерии, грибы, почва
Короткий адрес: https://sciup.org/148201002
IDR: 148201002 | УДК: 631.46
Текст научной статьи Сравнение методов определения микробной биомассы для оценки биологических свойств почвы
Описание и количественная характеристика биологических свойств почвы является важным показателем биогеохимических процессов в окружающей среде. Кроме фундаментальных задач, таких, как описание структуры биотических сообществ и функционирования почвенных систем, данные о биологических свойствах почвы используются для решения большого количества прикладных проблем, например, определения качества сельскохозяйственных почв, антропогенно-нарушенных или конструированных почв и грунтов (плодородные грунты теплиц, грунты газонов, рекультивационные работы и др.).
Методы определения микробной биомассы можно условно разделить на расчетные (пересчет на микробную биомассу данных о количестве выросших учета), косвенные химические, построенные на условном пересчете показателей биологической активности на биомассу (субстрат индуцированное дыхание, различные показатели ферментативной активности) и прямые химические, основанные на разрушении микробных клеток и последующей экстракции всей биомассы или какого-то индикационного компонента (различные методы фумигации-экстракции, выделения ДНК, липидных комплексов, грибного хитина и др.). Косвенные химические методы проще и быстрее, однако, из-за различного качественного состава микробоценозов, отдельные компоненты которого могут иметь
разную биологическую активность, эти данные могут трактоваться только как ориентировочные и приблизительные. Прямые методы точнее, кроме того, их преимущество состоит в том, что реально полученное вещество микробной биомассы может применяться для решения ряда иных задач, например, таких как определение химического или изотопного состава микроорганизмов, радиоуглеродного датирования микробной биомассы и других. Все указанные выше методы существуют в огромном количестве модификаций [2-4, 6]. Неоднократно проводилось их сравнение между собой при обработке одних и тех же проб почв [3, 4]. В настоящей работе мы предприняли попытку сравнения нескольких методов с использованием специально созданных модельных образцов с известными исходными характеристиками.
Объекты и методы. Для приготовления модельных образцов использовали известное количество стерильного субстрата и культуры. В качестве субстратов были использованы дополнительно измельченные до фракции крупной и мелкой пыли: кварцевый песок и вермикулит. В качестве культур микроорганизмов использовали штаммы из коллекции кафедры биологии почв факультета почвоведения МГУ: бактерии: Pseudomonas sp., Rhodococcus sp. и Micrococcus sp., мицелиальные грибы Fusarium sp. и Ku-ehneromyces mutabilis и неидентифицированный штамм дрожжей. Биомасса была получена осаждением суспензий (центрифугирование 2500 об/мин) организмов, полученных в накопительной жидкой культуре при встряхивании 120 об/мин. на 5-7 сутки. Использовались среды:
глюкозо-пептон-дрожжевой бульон (10 г/л) для бактерий и среда Чапека (глюкоза 10 г/л) для грибов. Для приготовления образца брали соотношение на 1 г субстрата 1 мл концентрированной суспензии. Биомасса организмов определялась взвешиванием сухой аликвоты суспензии (высушивание при 105°С, 6 часов). Для перехода от веса к содержанию углерода в микробной биомассе исходили из его содержания 50%. Также в опыте использовались образцы природных черноземов выщелоченных, отобранных в Тульской области Щелковском районе.
Для всех образцов проводился также прямой микроскопический учет бактерий и мицелия грибов с использованием камеры Гаряева. Дополнительно численность бактерий в природных почвах определялась методом учета колоний после посева разведений суспензий почв на глю-козо-пептон-дрожжевой агар. Для всех методов применяли парную повторность, при отсутствии отклонений более чем на 10% вычисляли простое среднее.
Субстрат-индуцированное дыхание (СИД) . Метод основан на наблюдении за непрерывном выделением СО 2 после внесения в образец раствора глюкозы. В модификации Бека вносится 400 или 800 мг глюкозы на 100 г для пахотных и лесных почв эквивалента абсолютно сухой почвы соответственно [3]. Мы проводили измерение следующим образом. Во флаконы объемом 125150 мл с герметичными резиновыми крышками помещалось по 5 г свежей почвы. Во флакон вносится раствор глюкозы из расчета 400 мг глюкозы на 100 г почвы (на 5 г – 0,5 мл рабочего раствора содержащего 40 мг/мл). Из флаконов отбирались шприцом газовые пробы с интервалом в 15 минут в течение 2 часов. Содержание СО 2 определялось на анализаторе с инфракрасным оптическим датчиком. Результаты могут быть пересчитаны на биомассу C микробный (мг С на 1 г почвы) умножением СИД в мг С-СО 2 /1 г х 1 час на коэффециент 30 [4] или 50,4 [6].
Гидролиз флюоресцеин диацетата (ФДА). Метод основан на способности ферментных комплексов эстераз микроорганизмов осуществлять гидролиз бесцветного реактива флюоресце-ин диацетата с образованием ярко окрашенного флюоресцеина [5]. Определение выполняли в следующей модификации. К 5 г свежего образца прибавляли 25 мл дистиллированной воды и по 5 капель (0,15 мл) рабочего раствора ФДА в ацетоне (для достижения концентрации в пробе 100 мкг ФДА на 1 мл суспензии). Флаконы закрывали крышками и инкубировали при температуре 24 градуса 4 часа при периодическом однократном взбалтывании раз в час. После инкубации суспензию фильтровали, аликвоту фильтрата помещали в плаcтиковые кюветы и фотоколори-метрировали при длине волны 470 нм (490 нм по [5]). Контрольный раствор – 0,15 мл рабочего раствора ФДА в стерильной дистиллированной воде.
Метод фумигации-экстракции. Метод предполагает обработку образцов почв парами хлороформа, в результате которой происходит лизис микробных клеток, приводящий к образованию дополнительного количества органических соединений углерода и азота, переходящих в раствор экстрагента [2]. Оценка содержания C и N микробной биомассы проводится по разности концентраций C и общего N в фугированном и исходном образцах. В качестве экстрагента может использоваться K 2 SO 4 или KCl в концентрации 0,5 М [3], однако было показано, что снижение молярности экстрагента в 10 раз не влияет существенно на эффективность экстракции [1]. В настоящей работе использовали фумигацию образцов парами хлороформа без этанола в темноте в течение 5 суток и последующую экстракцию 0,05 М раствором K 2 SO 4 . Экстракция поводилась для контрольной (не фумигирован-ной) и фумигированной части пробы. Определение содержания C и N в растворах проводили на автоматическом анализаторе Elementar Vario EL III. Содержание микробного углерода находили по разнице проб. В работах Бека [3] был предложен поправочный коэффициент показывающий полноту экстракции углерода из почв 0,45. В наших расчетах коэффициент не использовали.
Результаты. Полученные результаты рассчитанной микробной биомассы для модельных образцов с культурами микроорганизмов в субстрате приведены в таблице 1.
Таблица 1. Сравнительные данные микробной биомассы определенной различными методами (абсолютно сухой вес, С микробное мг).
|
Состав |
Исходная биомасса |
Фумигация экстракция |
Гидролиз ФДА |
СИД |
|
Fusarium + вермикулит |
1,57 |
0,27 |
12,5 |
0,37 |
|
дрожжи + песок |
25,1 |
14,4 |
2,5 |
0,15 |
|
Rhodococcus + песок |
3,22 |
2,47 |
4,1 |
5,51 |
|
Micrococcus + песок |
2,45 |
2,53 |
не опр. |
3,88 |
|
Kuehneromyces mutabi-lis + песок |
243 |
75,2 |
более 50 |
12,74 |
Дополнительно был построен калибровочный график для метода гидролиза ФДА. Для этого определялась численность не мицелиальных микроорганизмов и готовились разведения пробы с различной численностью. Измерение оптической плотности проводилось в два временных срока 4 и 16 часов. Результаты представлены на рис. 1. Сравнительные результаты для образцов природных почв, где численность и биомасса определялась различными методами, приведены в таблице 2.
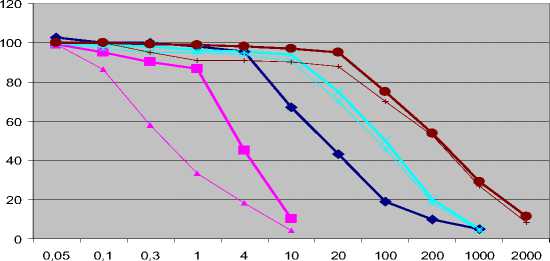
Pseudomonas, 4 часа дрожжи, 4 часа дрожжи, 16 часов Rhodococcus, 4 часа Rodococcus, 16 часов Micrococcus, 4 часа Micrococcus, 16 часов численность, *10(6)
Рис. 1. График зависимости оптической плотности раствора флюоресцеина (вертикальная ось) от численности микроорганизмов, определяемых методом гидролиза флюоресцеин диацетата
Таблица 2. Сравнительные данные о численности и биомассе микроорганизмов в природных почвах (выщелоченный чернозем) определенные различными методами.
|
Образец |
Численность и биомасса по данным посева и прямого учета |
Фумигация-экстракция, мг С , микроб. |
СИД, мг с . мик роб. **** |
|||
|
бактерии, КОЕ* на 1 г почвы, 10 9 |
биомасса, мг/1 г |
** |
*** |
|||
|
мицелия |
спор |
|||||
|
разрез 1, 0-5 см |
0,9 |
9,1 |
2,66 |
0,380 |
0,520 |
4,23 |
|
разрез 1, 40-50 см |
1,2 |
0,39 |
0,15 |
0,118 |
0,144 |
0,04 |
|
разрез 2, 0-10 см |
6 |
0,49 |
0,54 |
0,212 |
0,360 |
0,54 |
|
разрез 2, 40-50 см |
2,2 |
0,35 |
0,19 |
0,118 |
0,205 |
0,12 |
Примечания: * - колонии образующих единиц, ** - раздельное определение в экстракте фумигированной и не фумигированной пробе, *** - последовательное определение, когда после первой экстракции проба подсушивалась, ставилась на фумигацию и затем повторно экстрагировалась, **** - использовали поправочный коэффициент 50,4 [3].
Обсуждение. Сравнение различных методов определения микробной биомассы в модельных образцах с известными параметрами показало, что метод фумигации-экстракции позволяет определить биомассу микроорганизмов точнее в сравнении с другими методами (субстрат-индуцированного дыхания и гидролиза флюо-ресцеин диацетата). Полнота выделения этим методом для бактерий составила от 77 до 100%, для дрожжей 56%, и существенно меньше для мицелиальных грибов – 18-30%. Субстрат индуцированное дыхание и гидролиз ФДА дают несколько завышенные данные для бактерий и существенно заниженные данные для грибов. Бактерии реагируют на гидролиз ФДА в целом более чувствительно, чем грибы, наименьшая активность получена для дрожжей. По графику на рис. 1 хорошо видно, что интенсивность гидролиза ФДА отличается в начальной стадии (особенно у грибов наблюдается запаздывание), но затем через несколько часов достигает стабильных значений и изменяется мало, однако метод гидролиза ФДА крайне чувствителен к видовому составу организмов.
Сопоставление методов определения биомассы для природных образцов показало, что метод фумигации-экстракции показало, что дает более адекватные данные для бедных почв и заниженные данные для верхнего горизонта, богатого преимущественно грибами. Данные СИД оказались ближе по значениям для образца содержащего много мицелия. Качественные соотношения образцов между собой по принципу «больше-меньше» оказались одинаковыми для всех использованных методов.
Выводы: практически проанализированные методы определения микробной биомассы имеют системные ошибки и могут давать отклонения в 2-4 раза от истинных значений, а в ряде случаев и более. Наибольшую ошибку в результат может вносить качественный состав микробного сообщества, в частности доля микроскопических грибов, которые при существенном вкладе в биомассу имеют показатели биохимической активности ниже, чем бактерии. При использовании метода фумигации-экстракции для количественного выделения микробного углерода из почв следует учитывать, что в действительности извлекается только часть микробного углерода (в случае с мицелиальными грибами по нашим данным только 18%).
Работы выполнялись при поддержке гранта РФФИ 12-04-01786.
Список литературы Сравнение методов определения микробной биомассы для оценки биологических свойств почвы
- Макаров, М.И. Растворимость лабильных форм углерода и азота почв в K2SO4/М.И. Макаров, М.С. Шулева, Т.И. Малышева, О.В. Меняйло//Почвоведение. 2012. В печати.
- Anderson, J.P.E. A physiological method for the quantitative measurement of microbial biomass in soil/J.P.E. Anderson, K.H. Domsch//Soil Biol. Biochem., 1978. N10. P. 215-221.
- Beck, T. An inter-laboratory comparison of ten different ways of measuring soil microbial biomass C/T. Beck, G. Joergensen, E. Kandeler et al.//Soil Biology and Biochemistry. 1997. N29(7). P. 1023-1032.
- Kaiser, E.A. Evaluation of methods to estimate the soil microbial biomass estimations and the relationship with soil texture and organic matter/E.A. Kaiser, T. Mueller, R.G. Joergensen et al.//Soil Biology & Biochemistry. 1992. N24. P. 675-683.
- Schnurer, J. Fluorescein Diacetate Hydrolysis as a Measure of Total Microbial Activity in Soil and Litter/J. Schnurer, T. Rosswall//Applied and Environmental Microbiology. June 1982. P. 1256-1261.
- Sparling, G.P. The substrate induced respiration method//In K. Alef and P. Nannipieri (ed.), Methods in applied soil microbiology and biochemistry. -Academic Press, London, United Kingdom, 1995. P. 397-404.


