Сравнение мезенхимальных стромальных клеток костного мозга и региональных стволовых клеток сердца и фибробластов кожи человека
Автор: Павлова Софья Викторовна, Сергеевичев Д.С., Чепелева Е.В., Козырева В.С., Малахова А.А., Захарова И.С., Григорьева Е.В., Покушалов Е.А., Закиян С.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4-2 т.19, 2015 года.
Бесплатный доступ
Характерный маркер кардиальных стволовых клеток - тиразинкиназный рецептор c-kit. Клетки с фенотипом c-kit+ легко выделяются и культивируются in vitro. Однако истинным кардиомиогенным потенциалом обладают только кардиальные стволовые клетки, полученные из сердца постнатальных животных. Исследователи предполагают две популяции c-kit+ клеток в сердце различного происхождения в эмбриогенезе. Клетки c-kit+, способные дифференцироваться в кардиомиоциты, происходят из клеток первичного кардиального поля и исчезают вскоре после рождения, а те, что имеют проэпикардиальное происхождение, экспрессируют мезенхимальные маркеры и способны к дифференцировке в эндотелиальном, муральном и фибробластном направлениях. Ранее мы описали c-kit+ клетки, выделенные из фрагментов ушка правого предсердия, и исследовали их ангиогенный потенциал in vitro. В этом исследовании мы сравнили поверхностные маркеры мезенхимальных стволовых клеток костного мозга, кардиальных стволовых клеток и фибробластов кожи человека методом проточной цитометрии и полимеразной цепной реакции с обратной транскрипцией. Показали, что культура кардиальных стволовых клеток человека, полученная в результате магнитного сортинга с помощью антител на c-kit-рецептор является гетерогенной. В ней присутствуют клетки, несущие характерный набор поверхностных маркеров мезенхимальных стволовых клеток костного мозга, эндотелиальных и муральных клеток. Иммунофенотип фибробластов кожи также представлен характерным набором маркеров мезенхимальных стволовых клеток, за исключением дополнительного маркера CD10, соответствующего эластазе, нейтральной пептидазе. Кроме того, фибробласты кожи дифференцируются в остеогенном и адипогенном направлениях при использовании индукционных сред. Таким образом, фибробласты кожи человека, полученные согласно стандартным протоколам, являются мезенхимальными стволовыми клетками кожи. В соответствии с иммунофенотипом мезенхимальные стволовые клетки костного мозга, кардиальные стволовые клетки и фибробласты кожи экспрессируют гены паракринных факторов HGF, VEGF, PDGFb, ANG1, ANG2, IGF1, TGFb, обладающих кардиопротекторным и ангиогенным эффектами.
Кардиальные стволовые клетки, мезенхимальные стволовые клетки, регенерация миокарда
Короткий адрес: https://sciup.org/142140864
IDR: 142140864
Текст научной статьи Сравнение мезенхимальных стромальных клеток костного мозга и региональных стволовых клеток сердца и фибробластов кожи человека
ки данного органа, и нерегиональные – привносимые из других органов. К нерегиональным стволовым клеткам относятся прежде всего стволовые клетки костного мозга. В составе костного мозга выделяют три вида стволовых клеток: гемопоэтические стволовые, эндотелиальные прогениторные и мезенхимальные стволовые клетки (МСК). Гемопоэтические стволовые клетки (CD34+, CD45+, c-kit+) являются родоначальниками форменных элементов крови. Эндотелиальные прогени-торные клетки (мононуклеары, CD34+) унипотентны, дифференцируются только в клетки эндотелия сосудов, могут мигрировать в очаг повреждения и способствовать неоангиогенезу. МСК (CD34–, CD45–, CD13+, CD29+, CD44+, CD73+, CD90+, CD105+) выделяются из костного мозга и обладают наибольшим потенциалом к дифференцировке в соматические клетки различных типов. В 2003 г. исследователи предположили, что, помимо гемопоэтических стволовых клеток, c-kit-рецептор может характеризовать и другие прогениторные клетки, например кардиальные стволовые. В сердце грызунов выявляются клетки c-kit+ Nkx2.5+, GATA4+, CD34–, CD45–, которые способны дифференцироваться в кар-диомиогенном, эндотелиальном, муральном направлениях [1–5]. Таким образом, эти клетки подходили на роль резидентных кардиальных стволовых клеток (КСК). Дальнейшее изучение КСК привело к противоречивым результатам. С одной стороны, c-kit-позитивные клетки в эмбриогенезе выявляются в составе первого кардиального поля (primary heart field, PHFs) и необходимы для нормального эмбрионального развития сердца [6, 7]. При культивировании in vitro КСК способны индуцироваться в кардиальном направлении и экспрессировать гены Nkx2.5 и TropT [4]. С другой стороны, в генетических экспериментах по наблюдению за c-kit-позитивны-ми клетками кардиомиогенные потомки выявлялись на низком и несущественном для развития или регенерации миокарда уровне. Потомки c-kit-клеток обнаруживались среди эндотелиальных, муральных и интерстициальных клеток сердца [8]. Клетки c-kit+, выделенные из взрослых сердец, обладают фибробластной морфологией и имеют ряд маркеров, характерных для МСК. Многочисленные эксперименты по трансплантации аутологичных КСК в зону ишемии у разных видов животных показали, что КСК преимущественно оказывают паракринный эффект, стимулируют ангиогенез и не дифференцируются в кардиомиоциты in vivo [3, 9]. Следовательно, c-kit+ кардиальные клетки взрослых организмов могут представлять популяцию резидентных мезенхимальных стволовых клеток, поэтому в данной работе сравненили c-kit+ кардиальные клетки с другими доступными типами мезенхи- мальных клеток – мезенхимальными стромальными клетками костного мозга (МСК КМ) и фибробластами кожи (ФК) человека.
Материал и методы
Выделение мезенхимальныхстромальных клеток из костного мозга
Мезенхимальные стромальные клетки получали из костного мозга здорового донора после подписания информированного согласия [5]. Мононукле-арную фракцию клеток костного мозга выявляли методом центрифугирования на градиенте плотности с использованием реагента LymphoLyte (Cedarlane, Канада), затем проводили двукратную отмывку клеточной суспензии раствором ФБД. Далее клетки высаживали в культуральные флаконы Т-25 в 10 мл среды Mesencult XF (StemCell, Канада) с концентрацией 105 клеток/мл. На третьи сутки культивирования в СО2-инкубаторе в атмосфере 5% углекислоты в культуральных флаконах полностью заменяли среду Mesencult XF. В дальнейшем каждые 3–4 дня заменяли только половину объема среды. При достижении 80% конф-люэнтности производили пассаж клеток, для чего использовали MesenCult-ACF Dissociation Kit (StemCell, Канада). После второго пассажа клетки пересаживали во флаконы Т-175 в 40 мл питательной среды DMEM (Sigma, США), содержащей 10% фетальной телячьей сыворотки (StemCell, Канада), 2 мМ L-глутамина и 60 мкг гентамицина. После пятого пассажа проводили им-мунофенотипирование клеток с помощью проточного цитофлюориметра Navios (Beckman Coulter, США).
Выделение кардиальных стволовых клеток
Культуры клеток сердца человека выявляли из послеоперационного материала, предоставленного в ФГБУ «HНИИПК им. акад. Е.Н. Мешалкина» Минздрава России, по описанным методикам [4, 10–12]. Полученные фрагменты сердца измельчали механически до кусочков размером 1–3 мм3 и проводили ферментативный гидролиз кусочков в растворе 0,1% трипсина и 0,1% коллагеназы IV (3 раза по 10 мин при 37 °С). Затем клетки и фрагменты ткани высаживали на пластик, обработанный желатином, в ростовой среде СЕМ (Iscove's Modified Dulbecco's Medium, IMDM; GIBCO), 10% эмбриональной бычьей сыворотки (FBS, fetal bovine serum; HyClone, Logan, UT), 100 Ед/мл пенициллина (GIBCO), 100 Ед/мл стрептомициана (GIBCO), 2 ммоль/л L-глутамина (Invitrogen), 0,1 ммоль/л 2-меркаптоэтанола (GIBCO).
|
Праймеры, использованные в анализе экспрессии генов полимеразной цепной реакцией с обратной транскрипцией |
||
|
Ген |
Структура праймера |
Размер продукта, п. о. |
|
GAPDH |
5’ TGTTGCCATCAATGACCCCTT 3’ 5’ CTCCACGACGTACTCAGCG 3’ |
201 |
|
HGF |
5’ TCACGAGCATGACATGACTCC 3’ 5’ AGCTTACTTGCATCTGGTTCC 3’ |
300 |
|
VEGF |
5’ ATGAACTTTCTGCTGTCTTGGGT 3’ 5’ TGGCCTTGGTGAGGTTTGATCC 3’ |
323 |
|
PDGFb |
5’ GATCCGCTCCTTTGATGATC 3’5’ GTCTCACACTTGCATGCCAG 3’ |
434 |
|
VWF |
5’GCAAACAGTGGTAAGAGGAGGAC 3’5’AGGCAGCTCCACTCGGCACAT 3’ |
590 |
|
Nestin |
5’ AGAGGGGAATTCCTGGAG 3’5’ CTGAGGACCAGGACTCTCTA 3’ |
410 |
|
VE-cadher |
5’ GCCAACATCACAGTCAAG 3’5’ GCCATATCCTCGCAGAAG 3’ |
173 |
|
CD31 |
5’ GAAGTTGGCTGGAGGTGCTC 3’5’ GCTGTTGGTGGAAGGAGTGC 3’ |
700 |
|
PDGFRb |
5’ CAGTAAGGAGGACTTCCTGGAG 3’5’ CCTGAGAGATCTGTGGTTCCAG 3’ |
178 |
|
A-sma |
5’ CACTGCCTTGGTGTGTGACAAT 3’5’ CGTAGCTGTCTTTTTGTCCCATTC 3’ |
145 |
|
KDR1 |
5’CCTCTACTCCAGTAAACCTGATTGGG3’ 5’TGTTCCCAGCATTTCACACTATGG3’ |
219 |
|
Ang1 |
5’ GCCTACACTTTCATTCTTCCAGA 3’ 5’ TCTTCCTTGTGTTTTCCTTCCAT 3’ |
500 |
|
Ang2 |
5’ TTATCACAGCACCAGCAAGC 3’ 5’ CGCGAGAACAAATGTGAGAA 3’ |
220 |
|
NG2 |
5’ ACACTGACAGACAGTTTTGTCCT 3’ 5’ ATGGTGTAGACCAGATCCTCAGA 3’ |
224 |
|
IGF1 |
5’ CCTCAGACAGGCATCGTGGAT 3’ 5’ GCACTCCCTCTACTTGCGTTCTT 3’ |
179 |
|
IGF2 |
5’GACACCCTCCAGTTCGTCTGTG 3’ 5’ ACACGTCCCTCTCGGACTTG 3’ |
169 |
|
Tie2 |
5’ TACTAATGAAGAAATGACCCTGG 3’ 5’ GGAGTGTGTAATGTTGGAAATCT 3’ |
826 |
|
cMET |
5’ CCCCGAGCGCTTTGTGAGCA 3’ 5’ AAGTCAGCGGCGCAAGGACC 3’ |
128 |
|
SFRP1 |
5' CGTCTGCATCGCCATGAC 3’ 5’ GATGGCCTCCGATTTCAACTC 3’ |
110 |
|
c-kit |
5’ GCGTGGGCGACGAGATTAGGCTG 3’ 5’ CATGATGCCCGCCTTGGGGTCAG 3’ |
368 |
|
TGFB1 |
5’ TGGTGGAAACCCACAACGAA 3’, 5’ AGAAGTTGGCATGGTAGCCC 3’ |
630 |
|
OPN |
5’ GGTGATGTCCTCGTCTGTA 3’ 5’ CCAAGTAAGTCCAACGAAAG 3’ |
320 |
Метод магнитно-активируемой клеточной сортировки (MACS)
Сортировку кардиальных культур клеток на маркер c-kit (CD117) проводили с помощью набора CD117 MicroBead Kit (Miltenyi Biotec) по предложенной фирмой методике. Культуру клеток диссоциировали диспазой (1 мг/мл, STEMCELL Technologies), инкубировали с антителами на CD117, коньюгированными с магнитными частицами (Miltenyi Biotec) в фосфатном буфере с добавлением 0,5% БСА и 0,2 мМ ЭДТА 15 мин при 4 °С, периодически перемешивая встряхиванием пробирки. Затем клетки дважды промывали, ресуспендировали в 1 мл того же буфера и наносили на магнитную колонку (Miltenyi Biotec), помещенную в магнитное поле. После трехкратной промывки колонку выносили из магнитного поля и при помощи поршня вымывали связавшиеся с антителами клетки. Для повышения процента c-kit-позитивных клеток в сортированной культуре, в соответствии с рекомендацией производителя, полученную фракцию клеток вторично наносили на новую колонку и повторяли процедуру сортировки. Отсортированные клетки высевали на культуральный пластик в среду CEM и в течение 2–3 пассажей наращивали до получения клеток, достаточных для дальнейшего анализа.
Получение культуры фибробластов кожи
Фибробласты кожи человека получали из биоптата здорового донора после подписания информированного согласия по стандартным протоколам [13]. Кусочки биоптата транспортировали в среде 95% DMEM, 5% FBS, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина. Промывали в буфере DPBS, измельчали биоптат хирургическим скальпелем до 0,5–1,0 мм3 в небольшом количестве ростовой среды. Переносили на чашки Петри, обработанные 0,1% раствором желатина 10–15 мин при комнатной температуре, и добавляли ростовую среду 700–800 мкл на 10 см2. Культивировали кусочки биоптата в минимальном количестве среды для их прикрепления к поверхности пластика 2–5 суток, ежедневно подкапывая свежей среды, после прикрепления доводили объем среды до 1,5–2,0 мл. Среда для культивирования фибробластов содержала DMEM 10% эмбриональной бычьей сыворотки (FВS, Invitrogen), 1х раствор несущественных аминокислот (NEAA), 1 мМ раствора пирувата натрия, 1 мМ L-глута-
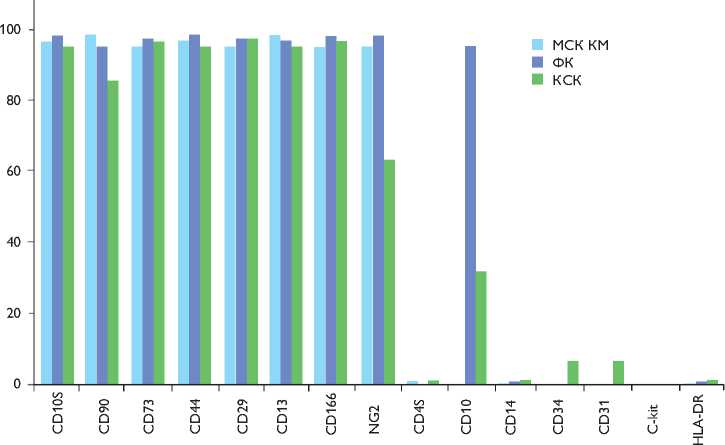
Рис. 1. Анализ иммунофенотипа клеток, полученных из биоптатов костного мозга (мезенхимальные стромальные клетки костного мозга, МСК КМ), сердца (кардиальные стволовые клетки, КСК) и кожи человека (фибробласты кожи, ФК)
мина, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина (Invitrogen).
Дифференцировка в остеогенном и адипогенном направлениях
Дифференцировку клеток проводили по стандартным протоколам с минорными модификациями. Для остеогенной дифференцировки клетки инкубировали в стандартной среде с добавлением 5х10–7 М дексаметазона, 10 мМ β -глицерофосфата натрия и 50 мкг/мл аскорбиновой кислоты (Sigma, США). Для адипогенной дифференцировки клетки инкубировали в стандартной среде с добавлением 5х10–6 М дексаметазона, 1 0 мг/мл инсулина и 0,5 мМ изобутилметилксантина (Sigma, США). Результаты адипогенной дифференцировки выявляли гистохимическим окрашиванием клеток Oil-red-O (Sigma). Индукцию в остеогенном направлении выявляли методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) по наличию экспрессии гена осте-опонтина (OPN) .
Анализ клеток методом проточной цитофлюорометрии
Культуры клеток анализировали на цитофлюори-метре Navios (Beckman Coulter, США) и проточном цитометре FACS CantoII (BectonDickinson, США). Исследовали мембранную экспрессию маркеров CD73
(Becton Dickinson, США) и CD13, CD14, CD29, CD34, CD44, CD45, CD90, CD105, CD166, HLA-DR (Beckman Coulter, США), CD31, NG2 (eBioscience), CD117 (# 130-091-733, Miltenyi Biotec). Пробоподготовку и анализ клеточного материала проводили согласно рекомендациям производителей.
Анализ культур методом полимеразной цепной реакции с обратной транскрипцией
Рибонуклеиновую кислоту (РНК) выделяли из культур клеток при помощи TRI Reagent (Sigma) по инструкции производителя. Для очистки образцов РНК от контаминации дезоксирибонуклеиновой кислоты (ДНК) использовали набор реагентов TURBO DNA-free (Ambion). Синтез кДНК проводили при помощи обратной транскриптазы SuperScript (Promega). ПЦР осуществляли на амплификаторе Biometra TRIO-Thermoblock по стандартному протоколу, используя специфические праймеры ( таблица ). Полученные фрагменты ДНК анализировали методом гель-электрофореза.
Результаты
Методом проточной цитометрии проанализировали поверхностные маркеры клеток МСК КМ (3 образца), КСК (полученных в результате c-kit+ MACS первичной кардиальной культуры, 3 образца) и фибробластов кожи
аб в
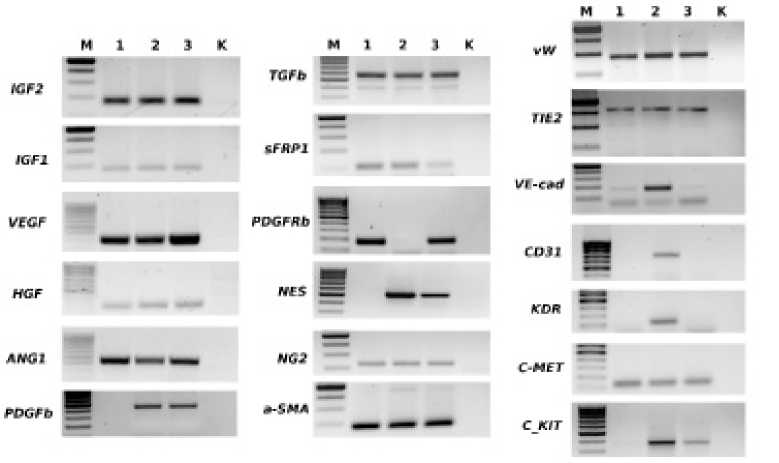
Рис. 2. Результаты ОТ-ПЦР-анализа экспрессии генов культур клеток: а – мезенхимальные стромальные клетки костного мозга (МСК КМ); б – кардиальные стволовые клетки (КСК); в – фибробласты кожи (ФК). К – отрицательный контроль; М – маркер молекулярного веса
человека (3 образца) на 3–7 пассажах культивирования после выделения (рис. 1). Культуры всех типов представлены клетками, несущими на мембранах маркеры мезенхимальных стромальных клеток – CD166, CD105, CD73, CD44, CD29, CD13 (95–98% клеток). Для МСК КМ и ФК маркер СD90 присутствовал у 95–99% клеток, а в культуре КСК отмечено 86±2% СD90-позитивных клеток. В культурах мезенхимальных стромальных клеток, кардиальных стволовых клеток и фибробластов кожи не выявляются маркеры гемопоэтической линии CD45 и CD14 (<1%), а также HLA-DR (<1%). Отличие между клетками популяций МСК-КМ, КСК и ФК обнаружено на уровне маркера CD10, который присутствует у 97,5±1,3% клеток ФК, в популяции МСК КМ он представлен менее чем у 10% клеток и выявляется в 32,3±1,2% КСК. CD10 идентифицирует поверхностную нейтральную эндопептидазу (Zn-зависимая металлопротеиназа, неприлизин) и является общим маркером лимфоидных предшественников. Вне лимфоидной системы CD10 экспрессируется на многих стромальных и эпителиальных клетках, в фибробластах кожи соответствует белку-эластазе [14]. Как было показано, характерным маркером МСК является NG2 протеогликан (neuron-glial antigen 2) [15, 16], который экспрессируется в 99% клеток МСК КМ и ФК, тогда как в культуре КСК он выявляется только в
65±3% клеток. Следовательно, культура КСК является достаточно гетерогенной по наличию позитивных/нега-тивных клеток с фенотипом CD90, CD10, NG2. Также в популяции КСК встречаются маркеры эндотелиальных клеток CD34 (5,2±1,4%) и CD31 (5,4±1,6%). Рецептор c-kit (CD117) не выявляется методом проточной цитометрии (antiCD117 (A3C6E3)-APC (# 130-091-733, Miltenyi Biotec)) ни в одной популяции клеток, даже в c-kit-сортированных КСК. Возможно, что в процессе культивирования происходит дифференцировка КСК в эндотелиальном и/или муральном направлении. Хотя ген c-kit экспрессируется в КСК и фибробластах кожи, что показано методом ОТ-ПЦР (рис. 2). Также с помощью ОТ-ПЦР показана экспрессия генов ростовых и паракринных факторов (и их рецепторов) VEGF, HGF (c-MET), ANG1 (Tie2), IGF1, IGF2, TGFb и SFRP1 в культурах МСК КМ, КСК и фибробластов кожи. В отличие от КСК и ФК в МСК КМ не выявлена экспрессия фактора PDGFb, хотя его рецептор PDGFRb экспрессируется как в МСК КМ, так и ФК. Маркеры, характерные для эндотелиальных клеток, VEGFR2 (KDR) и CD31 выявляются только в культурах КСК. В то же время экспрессия генов фактора фон Виллебранда (и белка межклеточной адгезии VE-cadherin, как и маркеров перицитов NG2 и a-SMA, выявляется во всех исследуемых культурах. Маркер пери-
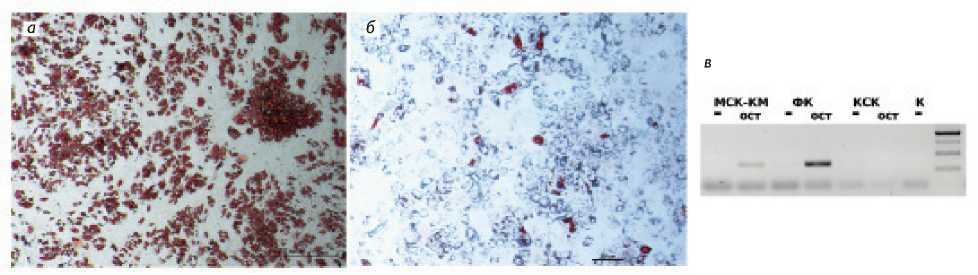
Рис. 3. Адипогенной дифференцировка: а – мезенхимальные стромальные клетки костного мозга; б – фибробласты кожи, окрашивание клеток Oil-red-O (Sigma); в – ОТ-ПЦР-анализ экспрессии гена OPN в культурах мезенхимальных стромальных клетках костного мозга (МСК КМ), кардиальных стволовых клеток (КСК) и фибробластов кожи (ФК), индуцированных в остеогенном направлении. Клетки, культивированные на стандартной ростовой среде (–); клетки, культивированные в остеогенной среде (ост.)
цитов и нейральных клеток Nestin экспрессируется только в КСК и фибробластах кожи.
Мы провели индукцию адипогенной и остеогенной дифференцировки культур МСК КМ, КСК и ФК. Методом гистологического окрашивания Oil-red-O показано, что в культурах МСК КМ и ФК через 2 недели выявляются клетки, содержащие гранулы жира (рис. 3, а, б ). В отличие от МСК КМ не все клетки ФК дифференцируются в адипоциты. Результаты остеогенной дифференцировки мы наблюдали по индукции экспрессии гена остеопонтина в культурах МСК КМ и ФК (рис. 3, в ). Для культуры КСК дифференцировку в ади-погенном и остеогенном направлениях нам показать не удалось, хотя данные некоторых исследованиях свидетельствуют о такой возможности [3].
Обсуждение
Природа, особенности и потенциальные возможности c-kit+ кардиальных клеток до сих пор являются предметом обсуждения: какую роль они играют в регенерации поврежденного миокарда, могут ли являться предшественниками кардиомиоцитов? По всей видимости, карди-омиогенным потенциалом обладают c-kit+ эмбриональные клетки первичного кардиального поля, которые исчезают в первые дни после рождения. Другая популяция c-kit+ клеток выявляется во взрослом сердце и способна дифференцироваться в эндотелиальном, муральном и фибробластном направлениях [3]. В нашем исследовании, как и в работах других авторов [3, 12], c-kit+ клетки, полученные из сердца взрослого организма, экспрессируют мезенхи- мальные маркеры, характерные для МСК КМ. Также мы обнаружили, что на ранних пассажах в популяции c-kit+ сортированных кардиальных клеток методом проточной цитометрии на фоне отсутствия CD117 (c-kit) маркера выявляются маркеры эндотелиальных клеток CD31 (5,4±1,6%) и их предшественников CD34 (5,2±1,4%). Мы предположили, что в процессе культивирования происходит спонтанная дифференцировка КСК в эндотелиальном, муральном и фибробластном направлениях. Этот факт может объяснить гетерогенность культуры по маркерам NG2 и CD10. Как показано ранее, с-kit+ мезенхимальные клетки сердца являются региональными, поскольку при трансплантации сердца c-kit+ клетки имеют кариотип донора [17]. Во взрослом сердце c-kit+ клетки выявляются в участках, имеющих проэпикардиальное происхождение, – эпикарде, субэпикарде, интерстициальных участках миокарда, при этом количество их уменьшается в направлении от эпикарда к эндокарду. Недавно высказано предположение, что в ответ на повреждение миокарда c-kit+ мезенхимальные клетки сердца могут появляться вновь в результате эндотелиально-мезенхимального перехода клеток эпикардиального слоя. Такая возможность продемонстрирована in vitro при культивировании клеток эпикарда в присутствии TGFb-фактора [18].
Таким образом, в течение эмбрионального и постэмбрионального развития в сердце обнаруживаются две популяции c-kit+ клеток: в составе клеток первичного кардиального поля, которые участвуют в развитии кардиомиоцитов (хотя и в незначительной степени) и исчезают вскоре после рождения, и c-kit+ клетки, имеющие про-эпикардиальное происхождение и иммунофенотип МСК, способные к дифференцировке в эндотелиальном, муральном и фибробластном направлениях.
Выводы
Культура КСК человека, полученная в результате магнитного сортинга с помощью антител на c-kit-рецептор, является гетерогенной. В ней присутствуют клетки, несущие характерный набор поверхностных маркеров МСК КМ, эндотелиальных и муральных клеток. Можно предположить, что гетерогенность культуры и отсутствие ckit-рецептора в сортированных клетках обусловлена дифференцировкой с-kit-позитивных клеток в васкулярном направлении в процессе культивирования in vitro .
Иммунофенотип фибробластов кожи также представлен характерным набором маркеров МСК, за исключением CD10, соответствующего эластазе, нейтральной пептидазе. Мы показали, что ФК дифференцируется в остеогенном и адипогенном направлениях при использовании индукционных сред. Таким образом, фибробласты кожи человека, полученные по стандартным протоколам, являются мезенхимальными стволовыми клетками кожи. В соответствии с иммунофенотипом МСК КМ, КСК и ФК экспрессируют гены паракринных факторов HGF, VEGF, PDGFb, ANG1, ANG2, IGF1, TGFb, обладающих кардипротекторным и ангиогенным эффектами.
Работа поддержана грантом РФФИ № 14-04-00082 и бюджетным проектом Института цитологии и генетики СО РАН VI.60.1.2.
Список литературы Сравнение мезенхимальных стромальных клеток костного мозга и региональных стволовых клеток сердца и фибробластов кожи человека
- Beltrami A.P., Barlucchi L., Torella D., Baker M., Limana F., Chimenti S., Kasahara H., Rota M., Musso E., Urbanek K., Leri A., Kajstura J., Nadal-Ginard B., Anversa P. Adult cardiac stem Cells are multipotent and support myocardial regeneration//Cell. 2003. Vol. 114. № 6. P. 763-76.
- Bolli R., Chugh A.R., D'Amario D., Loughran J.H., Stoddard M.F., Ikram S., Beache G.M., Wagner S.G., Leri A., Hosoda T., Sanada F., Elmore J.B., Goichberg P., Cappetta D., Solankhi N.K., Fahsah I., Rokosh D.G., Slaughter M.S., Kajstura J., Anversa P. Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial//Lancet. 2011. Vol. 378. № 9806. P. 1847-57.
- Keith M.C., Bolli R. "String theory" of c-kit(pos) cardiac cells: a new paradigm regarding the nature of these cells that may reconcile apparently discrepant results//Circ. Res. 2015. Vol. 116. № 7. P. 1216-30.
- Павлова С.В., Перовский П.П., Чепелева Е.В., Малахова А.А., Дементьева Е.В., Покушалов Е.А., Сухих Г.Т., Закиян С.М. Характеристика кардиальных культур клеток, полученных из экспланта сердечной мышцы человека//Клеточные технологии в биологии и медицине. 2013. № 3. С. 132-141.
- Сергеевичев Д.С., Сергеевичева В.В., Субботовская А.И., Подхватилина Н.А., Васильев В.Ю., Русакова Я.Л. Токсическое влияние детергентов на мезенхимальные стромальные клетки человека при заселении графтов//Патология кровообращения и кардиохирургия. 2013. № 2. С. 67-73.
- Ferreira-Martins J., Ogorek B., Cappetta D., Matsuda A., Signore S., D'Amario D., Kostyla J., Steadman E., Ide-Iwata N., Sanada F., Iaffaldano G., Ottolenghi S., Hosoda T., Leri A., Kajstura J., Anversa P., Rota M. Cardiomyogenesis in the developing heart is regulated by c-kit-positive cardiac stem cells//Circ. Res. 2012. Vol. 110. № 5. P. 701-15.
- Wu S.M., Fujiwara Y., Cibulsky S.M., Clapham D.E., Lien C.L., Schultheiss T.M., Orkin S.H. Developmental origin of a bipotential myocardial and smooth muscle Cell precursor in the mammalian heart//Cell. 2006. Vol. 127. № 6. P. 1137-50.
- van Berlo J.H., Kanisicak O., Maillet M., Vagnozzi R.J., Karch J., Lin S.C., Middleton R.C., Marban E., Molkentin J.D. c-kit+ cells minimally contribute cardiomyocytes to the heart//Nature. 2014. Vol. 509. № 7500. P. 337-41.
- Чепелева Е.В., Павлова С.В., Малахова А.А., Милевская Е.А., Русакова Я.Л., Подхватилина Н.А., Сергеевичев Д.С., Покушалов Е.А., Караськов А.М., Сухих Г.Т., Закиян С.М. Терапия хронического кардиосклероза у крыс линии WAG культурами кардиоваскулярных клеток, обогащенными стволовыми клетками сердца//Клеточные технологии в биологии и медицине. 2015. № 3. С. 10.
- He J.Q., Vu D.M., Hunt G., Chugh A., Bhatnagar A., Bolli R. Human cardiac stem cells isolated from atrial appendages stably express c-kit//PLoS One. 2011. Vol. 6. № 11. P. e27719.
- Davis D.R., Kizana E., Terrovitis J., Barth A.S., Zhang Y., Smith R.R., Miake J., Marban E. Isolation and expansion of functionally-competent cardiac progenitor cells directly from heart biopsies//J. Mol. Cell. Cardiol. 2010. Vol. 49. № 2. P. 312-21.
- Koninckx R., Daniels A., Windmolders S., Carlotti F., Mees U., Steels P., Rummens J.L, Hendrikx M., Hensen K. Mesenchymal stem cells or cardiac progenitors for cardiac repair? A comparative study//Cell. Mol. Life Sci. 2011. Vol. 68. № 12. P. 2141-56.
- Medvedev S.P., Malakhova A.A., Grigor'eva E.V., Shevchenko A.I., Dementyeva E.V., Sobolev I.A., Lebedev I.N., Shilov A.G., Zhimulev I.F., Zakian S.M. Derivation of induced pluripotent stem cells from fetal human skin fibroblasts//Acta Naturae. 2010. Vol. 2. № 2. P. 102-6.
- Morisaki N., Moriwaki S., Sugiyama-Nakagiri Y., Haketa K., Takema Y., Imokawa G. Neprilysin is identical to skin fibroblast elastase: its role in skin aging and UV responses//J. Biol. Chem. 2010. Vol. 285. № 51. P. 39819-27.
- Russell K.C., Tucker H.A., Bunnell B.A., Andreeff M., Schober W., Gaynor A.S., Strickler K.L., Lin S., Lacey M.R., O'Connor K.C. Cellsurface expression of neuron-glial antigen 2 (NG2) and melanoma cell adhesion molecule (CD146) in heterogeneous cultures of marrow-derived mesenchymal stem cells//Tissue Eng. Part A. 2013. Vol. 19. № 19-20. P. 2253-66.
- Kozanoglu I., Boga C., Ozdogu H., Sozer O., Maytalman E., Yazici A.C., Sahin F.I. Human bone marrow mesenchymal cells express NG2: possible increase in discriminative ability of flow cytometry during mesenchymal stromal cell identification//Cytotherapy. 2009. Vol. 11. № 5. P. 527-33.
- White A.J., Smith R.R., Matsushita S., Chakravarty T., Czer L.S., Burton K., Schwarz E.R., Davis D.R., Wang Q., Reinsmoen N.L., Forrester J.S., Marban E., Makkar R. Intrinsic cardiac origin of human cardiospherederived cells//Eur. Heart J. 2013. Vol. 34. № 1. P. 68-75.
- Di Meglio F., Castaldo C., Nurzynska D., Romano V., Miraglia R., Bancone C., Langella G., Vosa C., Montagnani S. Epithelial-mesenchymal transition of epicardial mesothelium is a source of cardiac CD117-positive stem cells in adult human heart//J. Mol.Cell Cardiol. 2010. Vol. 49. № 5. P. 719-27.


