Сравнение нуклеофильности n-донорных лигандов при взаимодействии с Zn-ТФП, SbCl 5, BF 3 и йодом в апротонных растворителях
Автор: Андреев Владимир Петрович, Соболев Павел Сергеевич, Мухина Наталья Ильинична
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-математические науки
Статья в выпуске: 4 (149), 2015 года.
Бесплатный доступ
Рассмотрены корреляции основности/нуклеофильности n-донорных лигандов с использованием различных шкал (в качестве v-акцепторов использованы кислоты Льюиса: I 2, SbCl 5, BF 3, Zn-ТФП и кислота Бренстеда - п-фторфенол). Показано, что в этом ряду донорные числа Гутмана (DN) обладают наиболее слабой предсказательной способностью нуклеофильности соединений. Другие шкалы хорошо коррелируют друг с другом, причем стерические факторы наименее существенны при координации с йодом и п-фторфенолом. По-видимому, на настоящий момент наиболее удобной является шкала основности/нуклеофильности n-донорных лигандов, использующая координацию Zn-ТФП с соединениями в хлороформе. Данная модельная система позволяет достаточно быстро определять кинетические (К, Δλ) и термодинамические параметры (ΔН 0, ΔS 0 и ΔG 0) с помощью электронной спектроскопии, а также выделять молекулярные комплексы в кристаллическом состоянии для исследования методом рентгеноструктурного анализа.
Координация, цинк-тетрафенилпорфирин, нуклеофильность, основность, электронная спектроскопия, йод, трифторид бора, пятихлористая сурьма
Короткий адрес: https://sciup.org/14750912
IDR: 14750912 | УДК: 547.979.733+547.233+541.124+541.121:536.7
Текст научной статьи Сравнение нуклеофильности n-донорных лигандов при взаимодействии с Zn-ТФП, SbCl 5, BF 3 и йодом в апротонных растворителях
Ранее нами была предложена новая шкала нуклеофильности n-донорных лигандов, основывающаяся на константах устойчивости комплексов с Zn-ТФП в хлороформе при 25 ° C [1]. Ввиду того что к настоящему времени накоплены кинетические и термодинамические данные для 190 лигандов [2], [3], [4], [5], в данной статье мы решили проверить, насколько успешно они коррелируют с соответствующими величинами, полученными для координации с молекулярным йодом [6], [7], [8], [9], SbCl 5 и BF 3 .
Использование понятия полосы переноса заряда (ППЗ) в электронных спектрах комплексов различных соединений с йодом позволило определить большое количество констант устойчивости в соответствии с уравнением (1), в котором I 2 является кислотой Льюиса, B – основанием Льюиса, BI 2 – йодным комплексом, а величина K c – константой устойчивости комплекса (изменяется в пределах 10–1–106 л/моль).
К настоящему времени определены тысячи подобных констант в различных апротонных растворителях (например, алканы, CCl 4 , CH 2 Cl 2 или CHCl3) при различных температурах, которые довольно часто противоречат друг другу.
В работе [8] были выбраны наиболее надежные значения K c , измеренные в близких по природе растворителях при одной температуре, и введена «дийодная» шкала основности pK BI2 для 642 сильно различающихся по своей природе органических оснований. Значения pK BI2 были определены в соответствии с уравнением (3), в котором K c – это константа равновесия в уравнении (1) в алкане при 298 K.
pK BI2 = lg (K c /1 л∙моль–1). (3)
Символ pKBI2 введен по аналогии со значением pKBH+, используемым для шкалы основности по Бренстеду [11], и pKBHX – шкалы основности по отношению к 4-фторфенолу (донор протона при образовании водородной связи с другими соединениями).
Ожидается, что наиболее сильные «дийод-ные», «протонные» и «4-фторфенольные» основания должны иметь наибольшие значения pKBI2, pKBH+ и pKBHX соответственно. Однако перечисленные шкалы можно расширить, используя в качестве акцепторов другие кислоты Льюиса (например, галогенсодержащие соединения, способные к образованию галогенной связи) и Брен-стеда – Лоури (источники протона).
Величины pKBI2 могут быть конвертированы в шкалу энергий Гиббса с помощью уравнения (4).
ΔG0(KДж∙моль–1) = –RTlnK c = –5,708∙pK BI2 (4) (при 298 К).
В шкале энергий Гиббса значения ΔG0 между нейтральными донорами и акцепторами варьируют в довольно широком интервале (0–40 КДж/ моль).
В работе [8] указывается, что между pKBI2 и pKBHХ (уравнения (1) и (2)) для нескольких сотен сильно различающихся по своей природе органических оснований чрезвычайно сложно выявить какие-то общие корреляции.
На наш взгляд, в первую очередь это обусловлено тем, что авторы математически пытаются сопоставить значения pKBI2 и pKBHX чрезвычайно разнообразных по структуре соединений, используя минимальный набор параметров. Однако атомы йода (в молекуле йода) и водорода (в п-фторфеноле), за счет которых образуются молекулярные комплексы в этих двух шкалах, сильно отличаются по размерам, поляризуемости, электроотрицательности и другим физическим параметрам. В терминах шкалы Пирсона (ЖМКО) атом йода является мягким, а водород жестким центром, и прочность связей, образованных с их участием, должна сложным образом зависеть от жесткости/мягкости партнера.
Мы попытались сильно упростить этот подход и на основании данных работ [6], [7], [8], [9] построить корреляции для отдельных классов соединений, в которых существенны только изменения электронных эффектов. При этом предполагалось, что для соединений, не подчиняющихся линейной корреляции, можно будет обнаружить дополнительные эффекты, влияющие на процесс координации.
Как видно из рис. 1, для 3- и 4-замещенных пиридинов и анилинов выполняются линейные корреляции между lgK Zn-ТФП и pK BI2 , однако для 2-замещенных производных, вторичных и третичных анилинов это не так: точки для 2-хлор-, 2-бром-, 2-фторпиридинов (см. рис. 1а), а также N-метил- и N, N-диметиланилинов (см. рис. 1б)
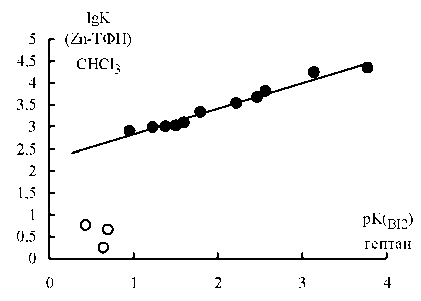
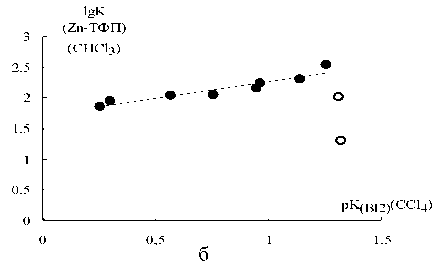
Рис. 1. Зависимость lgK Zn-ТФП от pK BI2 для процессов координации с (а) пиридинами (X =4-Me 2 N, 4-NH 2 , 4-Me, 3-Me, H, 4-MeC=O, 4-COOEt, 3-F, 3-Br, 3-Cl, 4-CN; lgK Zn-ТФП = 0,59∙pK BI2 +2,25; n 11, r 0,99; внизу точки для 2-хлор-, 2-бром-, 2-фторпиридинов) и (б) анилинами (X = 4-MeO, 3-MeO, 4-Me, 3-Me, H, 4-Br, 3-Br, 3-Cl; lgK Zn-ТФП = 0,55∙pK BI2 +1,72; n 8, r 0,94; внизу точки для N-метил-и N, N-диметиланилина)
в силу влияния стерических факторов сильно отклоняются от прямых, выведенных для других производных.
Однако в случае корреляции pKBI2 от pKBHX для координации с пиридинами наблюдаются несколько другие закономерности (рис. 2). Во-первых, точки для соединений, содержащих заместители во втором положении пиридинового кольца (2-амино-, 2-метил, 2-фтор, 2-хлор-, 2-бромпиридины и 2,2’-бипиридин), хорошо подчиняются линейному уравнению в отличие от зависимости lgKZn-ТФП –pKBI2 (см. рис. 1а). По-видимому, это связано с тем, что атомы водо-
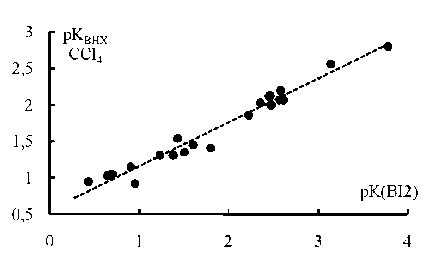
Рис. 2. Зависимость pK BHX от pK BI2 (растворитель: гептан, циклогексан, CH 2 Cl 2 или CCl 4 ) для процессов координации с пиридинами (X = 4-Me 2 N, 4-NH 2 , 4-MeO, 4-Et, 3-NH 2 , 4-Me, 3-Me, H, 2-NH 2 , 2-Me, 4-MeC=O, 4-Cl, 4-COOMe, 3-F, 3-Br, 3-Cl, 3-I, 4-CN, 2-F, 2-Cl, 2-Br; 2,2’-бипиридин), pK BHX = 0,60∙ pK BI2 + 0,56; r 0,98n 22
рода и йода более доступны для образования донорно-акцепторной связи в комплексе, чем атом цинка, находящийся в плоскости порфиринового кольца. Во-вторых, точки для 4-ацетил- и 4-ци-анопиридинов несколько сильнее отклоняются вниз от прямой, чем другие лиганды. Возможно, это связано с очень сильными акцепторными свойствами указанных заместителей в пиридиновом кольце. Известно, что заместители, обладающие сильным –М эффектом, не влияют на основность пиридинов по механизму сопряжения, характерному для этих групп, из-за чрезвычайно высокой электроноакцепторности пиридинового атома азота. Вследствие этого такие заместители, как NO2 и CN, которые обычно являются акцепторами электронов, проявляют в этом случае донорные свойства по механизму сопряжения. Этим обусловлено то, что пиридины, содержащие указанные функциональные группы в четвертом положении (pKa для 4-нитропиридина 1,39 и 4-цианопиридина 1,86), оказались более сильными основаниями [5], чем пиридины, содержащие эти же заместители в третьем положении (pK a для 3-нитропиридина 1,18, для 3-ци-анопиридина 1,35).
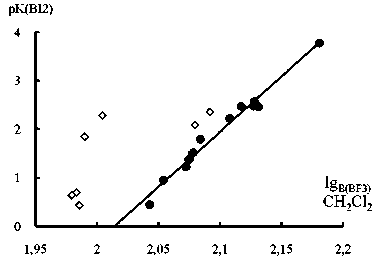
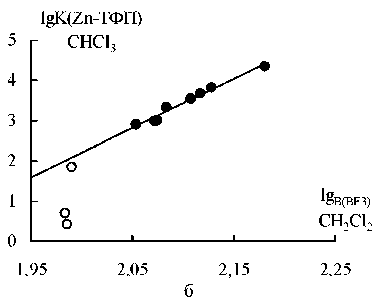
Рис. 3. Зависимость (а) pK BI2 (растворитель: гептан, CHCl 3 , CH 2 Cl 2 или CCl 4 ) от pK B (BF3) (Х = 4-Me 2 N, 4-MeO, 4-трет-Bu, 4-Me, 3-Me, H, 4-MeC=O, 3-MeC=O, 3-Br, 3-Cl, 4-CN, 3-CN; pK BI2 = 22,7∙pK B (BF3) – 45,9; n 12, r 0,99; вверху точки для 2-хлор-, 2-бром-, 2-фтор-, 2-метил-, 2-этил-, 2,6-диме-тил- и 2,4,6-триметилпиридинов) и (б) lgKZn-ТФП от pKB ( BF3 ) координации с пиридинами (X = 4-Me 2 N, 4-Me, 3-Me, H, 3-Br, 3-Cl, 4-MeC=O, 4-CN; lgK Zn-ТФП = 12,2∙pK B (BF3) –22,1; n 8, r 0,99; внизу точки для 2-хлор-, 2-бром-, 2-фторпиридинов)
С целью проверить гипотезу о влиянии пространственной структуры акцептора на нукле-офильность/основность лиганда мы построили корреляции pK BI2 – pK BF3 и lgK Zn-ТФП – pK BF3 (рис. 3, данные для координации с йодом и трифторидом бора взяты из работы [7]). В данном случае величина K BF3 (выражаемая в КДж/моль) характеризует сродство трифторида бора к основанию Льюиса в дихлорметане при 25 ° C при 1 атм.
Оказалось, что в обоих случаях поведение точек для 2-замещенных пиридинов не описывается линейным уравнением, причем на рис. 3а они находятся выше, а на рис. 3б – ниже прямых, по-видимому, указывая на то, что при координации с этими лигандами влияние стерических факторов при замене BF 3 на йод уменьшается, а на Zn-ТФП – возрастает. При этом в первом случае отклонение точек от прямой возрастает в ряду 2-MePy, 2-EtPy < 2-FPy, 2-ClPy, 2-BrPy < 2,6-Me 2 Py, 2,4,6-Me 3 Py. Отчасти такой порядок можно объяснить тем, что накопление алкильных групп в положениях 2 и 6 затрудняет координацию по атому азота особенно сильно при образовании связи N-B. Правда, увеличение при этом +I эффекта должно стабилизировать комплексы с обоими акцепторами. В 2-галоген-пиридинах при взаимодействии с йодом наряду с N-I не исключено одновременное образование «галогенных» связей, что в некоторой степени может дополнительно стабилизировать эти аддукты.
Для аммиака и первичных аминов, содержащих при атоме азота CH 2 группу, также наблюдается линейная зависимость pK BI2 от lgK Zn-ТФП , но точки для лигандов с большими по объему алкильными группами (изо- и трет-бутиламин) лежат вне прямой (рис. 4).
Наконец, традиционно используемая шкала Гутмана (для оценки электронодонорной способности) 180 растворителей [10] характеризует их основность по Льюису или способность акцептировать атом водорода при образовании водород-
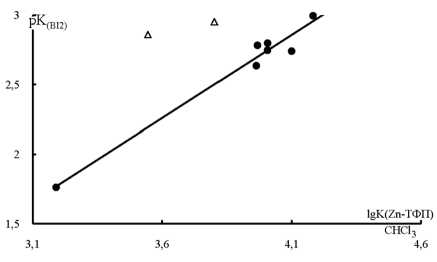
Рис. 4. Зависимость pKBI2 в гептане [7] от lgKZn-ТФП в хлороформе (pK BI2 = 1,20 lgK Zn-ТФП – 2,05 n 7 r 0,985; прямая построена по точкам для аммиака, метиламина, этиламина, н-бутиламина, изобутиламина, вторбутиламина, н-додеци-ламина). Над прямой находятся точки для изо-пропиламина и трет-бутиламина
Значения чисел (DN) Гутмана [10] для основных классов n-донорых лигандов
Основность и нуклеофильность основных классов органических соединений в апротонных растворителях типа хлороформа и 1,2-дихлорэтана в первом приближении можно представить в виде следующей последовательности:
фенолы < альдегиды, кетоны, простые и сложные эфиры < анилины < N-оксиды пиридинов < пиридины < предельные амины.
Представленные в таблице величины DN позволяют заключить, что существенные отличия в их значениях наблюдаются в случае сильно различающихся по строению веществ, тогда как для соединений одного и того же класса они довольно близки. В целом изменения значений DN находятся в соответствии с рядом основнос-ти/нуклеофильности, приведенным выше для lgK Zn-ТФП и lgK BI2 , однако есть и противоречия. Например, у N,N-диэтиланилина (DN 33) выше, чем у N,N-диметиланилина (DN 27); мы же для координации Zn-ТФП с этими соединениями в хлороформе получили обратный порядок изменения констант устойчивости (К Zn-ТФП ): 2,5 л∙моль–1 и 20,4 л∙моль–1. У пиперидина (DN 40) меньше, чем у трет-бутиламина (DN 57,5) и даже три-н-бутиламина (DN 50); однако наши значения К Zn-ТФП : 49700, 3510 и 12,0 л∙моль–1 соответственно.
В большинстве случаев (за исключением N-оксидов пиридинов: lgKZn-ТФП = 0,0534∙DN + 1,205, r 0,9999; n = 3) между DN и lgKZn-ТФП линейные корреляции даже внутри одного класса соединений отсутствуют.
Таким образом, шкала Гутмана (в отличие от pK BI2 , pK B (BF3) и pK Zn-ТФП ) не позволяет получить ясного представления о взаимосвязи между донорной способностью оснований/нуклеофилов и их способностью к образованию молекулярных комплексов, а также вывести корреляционные уравнения, позволяющие количественно предсказывать реакционную способность соединений. В основе этой неудачи, на наш взгляд, лежат следующие причины:
-
1. Чрезвычайное разнообразие используемых растворителей (при малом количестве однотипных объектов) приводит к тому, что образующиеся молекулярные комплексы со SbCl5 сложно классифицировать и корректный количественный учет электронных, стерических и других факторов на ΔН0 процесса координации становится трудноосуществимым.
-
2. Пентахлорид сурьмы является очень сильным акцептором электронов, в результате чего контроль за сохранением его чистоты в процессе эксперимента сопряжен с огромными трудностями. Этой же причиной обусловлено существенное нивелирование влияния величины электронной плотности на реакционном центре донора на энтальпию процесса образования молекулярного комплекса. Так, значения DN для анилинов, приведенных в таблице, изменяются от 27 до 36, а аммиака и предельных аминов от 39 до 61 единицы, то
есть в достаточно узком диапазоне; для некоторых же соединений они определены очень грубо (DN для аммиака 59 (42), метанола 19 (30)).
При использовании шкал основности pKBI2 и pKB ( BF3 ) отчасти учтены эти недостатки: использованы менее сильные, чем SbCl5, акцепторы (BF3 и особенно I2) и расширены серии однотипных лигандов, что позволило нам обсудить в данной статье их соответствие данным по комплексообразованию с Zn-ТФП (см. рис. 1–4). Однако недостатком указанных шкал является отсутствие литературных данных о термодинамике процесса комплексообразования.
В нашей шкале нуклеофильности/основнос-ти [1], [2], [3], [4], [5] мы учли перечисленные недостатки: в качестве акцептора используется довольно слабая кислота Льюиса – Zn-ТФП (исследуются только молекулярные комплексы n, v-типа состава 1 : 1 для достаточно больших групп нуклеофилов, относящихся к одному и тому же классу органических соединений) и приводятся ΔGo, ΔHo и ΔSo для комплексов.
Предложенный нами новый подход к оценке нуклеофильности молекул на основе данных, характеризующих устойчивость их комплексов с МП, несомненно, имеет массу достоинств. Исследование кинетики и термодинамики координации Zn-ТФП в хлороформе со 190 n-донорными лигандами (предельные, непредельные и ароматические амины, гетероароматические N-оксиды, спирты) методом электронной спектроскопии показало, что между координационными, химическими и биологическими процессами с участием одних и тех же лигандов/нуклеофилов/субстра-тов есть много общего, так как описываются подобными математическими уравнениями. С другой стороны, они имеют свои особенности. Так, нами впервые обнаружено, что амины, содержащие н-октильную группу, обладают повышенной нуклеофильностью по отношению к порфириновым системам (координация с Zn-ТФП, раскрытие экзоцикла феофорбида а).
На наш взгляд, исследование таких особенностей комплексообразования МП методом ЭСП может дать резкий толчок к более глубокому пониманию механизмов органических и биохимических реакций, поскольку данная модельная система позволяет:
-
1. Работать с очень низкими концентрациями реагентов благодаря высоким коэффициентам экстинкции МП и определять значения констант устойчивости комплексов в очень широком диапазоне (для метилацетата К = 0,62 л∙моль-1, для DABCO – 105000 л∙моль-1).
-
2. В течение одного дня определить константы устойчивости комплексов (и термодинамические характеристики координации) МП с несколькими лигандами и при нескольких температурах, поскольку равновесия устанавливаются очень быстро.
-
3. При наличии линейных зависимостей смещений максимумов полос поглощения ме-таллопорфирина (Δλ) при координации с ним определенного класса соединений от каких-либо параметров в течение нескольких минут обнаруживать наличие аномалии в поведении лиганда с известным значением параметра (отсутствие корреляции с Δλ свидетельствует о наличии неучтенных явлений).
-
4. Получать молекулярные комплексы МП с лигандами (в отличие от интермедиатов в органической и биологической химии) в индивидуальном состоянии и исследовать их пространственное строение методами РСА и газовой электронографии.
* Работа выполнена при поддержке Программы стратегического развития ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
COMPARISON OF NUCLEOPHILISITY OF n-DONOR LIGANDS IN INTERACTION WITH Zn-TPP, SbCl 5 , BF 3 AND IODINE IN APROTIC SOLVENTS
Список литературы Сравнение нуклеофильности n-донорных лигандов при взаимодействии с Zn-ТФП, SbCl 5, BF 3 и йодом в апротонных растворителях
- Андреев В. П., Нижник Я. П., Лебедева Н. Ш. Новая шкала основности/нуклеофильности, основывающаяся на параметрах, характеризующих образование аксиальных (n, v-типа) комплексов Zn-ТФП с лигандами (основаниями/нуклеофилами)//ЖОрХ. 2008. Т. 44. № 6. С. 914-922.
- Андреев В. П., Соболев П. С., Зайцев Д. О. Количественные корреляции, связывающие процессы координации Zn-ТФП и реакции нуклеофильного замещения с участием анилинов//ЖОрХ. 2012. Т. 48. Вып. 6. С. 776-783.
- Андреев В. П., Соболев П. С., Зайцев Д. О., Илюхин А. Б. Нуклеофильность гетероароматических N-оксидов при координации с Zn-тетрафенилпорфирином и в реакциях замещения//ЖОХ. 2014. Т. 84. № 1. С. 121-131.
- Андреев В. П., Соболев П. С., Зайцев Д. О., Визер С. А., Ержанов К. Б., Тафеенко В. А. Нуклеофильность N-пропаргиланилинов в процессах координации с Zn-тетрафенилпорфирином в хлороформе//ЖОХ. 2014. Т. 84. № 8. С. 1378-1387.
- Андреев В. П., Соболев П. С. Молекулярные комплексы металлопорфиринов как модельная система исследования донорно-акцепторных взаимодействий n, v-типа. Петрозаводск: Изд-во ПетрГУ, 2015. 355 с.
- Dartashevich E. V., Trotskaya E. A., Tsirelson V. G. The N I halogen bond in substituted pyridines as viewed by the sourse function and delocalization indices//Chemical Physics Letters. 2014. Vol. 601. P. 144-148.
- Laurence C., Gal J.-F. Lewis basicity and effinity scales. Data and measurement. Willey, 2010. 460 p.
- Laurence C., Graton J., Berthelot M., Ghomari M. J. El The diiodine basicity scale: toward a general halogenbond basicity scale//Chem. Eur. J. 2011. Vol. 17. P. 10431-10444. DOI: DOI: 10.1002/chem.201101071
- Laurence C., Graton J., Gal J.-F. An Overview of Lewis Basicity and Affinity Scales//J. Chem. Educ. 2011. Vol. 88. P. 1651-1657.
- Marcus Y. The Effectivity of Solvents as Electron Pair Donors.//J. Sol. Chem. 1984. Vol. 13. № 9. P. 599-604.
- Perrin D. D. Dissociation constants of Organic Bases in Aqueous Solution. Butterworths; London, 1965. 265 p.


