Сравнение различных режимов радиомодификации препаратом цисплатин при проведении лучевой терапии больным со злокачественными опухолями слизистой оболочки ротовой полости и ротоглотки
Автор: Гладков О.А., Важенин А.В., Шарабура Т.М., Кандакова Е.Ю., Галямова Ю.В., Сычв В.И., Курченкова О.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лекции
Статья в выпуске: 2 (26), 2008 года.
Бесплатный доступ
Представлены результаты одноцентрового рандомизированного исследования с целью сравнения трёх режимов введения цисплатина у больных раком ротоглотки и полости рта: в дозе 6 мг/м2 ежедневно (группа А), в дозе 40 мг/м2 еженедельно (группа В), в дозе 100 мг/м2 1 раз в 3 нед (группа С). Во всех трёх группах, с первого дня введения цисплатина, проводилась дистанционная лучевая терапия в традиционном режиме фракционирования по 2 Гр за фракцию, 5 дней в нед до СОД 68-70 Гр на аппарате «Рокус М». При СОД 70 Гр наименьшая кумулятивная доза цисплатина отмечена в группе А - 210 мг/м2, в группе В она составила 280 мг/м2, в группе С - 300 мг/м2. Вследствие токсических реакций лечение прерывалось в группе А у 18 пациентов (81,8 %), в группе В - у 17 (65,4 %), в группе С - у 5 (41,7 %). Несмотря на меньшую кумулятивную дозу цитостатика, частота полных резорбций опухоли была выше в группе А - 27,3 %, в группе В она составила 19,2 %, в группе С - 16,7 %.
Рак ротоглотки и полости рта, химиолучевая терапия, радиомодификатор, цисплатин
Короткий адрес: https://sciup.org/14054841
IDR: 14054841 | УДК: (616.31+616.321)-006.04:615.849.1
Текст научной статьи Сравнение различных режимов радиомодификации препаратом цисплатин при проведении лучевой терапии больным со злокачественными опухолями слизистой оболочки ротовой полости и ротоглотки
Рак полости рта и ротоглотки относится к опухолям с доступной визуальной диагностикой. Тем не менее около 60 % больных обращаются в специализированные онкологические учреждения при III–IV стадии болезни [1]. В большинстве подобных ситуаций основным методом лечения становится лучевое или химиолучевое лечение. Интенсивное изучение сравнительной эффективности лучевой терапии и комбинированного химиолучевого воздействия привело к появлению большого количества рандомизированных исследований. Итогом значительного опыта, накопленного за последние 20 лет, стали публикации нескольких метаанализов [3, 5–8], подтвердившие преимущество одновременной химиолучевой терапии. Из всего многообразия лекарственных средств одну из ведущих позиций занимает препарат цисплатин. Два крупных рандомизированных исследования [2, 4], после подведения итогов, предложили использовать монотерапию цисплатином в сочетании с лучевой терапией в качестве стандарта адъювантной терапии больных опухолью головы и шеи. Повышение эффективности лечения не могло не сказаться на побочных эффектах. У ряда пациентов рост токсических реакций вызывал перерывы в лечении и приводил к снижению противоопухолевого эффекта. Различные варианты введения цисплатина в сочетании с лучевой терапией предположительно могли бы изменить кумулятивный профиль токсичности.
Материал и методы
В 2005 г. было спланировано проспективное, открытое, сравнительное, одноцентровое, рандомизированное исследование. Целью его явилось изучение эффективности одновременного химиолучевого лечения у пациентов с местно-распространённым раком полости рта и ротоглотки с различными режимами введения цисплатина. Одновременно предполагалось сравнить профиль токсичности каждого из режимов. С 2005 г. по январь 2007 г. в Челябинском областном онкологическом диспансере рандомизировано 60 пациентов. Пациенты включались в исследование на основании следующих критериев: 1) возраст от 18 до 65 лет; 2) активность по шкале Карновского ≥ 70 %; 3) наличие морфологически подтверждённого диагноза рака полости рта или ротоглотки; 4) II–IV стадия заболевания, согласно шестому изданию классификации TNM (2002); 5) пациенты предварительно не должны были получать какого-либо противоопухолевого лечения по поводу рака полости рта или ротоглотки; 6)
отсутствие сопутствующей патологии в стадии декомпенсации (нестабильная стенокардия, нарушение ритма сердечной деятельности, сахарный диабет и т.д.); 7) абсолютное число нейтрофилов ≥ 1500 в мкл, тромбоцитов ≥100 000 в мкл, общий билирубин ≤ 30 ммоль/л, АСТ и АЛТ ≤ 2,5-кратного превышения от верхней границы нормы, креатинин ≤ 130 мкмоль/л.
После оценки соответствия критериям включения в исследование больных распределяли в три различные группы в зависимости от кратности и дозы введения цисплатина. Рандомизация осуществлялась с помощью генератора случайных чисел ППП. Statistica 6.0. В первой группе (А) пациентам ежедневно, за 1 ч до проведения лучевой терапии, внутривенно капельно вводили цисплатин (Ebewe) в дозе 6 мг/м2 в 400 мл 0,9 % физиологического раствора с предварительным введением противорвотных средств. Накануне, до введения препарата и в дальнейшем, еженедельно определялся уровень креатинина крови. Во второй группе (В) аналогичным образом вводили цисплатин еженедельно в дозе 40 мг/м 2 с дополнительной инфузионной нагрузкой 1200 мл физиологического раствора. В третьей группе (С) проводили лечение по стандартному режиму – 1 раз в 3 нед, в однократной дозе – 100 мг/м². Дополнительно проводили инфузию физиологического раствора до 2500 мл внутривенно. Использовалась стандартная
Таблица 1
|
Группы больных |
Группа А, n=22 |
Группа В, n=26 |
Группа С, n=12 |
|
Пол: мужчины |
21 |
23 |
12 |
|
женщины |
1 |
3 |
3 |
|
Возраст (медиана) |
55 |
54 |
54,5 |
|
Стадия процесса: II |
2 |
3 |
- |
|
III |
9 |
6 |
8 |
|
IV |
11 |
17 |
4 |
|
Локализация опухоли: |
|||
|
полость рта |
3 |
15 |
4 |
|
ротоглотка |
8 |
5 |
6 |
|
сочетанное поражение |
11 |
6 |
2 |
|
Степень дифференцировки опухоли: |
|||
|
G1 |
3 |
5 |
2 |
|
G2 |
8 |
8 |
5 |
|
G3 |
1 |
2 |
3 |
|
Не определена |
10 |
11 |
2 |
Характеристика групп больных
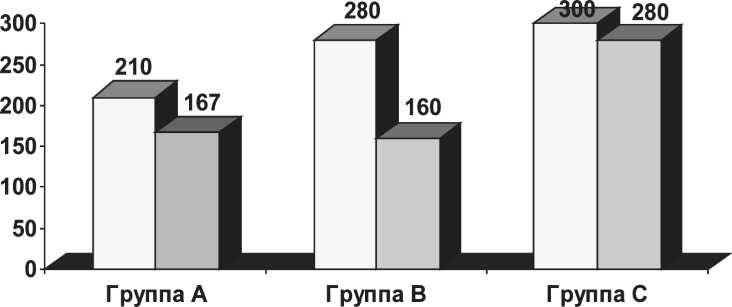
□ Должное количество цисплатина □ Реально введенное количество препарата
Рис. 1. Должное и реальное количество введенного цисплатина
пре-, постмедикация антиэметиками, глюкокортикоидами. Во всех трёх группах, с первого дня введения цисплатина, начинали дистанционную лучевую терапию в традиционном режиме фракционирования по 2 Гр за фракцию, 5 дней в нед до СОД 68–70 Гр (аппарат «Рокус М»).
На этапе промежуточного анализа, который представлен в публикации, в группу А включено 22, в группу В – 26, в группу С – 12 пациента (табл. 1). В конечном итоге в группы планируется включить одинаковое количество больных.
Во всех группах преобладали мужчины. Медиана возраста больных в сравниваемых группах была приблизительно одинаковой – 55, 54 и 54,5 года соответственно. Отмечено неравномерное распределение пациентов по локализации опухоли. В группах B и C было больше пациентов с опухолью полости рта, в группе A – с опухолью ротоглотки. Наиболее часто отмечался умереннодифференцированный рак.
При изучении суммарной дозы цисплатина, которую должны были получить пациенты в процессе одновременного химиолучевого лечения, выяснилось, что во всех группах она оказалась разной. Так, при очаговой суммарной дозе лучевой терапии 70 Гр, наименьшая кумулятивная доза цисплатина отмечена в группе A – 210 мг/м2. В группе B она составила 280 мг/м2. В группе C суммарная доза препарата была наибольшей – 300 мг/м2. Это было связано с тем, что последнее введение цитостатика приходилось на начало 7-й (завершающей) нед лучевой терапии.
По причине развития токсических реакций, при изучении полученных данных, подсчитано реальное количество введенного препарата. Суммарная доза цисплатина, полученная пациентами в процессе химиолучевого лечения, была максимальной в группе С – 93,3 % от исходной дозы, в группе А – 79,5 %, в группе В наименьшей – 57,3 % (рис. 1). Меньшие кумулятивные дозы были получены из-за возникновения токсических реакций у этих больных. Тяжесть побочных эффектов оценивалась по критериям
Таблица 2
|
Токсические реакции |
Группа А, n=22 |
Группа В, n=26 |
Группа С, n=12 |
|
Гранулоцитопения I–IV ст. |
10 |
13 |
6 |
|
Тошнота I–II ст. |
7 |
2 |
2 |
|
Рвота I–II ст. |
4 |
1 |
0 |
|
Слабость I–II ст. |
7 |
6 |
4 |
|
Гиперкреатининемия I–IVст. |
4 |
1 |
2 |
|
Стоматит I–IV ст. |
8 |
12 |
5 |
|
Всего |
48 |
47 |
24 |
Частота и тяжесть токсических реакций в сравниваемых группах
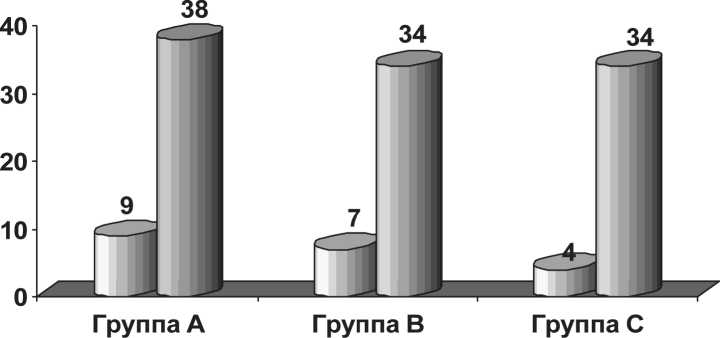
□ Средняя длительность перерыва, дни
□ Средняя доза ДЛТ, с которой начался перерыв, Гр
Рис. 2. Средняя доза лучевой терапии с момента перерыва и длительность прерывания лечения
CTC-NCIC ver.3.0. Наиболее частыми побочными эффектами являлись гранулоцитопения, слабость и стоматит. Отмечена тенденция к преобладанию гранулоцитопении и стоматита у больных группы B. В группе A превалировали тошнота и рвота. Эпителиит различной степени тяжести выявлялся у всех больных (табл. 2).
Вследствие токсических реакций лечение прерывалось у 18 пациентов (81,8 %) из группы A, у 17 больных (65,4 %) из группы B, у 5 (41,7 %) – из группы C. Неприемлемые токсические реакции и связанные с ними перерывы в лечении отмечались, начиная с 3-й нед лечения, практически с одинаковой частотой во всех группах (рис. 2). Продолжительность перерыва увеличивалась с уменьшением интервала введения цисплатина. Причинами приостановления лечения являлись токсические реакции III и IV ст., а также решение лечащего врача, принятое по оценке совокупности токсических реакций II степени и связанного с этим резкого ухудшения общего статуса больного. Наиболее тяжело переносился пациентами режим В – цисплатин в дозе 10 мг/м2. Связано это было со сложностью купирования отсроченной тошноты и рвоты, потерей аппетита, развитием выраженной слабости. Однако было отмечено, что при более частых перерывах и плохой переносимости лечения в группе пациентов с ежедневным введением цисплатина кумулятивная доза препарата была выше, чем в группе с еженедельным введением цитостатика. Мы сознательно не оговаривали в протоколе условия возобновления лечения цисплатином, прежде всего из соображений безопасности лечения, оставляя решение этого вопроса на усмотрение лечащего врача. Интересно было отметить, что введение цисплатина после купирования токсических реакций реже возобновлялось в группе В. По-видимому, данный факт можно объяснить тем, что в этой группе чаще имело место развитие токсических реакций в виде стоматитов и грану-лоцитопении, более грозных побочных реакций, с точки зрения врача, для больного.
Эффективность лечения оценивалась по RECIST, измерялся наибольший диаметр опухоли и сравнивался впоследствии с исходными значениями. Общая непосредственная эффективность лечения составила в группе A – 100 %, в группе B – 96,1 %, в группе C – 100 %. Полная резорбция опухоли отмечена у 6 больных (27,3 %) в группе A, у 5 (19,2 %) в группе B (19,2%), у 2 пациентов (16,7 %) – в группе C. Случаев прогрессирования опухоли не было. При анализе данных по эффективности химио-лучевого лечения следует учитывать факт более высокой эффективности ежедневного режима введения цисплатина, по сравнению со стандартным – 1 раз в 3 нед. Тогда как суммарная доза препарата при ежедневном введении была почти в 2 раза ниже, чем при стандартном.
В заключение хотелось бы отметить, что общая токсичность всех трёх режимов была приблизительно одинаковой, с преобладанием тошноты, рвоты в группе больных с ежедневным введением препаратов и стоматита, гра-нулоцитопении с еженедельным введением цисплатина. Несмотря на худшую переносимость ежедневного введения цисплатина, меньшая суммарная доза препарата была зафиксирована в группе еженедельного введения цитостатика из-за более серьёзных побочных эффектов. Результаты ежедневного введения цисплатина в сочетании с лучевой терапией обладают высокой непосредственной эффективностью, несмотря на меньшую суммарную дозу препарата.


