Сравнение традиционной лучевой терапии с методикой ускоренного гиперфракционирования в химиолучевом лечении локализованного мелкоклеточного рака легкого
Автор: Гулидов И.А., Золотков А.Г., Мардынский Ю.С., Иванова И.Н., Курсова Л.В., Гоголин Д.В., Рагулин Ю.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (55), 2013 года.
Бесплатный доступ
Представлены 5-летние результаты лечения 69 больных с локализованным мелкоклеточным раком легкого IIA–IIIA стадий. Лучевая терапия проведена в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы: разовая очаговая доза 1 + 1,5 Гр с интервалом 5–6 ч, суммарная очаговая доза 60–70 Гр в зависимости от общего состояния и функции легких. Полный эффект со стороны первичной опухоли в легком был достигнут у 13 (42 %) пациентов, медиана выживаемости составила 28 мес. Показатели 5-летней выживаемости – 26,2 %. Токсичность III степени по шкале RTOG в легком – 3,2 %, в перикарде – 6,5 %. Лучевых реакций III–IV степени со стороны крови и пищевода выявлено не было.
Мелкоклеточный рак легкого, ускоренное гиперфракционирование, химиолучевая терапия, острые лучевые реакции
Короткий адрес: https://sciup.org/14056295
IDR: 14056295 | УДК: 616.24–006.6:615.849.1:615.28
Текст научной статьи Сравнение традиционной лучевой терапии с методикой ускоренного гиперфракционирования в химиолучевом лечении локализованного мелкоклеточного рака легкого
В нашей стране ежегодно регистрируется около 65 тыс. заболеваний раком лёгкого. Мелкоклеточный рак лёгкого (МРЛ) встречается примерно у 15–20 % больных этой патологией, что составляет около 13 000 в год. Если в 70–90-х годах прошлого столетия МРЛ выявлялся у 25–30 % всех больных раком лёгкого, то в последние годы он встречается не более чем у 20 % пациентов, связывают этот факт с уменьшением числа курящих [5, 6]. Кроме того, новые диагностические методы (КТ, МРТ, ПЭТ) позволяют выявить МРЛ на более ранних стадиях: локализованный рак ранее выявлялся у 25 % больных, а в последние годы – у 40 %.
Мелкоклеточный рак лёгкого относится к наиболее злокачественно протекающим опухолям, которые характеризуются коротким анамнезом, быстрым течением, ранним метастазированием. В настоящее время общепризнано, что операция при МРЛ показана только при ранних стадиях (T1–2N0–1) [1–7]. При этом она должна дополняться 4 курсами адъювантной комбинированной химиотерапии (ХТ). Из общего числа больных оперируются не более 5 %.
Как правило, МРЛ – высокочувствительная к химио- и лучевой терапии (ЛТ) опухоль. Очень важным моментом в ХТ данного заболевания стала смена I линии. В настоящее время в качестве
ХТ первой линии лечения применяется схема ЕР (этопозид 100 мг/м2 + цисплатин 30 мг/м2, в 1, 8, 15-й день), которая заменила ранее широко применявшуюся схему CAV. Это особенно актуально для локализованного МРЛ, так как режим ЕР более удобен для комбинации с лучевой терапией, благодаря меньшей гематологической токсичности и потенцирующему эффекту на облучение.
Установлено, что клетки МРЛ имеют низкую способность к восстановлению сублетальных повреждений, которая делает их более чувствительными к ЛТ в режиме гиперфракционирования, когда используются дозы облучения менее традиционных 2 Гр за фракцию [1–3]. При этом ускоренные курсы имеют преимущество перед традиционными в связи со свойственной МРЛ значительной величиной пролиферативного пула, коротким временем удвоения опухоли, высокой способности к репопуляции и гетерогенности новообразования.
В настоящее время установлено, что отрицательное влияние на выживаемость больных неоперабельным раком легкого оказывает удлинение курса ЛТ. Следовательно, перспективным является применение нетрадиционных режимов облучения в химиолучевом лечении МРЛ, позволяющих сократить сроки, а также стоимость лечения [5, 8]. Таким образом, остаётся актуальным поиск оптимального фракционирования дозы ионизирующего излучения и его суммарной дозы; время, последовательность, схема полихимиотерапии.
Цель исследования – изучить эффективность химиолучевого лечения локализованного МРЛ IIA–IIIA стадий.
Материал и методы
В исследование включены 69 пациентов с морфологической верификацией МРЛ, которые были разделены на 2 группы:
1-я группа (n=31) – ЛТ в режиме ускоренного гиперфракционирования с неравномерным дроблением дневной дозы РОД 1 + 1,5 Гр с интервалом 5–6 ч, СОД 50–60 Гр;
2-я группа (n=38) – традиционная ЛТ, РОД 2 Гр, COД 60 Гр.
Всем пациентам проводилось 4 курса ХТ в режиме ЕР одновременно с началом ЛТ. Лучевая терапия проводилась 5 дней в нед на гамма-терапевтических аппаратах типа «АГАТ» и «РОКУС», а также на линейных ускорителях Philips SL 20, SL 75.
Отбор пациентов для химиолучевого лечения осуществлялся по принципу ожидаемой переносимости лечения. Это были преимущественно мужчины, в возрасте от 39 до 74 лет на момент начала лечения, в основном с IIА–IIВ ст. – 55 (79,7 %) больных, в том числе в 1-й – 25 (80,6 %) и во 2-й группе – 30 (78,9 %) пациентов, в остальных случаях – МРЛ IIIA ст. Все больные ранее не получали лучевой терапии; у них отсутствовали тяжелые сопутствующие заболевания в стадии декомпенсации (инфаркт миокарда, ИБС, сахарный диабет), статус по шкале Карновского – не ниже 70 %. Сроки наблюдения – не менее 5 лет после завершения лучевого лечения.
Эффективность методики лучевой терапии определяли по следующим критериям: излечен-ность первичного очага, размеры которого оценивали через 2 мес после окончания ЛТ. Состояние первичной опухоли и регионарных лимфатических узлов изучалось при каждом плановом обследовании больных. Показатели выживаемости рассчитывали актуриальным методом Каплана–Мейера, сравнение результатов между двумя группами проведено с использованием Log-Rank теста. Кроме того, сравнивали частоту и тяжесть лучевых реакций и повреждений согласно классификации, используемой в исследованиях RTOG и EORTC.
Результаты и обсуждение
Полный и выраженный эффект лечения со стороны первичной опухоли легкого был достигнут в 1-й группе у 13 (42 %), в контрольной группе – у 9 (24 %) больных. Медиана выживаемости составила 28 и 17 мес соответственно; 3-летняя выживаемость в 1-й группе – 40,1 %, во 2-й – 19,2 %; 5-летняя выживаемость – 26,2 % против 16,5 %, p=0,048 (Log-Rank test) (рис. 1).
В процессе химиолучевого лечения МРЛ все больные получали сопроводительную (поддерживающую) терапию, необходимость которой была обусловлена 2 причинами:
– обострением или декомпенсацией сопутствующей соматической патологии (хроническая обструктивная болезнь лёгких, ИБС, артериальная гипертензия, сахарный диабет, атеросклероз церебральных артерий, хронические заболевания ЖКТ, почек);
И.А. ГУЛИДОВ, А.Г. ЗОЛОТКОВ, Ю.С. МАРДЫНСКИЙ И ДР.
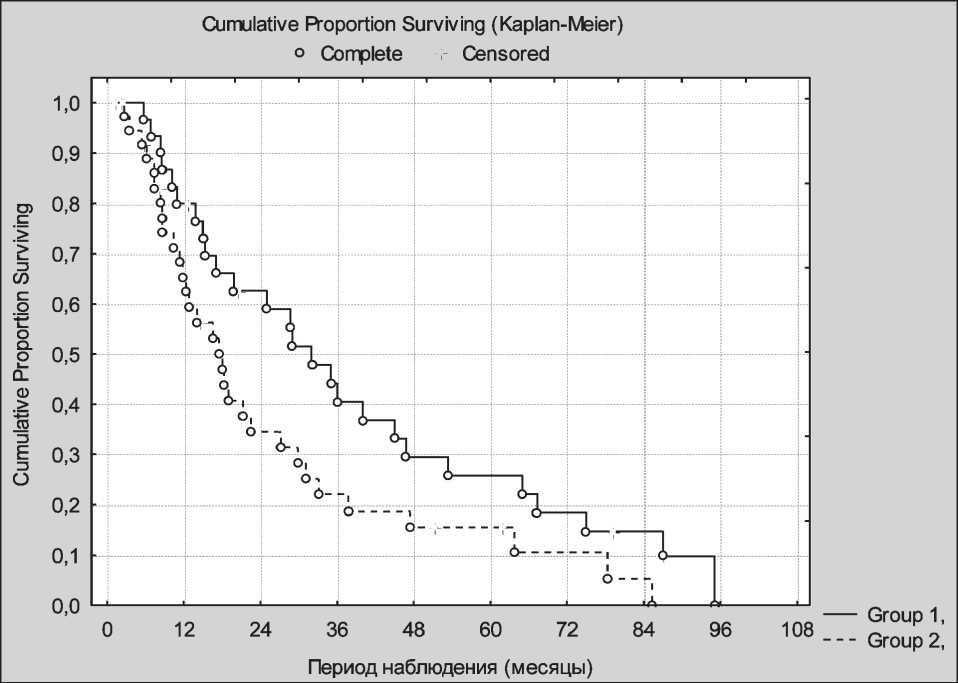
Рис. 1. Показатели отдаленной выживаемости пациентов с локализованным МРЛ в зависимости от метода лечения
– развитием лучевых реакций со стороны пищевода и лёгких.
На протяжении первых двух лет после лечения у 17 (54,8 %) человек из основной группы и 26 (68,4 %) – из контрольной было выявлено ре-цидивирование или прогрессирование МРЛ в регионарных и отдалённых лимфоузлах, втором лёгком, костях, головном мозге и других органах. В этих случаях были проведены паллиативные или симптоматические курсы ЛТ на вновь выявленные очаги в сопровождении II линии ХТ. В ряде случаев проведено несколько (в среднем 5–8) курсов химиолучевой терапии, что значительно увеличило продолжительность жизни данных больных.
Эзофагит I–II степени был наиболее частым проявлением острых лучевых реакций и, как правило, развивался при СОД 25–35 Гр. В 1-й группе он встречался несколько чаще, чем во 2-й – 83,9 % против 76,3 %. Назначалась симптоматическая терапия. Миелотоксичность I–II степени в сравниваемых группах встречалась с одинаковой частотой – у 12 (38,7 %) и 13 (34,2 %) больных соответственно. Ни в одном случае тяжесть острых реакций не являлась причиной незапланированного перерыва лучевой терапии. Токсичность III степени по шкале RTOG со стороны легкого встречалась в 3,2 %, перикарда – в 6,5 %, соответственно у 1 и
2 пациентов 1-й группы (таблица). Эзофагитов и эпидермитов III–IV степени не наблюдалось.
По данным литературы, после радикального курса ЛТ развиваются лучевые повреждения лёгких и сердца, которые в некоторых случаях осложняются дыхательной недостаточностью, сердечной недостаточностью, кровохарканием, лёгочным кровотечением [2, 7]. Указанная патология требует коррекции в амбулаторных или стационарных условиях. В абсолютном большинстве случаев лечение больных осуществляется консервативными методами. Используются противовоспалительные, антибактериальные, бронхо-муколитические, кар-диотропные средства. По показаниям – бронхоскопические и трансторакальные санации. Успешная коррекция указанной выше патологии позволяет осуществлять и продолжать специфическое хи-миолучевое лечение.
Международная практика показывает, что нельзя анализировать общую выживаемость пациентов с данной патологией без изучения химиолучевых реакций и повреждений. Они лимитируют как количество курсов ХТ, так и суммарные дозы облучения. В обеих группах больных не было зафиксировано ни одного случая смерти в процессе лечения, тогда как в мировой практике при использовании конформной лучевой терапии, аппаратов
Таблица
|
Лучевые повреждения |
I ст. |
II ст. |
III ст. |
Всего |
|
|
Пневмонит/ |
1-я группа |
9 (29,0 %) |
7 (22,6 %) |
1 (3,2 %) |
17 (54,8 %) |
|
пневмофиброз |
2-я группа |
13 (34,2%) |
9 (23,7%) |
- |
22 (57,9%) |
|
Перикардит |
1-я группа |
6 (19,4%) |
4 (12,9%) |
2 (6,5%) |
12 (38,7%) |
|
2-я группа |
11 (28,9%) |
7 (18,4%) |
- |
18 (47,4%) |
|
Частота и степень тяжести лучевых повреждений в сравниваемых группах
с модуляцией интенсивности ионизирующего излучения наблюдается до 5 % летальных исходов, непосредственно связанных с лечением [7].
Проведено изучение факторов прогноза: стадия, величина и локализация опухоли, степень регрессии, методика облучения. Единственным фактором прогноза, оказавшим достоверное влияние на 5-летнюю общую выживаемость в обеих изучаемых группах больных, оказалась полная регрессия новообразования, что соответствует мировому опыту [4, 11]. Таким образом, наше исследование проведено в соответствии с принятыми в международной практике методами лечения данной группы больных [6, 9]. Все больные получили химиолуче-вое лечение – «раннюю ЛТ», при которой доказаны лучшие результаты выживаемости [5, 10]. Нами подтверждено радиобиологическое обоснование применения ускоренных курсов дистанционной лучевой терапии этого агрессивного злокачественного новообразования. Очевидно, что сокращение длительности курса лучевой терапии усиливает подавление пролиферативного пула клеток МРЛ и приводит к увеличению продолжительности жизни пациентов.
Заключение
Методика неравномерного дробления дневной дозы лучевой терапии на две фракции 1 + 1,5 Гр с 5–6-часовым интервалом удовлетворительно переносится больными при лечении МРЛ IIВ–IIIА стадии. Показатели 5-летней выживаемости составили 26,2 % против 16,5 % при традиционном фракционировании дозы облучения, p=0,048 (LogRank test). Таким образом, методика ускоренного гиперфракционирования позволила достоверно увеличить пятилетнюю выживаемость у больных локализованной формой МРЛ. Перспективно дальнейшее совершенствование методик химио-лучевого лечения больных МРЛ с использованием ускоренного гиперфракционирования дозы и современных схем химиотерапии


