Сравнительная анатомо-морфологическая характеристика клеток эпидермиса и паренхимы коры гипокотиля у двух генотипов томата (Solanum lycopersicum L.) в условиях хлоридного засоления in vitro
Автор: Богоутдинова Л.Р., Баранова Г.Б., Баранова Е.Н., Халилуев М.Р.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические основы устойчивости, цитогенетические и биохимические маркеры
Статья в выпуске: 3 т.51, 2016 года.
Бесплатный доступ
Повышение устойчивости растений к неблагоприятным факторам окружающей среды относится к ключевым задачам современной сельскохозяйственной науки и производства. Томат ( Solanum lycopersicum L.) - культура, которая высокочувствительна к засолению. Понимание физиолого-биохимических и молекулярно-генетических адаптивных механизмов устойчивости растений томата к засолению как комплексного признака остается неотъемлемой составляющей многих фундаментальных исследований, результаты которых в последнее десятилетие все чаще находят практическое применение. Информация о влиянии хлорида натрия на мезоструктуру клеток различных тканей и органов у томата крайне ограничена. Целью настоящего исследования стало изучение мезоструктурной организации клеток эпидермиса и паренхимы коры гипокотиля двух хозяйственно ценных генотипов томата (селекционная линия ЯЛФ и сорт Рекордсмен), различающихся по солеустойчивости, в условиях хлоридного засоления in vitro. В эксперименте фрагменты асептических 10-12-суточных проростков томата с удаленными корнями переносили на агаризованную питательную среду Мурасиге-Скуга для индукции ризогенеза, которая содержала половинную концентрацию макро- и микросолей (1/2 МS), сахарозу (2 %) и 3-индолилмасляную кислоту (0,2 мг/л). В среду добавляли NaCl в концентрациях 0-250 мМ. На 8-е сут культивирования у укорененных проростков отбирали сегменты срединной части гипокотиля для проведения световой микроскопии. По результатам гистологического исследования были выявлены существенные различия между исследуемыми генотипами по размеру, а также форме эпидермальных и паренхимных клеток коры гипокотиля. Показано, что присутствие в среде ионов Na+ и Cl- значительно повлияло на размер межклетников в паренхиме коры гипокотиля, а также форму и площадь клеток эпидермиса и паренхимы у обоих генотипов томата. По сравнению с контролем (среда без добавления NaCl) достоверное уменьшение площади клеток эпидермиса (в 1,2 раза) и паренхимы коры (в 1,6 раза) гипокотиля у линии ЯЛФ наблюдалось уже в варианте 50 мМ NaCl. Уменьшение площади клеток этих типов тканей у сорта Рекордсмен происходило при большем содержании стрессового агента в питательной среде (100 и 150 мМ NaCl соответственно для клеток эпидермиса и паренхимы коры гипокотиля). При действии 250 мМ NaCl у линии ЯЛФ отмечалось резкое увеличение площади клеток в тканях обоих типов - до значений, которые существенно превышали таковые не только в других вариантах опыта, но и в контроле. Кроме того, в условиях сильного засоления у линии ЯЛФ происходило изменение формы клеток эпидермиса (они приобретали угловатые контуры) и паренхимы коры гипокотиля (сильное уплощение клеток). В отличие от линии ЯЛФ, у сорта Рекордсмен площадь эпидермальных и паренхимных клеток коры гипокотиля в условиях 0 и 250 мМ NaCl статистически значимо не различалась. Кардинальные различия между генотипами томата были установлены по площади межклеточного пространства в паренхимных клетках коры гипокотиля. В целом было установлено, что эпидермальные и паренхимные клетки гипокотиля томата сорта Рекордсмен менее чувствительны к присутствию в среде NaCl по сравнению с линией ЯЛФ. Выявленные изменения клеток по форме и размеру в этих типах тканей гипокотиля могут использоваться в качестве цитологических маркеров для сравнительной оценки генотипов томата по чувствительности и(или) устойчивости к засолению.
Томат, солевой стресс, анатомия гипокотиля, культивирование in vitro
Короткий адрес: https://sciup.org/142213940
IDR: 142213940 | УДК: 635.64:632.12:581.143:58.086 | DOI: 10.15389/agrobiology.2016.3.318rus
Текст научной статьи Сравнительная анатомо-морфологическая характеристика клеток эпидермиса и паренхимы коры гипокотиля у двух генотипов томата (Solanum lycopersicum L.) в условиях хлоридного засоления in vitro
Засоление относится к одним из главных стрессовых факторов, лимитирующих выращивание большинства сельскохозяйственных культур во многих агроклиматических зонах, значительно снижая качество продукции и урожайность (1). Согласно сведениям ФАО, площадь засоленных почв в мире, включая щелочное засоление, достигает 950 млн га. По раз- личным опубликованным данным, в мире от 33 до 50 % общей площади орошаемых земель подвержено засолению (2, 3). Томат (Solanum lycopersi-cum L.) высокочувствителен к засолению. Пороговое значение электропроводности почвенного раствора (ЕСе) для этой культуры составляет 2,5 дСм/м (4), что по классификации ФАО соответствует почве со слабой степенью засоления (ЕСе = 2,0-4,0 дСм/м).
Необходимое требование при изучении механизмов устойчивости растений к стрессовым абиотическим воздействиям, в частности к засолению, заключается в создании и поддержании контролируемых константных условий, что достаточно сложно достичь при тестировании в вегетационных сосудах в защищенном грунте или же вовсе невозможно при проведении полевых испытаний. Как известно, изменяющиеся факторы окружающей среды (температура, относительная влажность воздуха, интенсивность освещения, степень загрязненности воздуха и др.) кардинальным образом влияют на реакцию растений на засоление, что может привести как к ее усилению, так и к компенсации видимых проявлений (5, 6). Культивирование растений, а также их изолированных фрагментов, органов и тканей на питательных средах с добавлением токсичных ионов позволяет за сравнительно непродолжительный период провести скрининг потенциально устойчивых форм уже на ранних этапах развития, которые у многих культур, в том числе у томата, наиболее критические (2, 6). Немаловажно и то, что в ряде экспериментов установлена прямая корреляция между устойчивостью к засолению на стадии каллусной ткани in vitro и взрослых растений in vivo. Подобная тенденция отмечена у культурного и диких видов томата (7, 8), а также у растений семейства Cucurbtaceae (дыни, арбуза, огурца) (9).
В условиях засоления in vitro наблюдается ингибирование роста проростков и регенерантов томата по различным морфометрическим показателям, а также заметное снижение содержания хлорофилла в листьях (6, 8). Высокие концентрации хлорида или сульфата натрия приводят к изменению процессов дыхания, водного обмена и минерального питания (10-12). Это обусловлено гиперосмотическим и токсическим влиянием избыточных ионов (13, 14).
В последние десятилетия большое внимание исследователей уделено картированию локусов количественных признаков устойчивости томата к абиотическим стрессовым факторам, имеющим полигенную природу. Этот молекулярно-генетический подход находит применение в практической селекции при проведении маркер-опосредованного отбора растений томата с повышенной устойчивостью к засолению (15, 16). Существенный прогресс в понимании механизмов солеустойчивости достигнут за счет введения гетерологичных генов в растительный геном методами генетической инженерии. С использованием различных генно-инженерных стратегий к настоящему времени получены многочисленные сведения о трансгенных растениях томата, обладающих повышенной устойчивостью к засолению как in vitro, так и в условиях гидропоники и защищенного грунта (2, 5, 17). В то же время сведения о действии токсических ионов на мезострук-турную организацию тканей различных органов томата крайне ограничены (18-20). Новые знания в этой области в дополнение к молекулярно-генетическим и физиолого-биохимическим исследованиям будут способствовать большему пониманию адаптивных реакций растений на стрессовые условия, раскрытию механизмов устойчивости к засолению, разработке диагностических тестов и, в конечном итоге, повышению эффективности селекции на указанный признак.
Мы впервые на экспериментальной модели (два генотипа культурного томата с неодинаковой устойчивостью к засолению) сравнили анатомо-морфологические характеристики клеток эпидермиса и паренхимы коры гипокотиля в условиях in vitro при воздействии различных концентраций ионов Na + и Cl - .
Цель настоящего исследования — изучение мезоструктурной организации клеток эпидермиса и паренхимы коры гипокотиля у томата в условиях засоления NaCl.
Методика. Растительным материалом служили асептические проростки томата (Solanum lycopersicum L.) различающихся по солеустойчивости форм — более чувствительной селекционной линии ЯЛФ, используемой в качестве отцовской формы при получении гибрида F 1 Юниор, и более устойчивого сорта Рекордсмен. Донорные проростки получали из семян, которые подвергали поверхностной стерилизации в течение 10 с в 96 % этаноле, а затем в течение 7-8 мин в 20 % водном растворе хлорсодержащего коммерческого отбеливателя АСЕ с добавлением нескольких капель детергента Tween 20 («Merck», Германия). Обработанные семена 3-4 раза промывали дистиллированной водой и помещали в сосуды с питательной средой, основу которой составляют минеральные компоненты и витамины в соответствии с прописью Мурасиге-Скуга (MS) (21), с добавлением 3 % сахарозы и 0,7 % агара. У проростков на этапе образования 1-го настоящего листа отсекали корневую часть в районе гипокотиля таким образом, чтобы длина фрагментов составляла 1,5-2,0 см, после чего их переносили на среду для индукции ризогенеза ( 1 /2 дозы макро- и микросолей по прописи MS, 2 % сахарозы, 0,7 % агара, 0,2 мг/л 3-индолилмасляной кислоты) без NaCl (контроль) или с добавлением NaCl (опыт) в концентрациях 50, 100, 150, 200 и 250 мМ. Растения культивировали в контролируемых условиях световой комнаты при температуре 23 ° С, освещенности 3,0 клк и фотопериоде 16/8 ч (день/ночь).
На 8-е сут культивирования из срединной части проростков вырезали фрагменты гипокотилей размером 2-3 мм, фиксировали в 2,5 % растворе глутарового альдегида («Merck», Германия) на 0,1 М фосфатном буфере (рН 7,2) с добавлением 1,5 % сахарозы. Постфиксацию образцов в 1 % растворе OsO4 («Sigma», США), обезвоживание в этаноле повышающейся концентрации (30, 50, 70, 96 и 100 %), окиси пропилена («Fluka», Германия), и заключение в смесь эпоксидных смол EponTM 812 и Araldite («Merck», Германия) выполняли по стандартной методике (22). Полутон-кие срезы толщиной 1-2 мкм получали с помощью ультрамикротома LKB-V («LKB», Швеция) и монтировали на предметные стекла. Препараты просматривали и фотографировали, используя микроскоп Olympus BX51 («Olympus», Япония), оборудованный камерой Color View II («Soft Imaging System», Германия). Среднюю площадь клеток эпидермиса и паренхимы коры гипокотиля на срезе, а также площадь межклеточного пространства на срезе определяли с помощью программного обеспечения Cell-A («Olympus», Япония). Для каждого варианта проанализировали не менее 500 клеток каждого типа ткани (20-30 полутонких срезов), полученных от сегментов гипокотилей трех независимых проростков.
Статистическую обработку результатов проводили с использованием параметрических критериев Стьюдента, Фишера и Дункана. Расчеты осуществляли с помощью статистической программы AGROS (версия 2.11) и стандартных пакетов компьютерной программы Microsoft Excel 2007.
Результаты. Первичный ответ клеток на избыточное содержание ионов натрия и хлора заключается в регуляции водного и осмотического 320
гомеостаза за счет модификаций многих физиологических функций. Эта регуляция обеспечивается взаимодействием процессов, протекающих в цитоплазме клетки и ее оболочке, приводя тем самым к изменению размера и формы клеток в тканях (13, 23).
По результатам гистологического исследования мы выявили существенные различия между исследуемыми генотипами томата с неодинаковой солеустойчивостью по размеру и форме эпидермальных клеток гипокотиля у проростков, выращенных в контрольных условиях (без засоления). Так, средняя площадь клеток эпидермиса у линии ЯЛФ была в 1,3 раза больше, чем у сорта Рекордсмен (соответственно 843,5 и 644,5 мкм2) (рис. 1, А). Кроме того, эпидермальные клетки гипокотиля у линии ЯЛФ характеризовались более округлой формой (рис. 2, А). Анатомо-морфологические различия между генотипами были установлены и в отношении паренхимных клеток коры гипокотиля: у линии ЯЛФ они имели округлую форму (см. рис. 2, А), тогда как у сорта Рекордсмен — неправильную (см. рис. 2, Ж). При этом, как и в случае эпидермальных клеток, средняя площадь паренхимных клеток коры гипокотиля у линии ЯЛФ была значительно больше, чем у сорта Рекордсмен (см. рис. 1, Б).
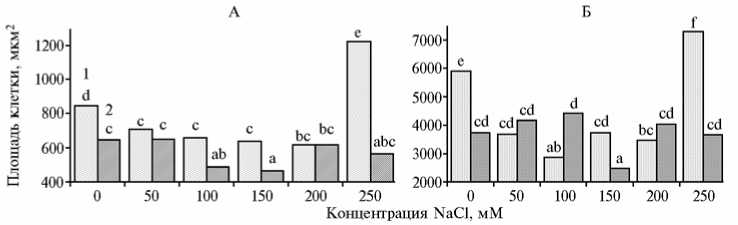
Рис. 1. Средняя площадь клеток эпидермиса (А) и паренхимы коры (Б) гипокотиля у проростков томата (Solanum lycopersicum L.) при культивировании in vitro на среде Мурасиге-Скуга с разным содержанием NaCl: 1 — линия ЯЛФ (менее солеустойчива), 2 — сорт Рекордсмен (более солеустойчив). Различия между вариантами, отмеченными одинаковыми буквами, статистически недостоверны по критерию Дункана ( а = 0,05).
Были установлены различия в реакции клеток гипокотиля по размеру и форме в зависимости от степени засоления, типа растительной ткани, а также генотипических особенностей (см. рис. 1, 2). Так, при культивировании проростков томата линии ЯЛФ на среде с добавлением наименьшей изученной концентрации NaCl (50 мМ) площадь эпидермальных клеток гипокотиля оказалась существенно меньше по сравнению с контролем (среда без засоления). Последующее повышение концентрации NaCl в среде до 200 мМ не приводило к изменению их размера, тогда как в условиях максимального хлоридного засоления наблюдалось значительное увеличение площади клеток, которая превышала соответствующие показатели не только в других вариантах опыта, но и в контроле. Кроме того, в условиях 250 мМ NaCl округлые клетки эпидермиса приобретали угловатые контуры (см. рис. 2, Е).
В отличие от линии ЯЛФ, достоверное снижение площади эпидермальных клеток гипокотиля у сорта Рекордсмен происходило при большей концентрации NaCl в среде (100 мМ). При 200 и 250 мМ NaCl наблюдалось увеличение площади клеток в этой ткани, и полученные значения были сравнимы с таковыми в контроле. Что касается формы, то в условиях умеренного и сильного засоления (концентрация NaCl 100 мМ и выше) эпидермальные клетки гипокотиля у томата сорта Рекордсмен приобретали более характерную для указанного типа ткани овально-продолговатую конфигурацию (см. рис. 2, И-М).

Рис. 2. Поперечные срезы срединной части гипокотиля у проростков томата (Solanum ly-copersicum L.) линии ЯЛФ (А-Е, менее солеустойчива) и сорта Рекордсмен (Ж-М, более солеустойчив) при культивировании in vitro на среде Мурасиге-Скуга с разным содержанием NaCl: А, Ж - без засоления; Б, 3 - 50 мМ NaCl; В, И - 100 мМ NaCl; Г, К - 150 мМ NaCl; Д, Л — 200 мМ NaCl; Е, М — 250 мМ NaCl. Звездочками отмечены паренхимные клетки коры гипокотиля, у которых наблюдается плазмолиз.
Клетки паренхимы коры гипокотиля, как и эпидермальные, оказались чувствительны к присутствию в среде NaCl, причем их реакция различалась между генотипами и зависела от степени засоления (см. рис. 1, Б). Так, добавление в состав питательной среды NaCl в концен-322
трациях 50 и 100 мМ приводило к существенному уменьшению площади паренхимных клеток в коре гипокотиля у проростков томата линии ЯЛФ. При больших концентрациях стрессора наблюдалось изменение их формы, выражающееся в сильном уплощении (см. рис. 2, Г-Е). В присутствии 250 мМ NaCl отмечалось значительное увеличение средней площади паренхимных клеток коры гипокотиля у линии ЯЛФ (более чем в 1,2 раза относительно контроля и в 2,0-2,5 раза — относительно других вариантов опыта).
В отличие от линии ЯЛФ, у томата сорта Рекордсмен 50 и 100 мМ NaCl засоление не приводило к уменьшению площади паренхимных клеток гипокотиля по сравнению с контролем. Напротив, наблюдалось их увеличение (площадь клеток при 50 и 100 мМ NaCl составила соответственно 4158 и 4412 мкм2), однако статистически значимых различий как между этими вариантами, так и с контролем установлено не было. Существенное уменьшение площади паренхимных клеток наблюдалось в том случае, когда проростки томата сорта Рекордсмен культивировали на среде с добавлением 150 мМ NaCl. Следует отметить, что присутствие в среде токсичных ионов в высоких концентрациях приводило к изменению конфигурации паренхимных клеток гипокотиля у указанного сорта. Как и в случае клеток эпидермиса, они приобретали более характерную для этого типа ткани округлую форму (см. рис. 2, К-М).
Уменьшение площади клеток эпидермиса (у обоих генотипов) и паренхимных клеток коры гипокотиля томата (у линии ЯЛФ) в сочетании с изменением их формы в условиях умеренного хлоридного засоления можно рассматривать в нескольких аспектах. С одной стороны, это может быть положительной адаптивной реакцией клеток на стрессовые условия. Известно, что нарушение водного баланса растений при действии NaCl, выражающееся в снижении оводненности тканей, приводит к уменьшению размера клеток и, тем самым, понижает осмотический потенциал клеточного сока (24, 25). С другой стороны, не исключено, что уменьшение клеток в размере происходит вследствие ингибирования их роста растяжением за счет дезорганизации цитоскелета. Так, С. Wang с соавт. (26) показали, что при 12-часовом воздействии 150 мМ и 250 мМ NaCl наблюдалось увеличение количества полимерного актина и увеличение диаметра пучков филаментов в эпидермальных клетках корня, гипокотиля и семядольного листа у проростков Arabidopsis thaliana (L.) Heynh. Через 18 ч в присутствии 150 мМ NaCl организация актинового цитоскелета в этих клетках сохранялась, однако добавление 250 мМ NaCl приводило к распаду актиновых филаментов, а впоследствии — к гибели проростков.
Резкое увеличение площади клеток эпидермиса и паренхимы гипокотиля при культивировании проростков томата линии ЯЛФ на среде, содержащей 250 мМ NaCl, может быть связано с их гибелью. В пользу такого предположения свидетельствует то обстоятельство, что в указанных условиях у проростков происходил некроз участка гипокотиля, который находился в непосредственном контакте с питательной средой. Регенерацию корней у таких проростков не наблюдали. Кроме того (см. рис. 2, Е), мы отчетливо отмечали большое число паренхимных клеток с характерными признаками необратимого плазмолиза, что, по-видимому, приводило к их гибели и последующему набуханию мертвых клеток. Однако подобное предположение требует дополнительных доказательств с помощью электронной микроскопии и гистохимических методов.
Присутствие в среде токсичных ионов Na+ и Cl- вызывало измене- ние размеров межклетников в паренхиме коры гипокотиля, причем в зависимости от генотипа реакция была кардинально противоположной (табл.).
Площадь межклетников (мкм2) в паренхиме коры гипокотиля у изученных генотипов томата (Solanum lycopersicum L.) in vitro на среде Мурасиге-Скуга под влиянием разных концентраций NaCl
|
Концентрация NaCl, мМ |
Линия ЯЛФ (менее солеустойчива) |
Сорт Рекордсмен (более солеустойчив) |
|
0 |
108,8 8 |
92,1def 8 |
|
50 |
82,1bcde |
128,2h |
|
100 |
66,8ab |
103,4f 8 |
|
150 |
77,4abcd |
94,9def 8 |
|
200 |
87,7cdef |
67,2ab |
|
250 |
100,3ef 8 |
61,5ab |
Примечание. Различия между вариантами, отмеченными одинаковыми буквами, статистически недостоверны по критерию Дункана (а = 0,05).
Так, при действии 50 мМ NaCl у сорта Рекордсмен отмечали существенное увеличение межклеточного пространства по сравнению с контролем. Схожую реакцию, выражающуюся в увеличении объема межклетников в палисадном мезофилле настоящего листа, наблюдали ранее у проростков томата сортов Mariela и Cambell 28, выращенных в условиях почвенного засоления (75 и 150 мМ NaCl) (19). Повышение концентрации NaCl приводило к уменьшению площади межклетников у сорта Рекордсмен: при засолении 100 и 150 мМ она была сравнима с контролем, тогда как при больших концентрациях NaCl эта величина оказалась соответственно в 1,4 и 1,5 раза меньше.
В отличие от сорта Рекордсмен, размер межклетников паренхимных клеток коры гипокотиля у проростков томата линии ЯЛФ, культивируемых на среде с добавлением NaCl в концентрациях от 50 до 200 мМ, был значительно меньше по сравнению с контролем. Максимальная изученная концентрация стрессового агента приводила к увеличению площади межклетников, величина которой была сравнима с таковой в контрольном варианте.
Таким образом, представленные экспериментальные данные согласуются с полученными ранее результатами, когда было показано, что реакция клеток разных тканей на хлоридное засоление не только сильно варьирует на межвидовом уровне, но и зависит от особенностей конкретных анализируемых генотипов одного вида.
Итак, по результатам гистологического исследования установлены существенные различия между исследуемыми генотипами томата по размеру, а также форме эпидермальных и паренхимных клеток коры гипокотиля. Воздействие токсичных ионов Na + и Cl - оказывало значительное влияние на эти цитоморфологические параметры у обоих генотипов. Различия между генотипами отмечены и в отношении реакции межклетников в паренхиме коры гипокотиля в условиях засоления. Установлено, что чувствительность эпидермальных и паренхимных клеток гипокотиля к присутствию в среде NaCl у томата сорта Рекордсмен ниже, чем у линии ЯЛФ. Изменение размера и формы клеток указанных типов тканей при засолении NaCl in vitro может использоваться в качестве цитологических маркеров для сравнительной оценки генотипов томата по чувствительности и(или) устойчивости к солевому стрессу. При этом для получения наиболее объективных и достоверных результатов сравнительную оценку необходимо осуществлять в широком диапазоне концентраций стрессового агента по комплексу анатомо-морфологических показателей (размер и форма клеток).
Список литературы Сравнительная анатомо-морфологическая характеристика клеток эпидермиса и паренхимы коры гипокотиля у двух генотипов томата (Solanum lycopersicum L.) в условиях хлоридного засоления in vitro
- Boyer J.S. Plant productivity and environment. Science, 1982, 218: 443-448 ( ) DOI: 10.1126/science.218.4571.443
- Foolad M.R. Recent advances in genetics of salt tolerance in tomato. Plant Cell Tiss. Org. Cult., 2004, 76(2): 101-119 ( ) DOI: 10.1023/B:TICU.0000007308.47608.88
- Flowers T.J. Improving crop salt tolerance. J. Exp. Bot., 2004, 55(396): 307-319 ( ) DOI: 10.1093/jxb/erh003
- Chinnusamy V., Jagendorf A., Zhu J.-K. Understanding and improving salt tolerance in plants. Crop Sci., 2005, 45(2): 437-448 ( ) DOI: 10.2135/cropsci2005.0437
- Cuartero J., Bolarin M.C., Asins M.J. Moreno V. Increasing salt tolerance in the tomato. J. Exp. Bot., 2006, 57(5): 1045-1058 ( ) DOI: 10.1093/jxb/erj102
- Shibli R.A., Kushad M., Yousef G.G., Lila M.A. Physiological and biochemical responses of tomato microshoots to induced salinity stress with associated ethylene accumulation. Plant Growth Regulation, 2007, 51(2): 159-169 ( ) DOI: 10.1007/s10725-006-9158-7
- Perez-Alfocea F., Estañ M.T., Caro M., Bolarín M.C. Responses of tomato cultivars to salinity. Plant and Soil, 1993, 150(2): 203-211 ( ) DOI: 10.1007/BF00013017
- Cano E.A., Perez-Alfocea F., Moreno V., Caro M., Bolarín M.C. Evaluation of salt tolerance in cultivated and wild tomato species through in vitro shoot apex culture. Plant Cell Tiss. Org. Cult., 1998, 53(1): 19-26 ( ) DOI: 10.1023/A:1006017001146
- Baragé M. Identificación de fuentes de tolerancia a la salinidad y al. estrés hídrico en especies silvestres de la familia Cucurbitaceae. PhD thesis, Universidad Politęcnica de Valencia, 2002.
- Баранова Е.Н., Аканов Э.Н., Гулевич А.А., Куренина Л.В., Данилова С.А., Халилуев М.Р. Интенсивность темнового дыхания трансгенных растений томата, экспрессирующих ген FeSOD1, в условиях хлоридного и сульфатного засоления. Доклады РАСХН, 2013, 6: 13-16.
- Romero-Aranda R., Soria T., Cuartero S. Tomato plant-water uptake and plant-water relationships under saline growth conditions. Plant Sci., 2001, 160(2): 265-272 ( ) DOI: 10.1016/S0168-9452(00)00388-5
- Yadav S., Irfan M., Ahmad A., Hayat S. Causes of salinity and plant manifestations to salt stress: a review. J. Environ. Biol., 2011, 32(5): 667-685.
- Munns R., Tester M. Mechanisms of salinity tolerance. Annu. Rev. Plant Biol., 2008, 59: 651-681 (doi: 10.1146/annurev.arplant.59.032607.092911).
- Баранова Е.Н., Гулевич А.А. Проблемы и перспективы генно-инженерного подхода в решении вопросов устойчивости растений к засолению (обзор). Сельскохозяйственная биология, 2006, 1: 39-56.
- Foolad M.R. Genome mapping and molecular breeding of tomato. Int. J. Plant Genomics, 2007: 64358 ( ) DOI: 10.1155/2007/64358
- Monforte A.J., Asíns M.J., Carbonell E.A. Salt tolerance in Lycopersicon species. IV. Efficiency of marker-assisted selection for salt tolerance improvement. Theor. Appl. Genet., 1996, 93(5): 765-772 ( ) DOI: 10.1007/BF00224074
- Bhatnagar-Mathur M., Vadez Z., Sharma K.K. Transgenic approaches for abiotic stress tolerance in plants: retrospect and prospects. Plant Cell Rep., 2008, 27(3): 411-424 ( ) DOI: 10.1007/s00299-007-0474-9
- Al-Tardeh S., Iraki N. Morphological and anatomical responses of two Palestinian tomato (Solanum lycopersicon L.) cultivars to salinity during seed germination and early growth stages. Afr. J. Biotechnol., 2013, 12(30): 4788-4797 ( ) DOI: 10.5897/AJB12.2707
- Sam O., Ramírez C., Coronado M.J., Testillano P.S., Risueño M.C. Changes in tomato leaves induced by NaCl stress: leaf organization and cell ultrastructure. Biologia Plantarum, 2004, 47(3): 361-366 ( ) DOI: 10.1023/B:BIOP.0000023878.58899.88
- Строгонов Б.П., Кабанов В.В., Шевякова Н.И., Лапина Л.П., Комизерко Е.И., Попов Б.А., Достанова Р.Х., Приходько Л.С., Курсанов А.Л. Структура и функции клеток растений при засолении. М., 1970.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 1962, 15: 473-497 ( ) DOI: 10.1111/j.1399-3054.1962.tb08052.x
- Уикли Б. Электронная микроскопия для начинающих. М., 1975.
- Горшкова Т.А. Растительная клеточная стенка как динамичная система. М., 2007.
- Кудоярова Г.Р., Холодова В.П., Веселов Д.С. Современное состояние проблемы водного баланса растений при дефиците воды. Физиология растений, 2013, 60(2): 155-165 ( ) DOI: 10.7868/S0015330313020140
- Холодова В.П., Мещеряков А.Б., Александрова С.Н., Кузнецов Вл.В. Исследование неспецифической стрессорной реакции растений на шоковое действие абиотических факторов. Вестник Нижегородского государственного университета им. Н.И. Лобачевского. Серия биология, 2001, 1: 151-154.
- Wang C., Zhang L., Yuan M., Ge Y., Liu Y., Fan J., Ruan Y., Cui Z., Tong S., Zhang S. The microfilament cytoskeleton plays a vital role in salt and osmotic stress tolerance in Arabidopsis. Plant Biology, 2010, 12: 70-98 ( ) DOI: 10.1111/j.1438-8677.2009.00201.x


