Сравнительная фармакокинетика эритромицина при направленном клеточно-ассоциированном транспорте и внутривенном введении у пациентов с пневмонией
Автор: Гуревич К.Г., Романов М.Д., Беляев А.Н., Пятаев Н.А., Минаева О.В.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Реаниматология и интенсивная терапия
Статья в выпуске: 2, 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14718711
IDR: 14718711
Текст статьи Сравнительная фармакокинетика эритромицина при направленном клеточно-ассоциированном транспорте и внутривенном введении у пациентов с пневмонией
Воспалительные заболевания, требующие применения антибиотикотерапии, являются одной из наиболее частых клинических и амбулаторных патологий. Между тем разработка новых антибактериальных препаратов дорога, а с течением времени наблюдается пазвитис резистентности к антибиотикам [14]. Кроме того, ряд острых состояний требует назначения антибактериальных препаратов в столь высоких дозах, что при введении их в организм человека обычным образом они могут вызывать развитие токсических реакций [8]. Именно поэтому особенно актуальным является поиск новых путей введения уже известных антибактериальных препаратов в организм человека.
Одним из путей решения данной проблемы является направленный транспорт (НТ) антибиотиков, обеспечиваемый, например, за счет введения экстракорпорально обработанных препаратом форменных элементов крови [3, 4, И]. При этом клетки крови выделяются из организма человека, подвергаются инкубации с антибиотиком и возвращаются в организм. Из кровотока обработанные клетки поступают в очаг воспаления, где создают концентрации антибиотика, во много раз превышающие те, которых можно достичь при других путях введения препарата. При этом токсический эффект минимальный или отсутствует. Г. П Ге-нинг и др. считают, что их органоспецифичность будет определяться в первую очередь следующими свойствами: способностью лейкоцитов мигрировать в очаг воспаления, эритроцитов — фиксироваться эритрофагоцитирующими клетками (в основном печени и селезенки), тромбоцитов — адгезироваться на поврежденных участках интимы сосуда [3].
Д. А. Швецов полагает, что в качестве носителей наиболее обоснованно использование клеток белой крови с учетом их способности быстро накапливаться в области очага острого воспаления [11]. При этом доказано, что антибиотики поступают в очаг воспаления и концентрируются там в большей степени, чем при внутривенном пути введения [4] Однако при практической реализации НТ возникает задача создания комплекса «препарат — носитель», т. е. обеспечения достаточно полного и прочного связывания антибиотиков клетками. С этой точки зрения макролидные антибиотики являются особенно привлекательными, т. к. обладают способностью накапливаться в клетках, что делает везмож- ним реализацию НТ с помощью интактных форменных элементов.
Между тем, несмотря на очевидные преимущества направленного транспорта антибиотиков, целый ряд проблем остается нерешенным. В частности, не изучены особенности фармакокинетики препаратов при клеточно-ассоциированном введении, что и явилось целью настоящего исследования
Фармакокинетические исследования выполнены у 20 пациентов (16 мужчин и 4 женщины в возрасте от 21 до 48 лет), находившихся на стационарном лечении в больнице скорой медицинской помощи г. Саранска в 2002 — 2006 гг. с диагнозом «внегоспитальная пневмония» и получавших эритромицин в суточной дозе '20 мг/кг (по 500 мг трижды в день). Больные были разделены на 2 группы по 10 человек в каждой. В первой группе (контроль) антибиотик вводился внутривенно на интактном носителе (0,9 % раствор хлорида натрия). Время инфузии составляло 20 мин. Во второй группе (основная группа) проводилась клеточно-ассоциированная антибиотико-терапия (КААБТ) по методике Лохвицкого и др. [5]. С помощью роликового насоса либо самотеком в стерильный гемоконтейнер забирали 400 мл крови, используя в качестве стабилизатора 3.8 % раствор глюгииира в объемном соотношении кровь/стабилизатор 5:1. Кровь центрифугировали 15 мин при 3 000 об/мин, плазму удаляли плазмоэкстрак-тором. В клеточную массу добавляли эритромицин в дозе 500 мг. Инкубировали 30 мин при 37 °C, после чего реинфузировали. Сеансы клеточно-ассоциированной антибиотикоте-рапии проводились ежедневно до получения необходимого клинического эффекта.
Фармакокинетические исследования выполнялись после первого введения препарата. Забор проб крови производился через 5, 10, 15, 30, 45, 60, 90, 120, 150, 180, 240, 300, 540, 720 мин после окончания инфузии.
Определение концентрации эритромицина проводили методом ВЭЖХ на хроматографе «Милихром-5» по методике, описанной Т Cachet и др. [12]. Образцы крови отбирали в гепаринизированные пробирки и центрифугировали 10 мин при 1 500 об/мин. Плазму отбирали в другую центрифужную пробирку, смешивали с равным объемом ацетонитрила, интенсивно встряхивали в течение 10 — 15 с, после чего центрифугировали при 10 000 об/ мин. Полученный супернатант вводили в хроматограф. Для разделения использовали колонку Нуклеосил-100 С18 размером 25 см х х 4,6 мм (Элсико, Москва), подвижную фазу ацетонитрил-тетрабутиламмония сульфат (0,2 М, pH 6,5) — фосфатный буфер (0,2 М, pH 6,5) — вода в соотношении 40 : 5 : 5 : 50 (v/v/v/v), скорость потока — 1,5 мл/мин, УФ-детектор при длине волны — 215 нм.
Оценку клинической эффективности применения направленного транспорта антибиотика проводили при сравнении результатов лечения 40 больных, получавших антибиотик внутривенно, и 48 пациентов, которым проводилась клеточно-ассоциированная антибиоти-котерапия. Оценка клинической эффективности проводилась по следующим показателям: частота клинического излечения в каждой из групп (доля больных, у которых отмечалось улучшение состояния и отсутствовала необходимость в повторных курсах антибактериальной терапии), у каждого пациента определялась продолжительность лихорадочного периода, периода положительных физикальных симптомов. Кроме того, определялась частота встречаемости таких побочных эффектов, как диспептические расстройства (тошнота, рвота, диарея), гепатопатия (увеличение сывороточной концентрации аланиновой аминотрансферазы на 50 % от исходной), аллергические реакции.
Оценка достоверности различий результатов проводилась с использованием t-критерия Стьюдента..
При внутривенном пути введении эритромицина изменение его концентрации в плазме крови описывается одноэкспоненциальной моделью (рис. 1). Наблюдается хорошая аппроксимация экспериментальных данных этой моделью (г = 0,993...0,998). Константа элиминации эритромицина составляет 0,00907 ± ± 0,000789 (мин"1).
В отличие от внутривенного пути введения эритромицина при направленном транспорте препарата изменение его концентрации в плазме крови неудовлетворительно описывается одноэкспоненциальной моделью (рис. 2). Аппроксимацию экспериментальных данных в данном случае нельзя признать хорошей, особенно при большем времени наблюдения (г = 0,873..0,918). Наиболее простой фарма-
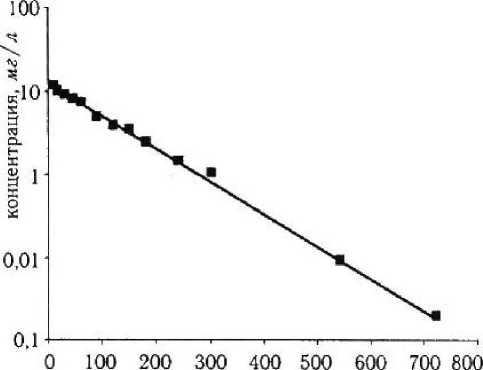
время, мин Рисунок /
Изменение концентрации эритромицина в плазме крови при внутривенном пути введении препарата и аппроксимация экспериментальных данных одноэкспоненциальной моделью (сплошная линия)
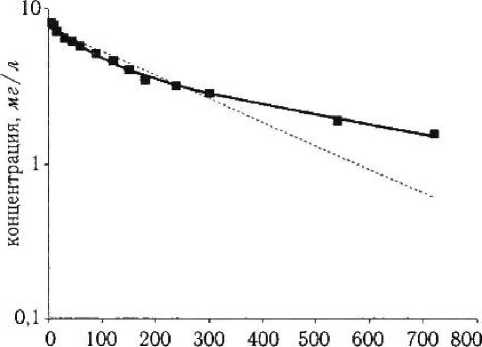
время, мин Рисунок 2
Изменение концентрации эритромицина в плазме крови при внутривенном пути введения препарата, аппроксимация экспериментальных данных одноэкспоненциальной (пунктирная линия) и двухэкспоненциальной (сплошная линия) моделью кокинетической моделью, позволяющей удовлетворительно описывать экспериментальные данные, является двухэкспоненциальная модель. При этом точность аппроксимации экспериментальных данных достаточно хорошая (г = 0,989.-0,997).
Таким образом, можно предположить, что ^тотгшил.зг'ггп'и’лппйо uuno ПТЗ» ПАТЛЫ А ЗПЫТПП-*--- — мицина приводит к появлению дополнительной экспоненты на фармакокинетической кривой. Это может свидетельствовать о модельном описании данных в виде двух камер, одна из которых является «депо» [1; 2]. При введении по методике НТ можно предположить, что подобным «депо» являются клетки крови. О том, что при экстракорпоральном введении появляется «депо» для эритромицина, свидетельствует следующий факт. Константы скорости элиминации эритромицина для экстракорпорального введения при аппроксимации экспериментальных данных двухэкспоненциальной моделью равны 0,00959 ± 0,00105 и 0,00188 ±
± 0,000298 (мин-1). При этом первая из констант, очевидно, отражает выведение находящегося в плазме крови эритромицина, т. к. она не отличается от таковой при внутривенном пути введения препарата. Вторая же экспонента, вероятно, отражает накопление эритромицина в клетках крови.
Для того чтобы при НТ клетки крови служили «депо» для эритромицина, необходимо связывание лекарственного вещества с ними. Косвенно о подобном связывании свидетельствует следующий факт. После инкубации антибиотика с клетками in vitro во вводимой среде преобладала клеточно-ассоциированная и^ГТк ППУПЯПЯТЯ КпипАитпятттлст АПЫТППМЬГТТТЛиЯ *---------------—'----- в плазме крови составила 731 ± 38 мг/л, а в клетках крови — 3567 ± 126 мг/л.
Изменение фармакокинетики антибиотика нашло отражение и в результатах его клинического применения. Следует отметить, что итоговый клинический эффект в сравниваемых группах значительно не различался, что, вероятно, связано с достаточно высокой чувствительностью к эритромицину актуальных для региона возбудители заболевания [9]. Однако в группе НТ отмечался более быстрый регресс проявлений пневмонии (табл. 1). Продолжительность лихорадочного периода и других клинических проявлений заболевания у больных второй группы была на 2 — 3 дня меньше, чем в первой группе.
Наиболее вероятным механизмом выявленных изменений является увеличение концентрации препарата в воспалительном очаге, которое, возможно, изменяет характер действия (с бактериостатического на бактерицидное) [9; 15]. Кроме того, может сказываться и бо-
Таблица I
Клиническая эффективность эритромицина при внутривенном введении и направленном клеточно-ассоциированном транспорте у больных со среднетяжелой внегоспитальной пневмонией
|
Показатель |
Значения показателя при различных способах введения |
Достоверность межгрупповых различий |
||
|
Внутривенно (п = 40) |
Направленный транспорт (п = 48) |
|||
|
Клиническая эффективность |
Абс |
36 |
45 |
> 0,05 |
|
% |
90,0 |
93,7 |
||
|
Продолжительность лихорадки, дни |
6,8 ± 1J |
4,7 ± 0,5 |
< 0,05 |
|
|
Продолжительность положительных физикальных симптомов, дни |
7.5 ± 0.9 |
5,2 ± 1,0 |
> 0,05 |
|
Таблица 2
Частота побочных эффектов антибиотикотерапии при внутривенном введении и направленном клеточно-ассоциированном транспорте эритромицина у больных со среднетяжелой в не госпитальной пневмонией
Кроме усиления основного эффекта, клеточно-ассоциированное введение изменяло частоту встречаемости побочных реакций на применение препарата. Как известно, побочные эффекты при применении эритромицина обычно отмечаются со стороны желудочно-кишечного тракта и обусловлены прокинетической активностью препарата (13; 16]. Частота выявления побочных эффектов терапии представлена в табл. 2. В группе больных, получавших эритромицин внутривенно, наиболее часто встречалась боль в животе и тошнота (в 32,5 и 30,0 % наблюдений соответственно). Диарея и повышение активности аланиновой трансаминазы отмечены в 12,0 и 7,5 % случаев.
При клеточно-ассоциированном введении частота побочных эффектов была меньшей, чем при внутривенном. Наиболее заметным было уменьшение встречаемости спастических абдоминальных болей (более чем в 2 раза по сравнению с контрольной группой, р < 0,05). Отмечалась также тенденция к снижению частоты тошноты и диарейного синдрома. Можно предположить, что уменьшение выраженности побочных эффектов связано со значительным снижением пиковой концентрации препарата, поскольку указанные эффекты в большинстве случаев прямо пропорциональны системной концентрации антибиотика (16; 18].
Таким образом, проведенные исследования продемонстрировали изменение фармакокинетической модели выведения эритромицина с одночастевой (при внутривенном введении) на двухчастевую (при введении по методике НТ), Элиминация эритромицина по одночастевой модели, наблюдаемая при внутривенном введении, согласуется с данными литературы [6; 9; 19] и свидетельствует о том, что скорости выведения препарата из внеклеточного и клеточного секторов равны или очень близки между собой.
При введении по методике НТ происходит значительное снижение пиковой концентрации, а также уменьшается скорость элиминации препарата по сравнению с внутривенным путем введения. Причина снижения плазменной Cmci заключается в том, что в момент введения большая часть препарата (около 80 %) депонирована в экстракорпорально обработанных форменных элементах. Видимо, данные клетки являются и тем «депо», из которого присходит замедленное высвобождение антибиотика, обус-ловаюшее появление дополнительной экспоненты на фармакокинетической кривой.
' Клиническое значение выявленных изменений плазменного фармакокинетического профиля заключается, прежде всего, в уменьшении частоты побочных эффектов терапии, которые обусловлены высокими системными концентрациями препарата. При интерпретации же усиления основного эффекта нужно учитывать не только изменения системной кинетики (хотя они тоже могут играть в этом определенную роль), но и возникающие при введении по методике НТ особенности распределения препарата в организме, в частности, накопление клеток, связавших антибиотик, в воспалительном очаге. Углубленное изучение названных особенностей позволит проводить фармакокинетическую оптимизацию антибио-тикотерапии и, возможно, приведет к разработке новых, более эффективных и безопасных, режимов дозирования препарата.
Исследование позволило нам сделать следующие выводы: 1) при введении эритромицина по методике направленного транспорта наблюдается изменение фармакокинетической модели по сравнению с внутривенным введением; 2) при направленном клеточно-ассоциированном транспорте эритромицина его максимальная концентрация и скорость изменения концентрации в плазме крови меньше, чем при внутривенном пути введения; 3) Клиническая эффективность внутривенного введения эритромицина и введения его по методике НТ достоверно не отличаются, однако при клеточно-ассоциированном введении терапевтический эффект наступает быстрее, а введение препарата реже сопровождается побочными реакциями.
Список литературы Сравнительная фармакокинетика эритромицина при направленном клеточно-ассоциированном транспорте и внутривенном введении у пациентов с пневмонией
- Белоусов Ю. Б. Общая и частная клиническая фармакокинетика/Ю. Б. Белоусов, К. Г. Гуревич. М.: Ремедиум, 2006. 807 с.
- Варфоломеев С. Д. Биокинетика: практический курс/С. Д. Варфоломеев, К. Г. Гуревич. М.: Фаир-пресс, 1999. 720 с.
- Генинг Т. П. Использование форменных элементов крови для направленной доставки химиотерапевтических и диагностических препаратов в очаг поражения/Т. П. Генинг, И. И. Колкер, Ж. Ш. Жумадилов//Антибиотики и химиотерапия. 1988. № 11. С. 867 -871.
- Гуляев А. Е. Лейкоцитарный транспорт антибиотиков/А. Е. Гуляев, С. В. Лохвицкий//Медицина и экология. 1996. № 1. С. 41 -47.
- Способ лечения хирургической инфекции/С. В. Лохвицкий, Г. Я. Кивман, А. Е. Гуляев, С. Г. Пьянов, Л. В. Губенко, В. Н. Зубцов. AC SU 1805390 А1.
- Макролиды/под ред. А. М. Попковой, А. Л. Верткина, С. В. Колобовой. М.: Диалог-МГУ, 2000. 108 с.
- Применение экстракорпоральной антибактериальной фармакотерапии у больных с хирургической инфекцией/А. Н. Вельских, В. Б. Потапчук, В. В. Лукин, А. Н. Плоцкий, А. А. Соколов, О. Ю. Стрельникова//Эфферентная терапия. 2003. Т. 9. № 1. С. 55 -56.
- Региональные особенности спектра возбудителей пневмонии/Н. А. Пятаев, И. С. Котлов, О. В. Минаева, Т. М. Романова//Тез. докл. X съезда анест. и реанимат. СПб., 2006. С. 336 -337.
- Страчунский Л. С. Макролиды в современной клинической практике/Л. С. Страчунский, С. Н. Козлов. Смоленск: Изд-во СГМУ, 1998. 506 с.
- Страчунский Л. С. Современная антимикробная химиотерапия/Л. С. Страчунский, С. Н. Козлов. М.: Боргес, 2002. 436 с.
- Швецов Д. А. Направленный транспорт антибиотиков в лечении острых неспецифических воспалительных заболеваний легких и плевры: автореф. дисс.. канд. мед. наук/Д. А. Швецов. Караганда 1996. 22 с.
- Cachet Т. Analysis of erythromycin estolate by liquid chromatography/T. Cachet, M. Delrue, J. Paesen, R. Busson, E. Roets, J. Hoogmartens. J Pharm Biomed Anal. 1992; 10 (10 -12): 851 -60.
- Downey К. M. Gastrointestinal side effects after intravenous erythromycin lactobionate/К. M. Downey, D. M. Chaput de Saintonge. Br. J. Clin. Pharmacol, 1986, 21: 295 -299.
- Neu H. C. Bacterial resistance to other agents. In: Antibiotics in Laboratory Medicine/H. C. Neu. Lorian V. (Ed.). 3rd ed. Baltimore etc., 1991: 714 -722.
- Norrby S. R. Safety and drug-drug interactions of macrolides, azalides, and streptogramins. In; New Macrolides, Azalides, and Streptogramins in Clinical Practice/H. C. Neu, L. S. Young, S. H. Zinner, J. F. Acar (Eds.). New York, etc., 1995: 61 -69.
- Peeters T. L. Erythromycin is a motilin receptor agonist/T. L. Peeters, G. Matthys, I. Depootere et al. Am-J. Physiol., 1989, 257: 470 -474.
- Periti P. Clinical pharmacokinetic properties of the macrolide antibiotics. Effects of age and various pathphysiological states (part I)/P. Periti, T. Mazzei, E. Mini et al. Clin. Pharmacokinet., 1989, 16: 193 -214.
- Tomomasa T. Erythromycin induces migrating motor complex in human gastrointestinal tract/T. Tomomasa, T. Kuruome, H. Arai et al. Digest. Dis. Sci., 1986, 31: 157 -161.
- Van Bambeke F. Macrolides: pharmacokinetics and pharmacodynamics/F. Van Bambeke, P. M. Tulkens. Intern J. Antimicrob Agents 2001; 18: 17 -23.


