Сравнительная характеристика кариометрических параметров микроспороцитов и клеток тапетума сформированных пыльников длинно- и короткостолбчатых растений Jasminum fruticans L. (Oleaceae)
Автор: Кузьмина Т.Н.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
В связи с изучением функциональной активности генеративных структур при гетеростилии проведен сравнительный кариометрический анализ клеток тапетума, а также микроспороцитов сформированных пыльников длинно- и короткостолбчатых растений Jasminum fruticans L. (Oleaceae). На основании измерения площадей ядра, ядрышка, подсчета количества ядер и ядрышек в клетках вычисляли суммарные значения площадей ядерных структур. Поскольку с ядрышками связаны процессы транскрипции и трансформации рибосомальной РНК (р-РНК), то состояние ядрышковых структур в клетке отражает уровень ее функциональной активности, поэтому в качестве характеристики функциональной активности клеток использовали значение ядерно-ядрышкового отношения (ЯЯО). Установлено, что у обеих флоральных форм в сформированном пыльнике преобладают двуядерные тапетальные клетки. Число ядрышек, приходящихся на клетку, варьирует от 1 до 14. У короткостолбчатых растений число тапетальных клеток с 6-8 ядрышками больше по сравнению с длинностолбчатыми растениями. Однако данный факт не отражается на значении ядерно-ядрышкового отношения. По функциональной активности клетки тапетума пыльников длинно- и короткостолбчатых растений не имеют статистически значимого различия. Сравнение кариометрических параметров микроспороцитов показало, что площади ядерных структур больше у длинностолбчатых растений, при этом они характеризуются более высоким значением ЯЯО (17.61±0.36) по сравнению с короткостолбчатыми растениями, у которых ЯЯО составляет 15.59±0.27. Понижение значения ЯЯО у короткостолбчатых растений является признаком усиления интенсивности белкового метаболизма их микроспороцитов, а следовательно, уровня функциональной активности их геномов. Различие функциональной активности микроспороцитов длинно- и короткостолбчатых растений может быть признаком проявления пола в зависимости от флорального морфологического типа растения.
Андроцей, гетеростилия, микроспорангий, пыльник, спорогенные клетки, стенка пыльника, ядерно-ядрышковое отношение, ядро, ядрышко, jasminum fruticans, oleaceae
Короткий адрес: https://sciup.org/147243405
IDR: 147243405 | УДК: 633.811:582.931:581.182.1:611.018.13 | DOI: 10.17072/1994-9952-2024-1-22-31
Текст научной статьи Сравнительная характеристика кариометрических параметров микроспороцитов и клеток тапетума сформированных пыльников длинно- и короткостолбчатых растений Jasminum fruticans L. (Oleaceae)
Гетеростилия покрытосеменных растений – это генетически контролируемый полиморфизм цветков, который связан с системой несовместимости. Явление гетеростилии, или разностолбчатости цветков, отмечено у представителей 36 семейств покрытосеменных растений [Агаджанян, 2000; Ganders 1979]. В зависимости от особенностей строения андроцея и гинецея цветка в пределах вида выделяют, как правило, две флоральные, или морфологические, формы. Цветки различных морфологических форм дифференцируются по высоте столбика пестика, форме рыльца пестика, размерам тычинок, пыльников, пыльцевых зерен [Pailler, Thompson, 1997; Tompson, Dommée, 2000; Klein, Freitas, Da Cunha, 2009; Valois-Cuesta, Soriano, Ornelas, 2011; Keller, de Vos, Conti, 2012]. Ключевым вопросом в изучении гетеростилии является выявление функционального значения полиморфизма цветков. Наиболее распространенным объяснением его биологической роли является свойственная гетеростильным видам гетероморфная несовместимость, при которой эффективным оказывается переопыление цветков, относящихся к различным морфологическим типам, т.е. когда пыльца из короткостолбчатых цветков попадает на рыльца длинностолбчатых цветков или наоборот. Как правило, у гетеростильных видов более эффективным является опыление, которое происходит между морфами, а опыление цветков внутри одной морфлогиче-ской формы показывает слабую завязываемость семян [Stevens, Murray, 1982; Valois-Cuesta, Soriano, Ornelas, 2011; Wu et al., 2015; Gao et al., 2021]. H.G. Baker было высказано предположение, что гетеростиль-ные виды можно рассматривать как переходную форму от гермафродитных видов к однополым растениям [Baker, 1960; Жинкина, 2000]. В частности, у Mussaenda pubescens (Rubiaceae) отмечены случаи редукции пыльников у длинностолбчатых цветков, и семязачатков – у короткостолбчатых [Li et al., 2010]. Проведенные ранее исследования генезиса пыльников и семязачатков дистильного вида Jasminum fruti-cans L. (Oleaceae) не выявили различий в ходе генезиса пыльников и семязачатков, а также редукции генеративных элементов коротко- и длинностолбчатых растений [Кузьмина, 2018, 2000; Шевченко, Плугатарь, 2019]. Однако флоральные формы J. fruticans различаются по долям морфологически нормальных пыльцевых зерен [Кузьмина, 2017]. Различия по фертильности пыльцевых зерен длинно- и короткостолбчатых растений указаны и для других гетеростильных видов ( Limonium caspium (Willd.) Gams., L. gmelinii (Willd.) O. Kuntzw, Goniolimon elatum (Fisch. ex Spreng.) Boiss . (Plumbaginaceae) [Демьянова, 2014], что может свидетельствовать о различной функциональной активности генеративных элементов флоральных форм гетеростильных видов.
Известно, что стенка гнезда (микроспорангия) сформированного пыльника состоит из нескольких слоев клеток, представленных эпидермисом, эндотецием, средним слоем и тапетумом, окружающих клетки спорогенной ткани [Батыгина, Васильева, 2002]. Наиболее функционально важными тканями микроспорангия являются спорогенная ткань и тапетум. Развитие спорогенной ткани приводит к формированию микроспороцитов – материнских клеток пыльцевых зерен. Tапетум как внутренний слой стенки микроспорангия, клетки которого непосредственно прилегают к спорогенной ткани, рассматривается как наиболее активная и чувствительная к стрессовым воздействиям соматическая ткань пыльника, которая в этот период функционирует как проводящая, обеспечивающая поступление питательных веществ к микроспороцитам [Резникова, 1984; Gothandam, Kim, Chung, 2007; Yeung et al., 2011]. Известно, что нарушения микроспорогенеза и формирования гаметофита сопряжены с морфоструктурными изменениями клеток тапетума, в которых изменения затрагивают главным образом эндоплазматический ретикулум [Vi- jayaraghavan, Ratnaparkhi, 1979; Gothandam, Kim, Chung, 2007; Shi et al., 2010; Du et al., 2019].
Для определения интенсивности функционирования клеточных структур служат ядерные и ядрышковые характеристики клеток, поскольку они отражают интенсивность белкового метаболизма клетки, а следовательно, дают представление о функциональной активности генома клетки [Челидзе, Зацепина, 1988; Архип-чук, 1995]. Определение числа ядрышек и их размеров позволяет дать оценку активности генов рибосомной РНК (рРНК) на цитологическом уровне [Архипчук, 1995], что служит основой для биотестирования и определения цитогенетической стабильности видов при воздействии различных внешних факторов [Дуброва, 1989; Архипчук, 1995; Владимирова, Муратова, 2005; Калаев и др., 2009]. Кариометрические исследования репродуктивных структур высших растений [Резникова, Бугара, 1979; Романова, Третьякова, 2005; Трочин-ская, Бланковская, Тоцкий, 2010] не затрагивают вопросы гетеростилии видов.
Цель работы – сравнительная кариометрическая характеристика микроспороцитов и тапетальных клеток у сформированных пыльников длинно- и короткостолбчатых растений J. fruticans в связи с определением уровня их функционального состояния у растений различных флоральных (морфологических) форм.
Материалы и методы исследования
Jasminum fruticans L. (жасмин кустарниковый) – дистильный вид флоры стран Средиземноморья, Западной Европы, Малой Азии, Черноморского побережья Кавказа, а также Южного берега Крыма [Голубев, 1996]. Для исследования пыльников длинно- и коротостолбчатых растений J. fruticans брали терминальные бутоны длиной 1.5–2 мм. Сбор материала проводили на территории Никитского ботанического сада (г. Ялта, Республика Крым; 44°30ʹ34ʺс.ш. 34°13ʹ58ʺ в.д.) в 2019–2021 гг. Для приготовления постоянных препаратов бутоны фиксировали в смеси F. A. A. (formalin : acetic acid : alcohol 70%). Материал обезвоживали с помощью изопропилового спирта, после чего делали постоянные препараты бутонов. Препараты окрашивали гематоксилином и алциановым синим, учитывая, что гематоксилин обеспечивает визуализацию базофильных структур, к которым относятся ядра и РНК-содержащие структуры [Коржев-ский, 2007], а алциановый синий дает интенсивную окраску клеточных стенок, что позволяет четко идентифицировать границы клеток. Анализ препаратов проводили с помощью микроскопа AxioScope A.1 (Carl Zeiss, Germany) и цифровой камеры AxioCamERc5s (Carl Zeiss, Germany). Для каждой флораль-ной формы на поперечных срезах пыльников делали измерения клеток 30 пыльников. Кариометрические показатели получены с помощью программы AxioVision Rel. 4.8.2. (Carl Zeiss, Германия). Основными параметрами измерений были площадь клетки, площадь ядра и площадь ядрышка. В случае многоядерных и многоядрышковых структур определяли их суммарную площадь. Кроме того, подсчитывали количество ядер и ядрышек, приходящихся на клетку. Ядерно-ядрышковое отношение (ЯЯО) определяли как отношение площади ядра к площади ядрышка, в случае многоядерных и многоядрышковых клеток вычисления проводили, используя суммарные показатели.
Вычисления и статистическую обработку данных делали в программном приложении Statistica 10.0 (StatSoft. Ins., USA). Определение статистически значимых различий проводили на основании t-критерия Стьюдента и критерия Фишера (F-критерий) при уровне статистической значимости p < 0.05. Сравнение выборочных долей клеток по числу ядер осуществляли с помощью критерия χ2 Пирсона [Гашев, Бетляе-ва, Лупинос, 2018]. Кариометрические данные представлены в виде: Х ± S x , где X – среднее арифметическое, S x – стандартная ошибка среднего.
Результаты исследования
Развитие стенки микроспорангия J. fruticans идет в центробежном направлении, при котором деление клеток первичного париетального слоя приводит к формированию тапетума и вторичного париетального слоя. Деление последнего в свою очередь дает начало эндотецию и среднему слою. Таким образом, у J. fruticans тапетум является производным первичного париетального слоя, который в сформированном микроспорангии многослойный, секреторного типа (рис. 1). Установлено, что в тапетуме сформированных пыльников J. fruticans преобладают двуядерные клетки. Так, в тапетуме длинностолбчатых растений 73.7% клеток двуядерные, а у короткостолбчатых растений их доля составляет 69.7%, что не представляет статистически значимого различия (χ2 = 3.94; df = 1; p = 0.05).
Известно, что для многоядрышковых клеток наиболее информативным показателем оценки функциональной активности генетического аппарата считается число ядрышек в клетке [Архипчук, 1995]. Количество ядрышек в тапетальных клетках варьирует от 1 до 14, при этом преобладают двуядрышковые клетки, что объясняется наличием двух ядер в большинстве клеток данной ткани. Так, у длинностолбчатых растений количество таких клеток составляет 48.3%, а у короткостолбчатых – 46.4% (рис. 2). Однако встречаются и клетки, ядра которых содержат большее число ядрышек. Показано, что у короткостолбчатых растений доля клеток, содержащих 6–8 ядрышек, выше, чем у длинностолбчатых растений. Клетки, содержащие более 9 ядрышек, встречаются у обеих флоральных форм лишь в единичных случаях.
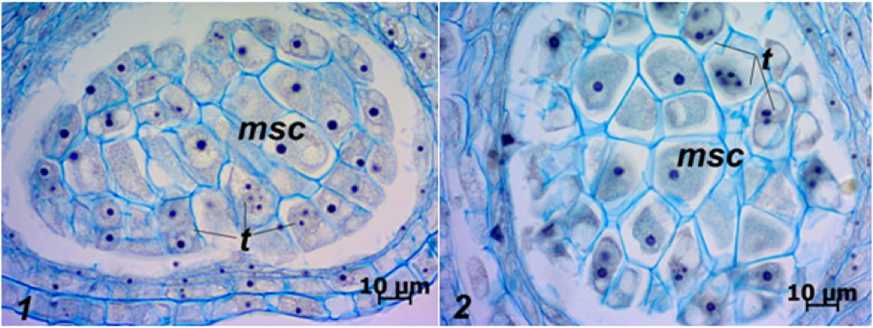
Рис. 1. Поперечные срезы микроспорангиев длинно- ( 1 ) и короткостолбчатых ( 2 ) растений J. fruticans : msc – микроспороциты; t – тапетум
[Cross section of microsporangium of long-styled ( 1 ) and short-styled ( 2 ) of J. fruticans : msc – microsporocytes; t – tapetum]
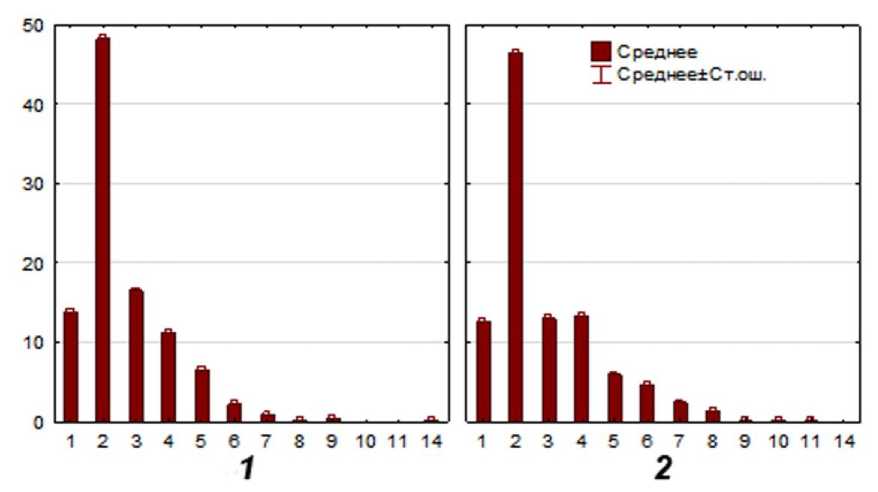
Рис. 2. Суммарное число ядрышек в клетках тапетума сформированных пыльников длинно- ( 1 ) и короткостолбчатых ( 2 ) растений J. fruticans .
Ось X – число ядрышек в ядре; Ось Y – процент клеток от общего числа проанализированных клеток
[The total number of nucleolus in tapetum cells of the formed anthers of long-styled ( 1 ) and short-styled ( 2) plants J. fruticans.
X axis – number of nucleoli in cell’s nuclear; Y axis – percentage of cells from the total number of cells analyzed]
Данные кариометрического анализа тапетальных клеток представлены в табл. 1. Клетки тапетума короткостолбчатых растений содержат более крупные ядра, суммарная площадь их ядрышек также оказывается больше по сравнению с длинностолбчатыми растениями. При этом, несмотря на статистически значимое различие клеток тапетума флоральных форм по площадям ядер и ядрышек, значения ЯЯО у них выражено слабо. Хотя можно отметить, что в сформированных пыльниках длинностолбчатых растений клетки тапетума по ЯЯО незначительно превышают аналогичный показатель короткостолбчатых. Анализ кариометрических параметров клеток тапетума сформированных пыльников длинно- и короткостолбчатых растений J. fruticans показал, что у обеих флоральных форм преобладают двуядерные клетки. В каждом ядре, как правило, содержится по одному ядрышку, а суммарное количество ядрышек на клетку равно двум. Таким образом, преобладают двуядрышковые тапетальные клетки. У короткостолбчатых растений, как упоминалось выше, чаще отмечаются клетки, содержащие более 5 ядрышек, что отражается на увеличении суммарной площади ядрышек, кроме того, они имеют более крупные ядра. Однако, в целом, это не оказывает статистически значимого влияния на показатели функциональной активности тапетальных клеток сравниваемых флоральных форм.
Таблица 1
Кариометрические параметры клеток тапетума сформированных пыльников длинностолбчатых и короткостолбчатых растений J. fruticans
[Karyometric parameters of tapetum cells of formed anthers of long-styled and short-styled plants J. fruticans ]
|
Параметр |
Длинно-cтолбчатые (n=1000) |
Короткостолбчатые (n=1000) |
t-критерий |
р-уровень |
|
Суммарная площадь ядер, мкм2 |
83.25±1.13 |
90.16±1.34 |
-3.95 |
0.001** |
|
Суммарная площадь ядрышек в клетке, мкм2 |
8.36±0.14 |
9.01±0.12 |
-3.46 |
0.001** |
|
Ядерно-ядрышковое отношение (ЯЯО) |
10.98±0.14 |
10.67±0.14 |
1.54 |
0.12ns |
Примечание. n – количество проанализированных клеток; ns – отсутствует статистически значимое различие при уровне статистической значимости p < 0.05; ** – различие статистически значимо при p < 0.05.
Микроспороциты у J. fruticans в гнезде пыльника расположены двумя–четырьмя рядами (см. рис. 1). Это крупные клетки, площадь которых варьирует в зависимости от морфотипа растения. Площадь поперечного сечения микроспороцитов в пыльниках у длинностолбчатых растений составляет 351.52±4.20 мкм2, а у короткостолбчатых – 330.27±3.92 мкм2. Микроспороциты J. fruticans содержат одно крупное ядро, занимающее центральное положение, в котором четко выражено одно ядрышко. Лишь в редких случаях отмечается образование двух–трех ядрышек. Для клеток с небольшим количеством ядрышек информативной характеристикой их функциональной активности является размер одиночных ядрышек [Архипчук, 1995]. Однако этот показатель относителен, поскольку размеры клеток и ядер у флоральных форм также различны (табл. 2).
Таблица 2
Кариометрические параметры микроспороцитов длинностолбчатых и короткостолбчатых растений J. fruticans
[Karyometric parameters of tapetum cells of formed anthers of long-styled and short-styled plants J. fruticans ]
|
Показатель |
Длинно-cтолбчатые (n=600) |
Короткостолбчатые (n=600) |
t-критерий |
р-уровень |
|
Площадь ядра, мкм2 |
134.50± 2.12 |
112.26± 1.53 |
8.52 |
0.001** |
|
Площадь ядрышка в клетке, мкм2 |
8.36± 0.11 |
7.72± 0.09 |
4.41 |
0.001** |
|
Ядерно-ядрышковое отношение (ЯЯО) |
17.61± 0.36 |
15.59± 0.27 |
4.52 |
0.001** |
Примечание. ** – различие статистически значимо при p < 0.05.
Поэтому наиболее объективную картину функциональной активности клетки демонстрирует ядерно-ядрышковое отношение (ЯЯО), свидетельствующее об интенсивности белкового метаболизма клетки [Машкин, Назарова, 1976; Хроленко и др., 2011]. У микроспороцитов короткостолбчатых растений ЯЯО меньше (15.59± 0.27) по сравнению с длинностолбчатыми растениями (17.61± 0.36).
Обсуждение результатов
Известно, что с увеличением размеров ядрышка в ядре снижается значение ЯЯО, что характерно для клеток, у которых наблюдается усиление активности белоксинтезирующей системы клетки. Следовательно, можно говорить, что у флоральных форм J. fruticans материнские клетки микроспор являются функционально неоднородными: бо́льшую интенсивность белкового метаболизма проявляют микроспоры пыльников короткостолбчатой формы. Как правило, увеличение активности ядрышковых организаторов хромосом, сопровождающееся снижением показателей ЯЯО, наблюдается при стрессовых повреждающих факторах (низких и высоких температурах. засухи. засоления. антропогенных воздействий и др.), что приводит к синтезу «стрессовых белков», являющихся ответной на цитологическом уровне адаптивной реакцией на стресс [Дуброва, 1989; Калаев и др., 2005; Вострикова, 2010; Калашник, 2013]. Таким образом, ядерно-ядрышковое отношение служит кариологическим признаком адаптивной устойчивости клеток. Как отмечалось выше, у дистильного вида J. fruticans микроспороциты короткостолбчатой формы имеют меньшее значение ЯЯО, что позволяет рассматривать их как более стабильную клеточную структуру по сравнению с аналогичными клетками длинностолбчатой формы. Характерно, что у длинностолбчатой формы дистильного вида Mussaenda pubescens (Rubiaceae) наблюдали процессы дегенерации пыльников [Li et al., 2010], что служит признаком функционального разделения полов в зависимости от морфологического типа растений. Процессы дегенерации генеративных элементов отмечены и у растений, отнесенных к группе потенциально обоеполых. Как правило, у этих растений в женских цветках деструктивные процессы в микроспорангиях проявляются в мейотический и постмейотический периоды, при этом на ранних этапах развитие и формирование клеточных слоев стенки микроспорангия, в том числе и тапетальной ткани, проходит без аномалий [Кордюм, Глущенко, 1976; Nugent et al., 2019]. В этом плане соотношение ядрышковой активности микроспороцитов и клеток тапетума пыльников длинно- и короткостолбчатых растений у J. fruticans может свидетельствовать о сходстве тенденции процессам развития пыльников, которые наблюдаются в пестичных и тычиночных цветках диэцичных растений с рудиментами органов другого пола. В частности, как пример переходной формы от гетеростилии к диэции, рассматривается Morinda parvifolia Bartl. ex DC. (Rubiaceae), у которого, несмотря на продуцирование морфологически одинаковых пыльцевых зерен растениями обеими флоральными формами, жизнеспособность пыльцы короткостолбчатых растений (S-форма) выше, чем у длинностолбчатых растений (L-форма) [Liu et al., 2012].
Заключение
В тапетуме сформированных пыльников у обеих флоральных форм J. fruticans преобладают двуядерные клетки, суммарное число ядрышек в которых равно двум. У короткостолбчатых растений по сравнению с длинностолбчатыми выше число клеток, в которых находится 6–8 ядрышек, что отражается на показателях суммарной площади ядрышек. Однако значение функциональной активности клеток тапетума длинно- и короткостолбчатых растений, оцениваемой как значения ядерно-ядрышкового отношения, не имеют статистически значимых различий.
Микроспороциты J. fruticans различаются по цитометрическим параметрам в зависимости от фло-ральной формы растения. Площади клеток и ядерных структур больше у длинностолбчатых растений.
Кариометрический анализ микроспороцитов показал статистически значимое снижение ядерно-ядрышкового отношения у короткостолбчатых растений по сравнению с длинностолбчатыми, что характеризует усиление функционирования их белоксинтезирующей системы. Данный факт можно рассматривать как проявление дифференциации функционирования мужской генеративной системы вида в зависимости от флорального (морфологического) типа растения
Список литературы Сравнительная характеристика кариометрических параметров микроспороцитов и клеток тапетума сформированных пыльников длинно- и короткостолбчатых растений Jasminum fruticans L. (Oleaceae)
- Агаджанян А.М. Распространённость и распределение гетеростилии в системе покрытосеменных растений // Успехи современной биологии. 2000. Т. 120, № 4. С. 348-360.
- Архипчук В.В. Использование ядрышковых характеристик в биотестировании // Цитология и генетика. 1995. Т. 29, № 3. C. 6-12.
- Батыгина Т.Б., Васильева В.Е. Размножение растений. СПб.: Изд-во СПб. ун-та, 2002. 232 с.
- Владимирова О.С. Муратова Е.Н. Кариологические особенности ели сибирской (Picea obovata Ledeb.) в условиях антропогенного загрязнения г. Красноярска // Экологическая генетика. 2005. Т. 3, № 1. С. 18-23.
- Вострикова Т.В. Эколого-физиологическая реакция семенного потомства древесных растений на стресс // Вестник Воронежского государственного университета. Сер. География. Геоэкология. 2010. № 1. С. 87-91.
- Гашев С.Н., Бетляева Ф.Х., Лупинос М.Ю. Математические методы в биологии. Анализ биологических данных в системе Statistica. М.: Юрайт, 2018. 208 с.
- Голубев В.Н. Биологическая флора Крыма. Ялта, 1996. 126 с.
- Демьянова Е.И. О полиморфизме некоторых гетеростильных растений лесостепного Зауралья // Вестник Пермского университета. Сер. Биология. 2014. Вып. 2. С. 10-17.
- Дуброва А.Н. Ядрышковые организаторы хромосом как адаптивный элемент вида // Журнал общей биологии. 1989. Т. 50, № 2. С.213-217.
- Жинкина Н.А. Гетеростилия // Эмбриология цветковых растений. Терминология и концепции. СПб.: Мир и семья. 2000. Т. 3. С. 82-83.
- Калаев В.Н. и др. Влияние низких активностей радона на ядерные структуры клеток апикальной меристемы корней Zebrina pendula Shcnizl (ядрышковый тест) // Вестник Воронежского государственного университета. Сер. География. Геоэкология. 2005. № 1. С. 80-85.
- Калаев В.Н. и др. Цитогенетические характеристики семенного потомства деревьев березы повислой в Хреновском бору // Лесоведение. 2009. № 3. С. 43-51.
- Калашник Н.А. Оценка функциональной активности ядрышковых организаторов хромосом у лиственницы Сукачева в условиях техногенного загрязнения // Вестник Оренбургского университета. 2013. 10 (159). С. 195-197.
- Кордюм Е.Л., Глущенко Г.И. Цитоэмбриологические аспекты проблемы пола покрытосеменных. Киев: Наукова думка, 1976. 200 с.
- Коржевский Д.Э. Применение гематоксилина в гистологической практике // Морфология. 2007. Т. 132, № 6. С. 77-82.
- Кузьмина Т.Н. Диморфизм цветков Jasminum fruticans L. // Вестник Пермского университета. Сер. Биология. 2017. Вып. 3. С. 233-239.
- Кузьмина Т.Н. Формирование мужских генеративных структур у Jasminum fruticans (Oleaecae) // Ботанический журнал. 2018. Т. 103, № 5. С. 654-663.
- Кузьмина Т.Н. Формирование семязачатка и семени Jasminum fruticans (Oleaceae) // Ботанический журнал. 2020. Т. 105, № 9. С. 919-930.
- Машкин С.И., Назарова М.Н. Сезонная динамика числа и размеров ядрышек. ядер и ядерно-ядрышковых отношений у представителей подсем. Сливовых при их интродукции // Цитология. 1976. Т. 18, № 12. С. 1438-1443.
- Резникова C.A. Цитология и физиология развивающегося пыльника. М.: Наука, 1984. 272 с.
- Резникова С.А., Бугара А.М. Функциональные изменения объема ядер в тканях развивающегося пыльника лилии // Цитология. 1979. Т. 21, № 6. С. 671-677.
- Романова Л.И., Третьякова И.Н. Особенности микроспорогенеза у лиственницы сибирской, растущей в условиях техногенного стресса // Онтогенез. 2005. Т. 36, № 2. С. 128-133.
- Трочинская Т.Г., Бланковская Т.Ф., Тоцкий В.М. Количественные признаки клеток мужских генеративных структур пшеницы, ржи и пшенично-ржаных гибридов в микроспорогенезе // Цитология и генетика. 2010. Т. 4. С. 48-54.
- Хроленко Ю.А. и др. Количественные характеристики ядрышек в клетках Panax ginseng in vivo и in vitro // Turczaninowia. 2011. T. 14, № 1. С. 104-108.
- Челидзе П.В., Зацепина О.В. Морфофункциональная классификация ядрышек // Успехи современной биологии. 1988. Т. 105, № 2. С. 252-258.
- Шевченко С.В., Плугатарь Ю.В. Исследования репродуктивной биологии семенных растений в Никитском ботаническом саду // Сборник научных трудов ГНБС. 2019. Т. 149. С. 177-198. URL: https://doi.org/10.36305/0201-7997-2019-149-177-198 (дата обращения: 19.07.2023).
- Baker H.G. Reproductive methods as factors in speciation in flowering plants // Cold Spring Harbor symp. Quant. Boil. 1960. Vol. 24. P. 177-191.
- Du K. et al. Abnormal tapetum development and energy metabolism associated with sterility in SaNa-1A CMS of Brassica napus L. // Plant Cell Rep. 2019. Vol. 38. P. 545-558. URL: https://doi.org/10.1007/s00299-019-02385-2 (дата обращения: 19.07.2023).
- Ganders F.R. The biology of heterostyly // New Zealand Journal of Botany. 1979. Vol. 17. P. 607-635. URL: https://doi.org/10.1080/0028825X.1979.10432574 (дата обращения: 19.07.2023).
- Gao S. et al. The nonreciprocal heterostyly and heterotypic self-incompatibility of Ceratostigma will-mottianum // J. Plant Res. 2021. Vol. 134. P. 543-557. URL: https://doi.org/10.1007/s10265-021-01269-5 (дата обращения: 19.07.2023).
- Gothandam K.M., Kim E.S., Chung Y.Y. Ultrastructural study of rice tapetum under low-temperature stress // J. Plant Biol. 2007. Vol. 50(4). P. 396-402. URL: https://doi.org/10.1007/BF03030674 (дата обращения: 19.07.2023).
- Keller B., de Vos J.M., Conti E. Decrease of sexual organ reciprocity between heterostulous primrose species. with possible functional and evolutionary implications // Annals of Botany. 2012. Vol. 110. P. 12331244. URL: https:// doi.org/10.1093/aob/mcs199 (дата обращения: 19.07.2023).
- Klein D.E., Freitas L., Da Cunha M. Self-incompatibility in a distylous species of Rubiaceae: is there a single incompatibility response of the morphs? // Sex Plant Reprod. 2009. Vol. 22. P. 121-131. DOI: 0.1007/s00497-009-0097-0. URL: https://pubmed.ncbi.nlm.nih.gov/20033433 (дата обращения: 19.07.2023).
- Li A.-M. et al. Cryptic dioecy in Mussaendapubescens (Rubiaceae): a species with stigma-height dimorphism // Annals of Botany. 2010. Vol. 106. P. 521-531. URL: https://doi.org/10.1093/aob/mcq146 (дата обращения: 19.07.2023).
- Liu Y. et al. Functional dioecy in Morinda parvifolia (Rubiaceae): a species with stigma-height dimorphism // Plant Systematics and Evolution. 2012. Vol. 298. P. 775-785. URL: https://doi.org/10.1007/s00606-011-0588-y (дата обращения: 19.07.2023).
- Nugent J.M. et al. Progressive programmed cell death inwards across the anther wall in male sterile flowers of the gynodioecious plant Plantago lanceolata // Planta. 2019. Vol. 249. P. 913-923. URL: https://doi.org/10.1007/s00425-018-3055-y (дата обращения: 19.07.2023).
- Pailler Th., Thompson J.D. Distyly and variation in heteromorphic incompatibility in Gaertnera vaginata (Rubiaceae) endemic to La Reunion Island // American Journal of Botany. 1997. Vol. 84(3). P. 315-327. URL: https://doi.org/10.2307/2446005 (дата обращения: 19.07.2023).
- Shi S. et al. A comparative light and electron microscopic analysis of microspore and tapetum development in fertile and cytoplasmic male sterile radish // Protoplasma. 2010. Vol. 241. P. 37-49. DOI: 10.1007/s00709-009-0100-5/ URL: https://link.springer.com/article/10.1007/s00709-009-0100-5 (дата обращения: 19.07.2023).
- Stevens V.A.M., Murray B.G. Studies on heteromorphic self-incompatibility systems: Physiological aspects of the incompatibility system of Primula obconica // Theoret. Appl. Genetics. 1982. Vol. 61. P. 245-256. DOI: 10.1007/BF00273782. URL: https://pubmed.ncbi.nlm.nih.gov/24270436/ (дата обращения: 19.07.2023).
- Tompson J.D., Dommee B. Morph-specific patterns of variation in stigma height in natural populations of distylous Jasminum fruticans // New Phytologist. 2000. Vol. 148. P. 303-314. URL: https://doi.org/10.1046/j.1469-8137.2000.00765.x (дата обращения: 19.07.2023).
- Valois-Cuesta H., Soriano P.J., Ornelas J.F. Dimorphisms and self-incompatibility in the distylous species Palicourea demissa (Rubiaceae): possible implications for its reproductive output // J. Plant Res. 2011. Vol. 124. P. 137-146. URL: https://doi.org/10.1007/s10265-010-0359-9 (дата обращения: 19.07.2023).
- Vijayaraghavan M.R., Ratnaparkhi S. Histological dynamics of anther tapetum in Heuchera micrantha // Proc. Indian Acad. Sci. 1979. Vol. 88. P. 309-316. URL: https://doi.org/10.1007/BF03046195 (дата обращения: 19.07.2023).
- Wu Xi.-Q. et al. Distyly and cryptic heteromorphic self-incompatibility in Mussaenda macrophylla (Rubiaceae) // Journal of Systematic sand Evolution. 2015. Vol. 9999. P. 1-13. URL: https://doi.org/10.1111/jse.12142 (дата обращения: 19.07.2023).
- Yeung E.C. et al. Anther, pollen and tapetum development in safflower Carthamus tinctorius L. // Sex Plant Re-prod. 2011. Vol. 24. P. 307-317. DOI: 10.1007/s00497-011-0168-x/ URL: https://pubmed.ncbi.nlm.nih.gov/21573927/ (дата обращения: 19.07.2023).


