Сравнительная характеристика методов постперфузионного снижения общей внеклеточной внесосудистой воды организма у детей, оперированных в условиях искусственного кровообращения
Автор: Шипулин В.М., Мерунко А.А., Пак В.А., Корбут А.А., Подоксенов Ю.К., Кораблева Г.Г.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 1 т.2, 1998 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/142233278
IDR: 142233278
Текст статьи Сравнительная характеристика методов постперфузионного снижения общей внеклеточной внесосудистой воды организма у детей, оперированных в условиях искусственного кровообращения
Искусственное кровообращение (ИК) у детей, особенно в раннем возрасте, вызывает накопление свободной жидкости в экстравазальном пространстве, что проявляется массивными тканевыми отеками [5, 6, 8, 14]. Причиной такого накопления является повышение капиллярной проницаемости. Хотя механизм реализации этого процесса еще до конца не выяснен, известно, что факторами, усиливающими выход жидкости в экстравазальное пространство, являются “воспалительный” ответ организма на проведение ИК, гемодилюция, повышенная гидрофильность тканей детского организма. Низкий вес, гипотермия и длительная ишемия миокарда количественно увеличивают экстрава-зальные отеки [9, 12]. Среди предложенных методов профилактики и лечения данного осложнения -профилактическое применение малых доз симпатомиме-тиков и диуретиков, а так же модифицированная ультрафильтрация (мУФ) [12]. Первый метод известен довольно хорошо и по сути является классическим. МУФ - относительно новый для детской кардиохирургии метод, где применение классической (одновременной с ИК) УФ (рис. 1) было ограничено опасным падением уровня в венозном резервуаре, так как скорость забора ультрафильтрата намного превышает скорость компенсаторного выделения жидкости из третьего пространства в сосудистое русло. Поэтому в 1991 г. S.K.Naik и M.J.Elliott [10, 11] предложили свой вариант УФ, назвав его модифицированным (рис. 2). Было изменено время проведения УФ и положение ультрафильтра. Модифицированная ультрафильтрация проводится после окончания ИК с забором крови из артериальной линии и возвратом непосредственно в правое предсердие через отдельную магистраль.
Поскольку в настоящее время в мире и в нашей стране проблема применения мУФ находится в стадии изучения, представляется интересным сравнить эффективность классического метода применения диуретиков и симпатоми-метиков с процедурой мУФ, которая применяется лишь немногими кардиохирургическими центрами [3, 4].
Цель работы - сравнить эффективность применения диуретиков и симпатомиметиков, а также модифицированной ультрафильтрации крови для снижения экстравазальных отеков у детей, оперированных в условиях искусственного кровообращения.
Материалы и методы
Обследовано две группы больных, оперированных в условиях ИК по поводу врожденных пороков сердца (ВПС). Основная группа п=15 чел. (3.6±0.71 лет) и контрольная п=12 чел. (7.1 ±1.04 лет). Распределение пациентов по нозологическим группам представлено в табл. 1, параметры перфузии — в табл. 2. Пациентам основной группы после
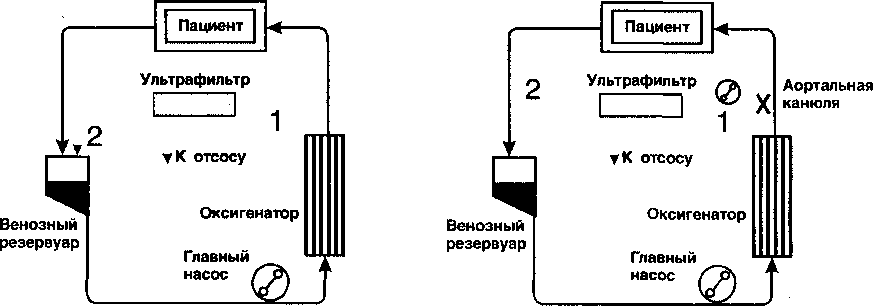
Рис. 1. Схема классической гемофильтрации
1 - приточная магистраль ультрафильтра,
2 - выводная магистраль ультрафильтра.
Рис. 2. Схема модифицированной гемофильтрации
1 - приточная магистраль ультрафильтра, 2 - выводная магистраль ультрафильтра. Крестик на приточной магистрали означает, что во время ИК ультрафильтрация не проводится.
ПАТОЛОГИЯ КРОВООБРАШЕМИЯ И КАРДИОХИРУРГИЯ 1'98
Таблица /
Распределение пациентов по нозологическим группам
окончания ИК проводилась модифицированная ультрафильтрация (мУФ). Использовались гемофильтры Baxter HemCon (США) с объемом заполнения 86 мл и диаметром пор 65 тыс. Дальтон.
|
Диагноз |
Основная группа |
Контрольная группа |
|
ДМПП |
6 |
7 |
|
ДМЖП |
3 |
2 |
|
ДМПП + ДМЖП |
2 |
- 1 |
|
Единое предсердие + аномалия митрального клапана |
1 |
|
|
Атрезия трикуспидального клапана |
1 |
|
|
Тетрада Фалло |
2 |
1 |
|
Аномалия Эбштейна в сочетании с синдромом ВПВ |
- |
1 |
|
Итого: |
15 |
12 |
Таблица 2
Параметры перфузии в основной и контрольной группах
|
Параметр |
Основная группа |
Контрольная группа |
|
Наркоз |
полная в/в анестезия |
полная в/в анестезия |
|
Длительность ишемии миокарда, мин |
90±18,8 |
59,4±9,4* |
|
Минимальная температура (пищевод), °C |
28,4±0,92 |
29,25±0,7* |
|
Минимальный гематокрит, % |
20,5±0,91 |
22±0,76* |
|
Объемная скорость перфузии, мл/мин/м2 |
2,5 |
2,5 |
|
Соотношение кровь/жидкость в первичном объеме заполнения |
1 : 4±0,63 |
1 : 5±0,7* |
|
Кардиоплегия антеградная холодовая |
р-р St. Thomas |
р-р St. Thomas |
МУФ проводили до уровня гематокрита 34.8±1.1% (исходный 20.5±0.91%). Среднее время мУФ составило 17±0.5 мин. Объем фильтрата - от 550 до 1800 мл. Скорость фильтрации определялась величиной давления в левом предсердии, но была в пределах 150-300 мл/мин. При падении левопредсердного давления гемодинамика поддерживалась снижением скорости фильтрации либо “добросом” оставшейся в резервуаре крови в артериальную линию. Разрежение в ультрафильтре достигало 125 мм водного столба. По достижении запланированного гематокрита (у “бледных” больных стремились к гематокриту 32-36%, у “синих" к 39-42%) сеанс мУФ всегда заканчивали гемоконцентрацией оставшейся в венозном резервуаре и магистральных трубках крови.
В контрольной группе с началом согрева ния больных в конце искусственного кровообращения вводился допмин в ренальных дозах (3-5 мкг/кг/мин). Кроме того, с началом согревания, начинали вводить диуретики (лазикс), доводя общую дозу до 2-3 мг/кг. Среднее количество мочи, полученное в результате применения лазикса и допмина, составило 3.6±0.4 мл/кг/час.
Количество внесосудистой внеклеточной воды организма (ОВВО) в обеих группах контролировалось методом биоэлектроимпеданса до операций, во время ее и в первые двое суток в раннем послеоперационном периоде. Для удобства расчетов количество ОВВО относили к массе
*р<0.05
Таблица 3
Клинические эффекты снижения количества экстравазальной воды после ИК
|
Эффект |
Основная группа |
Контрольная группа |
|
Симпатомиметики (допмин) п/о: |
||
|
- не применялись . . |
7 (77%) |
4 (33%)* |
|
- ренальные дозы . , |
2 (23%) |
6 (50%) |
|
- средние дозы |
2(17%) |
|
|
Кровопотеря, 3 ч п/о, мл/кг/час |
1,5±0,3 |
2,6±0,4* |
|
Количество часов ИВЛ |
3,4±0,3 |
5,8±0,8 |
|
Итого больных: |
12 |
12 |
•р<0.05
тела и выражали в процентах.
Для оценки клинического эффекта снижения ОВВО после ИК в обеих группах после операции сравнивали дозы кардиотоников, количество часов искусственной вентиляции легких (ИВЛ) и кровопотерю.
Результаты работы
Периоперационные изменения ОВВО в контрольной группе представлены на рис. 3. Исходное количество воды внеклеточного внесосудистого пространства в контрольной группе составило 84.8±3.1% от массы тела. На высоте ишемии миокарда количество экстравазальной воды достоверно снижалось. Такое снижение объясняется умеренной гиперосмолярностью первичного объема заполнения аппарата ИК, а также относительным снижением объема циркулирующей крови (ОЦК) больного (соответственно артериального и центрального венозного давления) за счет перемещения части ОЦК в аппарат ИК.
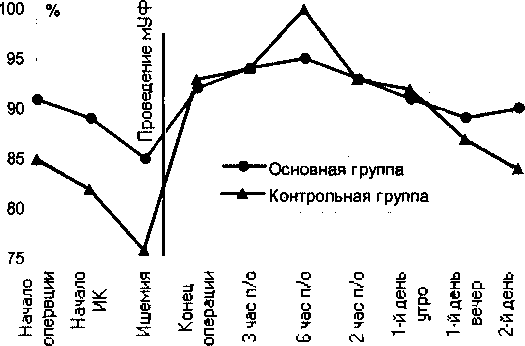
Рис. 3. Динамика периоперационных изменений ОВВО в основной и контрольной группах
После ишемии в последующие 12 часов тканевые отеки достоверно и значительно нарастали (99.3±4.4%). Нормализация ОВВО наступала к утру вторых послеоперационных суток в обеих группах.
При проведении корреляции обнаружено, что количество экстравазальной воды зависит от массы тела (г=0.86; р<0,0003), гематокрита в ходе ИК (г=0.47; р<0,05). При произведении массы тела и гематокрита мы получили числовой коэффициент, у которого корреляционные отношения с изменениями ОВВО были практически линейными (г=0.9; р=0.0002). При значениях этого коэффициента ниже 500 должны предприниматься особые мероприятия по профилактике тканевых отеков. В среднем у та- о ких пациентов прирост тканевой воды составил 20% от массы тела. При значении числового коэффициента выше 900 (обычно при массе тела больше 40 кг) прирост тканевой воды был не более 5-6% от массы тела.
Менее устойчивая зависимость получена между изменениями ОВВО и общим водным балансом операции (г=0.43; р=0.35), минимальной температурой охлаждения (г=0.55; р=0.14) и длительностью ишемии миокарда (г=0.55; р=0.35). Не найдено зависимости между изменениями ОВВО и температурой тела в пищеводе на разных этапах операции, что говорит об относительной независимости метода биоэлектроимпеданса от внешних факторов.
До проведения мУФ динамика ОВВО в основной группе практически повторяет таковую в контрольной группе. После проведения мУФ в основной группе отсутствует пик прироста количества экстравазальной воды. Возврат количества ОВВО к исходному наступает достоверно раньше, чем в контрольной группе (к исходу первых суток).
В табл. 3 представлены клинические эффекты снижения количества экстравазальной воды после ИК. В основной группе более низкой была доза симпатомиметических препаратов, а также снижено количество часов, проведенных пациентами на ИВЛ, и кровопотеря.
Обсуждение ■
Выяснено, что изменения ОВВО (накопление экстравазальной жидкости) после проведения ИК в детской кардиохирургической практике существенны. Тканевые отеки могут достигать 20% от массы тела и более, что, естественно, нарушает нормальное течение раннего послеоперационного периода даже в случае удачно проведенной операции и у “несложных" больных.
Намечающееся снижение достоверности в корреляции между изменениями ОВВО и общим водным балансом операции говорит о низкой эффективности применения диуретиков для снижения постперфузионных экстравазальных отеков. Это совпадает с данными R.J.Elliott [12]. Действительно, несмотря на достаточное количество мочи в постперфузионном периоде у больных контрольной группы, экстравазальные отеки имели свое выраженное проявление.
Клинические эффекты мУФ, по-видимому, объясняются не только снижением количества ОВВО, но так же удалением продуктов перекисного окисления липидов, медиаторов воспаления и комплиментарных факторов. Аналогичные, хотя и не многочисленные, данные получены рядом авторов [1, 2, 13].
Выводы
МУФ, по сравнению с применением симпатомиметиков и диуретиков, достоверно снижает количество ОВВО в раннем послеоперационном периоде.
Метод приемлем для использования в детской практике. Клиническим проявлением эффекта мУФ является снижение количества случаев сердечной слабости и уменьшение часов ИВЛ и кровопотери.
Проведение мУФ, по-видимому, даст возможность сократить количество донорской крови в ходе ИК и раннем послеоперационном периоде.
Список литературы Сравнительная характеристика методов постперфузионного снижения общей внеклеточной внесосудистой воды организма у детей, оперированных в условиях искусственного кровообращения
- Абрямян М.В., Ярустовский М.Б., Ильин В.Н. и др. Возможности модифицированной ультрафильтрации в элиминации медиаторов воспаления и комплиментарных факторов у грудных детей при коррекции врожденных пороков сердца // Грудная и сердечно-сосудистая хирургия; Тез. Первой ежегодной научной сессии НЦ ССХим. А.Н.Бакулева РАМН. -1997. №2. С.94-95.
- Кирсанова В.Н., МерункоА.А., Ковалев И.А. Влияние модифицированной ультрафильтрации на интенсивность перекисного окисления липидов // Грудная и сердечно-сосудистая хирургия; Тез. Первой ежегодной научной сессии НЦ ССХим. А.Н.Бакулева РАМН. -1997. №2. С.97.
- МерункоА.А., Шипулин В.М., ПакВ.А. Опыт применения модифицированной ультрафильтрации для снижения общей воды организма у детей, оперированных по поводу врожденных пороков сердца. //Грудная и сердечно-сосудистая хирургия; Тез. Первой ежегодной научной сессии НЦ ССХим. А.Н.Бакулева РАМН. -1997. №2. С.94.
- Ярустовский М.Б., Ильин В.Н., Григорьянц Ф.Г. и др. Применения модифицированной ультрафильтрации при радикальной коррекции сложных врожденных пороков сердца у новорожденных и грудных детей//Грудная и сердечно-сосудистая хирургия: Тез. Ill Всероссийского съезда сердечно-сосудистых хирургов. -1996. №6.С.201.
- Bergrnts S.E. Sumnung up. In: K.Messmer and Schi-mid-Schonbein, eds. Hemodilution, Theiretical Basis and Clinical Application. -New-York, Karger, 1972. P.309-313.


