Сравнительная эффективность химиолучевой терапии при плоскоклеточном раке прямой кишки и анального канала: исследование с псевдорандомизацией
Автор: Мурзо В.В., Гордеев С.С., Мышляков В.С., Мамедли З.З.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.22, 2023 года.
Бесплатный доступ
Введение. Спорадические случаи регистрации плоскоклеточного рака прямой кишки (пРПК) не позволяют охарактеризовать агрессивность этой опухоли и ее ответ на химиолучевую терапию по сравнению с более распространенными плоскоклеточными образованиями, в частности плоскоклеточным раком анального канала (пРАК). Цель исследования - сравнительная оценка непосредственных и отдаленных результатов проведения химиолучевой терапии у пациентов с пРПК и пРАК. материал и методы. В ретроспективное исследование включили пациентов с неметастатическим плоскоклеточным раком прямой кишки (пРПК) и плоскоклеточным раком анального канала (пРАК), получавших сходную химиолучевую терапию, и сопоставили их в соотношении 1:1 с применением псевдорандомизации (определение коэффициента склонности с последующим подбором пар) с использованием пакета MatchIt для R. Сопоставляемыми факторами были: пол, возраст, степень дифференцировки опухоли, размер первичного опухолевого узла, метастазы в тазовые лимфоузлы (N). Сравнение динамики ответа опухоли на лечение проводилось путем анализа выживаемости (ОВ и БРВ) методом Каплана - Майера с последующей верификацией по методу Log-Rank, частоты полного ответа через 6 мес. Результаты. Всего было оценено 15 подобранных пар пациентов (совпадение 1:1, n=30). Пациенты обеих групп имели достоверно схожие показатели по полу, возрасту, степени дифференцировки, исходному размеру первичной опухоли, отличаясь лишь по гистологическому подтипу опухоли. В группе пРАК 60 % пациентов имели метастазы в тазовые лимфоузлы, в группе пРПК - 46,67 % (p=1). Медиана наблюдения составила 44 мес. Трехлетняя ОВ у пациентов с пРАК составила 80 %, у пациентов группы пРПК - 78,8% (p=0,567); 3-летняя БРВ в группе пРАК составила 66,7 %, в группе пРПК - 34,7 % (p=0,406). Частота полного клинического ответа на химиолучевую терапию через 6 мес составила 86,7 % для группы пациентов с пРАК и 46,7 % для группы пациентов с пРПК (p=0,05). Органосохраняющее лечение проведено 93,3 % пациентов с пРАК и 73,3 % пациентов с пРПК (р=0,33). выводы. Общая и безрецидивная выживаемость не были достоверно снижены у пациентов с пРПК относительно пациентов с пРАК. Это указывает на схожие течение и прогноз этих заболеваний, однако для пРПК характерна достоверно более низкая частота полных клинических ответов на проводимое лечение.
Плоскоклеточный рак прямой кишки, плоскоклеточный рак анального канала, радикальная химиолучевая терапия, псевдорандомизация, сравнительная эффективность химиотерапии, ретроспективное исследование
Короткий адрес: https://sciup.org/140302018
IDR: 140302018 | УДК: 616.351+616.352]-006.61-08:615.28+615.849.1 | DOI: 10.21294/1814-4861-2023-22-4-14-21
Текст научной статьи Сравнительная эффективность химиолучевой терапии при плоскоклеточном раке прямой кишки и анального канала: исследование с псевдорандомизацией
Плоскоклеточный рак прямой кишки (пРПК) – редкое злокачественное новообразование (0,3 % всех случаев рака прямой кишки), не имеющее четко обозначенных факторов риска. Некоторые врачи стадируют это заболевание по TNM как рак анального канала, другие – как рак прямой кишки [1–3]. В соответствии с действующими клиническими рекомендациями принято лечить данное заболевание по аналогии с плоскоклеточным раком анального канала с помощью радикальной химиолучевой терапии (фторпиримидины и митомицин), что позволяет достичь более 80 % 5-летней общей выживаемости, в то время как при чисто хирургических методах лечения она составляла 48 % [4, 5]. Однако сравнительная эффективность химиолучевой терапии (ХЛТ) при пРПК и пРАК неизвестна. Достижение полного клинического ответа возможно и при аденокарциноме прямой кишки, однако такой эффект встречается значительно реже, чем при пРАК, и не может исходно позиционироваться как основная цель лечения [6, 7].
В литературе мало данных о результатах применения ХЛТ у пациентов с пРПК и сравнении этих результатов с эффективностью при аналогичном лечении пРАК, что свидетельствует о необходимости дальнейшего изучения этой темы [8–10]. В нашем исследовании мы оценили эффективность ХЛТ у пациентов с пРПК, а также определили, отличается ли при схожей методике лечения прогноз для пациентов с пРПК по сравнению с пациентами с пРАК – заболеванием, в отношении которого данное лечение является стандартом.
Цель исследования ‒ сравнительная оценка непосредственных и отдаленных результатов проведения химиолучевой терапии у пациентов с пРПК и пРАК.
Материал и методы
В исследовании использовалась база данных медицинских записей пациентов с кодом МКБ-Х С20 и МКБ-О 8490/3, 8490/3.1, 84903 – из архива НМИЦ онкологии им. Н.Н. Блохина и многоцентрового реестра РОСКР за период с 2000 по 2020 г. Мы провели ретроспективный анализ историй болезней и включили в исследуемую группу пациентов со следующими характеристиками: гистологически подтвержденный пРПК, отсутствие первично-множественных злокачественных новообразований (ПМЗНО), отсутствие отдаленных метастазов (М0), проведение химиолучевой терапии, стадия II–III. Из исследования исключали пациентов с аденокарциномой с плоскоклеточным компонентом.
Из проспективно поддерживаемой базы данных подобрана контрольная группа пациентов с плоскоклеточным раком анального канала (пРАК) методом псевдорандомизации 1:1 с целью минимизации систематических ошибок и обеспечения максимальной сопоставимости пациентов. Пациенты из исследуемой и контрольной групп были подобраны на основании многофакторного анализа с использованием логистической регрессии с включением в модель следующих параметров: пол, возраст, размеры опухоли, сТ, сN, гистологическая степень дифференцировки. Для сопоставления допускалась погрешность значений отношения рисков (ОР) в 3 %.
Стадирование проводили с использованием КТ грудной и брюшной полости с внутривенным контрастированием, МРТ малого таза. Всем пациентам проводили 3D-конформную ЛТ с разовой очаговой дозой (РОД) 2 Гр до суммарной очаговой дозы (СОД) 50–52 Гр на фоне химиотерапии капе-цитабином 825 мг/м2 2 раза в сутки, per os в дни ЛТ и митомицином 12 мг/м2, внутривенно болюсно в первый день ЛТ. Хирургическое лечение проводили в соответствии с принципами тотальной мезоректумэктомии. Нижнюю брыжеечную артерию перевязывали на уровне отхождения от аорты или непосредственно ниже уровня отхождения левой ободочной артерии. В обеих группах мы оценивали частоту достижения полного ответа за 6 мес, трехлетнюю общую (ОВ) и безрецидивную выживаемость (БРВ).
Статистическая обработка осуществлялась в программе IBM SPSS Statistics 25. Псевдорандомизация производилась с помощью расчета коэффициента склонности на основании факторов риска ухудшения прогноза пациентов методом логистической регрессии, дальнейшего сопоставления пациентов по коэффициенту склонности в соотношении 1:1 с помощью пакета MatchIt в R-Studio. Уровень статистической значимости различий между категориальными переменными рассчитывали с помощью chi-square-test. Для оценки ОВ и БРВ был использован метод Каплана–Майера.
Различия в выживаемости оценивали методом log-rank-test. ОВ оценивали с момента постановки диагноза до наступления летального исхода. БРВ определяли как интервал времени между датой постановки диагноза и датой смерти или до прогрессирования заболевания.
Результаты
В архиве НМИЦ онкологии им. Н.Н. Блохина и реестре РОСКР по сделанному запросу идентифицировали 253 медицинские записи, 190 из которых были исключены, поскольку опухоль была локализована в анальном канале, еще 13 были исключены, т.к. в архиве не были найдены истории болезни, в 26 случаях записи представляли собой пересмотр гистологического материала без лечения в клинике. Вначале в анализ планировалось включить 24 пациента, но 9 из них не получали химиолучевую терапию, которая являлась ключевым элементом исследования. За 2000–20 гг. в проспективно поддерживаемой базе данных пациентов клиники идентифицировано 173 записи пациентов с плоскоклеточным раком анального канала, получавших ХЛТ, из которых после псевдорандомизации было отсеяно 158 пациентов (рис. 1). Между пациентами из исследуемой и контрольной групп не было достоверных различий по основным характеристикам, которые могли повлиять на лечение и прогноз заболевания (таблица).
В контрольной группе через 6 мес после завершения ХЛТ полный клинический ответ отмечен у 13 (86,7 %) [sd=0,35] пациентов, тогда как в исследуемой группе полный клинический ответ наблюдался у 7 (46,7 %) [sd=0,52] пациентов (p=0,05).
Операции в связи с наличием остаточной опухоли были выполнены у 4 (26,7 %) пациентов в группе пРПК и у 1 (6,7 %) больного в группе пРАК (p=0,33). При этом 2 пациентам в группе пРПК выполнены сфинктеросохраняющие операции в объеме низкой чрезбрюшной резекции прямой кишки. У одного из них выявлен полный морфологический ответ на лечение. Оба пациента живы без признаков прогрессирования заболевания.
Медиана наблюдения составила 44 мес. За это время рецидивы развились у 4 (26,7 %) пациентов в исследуемой группе и у 5 (33,3 %) – в контрольной группе (p=1). Метастазы за это время появились у 4 (26,7 %) пациентов в исследуемой и у 3 (20 %) – в контрольной группе (р=1).
Трехлетняя ОВ составила 71,4 % (95 % ДИ 51,4–91,5 %) в группе пРПК и 76,9 % (95 % ДИ 60,8–93,1 %) в группе плоскоклеточного рака анального канала (р=0,567; рис. 2), а трехлетняя БРВ – 34,7 % (95 % ДИ 16,6–52,8 %) при пРПК и 66,7 % (50,9–82,5 %) при пРАК (p=0,406; рис. 3).
Обсуждение
Мы изучали ответ на ХЛТ у пациентов с пРПК и плоскоклеточным раком анального канала. Нам
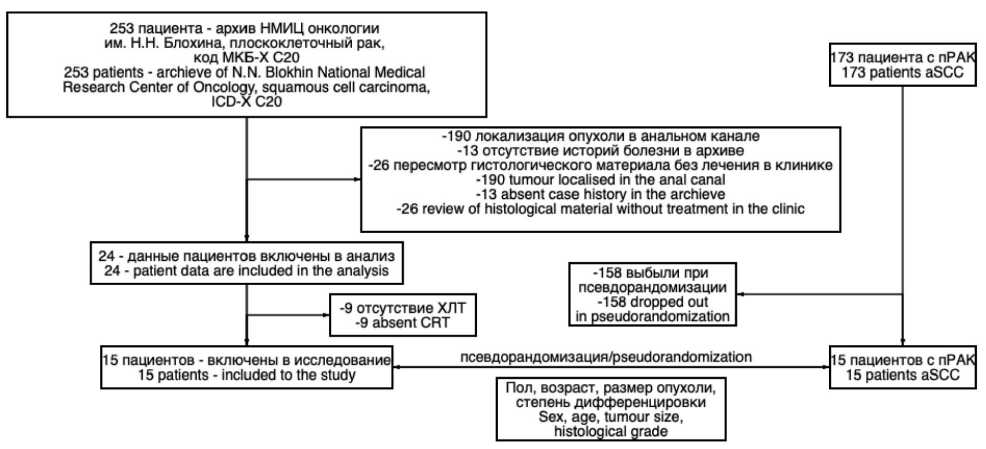
Рис. 1. Блок-схема отбора медицинских записей пациентов для исследования Fig. 1. Flowchart selection patients’ medical records for the study
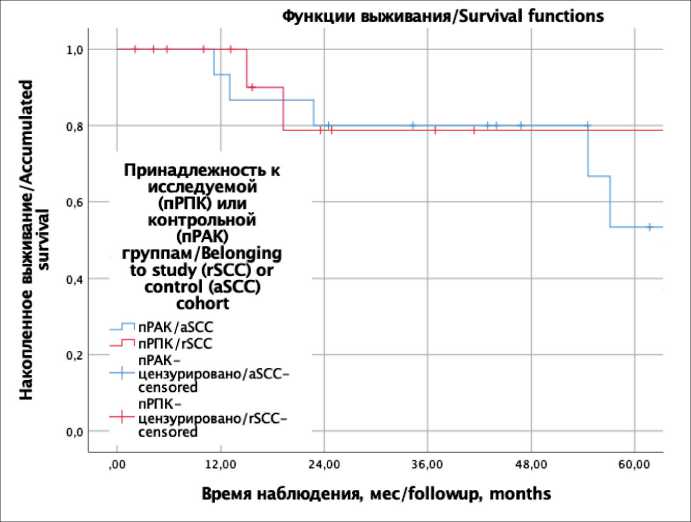
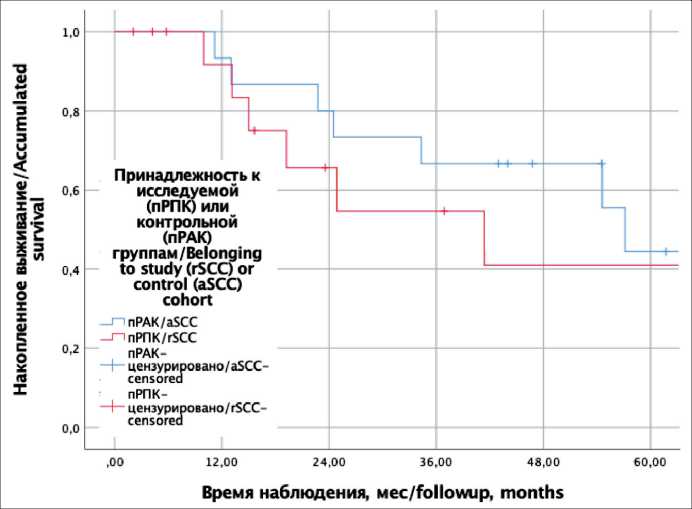
Рис. 2. Кривые общей выживаемости Каплана–Майера. Красной линией обозначена исследуемая группа (пРПК), синей – контрольная (пРАК)
Fig. 2. Kaplan–Meier overall survival curves. The red line indicates the study group (rSCC), the blue line – the control group (aSCC)
Рис. 3. Кривые безрецидивной выживаемости Каплана–Майера. Красной линией обозначена исследуемая группа (пРПК), синей – контрольная (пРАК)
Fig. 3. Kaplan–Meier desease-free survival curves. The red line indicates the study group (rSCC) and the blue line indicates the control group (aSCC)
Таблица/Table
Сравнительная характеристика пациентов
Comparative characteristics of patients
Отличные от наших данные относительно полного ответа были получены D. Musio et al. [11]: из 8 пациентов с пРПК после радикального курса ХЛТ у 75 % достигнут полный ответ на лечение, и только 1 пациенту потребовалось хирургическое лечение после ХЛТ. Для данного заболевания принято оценивать ответ через 182 дня, так же как и для пРАК [12]. Однако при сравнении выживаемости пациентов, получавших тримодальную (ХЛТ + хирургия) и хи-миолучевую терапию, S.W. Dutta et al. отслеживали ответ через более короткий промежуток времени (в среднем 67–73 дня после ХЛТ) и получили ожидаемо более низкое значение: 36 % (41/114 пациентов) имели полный ответ перед хирургическим вмешательством или дальнейшим наблюдением [10]. B. Id Said et al. считают, что пРПК следует лечить так же, как и пРАК, с применением радикальной ХЛТ как стандарта. В доказательство они приводят 100 % показатель полного клинического ответа на всех стадиях при отсутствии отдаленных метастазов и 5- и 10-летнюю общую выживаемость на уровне 82 % (95 % ДИ 66,1–100 %) [13]. В похожем по количеству пациентов в выборке исследовании, проведенном G. Loganadane et al., после ХЛТ частота клинического полного ответа составила 83 %. При среднем наблюдении более 85 мес общий показатель выживаемости за 5 лет составил 86 %
-
[14] . В исследовании J. Péron et al. с выборкой из 11 пациентов полный клинический ответ имели только 7 из них (~63,6 %), остальным в последующем было выполнено оперативное вмешательство [15]. Из приведенных примеров следует, что в различных выборках пациентов частота полного клинического ответа пРПК на лечение (оцененного по стандарту через 6 мес) колеблется в пределах от 46,7 % (в нашем исследовании) до 100 %, что, безусловно, связано с различными опциями лечения и неоднородностью выборок, однако может быть связано и с неоднородностью внутри самого заболевания.
В нашем исследовании 3-летняя ОВ при пРПК составила 71,4 %, при плоскоклеточном раке анального канала – 76,9 %, без значимых различий, что сравнительно ниже, чем в вышеупомянутых исследованиях. Сходные с нашими показатели выживаемости пациентов с пРПК получены S.W. Dutta et al. в ретроспективном исследовании: при плоскоклеточном раке прямой кишки cT1-cT3 и любой N 5-летняя ОВ составила 63,8 %. Также было выявлено, что 5-летняя ОВ не различается у пациентов, получавших тримодальную терапию (химиолучевая терапия в неоадъювантном режиме и хирургия) и химиолучевую терапию (p=0,936) [10]. Однако в анализе популяционного регистра из 1747 пациентов D.C. Steinemann et al. показано преимущество хирургического вмешательства: ОВ и БРВ были выше в группе, получавшей хирургическое лечение после ЛТ, по сравнению с группой, получавшей лучевую терапию (ОР 0,751, 95 % ДИ 0,566–0,997, р=0,048 и HR=0,679, 95 % ДИ 0,478– 0,966, р=0,031) [16]. Но в данном исследовании к лучевой терапии не была добавлена химиотерапия, что снижает ценность выводов. В систематическом обзоре G.R. Guerra et al. из 63 исследований, посвященных плоскоклеточному раку прямой кишки, пациенты, получившие ХЛТ, имели более высокую общую выживаемость (86 vs 46 %), а также более низкую частоту рецидивов и метастазов (25 и 10 % vs 30 и 13 %) по сравнению с пациентами, получившими хирургическое лечение [5]. В вышеупомянутом исследовании D.C. Steinemann et al. поднимают вопрос о том, могут ли пациенты с местнораспространенным заболеванием получить пользу от комбинированного лечения, однако эта польза не подтверждается другими исследованиями, включая недавний анализ SEER пациентов с плоскоклеточным раком прямой кишки, который включал больший объем выборки (3949 vs 1747 пациентов) и более поздние случаи (до 2017 г. vs 2013 г.) [17].
Революционным в оценке сходства пРПК и пРАК является исследование C. Astaras et al., вышедшее в 2023 г., в котором раскрывается молекулярно-генетическое сходство пРПК и пРАК, позволяющее абсолютно точно обобщить методики их лечения [18]. Так, показаны 100 % присутствие ВПЧ в опухоли, по аналогии с пРАК [19, 20], а также схожие мутации PIK3CA, PTEN, ATM, TP53. В частности, мутации в PIK3CA, PTEN, ATM являются мишенями таргетных препаратов, таких как ингибиторы тирозинкиназы (альпелисиб) для PIK3CA, ингибиторы AKT (капивасертиб) для PTEN и ингибиторы ATR (элимусертиб) для ATM [21–23]. Данные препараты со временем могут быть добавлены к ХЛТ или к другим методикам лечения как пРПК, так и пРАК.
Преимуществом нашего исследования является то, что оно является одним из немногих, в которых проводилась оценка отдаленных результатов лечения пациентов с пРПК в сравнении с больными плоскоклеточным раком анального канала. Нам удалось подобрать группу пациентов с похожей исходной клинической картиной заболевания,
Список литературы Сравнительная эффективность химиолучевой терапии при плоскоклеточном раке прямой кишки и анального канала: исследование с псевдорандомизацией
- Astaras C., Bornand A., Koessler T. Squamous rectal carcinoma: a rare malignancy, literature review and management recommendations. ESMO Open. 2021; 6(4). doi: 10.1016/j.esmoop.2021.100180.
- Sturgeon J.D., Crane C.H., Krishnan S., Minsky B.D., Skibber J.M., Rodriguez-Bigas M.A., Chang G.J., You Y.N., Eng C., Das P. Definitive Chemoradiation for Squamous Cell Carcinoma of the Rectum. Am J Clin Oncol. 2017; 40(2): 163–6. doi: 10.1097/COC.0000000000000126.
- Malakhov N., Kim J.K., Adedoyin P., Albert A., Schreiber D., Lee A. Patterns of Care and Outcomes of Low-Lying Adenocarcinoma and Squamous Cell Carcinoma of the Rectum. J Gastrointest Cancer. 2022; 53(1): 105–12. doi: 10.1007/s12029-020-00552-3.
- Клинические рекомендации «Рак прямой кишки». М: 2022. 78 с. [Clinical Guidelines “Rectal Cancer”. М., 2022. 78 p. (in Russian)].
- Guerra G.R., Kong C.H., Warrier S.K., Lynch A.C., Heriot A.G., Ngan S.Y. Primary squamous cell carcinoma of the rectum: An update and implications for treatment. World J Gastrointest Surg. 2016; 8(3): 252–65. doi: 10.4240/wjgs.v8.i3.252.
- Дудаев З.А., Худоеров Д.Х., Мамедли З.З., Алиев В.А., Гордеев С.С., Мышляков В.С. Тактика «watch and wait» (активное динамическое наблюдение) в лечении больных раком прямой кишки с клиническим полным ответом. Тазовая хирургия и онкология. 2022; 12(1): 35–40. [Dudaev Z.A., Khudoerov D.K., Mamedli Z.Z., Aliev V.A., Gordeev S.S., Myshlyakov V.S. “Watch and wait” strategy (active dynamic follow-up) in the management of rectal cancer patients with a complete clinical response. Pelvic Surgery and Oncology. 2022; 12(1): 35–40. (in Russian)]. doi: 10.17650/2686-9594-2022-12-1-35-40.
- Дудаев З.А., Худоеров Д.Х., Мамедли З.З., Алиев В.А., Гордеев С.С., Магаррамова З.Н. Непосредственные и отдаленные результаты лечения пациентов с раком средне- и нижнеампулярного отделов прямой кишки с клиническим и патоморфологическим полным ответом после комбинированной терапии. Тазовая хирургия и онкология. 2022; 12(1): 41–8. [Dudaev Z.A., Khudoerov D.K., Mamedli Z.Z., Aliev V.A., Gordeev S.S., Magarramova Z.N. Short-term and long-term treatment outcomes in patients with lower and middle rectal cancer with complete clinical and pathomorphological response after comprehensive treatment. Pelvic Surgery and Oncology. 2022; 12(1): 41–8. (in Russian)]. doi: 10.17650/2686-9594-2022-12-1-41-48.
- Dyson T., Draganov P.V. Squamous cell cancer of the rectum. World J Gastroenterol. 2009; 15(35): 4380–6. doi: 10.3748/wjg.15.4380.
- Jeong B.G., Kim D.Y., Kim S.Y. Concurrent chemoradiotherapy for squamous cell carcinoma of the rectum. Hepatogastroenterology. 2013; 60(123): 512–6. doi: 10.5754/hge11293.
- Dutta S.W., Alonso C.E., Waddle M.R., Khandelwal S.R., Janowski E.M., Trifiletti D.M. Squamous cell carcinoma of the rectum: Practice trends and patient survival. Cancer Med. 2018; 7(12): 6093–103. doi: 10.1002/cam4.1893.
- Musio D., De Felice F., Manfrida S., Balducci M., Meldolesi E., Gravina G.L., Tombolini V., Valentini V. Squamous cell carcinoma of the rectum: The treatment paradigm. Eur J Surg Oncol. 2015; 41(8): 1054–8. doi: 10.1016/j.ejso.2015.03.239.
- Glynne-Jones R., Sebag-Montefiore D., Meadows H.M., Cunningham D., Begum R., Adab F., Benstead K., Harte R.J., Stewart J., Beare S., Hackshaw A., Kadalayil L.; ACT II study group. Best time to assess complete clinical response after chemoradiotherapy in squamous cell carcinoma of the anus (ACT II): a post-hoc analysis of randomized controlled phase 3 trial. Lancet Oncol. 2017; 18(3): 347–56. doi: 10.1016/S1470-2045(17)30071-2. Erratum in: Lancet Oncol. 2017; 18(4). Erratum in: Lancet Oncol. 2020; 21(11).
- Id Said B., Buchan D., Liu Z., Kim J., Hosni A., Brierley J.D., Chadi S., Grant R.C., Kalimuthu S., Liu Z.A., Lukovic J. Demographics, pattern of practice and clinical outcomes in rectal squamous cell carcinoma. Colorectal Dis. 2023; 25(4): 608–15. doi: 10.1111/codi.16417.
- Loganadane G., Servagi-Vernat S., Schernberg A., Schlienger M., Touboul E., Bosset J.F., Huguet F. Chemoradiation in rectal squamous cell carcinoma: Bi-institutional case series. Eur J Cancer. 2016; 58: 83–9. doi: 10.1016/j.ejca.2016.02.005.
- Péron J., Bylicki O., Laude C., Martel-Lafay I., Carrie C., Racadot S. Nonoperative management of squamous-cell carcinoma of the rectum. Dis Colon Rectum. 2015; 58(1): 60–4. doi: 10.1097/DCR.0000000000000218.
- Steinemann D.C., Müller P.C., Billeter A.T., Bruckner T., Ulrich A., Müller-Stich B.P. Surgery is essential in squamous cell cancer of the rectum. Langenbecks Arch Surg. 2017; 402(7): 1055–62. doi: 10.1007/s00423-017-1614-5.
- Yang Y., Yu J., Hu J., Zhou C., Niu J., Ma H., Han J., Fan S., Liu Y., Zhao Y., Zhao L., Wang G. A systematic and comprehensive analysis of colorectal squamous cell carcinoma: Implication for diagnosis and treatment. Cancer Med. 2022; 11(12): 2492–502. doi: 10.1002/cam4.4616.
- Astaras C., De Vito C., Chaskar P., Bornand A., Khanfir K., Sciarra A., Letovanec I., Corro C., Dietrich P.Y., Tsantoulis P., Koessler T. The first comprehensive genomic characterization of rectal squamous cell carcinoma. J Gastroenterol. 2023; 58(2): 125–34. doi: 10.1007/s00535-022-01937-w.
- Daling J.R., Madeleine M.M., Johnson L.G., Schwartz S.M., Shera K.A., Wurscher M.A., Carter J.J., Porter P.L., Galloway D.A., McDougall J.K. Human papillomavirus, smoking, and sexual practices in the etiology of anal cancer. Cancer. 2004; 101(2): 270–80. doi: 10.1002/cncr.20365.
- Alemany L., Saunier M., Alvarado-Cabrero I., Quirós B., Salmeron J., Shin H.R., Pirog E.C., Guimerà N., Hernandez-Suarez G., Felix A., Clavero O., Lloveras B., Kasamatsu E., Goodman M.T., Hernandez B.Y., Laco J., Tinoco L., Geraets D.T., Lynch C.F., Mandys V., Poljak M., Jach R., Verge J., Clavel C., Ndiaye C., Klaustermeier J., Cubilla A., Castellsagué X., Bravo I.G., Pawlita M., Quint W.G., Muñoz N., Bosch F.X., de Sanjosé S.; HPV VVAP Study Group. Human papillomavirus DNA prevalence and type distribution in anal carcinomas worldwide. Int J Cancer. 2015; 136(1): 98–107. doi: 10.1002/ijc.28963.
- André F., Ciruelos E.M., Juric D., Loibl S., Campone M., Mayer I.A., Rubovszky G., Yamashita T., Kaufman B., Lu Y.S., Inoue K., Pápai Z., Takahashi M., Ghaznawi F., Mills D., Kaper M., Miller M., Conte P.F., Iwata H., Rugo H.S. Alpelisib plus fulvestrant for PIK3CAmutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1. Ann Oncol. 2021; 32(2): 208–17. doi: 10.1016/j.annonc.2020.11.011.
- Kalinsky K., Hong F., McCourt C.K., Sachdev J.C., Mitchell E.P., Zwiebel J.A., Doyle L.A., McShane L.M., Li S., Gray R.J., Rubinstein L.V., Patton D., Williams P.M., Hamilton S.R., Conley B.A., O'Dwyer P.J., Harris L.N., Arteaga C.L., Chen A.P., Flaherty K.T. Effect of Capivasertib in Patients With an AKT1 E17K-Mutated Tumor: NCI-MATCH Subprotocol EAY131-Y Nonrandomized Trial. JAMA Oncol. 2021; 7(2): 271–8. doi: 10.1001/jamaoncol.2020.6741. Erratum in: JAMA Oncol. 2021.
- Yap T.A., Tan D.S.P., Terbuch A., Caldwell R., Guo C., Goh B.C., Heong V., Haris N.R.M., Bashir S., Drew Y., Hong D.S., Meric-Bernstam F., Wilkinson G., Hreiki J., Wengner A.M., Bladt F., Schlicker A., Ludwig M., Zhou Y., Liu L., Bordia S., Plummer R., Lagkadinou E., de Bono J.S. Firstin-Human Trial of the Oral Ataxia Telangiectasia and RAD3-Related (ATR) Inhibitor BAY 1895344 in Patients with Advanced Solid Tumors. Cancer Discov. 2021; 11(1): 80–91. doi: 10.1158/2159-8290.CD-20-0868.


