Сравнительная клинико-эпидемиологическая характеристика ротавирусной инфекции у детей раннего возраста
Автор: Беделбаев М.К., Джолбунова Зуура Керимбековна, Халупко Елена Александровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 4 т.6, 2020 года.
Бесплатный доступ
В данной статье дана сравнительная характеристика клинико-эпидемиологических особенностей ротавирусной инфекции у детей до 1 года и 1-3 лет. Проведен анализ 83 историй болезни обследованных детей на ротавирусную инфекцию в возрасте до 3 лет. Больные были разделены на 2 группы: 1-я группа - дети до 1 года (48 больных), 2-я группа - дети от 1 до 3 лет (35 больных). В результате исследования было выявлено, что у детей 1-ой группы ротавирусная инфекция протекала преимущественно (P˂0,01) в виде тяжелого энтерита (71,0%), в сочетании с бактериальной кишечной инфекцией (75,0%), с достоверно (P˂0,05) частым (31,3%) вздутием живота из-за обильной водянистой диареи. Заболевание закончилось летальным исходом в 4,0% случаев. У абсолютного большинства (96,7%) детей 2-ой группы ротавирусная инфекция протекала в виде гастроэнтерита, с практически одинаковым соотношением среднетяжелых и тяжелых форм (47,0, 50,0%). Из-за больших потерь с многократной рвотой и жидким стулом достоверно (P˂0,01) чаще (53,3%) отмечалось снижение диуреза и повышение уровня креатинина (40,0%).
Ротавирусная инфекция, дети, эпидемиология, клиника, диагностика
Короткий адрес: https://sciup.org/14116204
IDR: 14116204 | УДК: 616.98:578.823.91-053.2 | DOI: 10.33619/2414-2948/53/17
Текст научной статьи Сравнительная клинико-эпидемиологическая характеристика ротавирусной инфекции у детей раннего возраста
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.98:578.823.91-053.2
Ротавирусная инфекция остается актуальной проблемой во всем мире [1–4], в том числе и в Кыргызстане. Ежегодно в мире регистрируется до 25 млн случаев заболевания ротавирусной инфекции, из них 600–900 тысяч (2,4–3,6%) — заканчиваются летальным исходом [3, 5], преимущественно у детей раннего возраста с отягощенным преморбидным фоном [6–7]. В США до начала программы ротавирусной вакцинации, в год происходило 47000–70000 госпитализаций детей в возрасте до 5 лет, и 20–60 детей этого возраста умирало в год в результате болезни [8–14].
В развивающихся странах почти 2 млн госпитализаций связано с ротавирусной инфекцией, которая, по оценкам, приводит к 453 000 случаев смерти детей в возрасте до 5 лет, что составляет около 40,0% всех случаев госпитализации, связанных с диареей у детей до 5 лет во всем мире [2, 13, 15–16].
Частота заболеваемости ротавирусной инфекцией носит четко выраженный сезонный характер, резко повышаясь в зимние месяцы среди детей раннего возраста и представляет значительную угрозу, где существует дефицит чистой воды [4, 10, 17–26].
Ротавирусная инфекция встречается как спорадически, так и в виде эпидемических вспышек, часто в детских дошкольных учреждениях и детских медицинских стационарах [10, 19–20]. Самая большая эпидемия ротавирусной инфекции произошла в Никарагуа в 2005 году, которая была связана с мутацией в геноме ротавируса и характеризовалась тяжелым течением болезни с развитием эксикоза [4, 27–30].
В ряде исследований показано, что при ротавирусной инфекции у детей выявляется дефицит по Т — лимфоцитам (78,0%), по Т — хелперам (46,0%), содержанию Ig A (67,0%), фагоцитарному показателю, а также снижена комплементарная активность крови. Из-за отсутствия активной продукции иммунноглобулинов в остром периоде заболевания, большое количество вирусов и их антигенов поступает в кровь, что приводит к развитию тяжелых форм болезни с неблагоприятным исходом [6, 10, 31–38].
В настоящее время во многих странах мира, в том числе в Кыргызстане не повсеместно проводится вакцинация против ротавирусной инфекции, поэтому заболеваемость среди детей раннего возраста остается на высоком уровне. Низкая этиологическая расшифровка острых кишечных инфекций (ОКИ) затрудняет дифференциальную диагностику с другими секреторными диареями [20, 39], в том числе вызванные условно–патогенными энтеробактериями (УПЭ).
Целью исследования: сравнительная характеристика клинико-эпидемиологических особенностей ротавирусной инфекции у детей до 1 года и 1–3 лет.
Материалы и методы исследования
Проведено обследование 83 детей в возрасте от 0–3 лет, больных ротавирусной инфекцией, находившихся на стационарном лечении в специализированных отделениях Республиканской клинической инфекционной больницы (РКИБ), г. Бишкек за период с 2014 по 2019 гг. Все больные были разделены на 2 группы: 1 группа — дети до 1 года (48 больных), 2 группа — дети от 1 до 3 лет (35 больных).
Критериями включения были: дети 0–3 лет, больные ротавирусной инфекцией.
Критерии исключения составили: дети старше 3 лет; секреторные диареи, вызванные другими вирусами, а также диареи, вызванные УПЭБ.
Клинический диагноз ротавирусной инфекции был подтвержден с помощью иммунохроматогрифического экспресс теста (комбинированный RV-AV тест), который определяет наличие вируса в фекалиях обследуемого за 15 минут (Фармацевтическая компания «Му Линь Сэнь» КР, г. Бишкек).
Статистическая обработка проводилась с помощью программы SPSS: описательная статистика, определение соответствия закону Гаусса, определение средних величин, парные сравнения не связанных выборок, определение показателя Р ≤0,05 [40].
Результаты исследования и их обсуждение
Возрастная структура обследованных детей преимущественно состояла из детей 1 года жизни (57,8%), среди которых преобладали дети в возрасте от 6 до 9 месяцев (45,8%). Дети 13 лет составляли 42,2% (Рисунок 1). Среди обследованных детей преобладали мальчики (54,2%). Из них жителями города Бишкек были 59,0% больных, жителями села — 41,0% детей. Из всех обследованных детей лишь два ребенка посещали детские дошкольные учреждения.
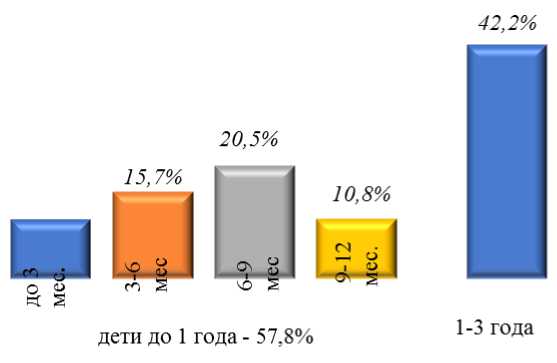
Рисунок 1. Возрастная структура детей, больных ротавирусной инфекцией.
Абсолютное большинство (88,0%) детей поступили в зимние месяцы года. За медицинской помощью в инфекционный стационар обратились 66,3% детей на 2±0,5 день болезни из-за проявлений гастроэнтерита. Скорой медицинской помощью было доставлено 13,3% больных, 15,7% детей направлены ЦСМ и 9,8% больных были направлены другими детскими стационарами.
Следует отметить, что 6,3% детей 1 группы из-за развития симптомов тяжелого обезвоживания на 3±0,5 день болезни поступали в отделении реанимации и интенсивной терапии (ОРИТ), средняя продолжительность лечения в ОРИТ составила 1,25±0,5 дней.
При изучении анамнеза жизни детей, больных ротавирусной инфекцией, отягощенный преморбидный фон был выявлен у 37,3% детей и представлен анемией (27,7%), ГИЭ (4,8%), ЭКД (1,2%), ВПС (1,2%). Большинство (67,5%) детей из первой группы находились на смешанном вскармливании, что возможно является одним из факторов, способствующих инфицированию ротавирусной инфекцией [20].
Контакт с больным ОКИ, был выявлен лишь у 6,0% детей в сравниваемых группах.
Дети из 1 группы поступали в стационар в более поздние сроки (на 3±0,7 день) от начала заболевания. Вероятно, это было связано с тем, что у детей 1 группы заболевание начиналось с энтеритного синдрома (водянистая диарея), который лечили в амбулаторных условиях самостоятельно. А у детей 2 группы заболевание начиналось с синдрома гастроэнтерита (многократная рвота и водянистая диарея), поэтому эти больные поступили в инфекционный стационар в более ранние (1±0,5 день) сроки от начала заболевания.
Выраженный интоксикационный синдром наблюдался у (52,1%, 43,3%) детей, умеренный у (47,9%, 56,7%) детей, больных ротавирусной инфекцией.
Как показано в Таблице 1, повышение температуры тела у детей в сравниваемых группах не имело по высоте (38,5 °С ± 0,5) и длительности (1,5±0,5 дней) статистических отличий.
Таблица 1.
КЛИНИЧЕСКИЕ СИМПТОМЫ РОТАВИРУСНОЙ ИНФЕКЦИИ
|
Сравниваемые группы |
1 группа |
2 группа |
Парные сравнения |
|
Температура тела (°C) |
|||
|
Медиана |
38,5 |
38,5 |
Mann–Whitney U-test = |
|
Межквартельный размах |
38–38,9 |
38–39 |
0,197 |
|
Длительность лихорадки (дни) |
|||
|
Медиана |
3 |
2 |
Mann–Whitney U-test = |
|
Межквартельный размах |
2–3 |
2–3 |
0,100 |
|
Длительность рвоты (дни) |
|||
|
Медиана |
2 |
3 |
Mann–Whitney U-test = |
|
Межквартельный размах |
1–2 |
2–5 |
0,01 |
|
Частота жидкого |
стула при поступлении |
||
|
Среднее значение и |
9,29±4,3 |
7,71±4,11 |
Independent Samples T |
|
стандартное отклонение |
test = 0,098 |
||
Рвота достоверно (Р˂0,01) чаще (79,2%, 96,7%) и дольше по продолжительности (1,5±0,5, 3,0±0,5 дней) отмечалась у детей 2 группы (Таблица 1). Жидкий стул наблюдался у всех больных в сравниваемых группах. Однако, следует отметить, что частота (9,29±4,3, 7,71±4,1) жидкого стула была больше у детей 1 группы. Из-за частого водянистого стула у детей 1 группы достоверно (Р˂0,05) чаще (31,3%, 13,3%) отмечалось вздутие живота. Характер стула у детей из 2 группы был преимущественно водянистым (60,0%), тогда как у 75,0% детей из 1 группы вследствие присоединения бактериальной кишечной инфекции отмечалось наличие патологических примесей в стуле (мутная слизь, кровь), которая подтверждена бактериологически у (10,4%, 2,9%) детей (эшерихии, шигелла), что свидетельствует о развитии микст–инфекции (ротавирусная + бактериальная)
Из-за больших потерь жидкости с рвотой и водянистой диареей, снижение диуреза достоверно (Р˂0,01) чаще (18,8%, 53,3%) отмечалось у детей 2 группы. Как показано на Рисунке 2, достоверно (Р˂0,01) чаще (71,0%, 47,0%) заболевание протекало в тяжелой форме у детей 1 группы, у которых в 6,3% были выявлены признаки тяжелого обезвоживания.
У всех больных проводились анализы крови: лейкоцитоз отмечался у (37,5%, 23,0%) детей с ротавирусной инфекцией. Изменения крови, характерные для вирусной инфекции (лейкопения и лимфоцитоз) были выявлены у (19,0%, 11,4%) детей в сравниваемых группах. Средние значения количества лимфоцитов и лейкоцитов не имело статистически значимых отличий (Таблица 2). У остальных (43,5%, 65,6%) обследованных детей гемограмма оставалась без изменений, что связано с иммунносупрессивным действием ротавируса.
При биохимическом исследовании крови у детей со сниженным диурезом достоверно (Р˂0,01) чаще (23,0%, 40,0%) повышение уровня креатинина было выявлено у детей 2 группы. Среднее значение креатинина (80,76±14,37, 71,56±16,98) не имело статистически значимых отличий (Таблица 2).
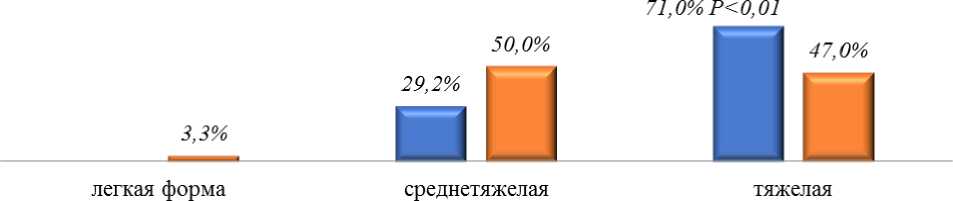
■ 1 группа - дети до года ■ 2 группа - дети старше года
Рисунок 2. Степень тяжести ротавирусной инфекции у детей раннего возраста.
Таблица 2.
ЛАБОРАТОРНЫЕ ДАННЫЕ ПРИ РОТАВИРУСНОЙ ИНФЕКЦИИ
|
Сравниваемые группы |
1 группа 2 группа |
Парные сравнения |
|
Гемоглобин, г/л |
||
|
Среднее значение и стандартное отклонение |
120,85±13,08 117,69±10,72 |
Independent Samples T test = 0,244 |
|
Эритроциты (×1012/л) |
||
|
Среднее значение и стандартное отклонение |
3,80±0,46 3,84±0,32 |
Independent Samples T test = 0,598 |
|
Цветовой показатель |
||
|
Среднее значение и стандартное отклонение |
0,89±0,07 0,94±0,06 |
Independent Samples T test = 0,001 |
|
Лейкоциты (×109/л) |
||
|
Среднее значение и стандартное 9,49±3,71 8,35±2,82 отклонение |
Independent Samples T test = 0,132 |
|
|
Нейтрофилы ПЯ, % |
||
|
Среднее значение и стандартное отклонение |
3,04±2,15 2,97±1,29 |
Independent Samples T test = 0,864 |
|
Нейтрофилы СЯ (%) |
||
|
Среднее значение и стандартное отклонение |
33,88±12,94 43,17±17,78 |
Independent Samples T test = 0,007 |
|
Лимфоциты (%) |
||
|
Среднее значение и стандартное отклонение |
55,04±14,76 48,42±17,44 |
Independent Samples T test = 0,065 |
|
Моноциты (%) |
||
|
Среднее значение и стандартное отклонение |
8,25±7,78 6,60±2,23 |
Independent Samples T test = 0,227 |
|
СОЭ (%) |
||
|
Среднее значение и стандартное отклонение |
4,29±2,42 5,46±3,58 |
Independent Samples T test = 0,101 |
|
Креатинин (мкмоль/л) |
||
|
Среднее значение и стандартное отклонение |
80,76±14,37 71,56±16,98 |
Independent Samples T test = 0,140 |
|
Мочевина (ммоль/л) |
||
|
Среднее значение и стандартное отклонение |
6,33±1,05 3,70±2,10 |
Independent Samples T test = 0,001 |
|
Остаточный азот (ммоль/л) |
||
|
Среднее значение и стандартное отклонение |
19,94±2,66 13,19±4,99 |
Independent Samples T test = 0,000 |
У детей 2 группы проводился биохимический анализ крови на количественное определение ПКТ (прокальцитонин), который определяет степень и характер воспалительного процесса [7, 41–42]. В результате тест показал у 11 (31,4%) детей наличие вирусной инфекции, а у остальных детей (68,6%) тест был в пределах нормы.
Всем детям с ротавирусной инфекцией было проведено патогенетическое и симптоматическое лечение. Инфузионную терапию получили абсолютное большинство (91,4%) детей, больных ротавирусной инфекцией. Антибактериальную терапию получили дети, у которых ротавирусная инфекция сочеталась с бактериальными энтероколитами (10,4%) и с пневмонией (4,0%). В основном назначались антибиотики цефалоспоринового ряда.
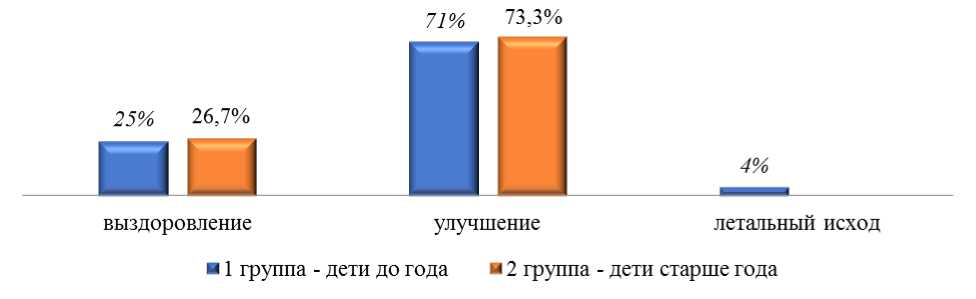
Рисунок 3. Исход болезни у детей в сравниваемых группах.
Как показано на Рисунке 3, большинство (71,0-73,3%) детей, больных ротавирусной инфекцией были выписаны из стационара с улучшением. Следует отметить, что у детей 1 группы в 4,0% случаев был летальный исход из-за развития осложнений и наслоения суперинфекции ОКИ и ОРВИ. Достоверно (Р<0,05) дольше (7±3,1; 4,4±2,1 дней) в инфекционном стационаре находились дети 1 группы.
Выводы:
Ротавирусная инфекция у детей первого года жизни характеризуется развитием тяжелого энтерита (71,0%), а у больных 1–3 лет — синдрома гастроэнтерита (96,7%), Р˂0,01.
Микст (ротавирусная+бактериальная) инфекция развивается часто (71,0%) у детей первого года жизни (Р˂0,01), что может привести к неблагоприятному исходу заболевания (4,0%).
Для ранней и дифференциальной диагностики ротавирусной инфекции от бактериальных острых кишечных инфекций и своевременной коррекции патогенетической терапии необходимо использовать иммунохроматографический экспресс тест.
Детям раннего возраста необходимо проведение вакцинопрофилактики ротавирусной инфекции.
Список литературы Сравнительная клинико-эпидемиологическая характеристика ротавирусной инфекции у детей раннего возраста
- World Health Organization. Global networks for surveillance of rotavirus gastroenteritis, 2001-2008 // Weekly Epidemiological Record. 2008. V. 83. №47. P. 421-425.
- World Organization Health. Immunization coverage. 6 December 2019. https://clck.ru/MwUBG
- Haffejee I. E. Neonatal rotavirus infections // Reviews of infectious diseases. 1991. V. 13. №5. P. 957-962. DOI: 10.1093/clinids/13.5.957
- Torok T. J., Kilgore P. E., Clarke M. J. et al. Visualizing geographic and temporal trends in rotavirus activity in the United States, 1991 to 1996 // The Pediatric infectious disease journal. 1997. V. 16. №10. P. 941-946. DOI: 10.1093/cid/civ1013
- Ферьева Е. Е. Ротавирусная инфекция // Consilium Provisorum. 2007. Т. 5. №1. С. 12-14.
- Greenberg H. B., Estes M. K. Rotaviruses: from pathogenesis to vaccination // Gastroenterology. 2009. V. 136. №6. P. 1939-1951.
- DOI: 10.1053/j.gastro.2009.02.076
- Monneret G. et al. Procalcitonin and C-reactive protein levels in neonatal infections // Acta Paediatrica. 1997. V. 86. №2. P. 209-212.
- DOI: 10.1111/j.1651-2227.1997.tb08870.x
- Вакцинопрофилактика ротавирусной инфекции у детей: Федеральные клин. рекомендации. Минздрав России, Союз педиатров России. М.: Педиатр, 2016. 40 с.
- Рычкова О. А., Казакевич Н. В., Дубинина О. А., Шарухо Г. В., Курбатсая М. А., Иванова Г. Н. и др. Профилактика ротавирусной инфекции: путь расширения региональной программы вакцинации Тюменской области // Фарматека. 2016. Т. 11. С. 101-106.
- Михайлова Е. В., Шульдяков А. А., Кошкин А. П., Левин Д. Ю. Ротавирусная инфекция у детей. 2006.
- UNICEF/WHO. Diarrhoea: Why children are still dying and what can be done. 2009. Retrieved 23 May 2010.
- Tate J. E., Burton A. H., Boschi-Pinto C., Steele A. D., Duque J., Parashar U. D 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis // The Lancet infectious diseases. 2012. V. 12. №2. P. 136-141.
- DOI: 10.1016/S1473-3099(11)70253-5
- Panozzo C. A. et al. Reduction in rotavirus after vaccine introduction. United States, 2000-2009 // Morbidity and Mortality Weekly Report. 2009. V. 58. №41. P. 1146-1149. http://www.cdc.gov/mmwr/PDF/wk/mm5841.pdf
- Nakawesi J. S. et al. Prevalence and factors associated with rotavirus infection among children admitted with acute diarrhea in Uganda // BMC pediatrics. 2010. V. 10. №1. P. 69.
- DOI: 10.1186/1471-2431-10-69
- CDC Surveillance Systems. Rotavirus in the U.S., November 5, 2019. https://www.cdc.gov/rotavirus/surveillance.html
- World Organization Health. Rotavirus. https://clck.ru/MwUBc
- Яцык Г. В., Захарова Н. И. Диареи новорожденных. М., 1997. С. 82-85.
- Битиева Р. Л. Оценка новых подходов к диагностике и терапии ротавирусной инфекции у детей: автореф. дисс. … канд. мед. наук. М., 2007. С. 23.
- Тихомирова О. В., Сергеева Н. В. и др. Ротавирусная инфекция у детей: особенности клинического течения, диагностические подходы и тактика терапии. СПб., 2005. С. 32.
- Баялиева М. М., Кадырова Р. М., Джолбунова З. К. Внутрибольничная ротавирусная инфекция у детей раннего возраста // Справочник врача общей практики. 2015. №8. С. 19-24.
- Bucardo F. et al. Mutated G4P [8] rotavirus associated with a nationwide outbreak of gastroenteritis in Nicaragua in 2005 // Journal of clinical microbiology. 2007. V. 45. №3. P. 990-997.
- DOI: 10.1128/JCM.01992-06
- Tao H. et al. Waterborne outbreak of rotavirus diarrhoea in adults in China caused by a novel rotavirus // The Lancet. 1984. V. 323. №8387. P. 1139-1142.
- DOI: 10.1016/S0140-6736(84)91391-6
- Fang Z. Y. et al. Investigation of an outbreak of adult diarrhea rotavirus in China // Journal of Infectious Diseases. 1989. V. 160. №6. P. 948-953.
- DOI: 10.1093/infdis/160.6.948
- Kotloff K. L. et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): a prospective, case-control study // The Lancet. 2013. V. 382. №9888. P. 209-222.
- DOI: 10.1016/S0140-6736(13)60844-2
- Giri S. et al. Rotavirus gastroenteritis in Indian children № 5 years hospitalized for diarrhoea, 2012 to 2016 // BMC public health. 2019. V. 19. №1. P. 69.
- DOI: 10.1186/s12889-019-6406-0
- Parashar U. D. et al. Global illness and deaths caused by rotavirus disease in children // Emerging infectious diseases. 2003. V. 9. №5. P. 565.
- DOI: 10.3201/eid0905.020562
- Fischer T. K. et al. Hospitalizations and deaths from diarrhea and rotavirus among children № 5 years of age in the United States, 1993-2003 // The Journal of infectious diseases. 2007. V. 195. №8. P. 1117-1125.
- DOI: 10.1086/512863
- Tate J. E. et al. Global, regional, and national estimates of rotavirus mortality in children № 5 years of age, 2000-2013 // Clinical Infectious Diseases. 2016. V. 62. №suppl_2. P. S96-S105.
- DOI: 10.1093/cid/civ1013
- Carneiro N. B. et al. Clinical and epidemiological aspects of children hospitalized with severe rotavirus-associated gastroenteritis in Salvador, BA, Brazil // Brazilian Journal of Infectious Diseases. 2005. V. 9. №6. P. 525-528.
- DOI: 10.1590/S1413-86702005000600013
- Odimayo M. S. et al. Prevalence of rotavirus-induced diarrhoea among children under 5 years in Ilorin, Nigeria // Journal of Tropical Pediatrics. 2008. V. 54. №5. P. 343-346.
- DOI: 10.1093/tropej/fmn081
- Рычкова О. А., Грахова М. А., Сагитова А. С., Кожевникова Л. А., Старостина О. В., Кузьмичева К. П. Ротавирусная инфекция возможности своевременной вакцинопрофилактики // Медицинский совет. 2018. №17. С. 215-219.
- Рудакова А. В., Харит С. М., Подколзин А. Т., Усков А. Н., Лобзин Ю. В. Оценка эффективности затрат на вакцинацию детей 5-валентной вакциной против ротавирусной инфекции в Российской Федерации. Педиатрическая фармакология. 2017. Т. 14. №6. С. 501-507.
- DOI: 10.15690/pf.v14i6.1833
- Syed Y. Y., Lyseng-Williamson K. A. Pentavalent rotavirus vaccine (RotaTeq®) in the prevention of rotavirus gastroenteritis: a profile of its use in the EU // Drugs & Therapy Perspectives. 2018. V. 34. №4. P. 143-149.
- DOI: 10.1007/s40267-018-0497-z
- Mwenda J. M. et al. Burden and epidemiology of rotavirus diarrhea in selected African countries: preliminary results from the African Rotavirus Surveillance Network // Journal of Infectious Diseases. 2010. V. 202. №Supplement_1. P. S5-S11.
- DOI: 10.1086/653557
- Payne D. C. et al. Long-term consistency in rotavirus vaccine protection: RV5 and RV1 vaccine effectiveness in US children, 2012-2013 // Clinical Infectious Diseases. 2015. V. 61. №12. P. 1792-1799.
- DOI: 10.1093/cid/civ872
- Leshem E. et al. Acute gastroenteritis hospitalizations among US children following implementation of the rotavirus vaccine // Jama. 2015. V. 313. №22. P. 2282-2284.
- DOI: 10.1001/jama.2015.5571
- Shah M. P. et al. Decline in emergency department visits for acute gastroenteritis among children in 10 US states following implementation of rotavirus vaccination, 2003-2013 // The Pediatric infectious disease journal. 2016. V. 35. №7. P. 782.
- DOI: 10.1097/INF.0000000000001175
- Payne D. C. A decade of documenting the impact of rotavirus vaccination in the United States: Understanding the post-rotavirus vaccine introduction era // European Expert Meeting on Rotavirus Vaccination (EEROVAC). 2017.
- Сулайманов У., Беделбаев М. и др. Эффективность применения препарата "Лактиале малыш" для лечения секреторной диареи у детей // Вестник КГМА им. И. К. Ахунбаева. 2018. №1. С. 149-153.
- Бююль А., Цефель П. SPSS: Искусство обработки информации. Анализ статистических данных и восстановление скрытых закономерностей. СПб.: ДиаСофтЮП, 2005. 608 с.
- Jacobs J. W. et al. Procalcitonin is a glycoprotein // Journal of Biological Chemistry. 1981. V. 256. №6. P. 2803-2807. PMID:
- ISBN: 7204375
- Cheval C. et al. Procalcitonin (PCT) is useful in predicting the bacterial origin of an acute circulatory failure in critically ill patients // Intensive care medicine. 2000. V. 26. №2. P. S153-S158.
- DOI: 10.1007/BF02900729


