Сравнительная морфологическая характеристика хеликобактерного и аутоиммунного гастрита
Автор: Пачуашвили Н. В., Нагорная Д. П., Тертычный А. С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Цель: провести сравнительный морфологический анализ хеликобактерного и аутоиммунного гастрита и определить ключевые морфологические критерии дифференциальной диагностики.Материалы и методы. В исследование было ретроспективно отобрано 30 случаев хронического атрофического хеликобактерного гастрита и 30 случаев хронического атрофического аутоиммунного гастрита. Во всех случаях хеликобактерного гастрита было подтверждено наличие Helicobacter pylori (H. pylori) морфологическими методами диагностики с помощью окраски препаратов по Гимза или дополнительно с помощью иммуногистохимического исследования. Все случаи аутоиммунного гастрита были дополнительно подтверждены клиниколабораторными методами диагностики, часть пациентов имели длительный анамнез диспансерного наблюдения, и биопсийный материал брался у них повторно. Обязательным условием было взятие как минимум пяти биоптатов согласно Сиднейскому протоколу.Результаты. Основным дифференциально-диагностическим признаком в нашем исследовании явилось обнаружение H. pylori, а также локализация поражения в теле желудка, характерная для аутоиммунного гастрита, и в антральном отделе - при хеликобактерном гастрите. Исследуемые группы отличались по полу (преобладание лиц женского пола в группе аутоиммунного гастрита), распространённости и активности воспаления (все случаи хеликобактерного гастрита имели признаки активности воспаления). При изучении содержания нейроэндокринных клеток в случаях хеликобактерного гастрита в теле желудка отмечалась простая гиперплазия нейроэндокринных клеток, при аутоиммунном гастрите было отмечено появление цепочек и узелков, что соответствовало линейной и нодулярной гиперплазии нейроэндокринных клеток.Выводы. Полученные в исследовании морфологические критерии позволяют провести дифференциальный диагноз между хеликобактерным и аутоиммунным гастритом. Это крайне важно с учётом различий в подходах к лечению и тактике динамического наблюдения при этих вариантах хронического гастрита.
Хронический гастрит, хеликобактерный, аутоиммунный, морфологическая диагностика, h. pylori, атрофия, метаплазия
Короткий адрес: https://sciup.org/143179931
IDR: 143179931 | УДК: 616.33-002.27 | DOI: 10.20340/vmi-rvz.2023.1.MORPH.1
Текст научной статьи Сравнительная морфологическая характеристика хеликобактерного и аутоиммунного гастрита
-
H. pylori является наиболее распространенной несамокупирующейся бактериальной инфекцией человека. В промышленно развитых странах инфекция среди детей постепенно снижается, но распространённость H. pylori по-прежнему высока в странах с низким социально-экономическим статусом [3].
Цель данного исследования – провести сравнительный морфологический анализ хелико-бактерного и аутоиммунного гастрита и определить ключевые морфологические критерии дифференциальной диагностики.
Материалы и методы
Морфологическую характеристику биоптатов проводили по критериям модифицированной Сиднейской системы, которые включали оценку степени выраженности воспаления, активность, атрофию и наличие H. Pylori, и оценивались полуколичественно как слабо выраженные, умеренно выраженные и выраженные с помощью визуально аналоговой шкалы. Отдельно проводили оценку наличия метаплазии эпителия по каждому из вариантов: кишечная псевдопилорическая псевдопанкреати-ческая; кишечную метаплазию дополнительно подразделяли на полную и неполную. Проводили оценку биоптатов по системе OLGA/OLGIM. OLGA/OLGIM (Operative Link for Gastritis Assessment,
OLGIM – на основе оценки кишечной метаплазии) – это проверенная система стадирования, которая учитывает как показатель атрофии (оцениваемый в каждом отдельно взятом биоптате), так и локализацию (тело или антральный отдел), из которого были получены биоптаты (т. е. кислотопродуцирующая или антральная слизистая оболочка, в соответствии с Сиднейским протоколом).
Обработка морфологического биопсийного материала осуществлялась по общепринятой методике. Полученный гистологический материал фиксировали в 10 % забуференном формалине, обрабатывали в аппарате гистологической проводки фирмы Leica ASP200 (Германия), заливали в парафин. Далее готовые серийные срезы окрашивали гематоксилином и эозином по общепринятой методике и по методу Гимза. ИГХ исследование с антителами к H. pylori (поликлональные фирмы Dako, США) и к хромогранину А (клон 5H7 фирмы Leica, Германия) производилось на автоматическом иммуногистостейнере Leica BOND III (Германия) по стандартным протоколам, рекомендованным фирмой-производителем.
Статистическую обработку полученных данных проводили с помощью Microsoft Excel (Microsoft Corporation, США) и описательной статистики в программе STATISTICA 6.0 (StatSoft, Inc., США). Результаты представляли в виде абсолютных чисел и процентов, медианы и квартилей.
Результаты исследования
С учётом того, что отбор случаев проводили ретроспективно, в группу хеликобактерного гастрита (ХГ) включили только случаи с атрофическими изменениями слизистой оболочки. Случаи аутоиммунного гастрита (АИГ) были дополнительно подтверждены иммунологическими тестами на наличие антител к париетальным клеткам и внутреннему фактору, в части случаев дополнительно проводили оценку гастропанели и определяли уровень гастрина 17 в сыворотке крови. Все пациенты с АИГ имели анамнез наблюдения не менее одного года. При сравнении возрастных характеристик в исследуемых группах было отмечено широкое колебание, но средний возраст в группе АИГ оказался ниже и составил 55,1 года по сравнению со средним возрастом 66 лет в группе
ХГ. Было отмечено существенное преобладание лиц женского пола в группе АИГ (соотношение мужчин и женщин при АИГ составило 1:4, а при ХГ – 1:1,5), что подтверждает данные литературы [6].
Важным и определяющим в постановке диагноза ХГ явилось обнаружение в биоптате бактерии H. pylori, которую при высокой степени обсе-мененности можно было обнаружить и в препаратах, окрашенных гематоксилином и эозином, и подтвердить их наличие при окраске по Гимза. В сомнительных случаях приходилось прибегать к проведению ИГХ реакций. Это оказалось также актуальным для случаев АИГ, в которых из-за ахлоргидрии можно обнаружить другие бактерии в покрывающей слизи, и для исключения присутствия H. pylori требовалось использование ИГХ метода как наиболее специфичного и исключить неспецифическое окрашивание других бактерий, и тем самым предупредить неоправданное назначение эрадикационной терапии.
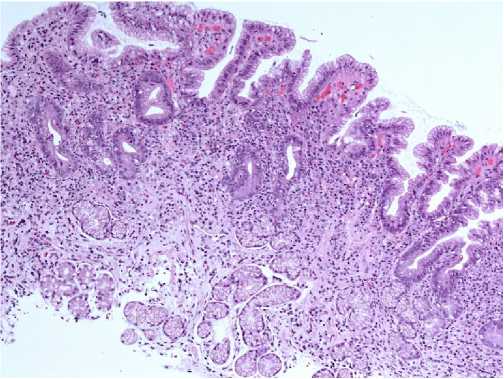
Figure 1. Helicobacter pylori – associated gastritis. Chronic moderately severe active atrophic gastritis of the antrum. Inflammatory infiltrate is localized in the superficial sections of the mucous membrane. х 100. Stained with hematoxylin and eosin
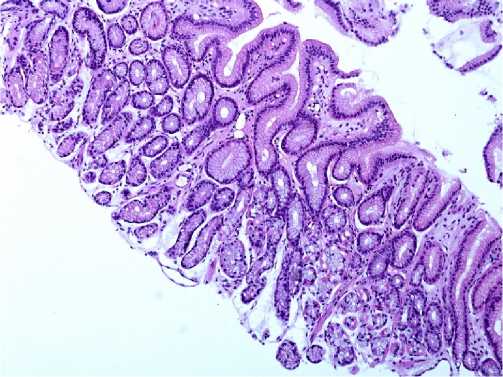
Figure 2. Autoimmune gastritis. Chronic minimal superficial gastritis of the antrum in autoimmune gastritis. Almost complete absence of inflammatory changes. Morphological signs of reactive gastropathy. х 100. Stained with hematoxylin and eosin
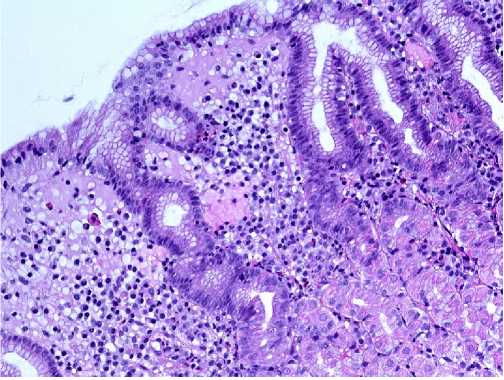
Figure 3. Helicobacter pylori gastritis. Chronic moderate active superficial Helicobacter pylori gastritis of the body of the stomach with focal hyperplasia of the foveolar layer. x200. Stained with hematoxylin and eosin
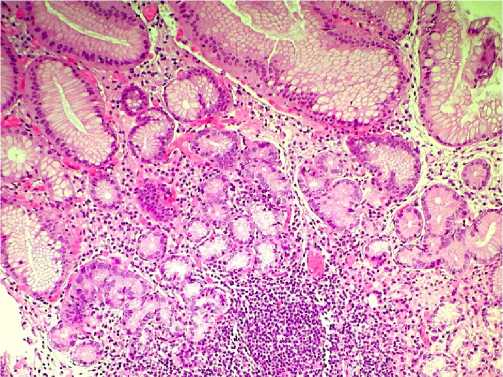
Figure 4. Autoimmune gastritis. Chronic moderately severe inactive atrophic gastritis of the body of the stomach with widespread pseudopyloric metaplasia and the formation of lymphoid accumulations. x200. Stained with hematoxylin and eosin
К дополнительным важным косвенным признакам присутствия в биоптате H. pylori относятся признаки активности воспаления, которые характери-зируются присутствием сегменто-ядерных лейкоцитов в воспалительном клеточном инфильтрате, которые проникают в эпителий на уровне ямок и даже могут обнаруживается в их просвете (рис. 5).
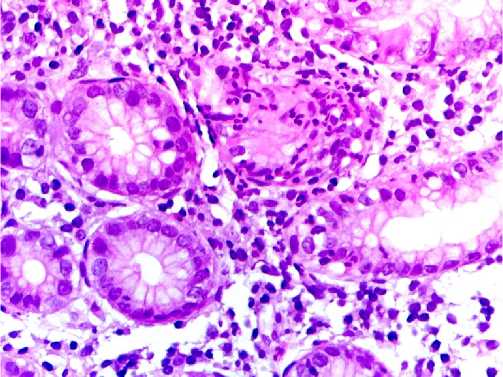
Рисунок 5. Хеликобактерный гастрит. Морфологические признаки активности в виде появления сегменто-ядерных лейкоцитов и инфильтрация ими эпителия ямок. Важный морфологический признак присутствия в биоптате H. pylori. Ув. x 400. Окраска гематоксилином и эозином
Figure 5. Helicobacter pylori gastritis. Morphological signs of activity in the form of the appearance of segmented nuclear leukocytes and their infiltration of the epithelium of the pits. An important morphological sign of the presence of H. pylori in the biopsy. x 400. Stained with hematoxylin and eosin
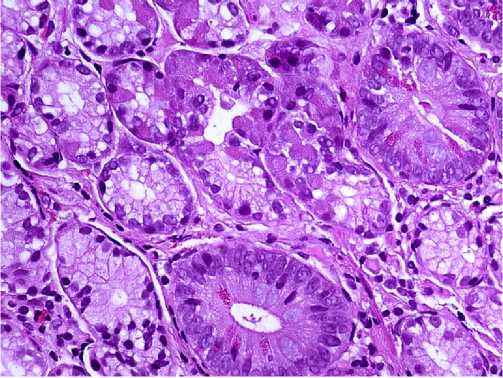
Рисунок 6. Аутоиммунный гастрит. Распространённая псевдопилорическая метаплазия, микроочаги полной кишечной метаплазии с наличием клеток Планета и участок псевдопанкреатической метаплазии с наличием клеток, напоминающих ацинарные клетки поджелудочной железы. Ув. x 400. Окраска гематоксилином и эозином
Figure 6. Autoimmune gastritis. Widespread pseudopyloric metaplasia, microfoci of complete intestinal metaplasia with the presence of Planet cells and an area of pseudopancreatic metaplasia with the presence of cells resembling pancreatic acinar cells. x 400. Stained with hematoxylin and eosin
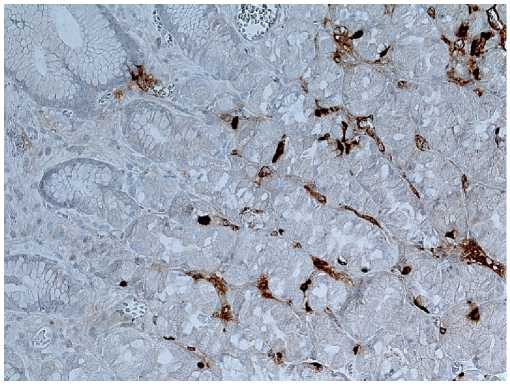
Рисунок 7. Хеликобактерный гастрит. Простая гиперплазия нейроэндокринных клеток. ИГХ реакция с антителом к хромогранину А. Ув. х 200
Figure 7. Helicobacter pylori gastritis. Simple hyperplasia of neuroendocrine cells. IHC reaction with an antibody to chromogranin A. Uv. х 200
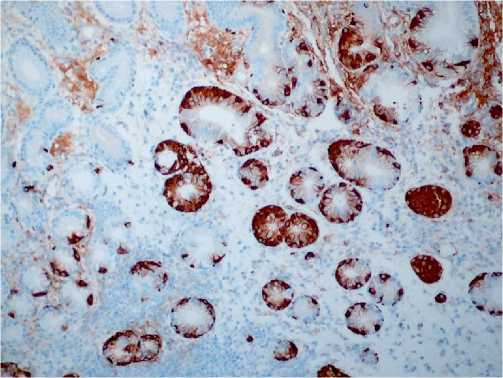
Рисунок 8. Аутоиммунный гастрит. Простая линейная и узелковая гиперплазия нейроэндокринных клеток. ИГХ реакция с антителом к хромогранину А. Ув. х 200
Figure 8. Autoimmune gastritis. Simple, linear and nodular hyperplasia of neuroendocrine cells. IHC reaction with an antibody to chromogranin A. Uv. х 200
Таблица 1. Сравнительная морфологическая характеристика хеликобактерного и аутоиммунного гастрита
Table 1. Comparative morphological characteristics of Helicobacter pylori and autoimmune gastritis
|
Показатель |
Хеликобактерный гастрит |
Аутоиммунный гастрит |
|
Возраст |
41–84 (средний 66) |
35–83 (средний 55,1) |
|
Соотношение по полу «мужчины : женщины» |
1:1.5 |
1:3,5 |
|
Локализация основных проявлений |
антральный отдел |
тело |
|
Воспаление |
поверхностное |
глубокое |
|
Активность |
+ |
– |
|
Атрофия |
+ |
+ |
|
Кишечная метаплазия |
+ |
+ |
|
Псевдопилорическая метаплазия |
– |
+ |
|
Псевдопанкреатическая метаплазия |
– |
+ |
|
Обнаружение H. pylori |
+ |
– |
|
Гиперплазия НЭК |
простая |
линейная и нодулярная |
Обсуждение
Спустя почти четыре десятилетия после открытия Helicobacter pylori как основной причины гастрита, хеликобактерная инфекция официально признана инфекционным заболеванием, которое в настоящее время включено в 11-й пересмотр Международной классификации болезней.
Высокий процент 3-й стадии в группе ХГ в нашем исследовании, который составил 10 %, связан с целенаправленным отбором в исследованную группу только атрофических форм ХГ.
Заключение
OLGA или OLGIM являются соответствующими гистологическими системами стадирования для оценки степени тяжести атрофии. В то время как КМ является компонентом атрофии и, таким образом, также входит в систему стадирования OLGA, в стадировании OLGIM КМ является единственным параметром. Гистологическая оценка атрофии должна привести к окончательной оценке стадии гастрита (OLGA/OLGIM), которая последовательно ранжирует риск развития рака у конкретного пациента.
Гистологическое определение стадии должно быть дополнено этиологической информацией, такой как показатели, которые можно получить из гистологического фенотипа гастрита и из гистологического обнаружения инфекционного агента (H. pylori).
Для АИГ намного важнее провести правильную этиологическую диагностику гастрита, исключить присутствие H. pylori и правильно интерпретировать характер метапластических процессов. В сложных случаях помогает разобраться ИГХ исследования с антителами к H. pylori при наличии другой микрофлоры и к хромогранину А для обнаружения гиперплазии НЭК.
Список литературы Сравнительная морфологическая характеристика хеликобактерного и аутоиммунного гастрита
- Liou J.M., Malfertheiner P., Lee Y.C., Sheu B.S., Sugano K., Cheng H.C., et al. Screening and eradication of Helicobacter pylori for gastric cancer prevention: the Taipei global consensus. Gut. 2020;69:2093-2112. https://doi.org/10.1136/gutjnl-2020-322368
- Sugano K., Tack J., Kuipers E.J., Graham D.Y., El-Omar E.M., Miura S., et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015;64(9):1353-67. https://doi.org/10.1136/gutjnl-2015-309252
- Malfertheiner P., Megraud F., Rokkas T., Gisbert J.P., Liou J.M., Schulz C., et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022;71:1724-1762. https://doi.org/10.1136/gutjnl-2022-327745
- Miceli E., Vanoli A., Lenti M.V., Klersy C., Di Stefano M., Luinetti O., et al. Natural history of autoimmune atrophic gastritis: a prospective, single centre, long-term experience. Aliment Pharmacol Ther. 2019;50(11 -12):1172-80. https://doi.org/10.1111/apt.15540
- Rugge M., Savarino E., Sbaraglia M., Bricca L., Malfertheiner P. Gastritis: the clinico--pathological spectrum. Dig Liver Dis. 2021 ;53(10): 1237-46. https://doi.org/10.1016/j.dld.2021.03.007
- Lenti M.V., Rugge M., Lahner E., Miceli E., Toh B.H., Genta R.M., et al. Autoimmune gastritis. Nat Rev Dis Primers. 2020;6(1):56. https://doi.org/10.1038/s41572-020-0187-8
- Pimentel-Nunes P., Libanio D., Marcos-Pinto R., Areia M., Leja M., Esposito G., et al. Management of epithelial precancerous conditions and lesions in the stomach (maps II): European Society of gastrointestinal endoscopy (ESGE), European Helicobacter and microbiota Study Group (EHMSG), European Society of pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019;51(4):365-88. https://doi.org/10.1055/a-0859-1883
- Rugge M., Correa P., Di Mario F., El-Omar E., Fiocca R., Geboes K., et al. OLGA staging for gastritis: a tutorial. Dig Liver Dis. 2008;40(8):650-658. https://doi.org/10.1016Zj.dld.2008.02.030
- Rugge M., Fassan M., Pizzi M., Pennelli G., Nitti D., Farinati F. Operative link for gastritis assessment gastritis staging incorporates intestinal metaplasia subtyping. Hum Pathol. 2011;42(10):1539-1544. https://doi.org/10.1016/j.humpath.2010.12.017
- Rugge M., Genta R.M., Fassan M., Valentini E., Coati I., Guzzinati S., et al. OLGA Gastritis Staging for the Prediction of Gastric Cancer Risk: A Long-term Follow-up Study of 7436 Patients. Am J Gastroenterol. 2018;113(11):1621-1628. https://doi.org/10.1038/s41395-018-0353-8
- Isajevs S., Liepniece-Karele I., Janciauskas D., Moisejevs G., Putnins V., Funka K., et al. Gastritis staging: interobserver agreement by applying OLGA and OLGIM systems. Virchows Arch. 2014;464(4):403-407. https://doi.org/10.1007/s00428-014-1544-3
- Goldenring J.R. Pyloric metaplasia, pseudopyloric metaplasia, ulcer-associated cell lineage and spasmolytic polypeptide-expressing metaplasia: reparative lineages in the gastrointestinal mucosa. J Pathol. 2018;245(2):132-137. https://doi.org/10.1002/path.5066
- Yue H., Shan L., Bin L. The significance of OLGA and OLGIM staging systems in the risk assessment of gastric cancer: a systematic review and meta-analysis. Gastric Cancer. 2018;21(4):579-587. https://doi.org/10.1007/s10120-018-0812-3
- Нагорная Д.П., Саркисян С.Д., Васильева О.В., Ильичева К.А., Тертычный А.С. Оценка содержания нейроэндокринных клеток в слизистой оболочке желудка у больных аутоиммунным гастритом. Журнал анатомии и гистопатологии. 2022; 11(3):109-113. [Nagornaya D.P., Sarkisyan S.D., Vasil'eva O.V., Il'icheva K.A., Tertychnyi A.S. Assessment of the content of neuroendocrine cells in the gastric mucosa in patients with autoimmune gastritis. Journal of Anatomy and Histopathology. 2022;11(3):109-113. (In Russ). https://doi.org/10.18499/2225-7357-2022-11-3-109-113]


