Сравнительная оценка эффективности роботизированного и традиционного эндопротезирования коленного сустава: проспективное рандомизированное исследование
Автор: Гайрабеков И. М.-Х., Каграманов С.В., Загородний Н.В., Горбатюк Д.С., Чрагян Г.А., Эседов Г.И., Явлиева Р.Х.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Оригинальное исследование
Статья в выпуске: 4 (62), 2025 года.
Бесплатный доступ
Обоснование. Остеоартрит коленного сустава является одной из наиболее распространённых причин хронической боли и ограничения подвижности у пациентов среднего и пожилого возраста. Несмотря на доказанную эффективность тотального эндопротезирования, до 20 % пациентов остаются неудовлетворёнными результатами лечения вследствие ограниченной точности позиционирования компонентов и нарушения баланса мягких тканей. Применение роботизированной технологий направлено на повышение прецизионности хирургических манипуляций и воспроизводимости результатов, однако их клинические преимущества по сравнению с традиционными методами требуют дальнейшего изучения. Цель исследования. Сравнить клинико-функциональные результаты и безопасность роботизированного и традиционного эндопротезирования коленного сустава в проспективном рандомизированном исследовании с двухлетним периодом наблюдения. Методы. Проведено одноцентровое проспективное рандомизированное исследование с участием 100 пациентов (по 50 в основной и в группе сравнения) с гонартрозом III–IV ст. Kellgren & Lawrence. В основной группе выполнялось роботизированное эндопротезирование с использованием системы Cuvis Joint™, в контрольной — традиционное мануальное ТЭКС. Функциональные исходы оценивали по шкалам IKDC, KSS, ВАШ и Лекена до операции, далее через 2, 6, 12 и 24 месяца после операции. Для статистического анализа использовали критерий Манна-Уитни и χ² Пирсона, пороговый уровень значимости р = 0,05. Результаты. Оценены исходы всех 100 пациентов. По шкале IKDC отмечено достоверное улучшение в основной группе на сроках 2 мес. (42 против 36; p < 0,001), 6 мес (55 против 52; p = 0,001) и 12 мес (68 против 65; p = 0,001), с выравниванием показателей через 2 года (p = 0,141). По шкале KSS преимущества роботизированной методики сохранялись на всех сроках наблюдения (p < 0,01). Болевой синдром по ВАШ и индекс Лекена был достоверно ниже в основной группе начиная с 2 месяцев после операции (p < 0,01). Средняя продолжительность операции составила 95 мин против 60 мин (p < 0,001), а интраоперационная кровопотеря — 300 мл против 250 мл (p = 0,022). Нежелательных явлений и осложнений не зарегистрировано. Заключение. Роботизированное эндопротезирование коленного сустава обеспечивает улучшение функциональных показателей и снижение болевого синдрома по сравнению с традиционной техникой при сопоставимом профиле безопасности. Увеличение длительности операции и кровопотери отражает влияние кривой обучения и не уменьшает клиническую эффективность метода. Полученные данные подтверждают целесообразность внедрения роботизированных технологий в эндопротезирование крупных суставов (в частности, коленного).
Эндопротезирование коленного сустава, роботизированная хирургия, артропластика, робот-ассистированные операции, проспективное исследование
Короткий адрес: https://sciup.org/142246874
IDR: 142246874 | УДК: 617.3 / 617-089 | DOI: 10/17238/issn2226-2016.2025.4.26-38
Текст научной статьи Сравнительная оценка эффективности роботизированного и традиционного эндопротезирования коленного сустава: проспективное рандомизированное исследование
Дегенеративные заболевания коленного сустава, в первую очередь остеоартрит, остаются одной из ведущих причин хронической боли, ограничения подвижности и утраты трудоспособности у лиц среднего и пожилого возраста. Стремительный рост количества вмешательств тотального эндопротезирования коленного сустава (TKA – total knee arthroplasty) обусловлен демографическим старением и увеличением распространённости лишнего веса пациентов старше 50 лет. Несмотря на доказанную эффективность TKA в направление устранения болевого синдрома и восстановления функции, до 15–20 % пациентов остаются неудовлетворённым и результатом операции, что связывают с неточной установкой компонентов, остаточной деформацией оси нижней конечности и несбалансированностью мягко-тканных структур.
В Российской Федерации также отмечается неуклонный рост показателя заболеваемости ОА, в период 2006–2010 годов показатель первичной заболеваемости вырос с 669 317 до 745 732 случаев [4]. Согласно федеральным статистическим данным, в 2020 г. в России выполнено 49 974 операций [5] эндопротезирования коленного сустава (40,1 % от всех операций эндопротезирования суставов), что лишь немногим меньше предыдущего года (54 720 операций) по причине вводимых в 2020 г. эпидемиологических ограничений. Только у пациентов старше трудоспособного возраста в 2020 г. зарегистрировано 333 829 случаев заболевания артрозами всех видов, что позволяет косвенно оценить долю артрозов коленного сустава приблизительно в 133 тыс. случаев (40 %) [5].
Применение роботизированной тотальной артропластики коленного сустава (R-TKA) способствует более точному выполнению резекций, обеспечивает оптимальное позиционирование имплантатов и равномерное распределение суставных зазоров, что, в свою очередь, способно уменьшить риск необходимости ревизионных вмешательств в дальнейшем [6, 7].
На этом фоне развивается направление роботизированного эндопротезирования коленного сустава (RA-TKA — robotic-assisted total knee arthroplasty), которое призвано повысить воспроизводимость вмешательства, точность установки компонентов и баланс мягких тканей. Современные роботизированные платформы (MAKO, ROSA, CORI/NAVIO, VELYS, CUVIS и др.) позволяют реализовывать методики и подходы как image-based (с предоперационным КТ-планированием), так и imageless (без подобного планирования, но с интраоперационной навигацией, обратной связью и возможностью контроля мягкотканного баланса в реальном времени) [4, 6, 8–10].
Несмотря на большое количество исследований, посвящённых сравнению результатов RA-TKA и традиционных методов, опубликованные данные неоднозначны. Отдельные работы демонстрируют улучшение точности постановки компонентов, ранних функциональных показателей, а так же меньшим ятрогенным повреждением мягких тканей, костных структур и снижением локальной воспалительной реакции в раннем послеоперационном периоде при использовании роботизированной технологии [7, 11–13], в то время как другие предполагают сопоставимые результаты между двумя подходами [14, 15]. Высказываются опасения, связанные с необходимостью освоения технологии, увеличением продолжительности операции и значительными затратами, сопутствующими внедрению роботизированных систем [14, 16]. Учитывая быстрое внедрение (R-TKA) в клиническую практику, существует острая необходимость в широкой оценке ее эффективности и безопасности по сравнению с традиционными методами..
Цель исследования
Цель исследования – сравнение клинико-функциональных результатов (включая отдаленные в сроки до 2 лет с момента операции) эндопротезирования коленного сустава, выполняемого роботизированным и традиционным методом.
Методы
Дизайн исследования
В остальном протоколы до- и послеоперационного ведения пациентов были схожи.
Условия проведения исследования
Запланированный срок проведения исследования: с ноября 2023 по сентябрь 2025 года – проведение операций и сбор данных, с октября 2025 по ноябрь 2025 года – статистическая обработка данных и создание публикации.
Критерии соответствия (отбора)
-
• Критерии включения: возраст пациентов более 18 лет; наличие показаний к первичному одностороннему тотальному эндопротезированию коленного сустава (гонартроз III–IV ст. по Kellgren & Lawrence); Наличие письменного информированного добровольного согласия пациента на участие в исследовании.
-
• Критерии невключения: наличие активной инфекции в области коленного сустава или системной инфекции; тяжелые системные заболевания, такие как декомпенсированный сахарный диабет, остеопороз тяжелой степени или выраженная саркопения; нервно-мышечные нарушения, затрагивающие функцию нижних конечностей; аллергические реакции или индивидуальная непереносимость металлических компонентов имплантатов; участие в других клинических исследованиях на момент включения в данное исследование; наличие анкилоза коленного сустава при отсутствии болевого синдрома или выраженной деформации; противопоказания к хирургическому вмешательству, выявленные в ходе предоперационного обследования; беременность, период лактации или планирование беременности в течение периода наблюдения; Другие факторы, которые могли бы повлиять на достоверность результатов исследования или возможность проведения полноценного наблюдения.
-
• Критерии исключения: отказ пациента от участия в исследовании в рамках как основной, так и контрольной группы; Нарушение пациентом рекомендаций лечащего врача либо предписанного режима.
Подбор участников в группы
-
• Отбор участников проводился на основании заранее определённых критериев включения, невключения и исключения. Все пациенты проходили предварительный клинико-инструментальный отбор, включавший сбор анамнеза,
объективное обследование и оценку данных рентгенографии коленных суставов с классификацией степени артроза по Kellgren & Lawrence . Для обеспечения сопоставимости групп применялся метод индивидуального подбора пар (matching) по возрасту. Участники были распределены по возрастным интервалам (включительно): 18–30 лет, 31–40 лет, 41–50 лет, 51–60 лет, 61–70 лет, 71–80 лет. Каждому пациенту основной группы подбирался участник контрольной группы, соответствующий по возрастному диапазону. Соотношение между основной и контрольной группами составляло 1:1 (по 50 пациентов в каждой группе). Выбор возрастного критерия для сопоставления обусловлен его влиянием на клинические и функциональные результаты тотального эндопротезирования коленного сустава.
Другие параметры (пол, стадия гонартроза по Kellgren– Lawrence, показания к оперативному лечению) контролировались за счёт применения единых критериев включения и исключения.
Методика формирования групп соответствует принципам описания наблюдательных исследований, изложенным в руководстве STROBE (Strengthening the Reporting of Observational Studies in Epidemiology).
Формирование выборки
Выборка сформирована на основе перечня пациентов, ожидающих госпитализации в отделение эндопротезирования крупных суставов и впоследствии госпитализированных для проведения планового эндопротезирования коленного сустава. Пациентам на дооперационном этапе предлагался выбор метода лечения; при согласии пациента на роботизированное вмешательство он определялся как участник основной группы.
Рандомизация пациентов была стратифицирована по методу эндопротезирования. Основная группа формировалась (путем рандомизации) из числа пациентов, давших согласие на роботизированное вмешательство и которым оно было затем выполнено. Аналогично, контрольная группа формировалась путем рандомизации из числа пациентов, которым проведено эндопротезирование коленного сустава традиционным (без робот-ассистенции) способом.
Все отбираемые пациенты соответствовали критериям включения. Случаев исключения пациента из исследования впоследствии не было; на этот случай в рамках исследования предполагалась замена пациента другим, случайно выбранным из пула оперированных тем или иным изучаемым способом.
Характеристики выборки
В таблице 1 представлены исходные характеристики пациентов основной и контрольной групп. Группы сопоставимы по ключевым антропометрическим показателям возраста, пола, ИМТ; не сопоставимы по стороне, на которой проводилось вмешательство (левая/правая).
Таблица 1
Сравнение основной и контрольной групп по исходным характеристикам
|
Показатели |
Основная группа, n = 50 |
Контрольная группа, n = 50 |
р |
|
Возраст пациентов (лет) |
68,0 (9,0) |
68,0 (14,0) |
0,286 |
|
Индекс массы тела, кг/м2 |
31,2 (3,9) |
32,0 (3,0) |
0,244 |
|
Пол |
Ж: 40 (80,0%), М: 10 (20,0%) |
Ж: 39 (78,0%), М: 11 (22,0%) |
0,807 |
|
Сторона вмешательства (Л/П) |
Л: 30 (60,0%), П: 20 (40,0%) |
Л: 20 (40,0%), П: 30 (60,0%) |
0,046 |
Примечание
1. Результаты для количественных данных представлены как Ме (Q1-Q3).
2. Статистическое сравнение – с помощью критерия Манна-Уитни для количественных показателей, χ2 Пирсона – для частот (пол, сторона вмешательства).
3. Сокращения: М – мужской пол; Ж – женский пол; Л – левая сторона вмешательства, П – правая сторона вмешательства.
Описание метода
Операция по эндопротезированию коленного сустава в основной группе выполнялась с применением автономной роботизированной системы Cuvis Joint™ , тогда как в группе сравнения использовалась традиционная мануальная методика оперативного вмешательства. Всем пациентам хирургическое вмешательство выполнялось по методике механического выравнивания. Предоперационная подготовка, ведения пациента в периоперационном периоде, а также тактика послеоперационного наблюдения (в том числе в отдалённые сроки) были идентичными в обеих группах.
Всем пациентам выполнялся единый хирургический доступ — медиопателлярный . В контрольной группе операция осуществлялась с использованием стандартного и специализированного хирургического инструментария, предназначенного для ручного эндопротезирования.
В данном разделе представлено детальное описание хирургической техники, реализованной с применением автономной роботизированной системы Cuvis Joint™.
Предоперационное планировани е. Система Cuvis Joint™ – автономная роботизированная платформа для тотального эндопротезирования коленного сустава, основанная на использовании данных КТ. После загрузки изображений в программное обеспечение J-planner™ выполняется автоматическая сегментация и 3D-реконструкция сустава (рис. 1). Хирург определяет центры вращения суставов, осевые соотношения, степень деформации, размеры имплантатов и объёмы костной резекции. На основе данных формируется отчёт о планируемом выравнивании, передаваемый на консоль робота.
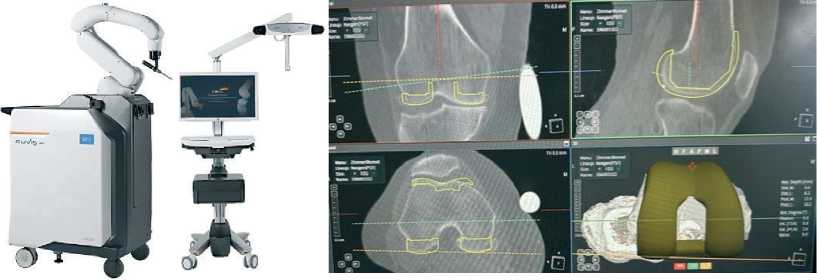
Рисунок 1. Слева – робот Cuvis Joint™; справа – ПО J-planner™
Интраоперационный этап. Перед вмешательством проводится калибровка робота и установка стерильного покрытия. Нижняя конечность фиксируется на позиционере De Mayo V2™ (рис. 2а). В бедренную и большеберцовую кости на 10 см от суставной линии устанавливаются бикортикаль- ные навигационные штифты с отражающими маркерами (рис. 2b–d). Регистрация поверхностей выполняется стилусом (рис. 2е), после чего система формирует виртуальное 3D-изображение сустава, сопоставляемое с КТ-данными. Точность регистрации подтверждается RMSE < 1 мм.
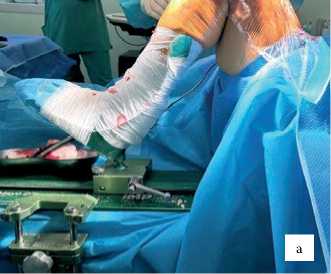
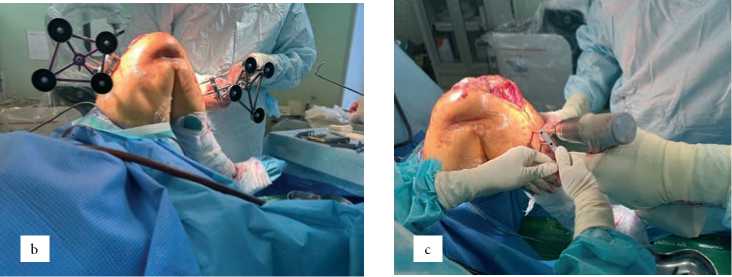
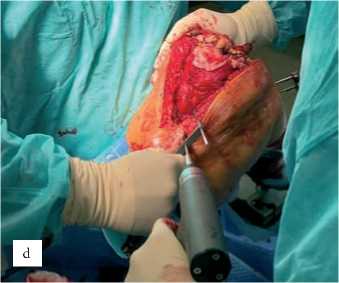
Рисунок 2. а) позиционер (De Mayo V2™, Imp incorporation, Plainville, Connecticut, USA); b) отражающие решетки, закрепленные на диафизарных кортикальных штифтах Штейнмана; c) большеберцовую кость вставлены два штифта Штеймана; d) бедренную кость вставлены два штифта Штеймана; e) регистрация бедренной и большеберцовой костью стилусом
Балансировка и контроль движений. Система отображает суставные промежутки в реальном времени на всём диапазоне движений (рис. 3а), что обеспечивает оптимальную балансировку. Для предотвращения смещений конечность фиксируется к роботизированной руке крючкообраз- ными зажимами (рис. 3б). При превышении допустимого смещения (> 1 мм) робот автоматически блокирует резецирующий инструмент (рис. 3с).
Костные резекции и имплантация. Резекция выполняется поэтапно, начиная с дистальной части бедренной кости, при помощи фрезы 6,2 мм с непрерывным орошением физиологическим раствором. Робот следует заданной траектории, обеспечивая точность до 1 мм (рис. 3д). После завершения резекции производится имплантация компо- нентов согласно навигационным данным. Использовались 2 типа эндопротеза Эндопротез NexGen (Zimmer Biomet, США) и Meril (Meril Life Sciences, Индия) цементной фиксации CR и PS .
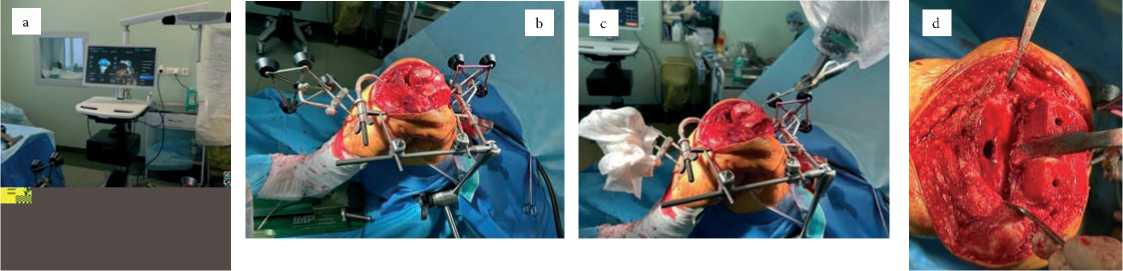
Рисунок 3. Этапы костной резекции и установки (имплантации) эндопротеза
Послеоперационный контроль . На следующий день выполняются рентгенограммы для оценки восстановления механической оси и точности позиционирования компонентов в фронтальной плоскости (рис. 4).
Рисунок 4. Постуральная рентгенограмма после операции
Дополнительные изучаемые параметры
В качестве дополнительных изучаемых параметров регистрировали время операции (в минутах) и интраоперационную потерю крови (в мл) для каждого из пациентов.
Время операции отсчитывалось с момента разреза кожи до наложения финального (завершающего) кожного шва.
Объем интраоперационной потери крови рассчитывался как сумма объемов содержимого резервуара аспирационного отсоса и объёма крови, извлечённого интраоперационно путем использования стерильных марлевых салфеток.
Результаты исследования
В целях комплексной оценки состояния пациентов в качестве основного исхода исследования предполагалась совокупность количественных признаков – данных анкетирования пациентов по шкалам IKDS, KSS, ВАШ (визуальная аналоговая шкала боли), шкале Лекена в сроки: до операции; 2, 6, 12, 24 месяца после операции.
Истинная конечная точка исследования – завершение сбора данных для всех 100 пациентов-участников исследования.
Методы регистрации результатов
Регистрация исходов проводилась путем анкетирования пациентов в определенные сроки (до операции, 2, 6, 12, 24 месяца после операции) с использованием всех шкал (IKDC, KSS, ВАШ, Лекена). Порядок тестирования определялся в соответствии с наступлением сроков анкетирования.
Анализ в подгруппах
Анализ в подгруппах (пол, возраст) не предполагался, ограничиваясь представлением данных с помощью методов описательной статистики.
Статистические процедуры
Запланированный размер выборки
Запланированный размер выборки рассчитан с учетом уровня значимости 5%, мощности 90% и ожидаемого процента успешных исходов (удовлетворительное состояние пациента хотя бы по одной из используемых шкал). При расчете размера выборки (тип исследования – «испытание превосходства» (superiority trial) при помощи онлайн-калькулятора с учетом различий в значениях ожидаемых целевых параметров (шкалы ВАШ, IKDC, KSS, Лекена) выбрано наи- большее (из полученных) значение выборки – по 49 пациентов в каждой группе (всего 98), затем округленное до 50 (всего 100 пациентов в 2 группах).
Специфические условия остановки исследования, за исключением достижения целевого количества участвующих пациентов, не планировались.
Статистические методы
Статистический анализ данных проведен с помощью программного обеспечения IBM SPSS Statistics 26 (IBM Corp., США).
На этапе планирования статистического анализа проверена нормальность распределения количественных данных с помощью одновыборочного теста Колмогорова-Смирнова; обнаружено ненормальное распределение значений для большинства количественных переменных, по данной причине принято решение об использовании:
-
• Для описательной статистики количественных данных – медианы (Me) и межквартильного интервала (Q1-Q3).
-
• Для сравнения групп (основная и контрольная) – использование статистического критерия Манна-Уитни с пороговой значимостью р=0,05.
Описание качественных показателей (мужской/женский пол пациента, левая/правая сторона вмешательства) произведено с помощью частот, а статистическое сравнение – с помощью критерия χ2 Пирсона.
Результаты
Основные результаты исследования
Исход был установлен у всех (100,0 %) пациентов, вошедших в исследование.
В таблице 2 систематизированы основные (функциональные) результаты проведенных оперативных вмешательств; на рис. 5 представлены графики формата «ящики и усы», иллюстрирующие полученные результаты.
Таблица 2
Сравнение основной и контрольной групп по функциональным исходам оперативных вмешательств
|
Значение шкалы и срок |
Контроль (n=50) |
Основная (n=50) |
Статистическая значимость (р) |
Группа c лучшим показателем |
||
|
Me |
Q1-Q3 |
Me |
Q1-Q3 |
|||
|
IKDC, 0 мес. |
20,0 |
3,0 |
21,0 |
9,0 |
0,413 |
- |
|
IKDC, 2 мес. |
36,0 |
6,0 |
42,0 |
4,0 |
<0,001 |
Основная |
|
IKDC, 6 мес. |
52,0 |
9,0 |
55,0 |
8,0 |
0,001 |
Основная |
|
IKDC, 12 мес. |
65,0 |
7,0 |
68,0 |
8,0 |
0,001 |
Основная |
|
IKDC, 2 года |
70,0 |
6,0 |
73,0 |
8,0 |
0,141 |
- |
|
ВАШ, 0 мес. |
8,0 |
2,0 |
8,0 |
1,0 |
0,416 |
- |
|
ВАШ, 2 мес. |
6,0 |
1,0 |
4,0 |
3,8 |
<0,001 |
Контрольная |
|
ВАШ, 6 мес. |
3,0 |
2,0 |
2,0 |
1,8 |
<0,001 |
Контрольная |
|
ВАШ, 12 мес. |
1,0 |
1,0 |
1,0 |
2,0 |
0,001 |
Контрольная |
|
ВАШ, 2 года |
1,0 |
2,0 |
0,0 |
1,0 |
0,011 |
Контрольная |
|
KSS, 0 мес. |
55,0 |
20,0 |
64,0 |
25,0 |
0,061 |
- |
|
KSS, 2 мес. |
115,0 |
6,0 |
120,0 |
17,0 |
0,002 |
Основная |
|
KSS, 6 мес. |
154,0 |
10,0 |
155,0 |
18,0 |
0,049 |
Основная |
|
KSS, 12 мес. |
170,0 |
9,0 |
180,0 |
24,0 |
<0,001 |
Основная |
|
KSS, 2 года |
180,0 |
9,0 |
190,0 |
28,0 |
0,003 |
Основная |
|
Лекен, 0 мес. |
14,0 |
5,0 |
14,0 |
3,5 |
0,231 |
- |
|
Лекен, 2 мес. |
9,0 |
3,0 |
6,0 |
1,5 |
<0,001 |
Контрольная |
|
Лекен, 6 мес. |
4,5 |
2,0 |
2,0 |
2,3 |
0,002 |
Контрольная |
|
Лекен, 12 мес. |
2,0 |
2,0 |
1,0 |
2,0 |
0,002 |
Контрольная |
|
Лекен, 2 года |
1,0 |
1,0 |
0,0 |
1,5 |
0,001 |
Контрольная |
Примечание
1) Сравнение групп проведено с помощью критерия Манна-Уитни.
2) Текст в ячейках, где р<0,05, выделен полужирным шрифтом.
3) Прочерк в столбце «Группа с лучшим показателем» означает сопоставимость групп (p>0,05).
Распределение показателей по шкалам во времени (ящики с усами, основная vs контрольная группы)
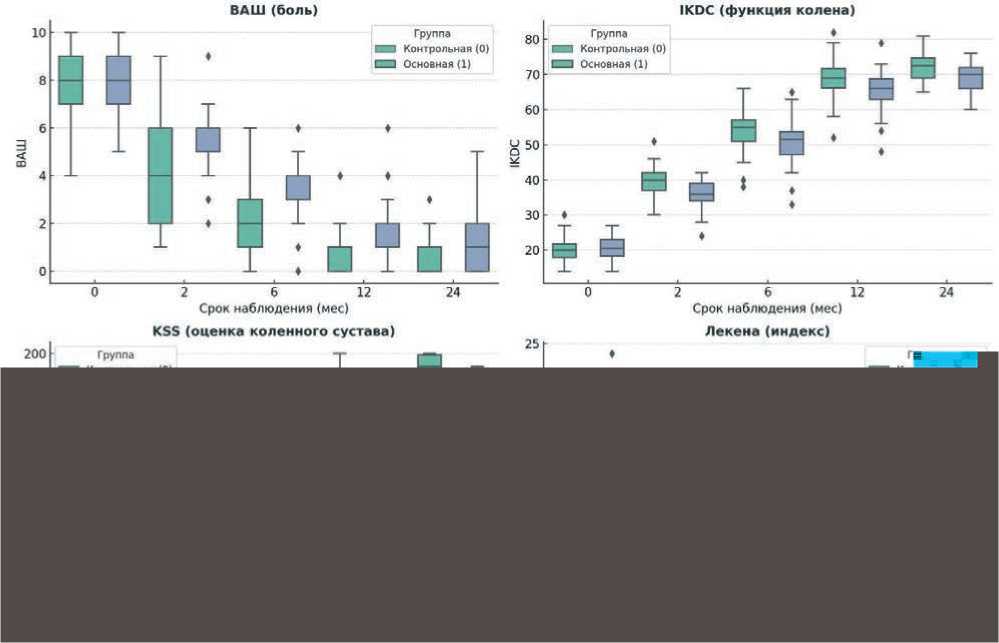
Рисунок 5. Графики формата «ящики и усы», иллюстрирующие полученные результаты
На основе полученных результатов возможно заключить следующее:
-
• Шкала IKDC. Анализ динамики функционального состояния по шкале IKDC показал, что до операции различия между группами отсутствовали (p = 0,413). Уже через 2 месяца после вмешательства наблюдалось достоверное преимущество основной группы – 42 балла против 36 (p < 0,001).
Данное преимущество сохранялось на сроках 6 мес. (p = 0,001) и 12 мес. (p = 0,001), что свидетельствует о более быстрой функциональной реабилитации.
К двухлетнему периоду показатели выравнивались (73 против 70, p = 0,141), что указывает на достижение сопоставимого конечного результата при различной динамике восстановления.
-
• По шкале ВАШ) различий до операции не выявлено (p = 0,416). Уже на втором месяце послеоперационного периода выраженность боли была достоверно ниже у пациентов основной группы (4,0 против 6,0, p < 0,001).
На сроках 6 мес (p < 0,001), 12 мес (p = 0,001) и 24 мес (p = 0,011) сохранялось преимущество в пользу роботизированного метода.
Полученные данные подтверждают, что точность позиционирования компонентов и меньшая травматизация мягких тканей при роботизированной установке приводят к более выраженному снижению болевого синдрома в раннем и среднем послеоперационном периодах.
-
• Общая функциональность (KSS-2000). Согласно шкале KSS-2000, дооперационные показатели были сопоставимы между группами (p = 0,061).
Уже через 2 месяца медиана KSS составила 120 против 115 баллов (p = 0,002) в пользу основной группы, а к 12 месяцам – 180 против 170 баллов (p < 0,001).
Через 2 года разница сохранялась (190 против 180, p = 0,003).
Более высокие значения KSS указывают на лучшее восстановление стабильности, объёма движений и функции сустава, что подтверждает клиническое преимущество роботизированного эндопротезирования.
-
• Шкала Лекена. Анализ показателей по шкале Лекена выявил достоверно меньшую выраженность ограничений в основной группе начиная с 2 месяцев после операции (6,0 против 9,0, p < 0,001) и на всех последующих сроках наблюдения (p < 0,01).
Более низкие значения шкалы отражают меньшую боль, лучшую подвижность и качество жизни пациентов, оперированных с использованием роботизированной технологии.
В совокупности, различия между группами оказались статистически достоверными по большинству исследованных параметров:
-
• время операции и кровопотеря – выше при роботизированных вмешательствах (p < 0,05);
-
• значения шкал IKDC, KSS – выше при роботизированных вмешательствах (p < 0,01);
-
• значения шкал ВАШ, Лекена – ниже при роботизированных вмешательствах (p < 0,01).
Дополнительные результаты исследования
Изучались и сравнивались длительность операции (в минутах) и интраоперационная потеря крови (в мл). Результаты представлены в таблице 3.
Таблица 3
Дополнительные результаты исследования
|
Показатель |
Контроль (Me; Q1–Q3) |
Основная (Me; Q1–Q3) |
p |
|
Время операции, мин |
60,0; 5,0 |
95,0; 33,0 |
<0,001 |
|
Потеря крови, мл |
250,0; 100,0 |
300,0; 175,0 |
0,022 |
Примечание: сравнение групп с использованием критерия Манна-Уитни. Пороговая значимость р=0,05.
Нежелательные явления
В процессе исследования нежелательных явлений не зарегистрировано.
Обсуждение
Активное роботизированное эндопротезирование обеспечивает достоверно лучшие функциональные и субъективные результаты при незначительном увеличении интраоперационных показателей, что подтверждает его клиническую эффективность.
Хотелось бы отметить, что в настоящем исследовании точность позиционирования компонентов и механического выравнивания не оценивалась, поскольку данный аспект уже убедительно продемонстрирован в ряде крупных систематических обзоров и метаанализов, неизменно показывающих снижение доли радиологических «аутлаеров» и улучшение точности установки компонентов при RA-TKA по сравнению с традиционной техникой [17–22].
В то же время большинство современных метаанализов и РКИ показывает, что улучшенная радиологическая точность не сопровождается выраженным преимуществом в коротко- и среднесрочных клинических и функциональных исходах: различия в шкалах функциональной оценки,
PROMs и частоте осложнений либо отсутствуют, либо остаются статистически незначительными, либо не достигают порога клинической значимости [1, 2, 23-25] (например, Forgotten Joint Score или улучшенные показатели функции в ранние сроки наблюдения), однако авторы подчёркивают, что долгосрочное влияние этих различий на выживаемость имплантатов и отдалённое качество жизни пациентов остаётся неясным и требует более длительного наблюдения [1, 2, 26-28]. Увеличение времени операции в данной работе обусловлено тем, что анализируемые вмешательства относятся к раннему этапу внедрения технологии, когда выраженное влияние оказывает кривая обучаемости хирурга и команды. Подобное удлинение операционного времени является ожидаемым феноменом для начальной фазы освоения роботизированной артропластики и хорошо описано в литературе, где ранний этап сопровождается временными затратами на регистрацию, планирование и адаптацию рабочего потока. Кривая обучаемости при RA-TKA, согласно систематическим обзорам, характеризуется прогрессивным сокращением времени операции при сохранении стабильной точности навигации и безопасности. Для выхода на профессиональный уровень большинству хирургов требуется около 15–25 вмешательств (медиана 16–21), при этом в «поздней» фазе операционное время уменьшается в среднем на 14–17 минут по сравнению с начальной стадией без ухудшения точности позиционирования компонентов [29–31]. Для различных платформ число операций, необходимое для достижения плато, варьирует: MAKO — 15–25, ROSA — 20–30, NAVIO — 18–28, а некоторые исследования указывают на оптимизацию рабочего потока уже после 7–11 вмешательств [32, 33]. Наличие в команде специалиста с опытом RA-TKA дополнительно сокращает длительность кривой обучаемости и снижает вариабельность показателей без роста частоты осложнений [34-35].
Представленные данные подтверждают, что клинические результаты R-TKA в раннем послеоперационном периоде лучше в сравнении с мануальной техникой TKA. Активная роботизированная система продемонстрировала стабильную воспроизводимость резекций и отсутствие интраоперационных повреждений мягких тканей в исследуемой когорте (n=50), что соответствует опубликованным данным по автономной системе Cuvis Joint™, где отмечается благоприятный профиль безопасности и отсутствие осложнений, связанных с устройством [8,36]. Наличие высокоточной резекции и выравнивания, подтверждённое клиническими и in vivo-исследованиями, вероятно, снижает потребность в агрессивном мягкотканном релизе и уменьшает риск технических ошибок [37]. В совокупности результаты подчеркивают безопасность технологии и клиническую значимость R-TKA.
Интерпретация дополнительных результатов исследования. Средняя продолжительность вмешательства статистически значимо выше в основной группе (95,0 мин против 60,0 мин; p<0,001), что отражает начальную фазу внедрения роботизированной технологии и соответствует описанной в литературе кривой обучаемости. Согласно данным исследования стабилизация временных показателей при роботизированном TKA достигается после 15–28 случаев [38]. Другие авторы указывают, что медиана кривой обучения для РА-ТКА составила 17 случаев (межквартильный интервал 9–27), при этом время операции на этапе освоения методики сократилось на 14,19 мин по сравнению с этапом обучения (сокращение на 17,03 мин, если учитывать только время от разреза кожи до наложения швов, р<0,0001)[39]. Умеренное повышение кровопотери в основной группе (300,0 мл против 250,0 мл; p=0,022) может быть связано с увеличением длительности вмешательства и дополнительными этапами регистрации/калибровки; по мере преодоления кривой обучения показатели обычно выравниваются [6, 40].
Ограничения исследования
Исследование имеет следующие ограничения:
-
1) Выборка исследования (100 пациентов) невелика в сравнении с целевой популяцией (количество операций эндопротезирования коленного сустава в РФ за 2023 г. – 50 902 с тенденцией к росту в предшествующие годы), хотя велика с точки зрения накопленного хирургического опыта в сравнении с другими исследователями и организации, на базе которых проводятся роботизированные операции эндопротезирования коленного сустава (десятки случаев и единичные случаи).
-
2) Формат работы отличался от «слепого исследования» в отношении изучаемого метода как для хирургов, так для пациентов (исследуемый и классический методы эндопротезирования предлагались пациентам и согласовывались с ними до хирургического лечения; оперирующим хирургам также был известен применяемый метод у каждого из пациентов, вошедших в исследование).
-
3) Основная и контрольная группа не сопоставимы по стороне, на которой выполнялось эндопротезирование коленного сустава (левая/правая).
Заключение
Результаты проведённого проспективного рандомизированного исследования демонстрируют, что роботизированное тотальное эндопротезирование коленного сустава обеспечивает статистически достоверное улучшение функциональных показателей (по шкалам IKDC и KSS) и снижение выраженности болевого синдрома (по ВАШ и шкале Лекена) по сравнению с традиционным мануальным методом. Полученные данные свидетельствуют о более быстрой функциональной реабилитации пациентов, меньшем субъективном уровне боли и лучшем восстановлении функции эндопротезированного сустава в раннем и среднем послеоперационных периодах. При этом профиль безопасности роботизированного вмешательства сопоставим с традиционным эндопротезированием: в ходе наблюдения не зарегистрировано ни одного нежелательного явления или осложнения, связанных с применением роботизированной технологии. Увеличение продолжительности операции и умеренное повышение интраоперационной кровопотери обусловлены влиянием кривой обучения и не оказывают существенного влияния на клинический результат.
Таким образом, эндопротезирование коленного сустава с использованием роботизированной системы продемонстрировала эффективность в обеспечении баланса мягких тканей, что подтверждает её клиническую состоятельность. Полученные результаты согласуются с международными данными о преимуществах роботизированных технологий, включая повышение точности и воспроизводимости хирургических манипуляций, а также улучшение ранних функциональных результатов. В дальнейшем требуется расширение выборки, продление периода наблюдения и проведение многоцентровых исследований для более полной оценки долгосрочных результатов роботизированных вмешательств.


